Композиция антимикробных препаратов для лечения инфекционных заболеваний людей и животных и способ её применения
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для лечения инфекционных заболеваний посредством применения комбинированных антимикробных препаратов (АМП). Используется композиция, включающая антибиотик и С4-7-алкилрезорцин, а также солюбилизатор. Способ и композиция позволяют замедлять или предотвращать развитие резистентности к антибиотику. 2 и 13 з.п. ф-лы, 12 табл., 2 пр., 1 ил.
Реферат
Область техники
Изобретение относится к области медицины, фармакологии и ветеринарии, а именно к лечению инфекционных заболеваний посредством применения комбинированных антимикробных препаратов (АМП). Новые АМП могут быть применены для лечения инфекционных заболеваний, вызываемых микроорганизмами, как у человека (холера, чума, сибирская язва, пневмония, раневые инфекции, внутрибольничные инфекции, кишечные инфекции и др.), так и у животных (сибирская язва, ящур, сап, бруцеллез, пневмония, и др.).
Уровень техники
Неэффективность известных лекарственных средств при лечении инфекционных заболеваний, обусловленная быстрорастущей лекарственной устойчивостью (резистентностью) к ним микроорганизмов, возбудителей инфекционных заболеваний, постоянно возрастает (Guilfoile P.G., Alcamo I.E., Heymann D. (editors). Antibiotic-Resistant Bacteria. Infobase Publishing. 2007). Научные исследования по разработке новых препаратов и технологий развиваются в нескольких направлениях, в том числе - поиска новых антибиотиков и создания комбинированных препаратов из уже известных соединений. В рамках последнего направления существуют два подхода к созданию таких препаратов:
1. Комбинация двух или более антимикробных веществ, направленных к разными мишенями в микробной клетке (Анисимов С.И. Комбинированные препараты в современной терапии инфекционно-воспалительных поражений глаз бактериальной этиологии. Русский медицинский журнал 2014 г, №26, с. 1874).
2. Комбинация двух веществ, одно их которых предотвращает разрушение второго (антибиотика) в организме (Gordon D. Amoxicillin-Clavulanic Acid (Co-Amoxiclav). In Grayson ML et al (eds). Kucers' the Use of Antibiotics: a Clinical Review of Antibacterial, Antifungal, Antiparasitic and Antiviral Drugs. 2010. London: Hodder Arnold/ASM Press, p. 193-194).
При этом, число новых антибиотиков крайне мало, например, с 2000 по 2013 гг. введено только два новых антибиотика (Butler et al., 2013), кроме того применение новых антибиотиков не предотвращает развития антибиотикоустойчивости (АУ) у патогенных бактерий. АУ формируется двумя путями:
1. Приобретением и наследованием генетических детерминант антибиотикорезистентности за счет их горизонтального переноса между микроорганизмами;
2. Образованием неделящихся антибиотикотолерантных клеток-персистеров, переживающих лекарственную атаку и затем прорастающих такой же популяцией, как родительская (Helaineemail S., Kugelberg Е. Bacterial persisters: formation, eradication, and experimental systems. Trends in microbiol. 2014. V. 22 (7), p. 17-424).
При этом переход в состояние персистеров и их прорастание сопряжены с акселерацией процессов адаптивной устойчивости, в том числе к антибиотикам, что рассматривается как дорога к генетически наследуемой антибиотикорезистентности (Cohen, N.R. et al. Microbial persistence and the road to drug resistance. Cell Host Microbe. 2013; 13: 632-642.). Кроме того, в организме хозяина патогенные бактерии могут образовывать так называемые биопленки, особое надклеточное состояние бактерий, когда клетки объединены внеклеточным матриксом из внеклеточных полимеров и прикреплены к поверхности органов. В этом состоянии клетки микробов чрезвычайно устойчивы к действию антибиотиков. Поэтому перспективными для антибиотикотерапии являются следующие подходы:
1. Снижение у клеток патогенов метаболической активности с целью подавления механизмов антибиотикорезистентности;
2. Минимизация (до полной элиминации) числа выживающих клеток-персистеров с целью как снижения бактерионосительства, так и обмена между клетками генетическими детерминантами устойчивости.
Как отмечено выше, существует подход к созданию новых препаратов, использующий принцип включения в один препарат нескольких разных веществ.
Например, препараты на основе двух антимикробных веществ схожего типа действия, сульфаниламида сульфаметаксозола и триметоприма, эффективны в отношении грамположительных и грамотрицательных бактерий (RU 2239418, RU 2239418, RU 2141823). Известны препараты, содержащие более 10 антибиотиков, действующих на разные мишени в клетках бактерий (RU 2323729). Недостатком этих АМП является развитие резистентности патогенных бактерий к препарату. Известны препараты, содержащие один антимикробный препарат и вещество, препятствующее его разрушению бактериями, например, амоксициллин и клавюланат (RU 2152213, ЕР 1142574). Однако и такие препараты не гарантируют развития к ним резистентности со стороны патогенных бактерий.
Анализ научной и патентной литературы свидетельствует, что ни один из известных АМП не обеспечивает отсутствия развития к нему резистентности со стороны патогенных бактерий. Кроме того, многие антибиотики могут вызвать побочные эффекты, и актуальна задача понижения применяемых дозировок. Поэтому остается актуальной задача разработки новых эффективных АМП, не вызывающих развитие резистентности, а также обладающих низкой токсичностью.
Раскрытие изобретение
Задачей настоящего изобретения является разработка и создание антимикробного лекарственного средства для лечения инфекционных заболеваний микробной этиологии.
Техническим результатом данного изобретения является разработка и создание фармацевтической композиции, представляющей собой комбинированное антимикробное лекарственное средство, которое
- обладает повышенной антимикробной эффективностью по отношению к широкому спектру микроорганизмов, в том числе микроорганизмов, резистентных к антибиотикам,
- обладает пониженной токсичностью,
- характеризуется тем, что один из компонентов данного комбинированного средства усиливает действие другого,
- характеризуется длительным сроком развития устойчивости микроорганизмов (бактерий, грибов, простейших и др.) к этому средству или предотвращающее развитие устойчивости (резистентности).
Указанный технический результат достигается посредством разработки и получения фармацевтической композиции для лечения инфекционных заболеваний микробной этиологии у субъекта, включающей, по меньшей мере, один антибиотик, а также один из С4-7-алкилрезорцинов и солюбилизатор.
В некоторых вариантах воплощения изобретения фармацевтическая композиция по изобретению дополнительно содержит, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество. В некоторых частных вариантах воплощения изобретения указанное вспомогательное вещество представляет собой растворитель и/или наполнитель.
В некоторых частных вариантах воплощения изобретения С4-7-алкилрезорцин представляет собой 4-н-бутилрезорцин, 4-гексилрезорцин или 5-гептилрезорцин.
В некоторых частных вариантах воплощения изобретения солюбилизатор представляет собой этиловый спирт, диметилсульфоксид или детергент.
В некоторых частных вариантах воплощения изобретения антибиотик выбирают из группы полипептидов, аминогликозидов, тетрациклинов, макролидов, гликопептидов, левомицетина, рубомицина, бета-лактамов, хинолонов, сульфаниламидов, изониазида, антигрибковых или противопротозойных препаратов.
В некоторых предпочтительных вариантах воплощения изобретения антибиотик и С4-7-алкилрезорцин берутся в соотношении, которое обеспечивает, по меньшей мере, двукратное снижение минимальной ингибирующей концентрации антибиотика.
В некоторых частных вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано бактериальной инфекцией, протозойной инфекцией или грибковой инфекцией.
В некоторых частных вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано грамположительными бактериями.
В некоторых частных вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано грамотрицательными бактериями.
В некоторых частных вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано грибами.
В некоторых частных вариантах воплощения изобретения инфекционное заболевание микробной этиологии вызвано простейшими.
В некоторых частных вариантах воплощения изобретения субъект представляет собой человека или животное.
Изобретение также предусматривает получение композиций по изобретению.
Изобретение также включает применение композиций по изобретению для лечения инфекционных заболеваний микробной этиологии у субъекта, нуждающегося в таком лечении.
Еще одним аспектом настоящего изобретения является способ лечения инфекционных заболеваний микробной этиологии, включающий введение субъекту композиций, являющихся предметом изобретения.
В частных вариантах воплощения изобретения способ лечения характеризуется тем, что фармацевтическая композиция может быть получена непосредственно перед ее введением путем смешивания компонентов в необходимых пропорциях.
В частных вариантах воплощения изобретения субъект представляет собой человека или животное.
Краткое описание рисунков.
Рисунок. 1. Диаграмма, отражающая содержание бактерий M. smegmatis в селезенке белых мышей (КОЕ/г селезенки) в разных вариантах добавления антимикробных средств.
Определения и термины
Резорцин (Резорцинол, 1,3-дигидроксибензол) - мета-дигидроксибензол:
.
Термин «алкил» в настоящем документе означает радикал ряда насыщенных углеводородов, причем включает как неразветвленные, так и разветвленные алкильные группы. Также термин «алкил» в настоящем документе относится к группам, обычно имеющим от четырех до семи атомов углерода. Например, термин - С4-7-алкил означает бутил, гексил и т.д.
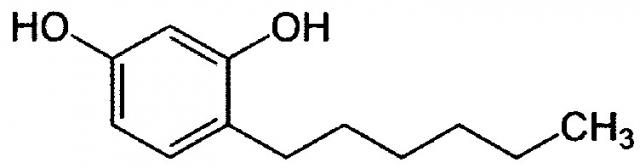
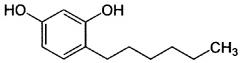
В настоящем документе под термином «С4-7-алкилрезорцин» понимаются, в частности, 4-н-бутилрезорцин, 4-гексилрезорцин или 5-гептилрезорцин. Согласно номенклатуре ИЮПАК, 4-гексилрезорцин - это 1,3-диокси-4-н-гексилбензол, который может быть представлен следующей структурной формулой:
.
Алкилрезорцины (АР) имеют полимодальное действие на клетки бактерий: они модифицируют структуру мембран, белков, нуклеиновых кислот, и таким образом, изменяют их функциональную активность. При высоких концентрациях алкилрезорцинов происходит нарушение работы мембран: мембраны переходят из физиологического жидкокристаллического состояния в твердокристаллическое. Это приводит к нарушению мембранных функций клетки, снижению дыхательной активности клетки. Тем самым снижается энергообеспеченность клеток и, следовательно, снижается их стрессоустойчивость. Высокие концентрации АР также приводят к снижению (до полной потери) активности ферментов разных типов, гидролаз, оксидаз и других. Тем самым клетка в условиях стресса лишается основных рабочих механизмов, ферментов, что снижает ее стрессоустойчивость. Активность ферментов снижается из-за ковалентного и не ковалентного связывания АР с функциональными группами и доменами белковых глобул. Влияние АР на нуклеиновые кислоты происходит по трем путям: 1) АР могут напрямую связываться с ДНК, изменяя их топологию и, следовательно, функциональные свойства; 2) АР снижают активность ферментов, обслуживающих ДНК (репликация, репарация, транскрипция, топология, хранение); 3) АР являются индукторами стрессовых регулонов, например, RpoS и SOS-ответа, что, ввиду отмеченных выше следствий влияния АР на клетку, вызывает неадекватное развитие стрессового ответа. В итоге развивается дистресс и потенцируется гибель клеток в присутствии летальных стрессоров, таких как антибиотики.
Термин «субъект» охватывает все виды млекопитающих, предпочтительно человека.
Под заболеваниями микробной этиологии в данном документе подразумеваются любые заболевания, вызванные как грамположительными или грамотрицательными бактериями, так и грибами, простейшими, а также заболевания смешанной этиологии. Примерами таких заболеваний могут быть, но не ограничиваясь ими, заболевания, вызванные бактериями из рода стафилококков (например, Staphylococcus aureus, Staphylococcus epidermidius), бактериями из рода стрептококков (например, Streptococcus pneumoniae), бактериями из семейства энтеробактерий, в частности бактерий рода Providencia (например, Providencia stuartii, Providencia sneebia и др.), а также микобактериями Mycobacterium tuberculosis, грибами рода Candida и другими.
Подробное раскрытие изобретения
Характеристика биологической активности композиций по изобретению
Поставленная задача решается путем создания фармацевтических композиций, в которых комбинируется не менее двух компонентов, одним из которых является один из известных антибиотиков, разрешенных к применению в медицинской или ветеринарной практике, а вторым - один из С4-7-алкилрезорцинов, предпочтительно выбранный из 4-гексилрезорцина, 5-гептилрезорцина или 4-н-бутилрезорцина. Кроме того, композиция включает вещества, способствующие солюбилизации компонентов, например этиловый спирт, диметилсульфоксид или детергенты.
Количество и соотношение действующих веществ зависит от вида микроорганизма и типа используемого антибиотика.
Предпочтительно, композиция по изобретению содержит 4-гексилрезорцин и один из антибиотиков, выбираемых из группы беталактамов, макролидов, аминогликозидов, тетрациклинов, хлорамфеникола, гликопептидов, полипептидов, хинолонов, рубомицина, сульфаниламидов, изониазида, антигрибных (противогрибковых) антибиотиков или антибиотиков против простейших. А также композиция содержит солюбилизирующий агент
Массовое соотношение АР : антибиотик преимущественно лежит в пределах 1000-0.05:1. Процентное содержание солюбилизирующих агентов в композиции должно быть достаточным для растворения компонентов, например содержание этилового спирта может составлять 0.5-50%.
Проведенные исследования показали, что применение новых комбинированных АМП по изобретению эффективно против грамположительных и грамотрицательных бактерий, а также грибов и простейших. Новые АМП по изобретению эффективно минимизируют или предотвращают развитие микробных форм переживания (персистенции) - клеток, остающихся после воздействия антибиотика, и биопленок, - а также замедляют или предотвращают развитие устойчивости (резистентности) у микроорганизмов к используемым антибиотикам.
Для подтверждения заявленного технического результата были проведены in vitro и in vivo исследования антимикробной активности известных антибиотиков, а также фармацевтических композиций по изобретению, включающих комбинации этих же антибиотиков с алкилрезорцинами (АР). АР в композициях по изобретению использовали в концентрациях, равных минимальной рост-ингибирующей концентрации (МИК). Об антимикробной активности фармацевтических композиций по изобретению судили по трем показателям:
1) снижению показателя МИК, определяемого как минимальная концентрация антибиотика или АМП, при которой отсутствует рост тест-организма на жидких средах в течение 24 ч;
2) снижению количества жизнеспособных клеток бактерий, как числа колониеобразующих единиц (КОЕ), остающихся после инкубации тест-культур с высокими концентрациями антибиотика (более высоких, чем 1 МИК).
3) показатель «фракционная ингибирующая концентрация» (ФИК, FIC) (Prichard MN, Prichard LE, Shipman С, Jr.: Strategic design and three-dimensional analysis of antiviral drug combinations. Antimicrob Agents Chemother 1993, 37: 540-545), рассчитывался в некоторых случаях в работе с клиническими изолятами.
Тест-объектами были выбраны: непатогенные представители патогенных бактерий грамотрицательная бактерия Escherichia coli, грамположительная бактерия Staphylococcus aureus, а также дрожжевые грибы Candida utilis, инфузории Paramecium caudatum. Использование непатогенных близкородственных организмов в подобных опытах допустимо из-за единообразия устройства клеток тест-организмов и их аналогов и механизмов действия антибиотиков. В опытах in vivo были использованы бактерии Mycobacterium smegmatis.
Исследуемые в данных экспериментах композиции по изобретению включали, в частности, антибиотики, представленные в таблице 1, а также алкилрезорцины (АР) - 4-н-бутилрезорцин, 4-гексилрезорцин, 5-гептилрезорцин. Солюбилизирующими агентами в исследуемых композициях по изобретению являются, в частности, этанол, диметилсульфоксид с содержанием 10-50% или поверхностно-активные вещества, например, Твин 80. Результат применения композиций по изобретению не зависел от способа солюбилизации, что было проверено в специальных экспериментах.
Для опытов in vitro культуры бактерий E. coli и S. aureus выращивали на среде LB в течение 18-20 ч (до стационарной фазы), затем использовали как инокулят (5%). Культуру выращивали в течение 1 ч до начала активного роста в колбе объемом 250 мл с 50 мл культуры бактерий. Затем культуру разливали по 2 мл в стеклянные пробирки с ватными пробками, куда предварительно были внесены растворы антибиотиков и АР в соответствующих количествах. Антибиотики и АМП вносили в виде индивидуальных растворов в воде с 10-50%-содержанием этанола или ДМСО или 1-5%-содержанием Твин-80. Конечное содержание этанола или ДМСО не превышало 3%, а Твин-80 - 0,05%. Важно отметить, что антибиотики и АР должны быть приведены в контакт с клетками микроорганизмов одновременно. Для этого в пустую пробирку сначала вносили аликвоту, например, 20 мкл раствора антибиотика, затем - аликвоту, например, 20 мкл, добавки, АР, растворы перемешивали, после чего добавляли 1960 мкл суспензии бактерий. Тем самым антибиотик и АР начинали действовать на микроорганизмы одновременно. Причем неожиданно было обнаружено, что при ином способе подачи веществ в культуру бактерий результаты экспериментов были значительно хуже (например, внесение АР без солюбилизаторов было невозможным ввиду их низкой растворимости; внесение АР перед антибиотиком за 30-60 мин не усиливало действия антибиотика, а наоборот, ослабляло его по сравнению с действием одного лишь антибиотика). Антибиотики и АР могут быть также внесены в виде композиции, содержащей и антибиотик, и АР. Причем и внесение раствора, содержащего антибиотик и АР, и внесение двух индивидуальных растворов, антибиотика и АР, с последующим внесением суспензии бактерий, приводили к одинаковым результатам. Пробирки инкубировали при 30°C и качании на круговом шейкере (100 об/мин). Рост оценивали через 24 ч на фотоэлектроколориметре ФЭК 56М при длине волны 540 нм. Рост считали отсутствующим, если оптическая плотность (ОП) была не выше, чем исходная.
Действие АМП на инфузорий Paramecium caudatum оценивали по снижению интенсивности их размножения (Руководство по определению методом биотестирования токсичности вод, донных отложений, загрязняющих веществ и буровых растворов. - М.: РЭФИЯ, НИА-Природа. - 2002. - 61 с.). Инфузории выращивали на минерально-дрожжевой среде Лозина-Лозинского состава, г: NaCl - 1,0; KCl - 0,1; MgSO4 - 0,1; CaCl*2H2O - 0,1; NaHCO3 - 0,2; вода дистиллированная до 1 л.; концентрацию инфузорий (кл/мл) определяли микроскопически при увеличении ×600. Критерием антипротозойного действия антибиотиков в чистом виде и в составе бинарных препаратов служило снижение численности инфузорий на 50% и более за 24 часа в исследуемой пробе.
Опыты проводили не менее чем в трех повторах по три параллельных опыта в каждом.
Сравнение эффективности известных антибиотиков и композиций по изобретению против микроорганизмов
Для исследования эффективности композиций по изобретению инокулят культур тест-объектов бактерий и грибов выращивали в течение 18 ч на среде LB при 30°C на качалке (шейкере) 100 об/мин. 2 мл культуры-инокулята вносили в 50 мл среды LB, выращивали 1 ч при 30°C на качалке, после чего разливали по 2 мл в стерильные стеклянные пробирки, куда заранее были добавлены композиции по изобретению, включающие антибиотики и 4-гексилрезорцин (ГР). Общий объем композиции по изобретению составлял не более 100 мкл. Конечная концентрация этанола или диметилсульфоксида (используемых как солюбилизирующие агенты), составляла не более 3%, что не влияло на рост тест-организмов. ГР был добавлен в количестве МИК, определенном в предварительных опытах по исследованию МИК для ГР. Эта концентрация не предотвращала роста бактерий. Пробирки ставили на качалку при температуре 30°C на 24 ч. Наличие роста регистрировали на фотоэлектроколориметре ФЭК-56 М при длине волны 540 нм.
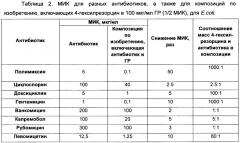
Таким образом, неожиданно было обнаружено, что для E. coli наблюдается значительное усиление антимикробного действия всех без исключения антибиотиков (причем антибиотиков разных типов действия и разной структуры) в присутствии МИК 4-гексилрезорцина. В наибольшей степени усиливается действие полимиксина, гентамицина, и левомицетина (МИК снижается в 10-50 раз), в несколько меньшей степени - для циклоспорина, ванкомицина, рубомицина (в 2-3 раза). При этом соотношение масс ГР : антибиотик в композиции варьирует в пределах 1000-0.05:1.
Как следует из таблицы 3, для S. aureus неожиданно было обнаружено значительное усиление антимикробного действия всех без исключения антибиотиков (причем антибиотиков разных типов действия и разной структуры) в присутствии МИК ГР. В наибольшей степени усиливается действие полимиксина, капремабола, левомицетина и ампициллина (в 5-10 раз). При этом соотношение масс ГР : антибиотик в композиции варьирует в пределах 600-0.75:1.
В таблице 4 представлено усиление действия на дрожжи C. utilis двух антигрибных (противогрибковых) антибиотиков под действием 4-гексилрезорцина в концентрации, не влияющей на ее рост. Следовательно, 4-гексилрезорцин также эффективно усиливает действие и антигрибных (противогрибковых) антибиотиков тоже.
Действие индивидуальных антибиотиков и композиций по изобретению на инфузории Paramecium caudatum оценивали по снижению интенсивности их размножения. Минимальную концентрацию, при которой развития инфузорий не происходило, считали за МИК. Результаты представлены в таблице 5. Представленные данные показывают, что 4-гексилрезорцин также эффективно усиливает действие и антипротозойных антибиотиков тоже.
Приведенные примеры иллюстрируют усиление антимикробного действия всех испытанных антибиотиков в присутствии 4-гексилрезорцина, взятого в концентрациях, не подавляющих рост тест-организмов четырех основных групп - грамположительных и грамотрицательных бактерий, грибов и простейших.
Сравнение эффективности антибиотиков и композиций по изобретению, включающих 5-гептилрезорцин (ГПР) и 4-н-бутилрезорцин (БР)
Эффективность композиций по изобретению, включающих другие алкилрезорцины - 5-гептилрезорцин и 4-н-бутилрезорцин, была исследована на E. coli и S. aureus. Результаты данных экспериментов представлены в таблицах 6-9.
В результате проведенных экспериментов неожиданно было обнаружено, что в присутствии МИК бутилрезорцина и гептилрезорцина для обоих испытанных штаммов бактерий наблюдается значительное усиление антимикробного действия всех испытанных антибиотиков.
Сравнение эффективности антибиотиков и композиций по изобретению, включающих 4-гексилрезорцин, против клинических изолятов патогенных бактерий
В дополнение к исследованию на лабораторных тест-объектах, описанных выше, эффективность композиций, включающих антибиотик и 4-гексилрезорцин, была испытана на клинических изолятах патогенных бактерий, в том числе - резистентных к действию испытываемых антибиотиков. Данный эксперимент был необходим, поскольку клинические изоляты могут отличаться по свойствам от лабораторных моделей.
Испытание проходило по схеме «шахматной доски», когда испытывали композиции, включающие различные комбинации антибиотиков и гексилрезорцина от 1/8 МИК и выше. По итогам испытаний рассчитывали фракционную ингибирующую концентрацию для композиций по изобретению, ФИК:
ФИК=МИК(аб+гр)/МИКаб+МИК(аб+гр)/МИКгр.,
где МИК(аб+гр) - минимальная ингибирующая концентрация композиций по изобретению, включающих антибиотик и гексилрезорцин, (мг/л);
МИКгр - минимальная ингибирующая концентрация гексилрезорцина, (мг/л);
МИКаб - минимальная ингибирующая концентрация антибиотика, (мг/л).
Если ФИК меньше 0.5 - вещества действуют синергидно, если меньше 1, но больше 0.5 - действуют аддитивно, при ФИК составляющей 1-4 - индифферентно, более 4 - действуют как антагонисты. Тест-объектами были грамположительные бактерии (таблица 10) и грамотрицательные бактерии (таблица 11).
Приведенные примеры показывают эффективность применения гексилрезорцина для усиления действия антибиотиков, применяемых в клинической практике, против клинических изолятов грамположительных и грамотрицательных бактерий, в том числе - против штаммов, обладающих резистентностью к испытываемым антибиотикам.
Исследование эффективности композиций по изобретению, включающих 4-гексилрезорцин, против бактерий in vivo
Для проведения испытаний была использована экспериментальная модель быстрого тестирования противотуберкулезных антимикробных препаратов (Jhamb SS et al. A short-term model for preliminary screening of potential anti-tubercular compounds // Scand J Infect Dis. 2009, 41 (11-12): 886-889). При этом определяли содержание бактерий Mycobacterium smegmatis в селезенке белых мышей инбредной линии BALBc через 3-е суток после введения суспензии бактерий в хвостовую вену.
Для опытов in vivo бактерии М. smegmatis выращивали на среде Сотона в течение 3-х суток. 100 мкл суспензии бактерий вводили в хвостовую вену белых мышей линии BALB. На 3-й сутки извлекали селезенку мыши, взвешивали, гомогенизировали, десятичные разведения гомогената высевали на плотную среду Сотона, инкубировали 5 суток и подсчитывали количество выросших бактерий.
Композиции по изобретению, включающие антибиотик и алкилрезорцин, добавляли в питье мышей. Также были испытаны отдельно антибиотик и алкилрезорцин. Метод детекции микобактерий после извлечения и гомогенизирования селезенки - высев на селективную плотную среду Сотона. Результаты данного исследования представлены на рисунке 1.
Приведенный пример иллюстрирует, что использование композиций по изобретению, включающих гексилрезорцин и противотуберкулезный препарат изониазид, снижает количество бактерий в селезенке белых мышей с 13500/г селезенки до 610, т.е. в 20 раз, тогда как взятые по отдельности испытанные антибиотик и алкилрезорцин практически не влияли на количество бактерий в селезенке мышей в условиях опыта по сравнению с контролем в пределах погрешности определения количества микобактерий. Такие данные подтверждают высокую эффективность композиций по изобретению в условиях применения в живом организме.
Исследование биоцидного действия композиций по изобретению, включающих антибиотик и 4-гексилрезорцин
Для определения биоцидного действия на E. coli, в частности двух антибиотиков - ампициллина и ципрофлоксацина, их использовали в высоких концентрациях, т.е. больших, чем МИК, - соответственно 10 и 100 мкг/мл. Гексилрезорцин добавляли в концентрации МИК. Количество КОЕ определяли через разное время инкубации. КОЕ определяли путем высева десятичных разведений на плотную питательную среду LB.
Приведенные результаты демонстрируют потенцирование алкилрезорцином биоцидного действия антибиотика. Например, численность КОЕ ниже через 3 ч инкубации на 4-5 порядков в вариантах совместного применения антибиотика и алкилрезорцина по сравнению с действием одного лишь антибиотика. Через 2-е суток (для ампициллина) и через 7 суток (для ципрофлоксацина) в варианте совместного применения антибиотика и алкилрезорцина жизнеспособные клетки не обнаруживались, тогда как в присутствии одного лишь антибиотика их концентрация составляла 108 и 103 кл/мл, для ампициллина и ципрофлоксацина, соответственно.
Отсутствие выживающих клеток обусловливает уникальную особенность композиций по изобретению, заключающуюся в том, что при их применении к данным композициям не будет развиваться резистентность у патогенных бактерий, т.к. она не успевает сформироваться, и не будет передаваться последующим поколениям бактерий ввиду отсутствия выживающих клеток.
Примеры композиций по изобретению
Пример 1. Для обработки культуры E. coli была создана композиция в виде раствора, состоящего из: воды и этанола в объемном соотношении 7:3, с концентрацией полимиксина 10 мкг/мл и гексилрезорцина 10 мг/мл. При добавлении 1%-го раствора такой композиции (разведение вышеуказанного раствора 1:100), роста бактериальной культуры не наблюдали (табл. 2).
Пример 2. Для обработки культуры S.aureus была создана композиция в виде раствора, состоящего из: воды и диметилсульфоксида в объемном соотношении 1:1, с концентрацией доксициклина 10 мкг/мл и гексилрезорцина 1.5 мг/мл. При добавлении 1%-го раствора такой композиции (разведение 1:100), роста бактериальной культуры не наблюдали (табл. 3).
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные эксперименты приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
1. Фармацевтическая композиция для лечения инфекционного заболевания микробной этиологии у субъекта, включающая терапевтически эффективное количество, по меньшей мере, одного антибиотика, а также один С4-7-алкилрезорцин и солюбилизатор.
2. Фармацевтическая композиция по п. 1, характеризующаяся тем, что дополнительно содержит, по меньшей мере, одно фармацевтически приемлемое вспомогательное вещество.
3. Фармацевтическая композиция по п. 1, характеризующаяся тем, что С4-7-алкилрезорцин представляет собой 4-н-бутилрезорцин, 4-гексилрезорцин или 5-гептилрезорцин.
4. Фармацевтическая композиция по п. 1, характеризующаяся тем, что солюбилизатор представляет собой этиловый спирт, диметилсульфоксид или детергент.
5. Фармацевтическая композиция по п. 1, характеризующаяся тем, что антибиотик выбирают из группы полипептидов, аминогликозидов, тетрациклинов, макролидов, гликопептидов, левомицетина, рубомицина, бета-лактамов, хинолонов, сульфаниламидов, изониазида, антигрибных или противопротозойных препаратов.
6. Фармацевтическая композиция по п. 1, в которой антибиотик и С4-7-алкилрезорцин берутся в соотношении, которое обеспечивает, по меньшей мере, двукратное снижение минимальной ингибирующей концентрации антибиотика.
7. Фармацевтическая композиция по п. 1, характеризующаяся тем, что инфекционное заболевание микробной этиологии вызвано бактериальной инфекцией, протозойной инфекцией или грибковой инфекцией.
8. Фармацевтическая композиция по п. 1, характеризующаяся тем, что инфекционное заболевание микробной этиологии вызвано грамположительными бактериями.
9. Фармацевтическая композиция по п. 1, характеризующаяся тем, что инфекционное заболевание микробной этиологии вызвано грамотрицательными бактериями.
10. Фармацевтическая композиция по п. 1, характеризующаяся тем, что инфекционное заболевание микробной этиологии вызвано грибами.
11. Фармацевтическая композиция по п. 1, характеризующаяся тем, что инфекционное заболевание микробной этиологии вызвано простейшими.
12. Фармацевтическая композиция по п. 1, характеризующаяся тем, что субъект представляет собой человека или животное.
13. Способ лечения инфекционного заболевания микробной этиологии, включающий введение фармацевтической композиции по п. 1 субъекту, нуждающемуся в таком лечении.
14. Способ по п. 13, характеризующийся тем, что фармацевтическая композиция может быть получена непосредственно перед ее введением путем смешивания компонентов в необходимых пропорциях.
15. Способ по п. 13, характеризующийся тем, что субъект представляет собой человека или животное.