Оптическая оценка поражения
Иллюстрации
Показать всеГруппа изобретений относится к медицинской технике, а именно к средствам измерения оптических свойств ткани в теле. Медицинское устройство содержит зонд, имеющий дистальный сегмент, выполненный с возможностью введения в тело пациента, причем зонд содержит по меньшей мере один чувствительный оптический блок, который размещен вдоль дистального сегмента и содержит первый и второй источники излучения, выполненные с возможностью испускать оптическое излучение в различных соответствующих первом и втором диапазонах длин волн по направлению к ткани в теле в непосредственной близости от дистального сегмента, и оптический датчик, выполненный с возможностью принимать оптическое излучение в первом и втором диапазонах длин волн, которое рассеивается от ткани, и выводить первый и второй электрические сигналы в ответ на интенсивность принятого оптического излучения. Способ оптической оценки поражения ткани осуществляется по первому варианту посредством работы устройства. При этом во втором варианте способ оптической оценки поражения ткани выполняет приложение радиочастотной (РЧ) электрической энергии таким образом, чтобы образовать поражение на участке ткани внутри тела пациента, измерение первого разброса интенсивности на участке в инфракрасном диапазоне излучения и второго разброса интенсивности на участке в красном диапазоне излучения при приложении электрической РЧ-энергии, и оценку образования поражения путем сравнения первого разброса интенсивности и второго разброса интенсивности. Использование группы изобретений позволяет повысить точность измерения оптических свойств. 3 н. и 23 з.п. ф-лы, 4 ил.
Реферат
Перекрестная ссылка на смежную заявку
Настоящая заявка является частичным продолжением заявки на патент США № 12/816492, поданной 16 июня 2010 г. и опубликованной как заявка на патент США № 2011/0313280, описание которой включено в настоящий документ путем ссылки.
Область применения изобретения
Настоящее изобретение относится по существу к инвазивным медицинским устройствам и процедурам и в частности к оценке состояния ткани, которая подвергается лечению в таких процедурах.
Предпосылки создания изобретения
Минимально инвазивная интракардиальная абляция является предпочтительным способом лечения различных типов аритмий. Для проведения такого лечения врач, как правило, вводит катетер через сосудистую систему в сердце, приводит дистальный конец катетера в контакт с тканью миокарда в областях с аномальной электрической активностью, а затем подает напряжение к одному или более электродам на дистальном конце или рядом с ним для создания некроза ткани.
Определение надлежащей дозы энергии, которую следует приложить в процедуре абляции для достижения желаемого результата, зачастую вызывает сложности. Когда доза недостаточна, непроводящее поражение не будет распространяться достаточно глубоко через стенку сердца для прерывания аномальной проводимости, в результате чего аритмия может сохраняться или возвращаться после завершения процедуры. С другой стороны, избыточная доза может привести к опасному повреждению ткани в месте абляции и вокруг него. Известно, что надлежащая доза отличается в разных случаях в зависимости от различных факторов, таких как геометрия катетера, толщина стенки сердца, качество электрического контакта между электродом катетера и стенкой сердца, а также кровотоком в непосредственной близости от места абляции.
Для повышения точности и согласованности процедур абляции были предприняты попытки прогнозировать и контролировать абляцию, основанные на измерении соответствующих физиологических параметров. Некоторые подобные способы описаны, например, в патенте США № 7306593, содержание которого включено в настоящий документ путем ссылки. Другим примером является патент США № 7918850, содержание которого включено в настоящий документ путем ссылки, в котором описан процесс мониторинга за ходом интракардиальной абляции в режиме практически реального времени путем оценки захвата сигнала электростимуляции.
Оптические способы оценки интракардиального поражения также известны в данной области. Например, в патенте США № 7662152, содержание которого включено в настоящий документ путем ссылки, описан катетер, содержащий корпус катетера и точечный электрод, выполненный с возможностью абляции ткани. Катетер дополнительно включает в себя множество оптических волноводов, выполненных с возможностью передавать оптическую энергию к точечному электроду и от него. Дистальная часть каждого волновода проходит через полую дистальную часть точечного электрода и прерывается в отверстиях, образованных в оболочке. Оценка поражения осуществляется путем измерения интенсивности света одной или более длин волн, улавливаемого на кончике катетера, полученного при излучении кончиком катетера света на ткань, на которой проводят абляцию. В патенте США № 8123745, содержание которого включено в настоящий документ путем ссылки, описан абляционный катетер с оптически прозрачным электропроводным наконечником для аналогичных целей.
Краткое описание изобретения
Варианты осуществления настоящего изобретения, описанные ниже в настоящем документе, обеспечивают улучшенные способы и устройства для измерения оптических свойств ткани в теле. Такие способы и устройства могут быть эффективно использованы для оптической оценки поражения.
Таким образом, в соответствии с вариантом осуществления настоящего изобретения медицинское устройство для измерения оптических свойств ткани в теле, включающее в себя зонд, имеющий дистальный сегмент, выполнено с возможностью введения в тело пациента. Зонд включает в себя по меньшей мере один чувствительный оптический блок, который размещен вдоль дистального сегмента и включает в себя первый и второй источники излучения, выполненные с возможностью испускать оптическое излучение в различных соответствующих первом и втором диапазонах длин волн по направлению к ткани в теле в непосредственной близости от дистального сегмента. Оптический датчик выполнен с возможностью принимать оптическое излучение в первом и втором диапазонах длин волн, которое рассеивается от ткани, и выводить первый и второй электрические сигналы в ответ на интенсивность принятого оптического излучения.
В некоторых вариантах осуществления первый диапазон длин волн представляет собой инфракрасный диапазон, а второй диапазон длин волн представляет диапазон видимого света. Например, первый диапазон длин волн может иметь пик интенсивности между 860 и 880 нм, тогда как пик интенсивности второго диапазона длин волн находится между 710 и 730 нм.
Как правило, устройство включает в себя блок управления, который соединен для выполнения сравнения первого и второго сигналов, а также для вывода указания на состояние ткани в ответ на указанное сравнение. Указание может быть основано на соотношении первого и второго сигналов.
В описанном варианте осуществления дистальный сегмент зонда включает в себя элемент для абляции, который выполнен с возможностью абляции ткани, а также указание, которое обеспечивает оценку поражения, образованного в ткани с помощью элемента для абляции. Элемент для абляции может включать в себя электрод, который выполнен с возможностью приведения в контакт с тканью и абляции ткани путем приложения радиочастотной энергии к ткани, причем блок управления выполнен с возможностью обеспечивать оценку поражения в процессе образования поражения во время приложения радиочастотной энергии. В одном варианте осуществления дистальный сегмент зонда выполнен с возможностью приведения в контакт и абляции эндокардиальной ткани в сердце пациента.
В некоторых вариантах осуществления первый и второй источники излучения включают в себя светоизлучающие диоды, которые встроены в дистальный сегмент.
Необязательно по меньшей мере один чувствительный оптический блок включает в себя множество чувствительных оптических блоков, которые размещены в различных соответствующих местах вдоль дистального сегмента. В одном варианте осуществления множество чувствительных оптических блоков включают в себя по меньшей мере первый и второй чувствительные оптические блоки, которые отстоят друг от друга вдоль дистального сегмента, а устройство включает в себя блок управления, который выполнен с возможностью взаимодействовать с первым и вторым чувствительными оптическими блоками таким образом, чтобы измерять сигналы, выводимые оптическим датчиком на первый чувствительный оптический блок в ответ на излучение, испускаемое попеременно источниками излучения в каждом из первого и второго чувствительных оптических блоков.
В другом варианте осуществления дистальный сегмент включает в себя колпачок, включающий в себя внешнюю стенку, перфорированную одним или более отверстиями, и внутреннюю стенку, содержащуюся внутри внешней стенки, на которой по меньшей мере один чувствительный оптический блок смонтирован таким образом, чтобы испускать оптическое излучение по направлению к ткани и принимать его из ткани через отверстия во внешней стенке. Внешняя стенка может включать в себя электропроводный материал, выполненный с возможностью приведения в контакт с тканью и приложения электрической энергии к ткани таким образом, чтобы выполнить абляцию ткани, в то время как орошающая текучая среда протекает через полость между внутренней и внешней стенками и выходит из полости через одно или более отверстий.
В настоящем документе также в соответствии с вариантом осуществления настоящего изобретения предложен способ оптической оценки поражения ткани, который включает в себя введение дистального сегмента зонда в тело пациента. Первый и второй источники излучения, размещенные вдоль дистального сегмента, приводят в действие для испускания оптического излучения в различных соответствующих первом и втором диапазонах длин волн по направлению к ткани в теле, которая находится в непосредственной близости от дистального сегмента. Оптический датчик, размещенный вдоль дистального сегмента, принимает оптическое излучение в первом и втором диапазонах длин волн, которое рассеивается от ткани. Первый и второй электрические сигналы, выводимые оптическим датчиком в ответ на интенсивность принятого оптического излучения в первом и втором диапазонах длин волн соответственно, обрабатываются для оценки состояния ткани.
В настоящем документе в соответствии с вариантом осуществления настоящего изобретения дополнительно предложен способ оптической оценки поражения ткани, который включает в себя приложение радиочастотной (РЧ) электрической энергии таким образом, чтобы образовать поражение в участке ткани внутри тела пациента. Первый разброс интенсивности на участке в инфракрасном диапазоне излучения и вторая разброс интенсивности на участке в красном диапазоне излучения измеряются во время приложения электрической РЧ-энергии. Образование поражения оценивается путем сравнения первого разброса интенсивности и второго разброса интенсивности.
Настоящее изобретение станет в полной мере более понятным из следующего подробного описания вариантов осуществления, представленных в настоящем документе, рассмотренных вместе со следующими чертежами.
Краткое описание чертежей
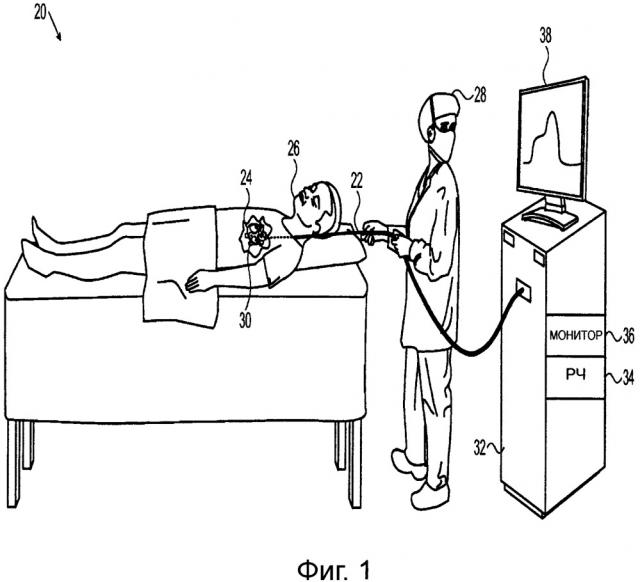
На фиг. 1 представлено схематичное изображение системы для интракардиальной абляции в соответствии с вариантом осуществления настоящего изобретения.
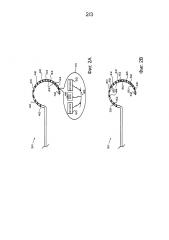
На фиг. 2A представлено схематичное изображение дистального сегмента катетера для абляции и измерения в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 2B представлено схематичное изображение дистального сегмента катетера для абляции и измерения в соответствии с другим вариантом осуществления настоящего изобретения.
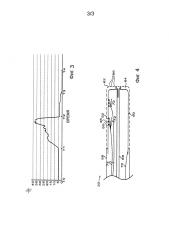
На фиг. 3 представлен график спектрального коэффициента отражения, измеренного катетером во время процедуры абляции, в соответствии с вариантом осуществления настоящего изобретения.
На фиг. 4 представлено схематичное изображение в разрезе дистального сегмента катетера для абляции и измерения в соответствии с другим вариантом осуществления настоящего изобретения.
Подробное описание вариантов осуществления
В вариантах осуществления настоящего изобретения, описанных ниже в настоящем документе, предложены устройства и способы, которые могут быть использованы для быстрой и точной оценки состояния ткани в теле путем сравнения интенсивности рассеяния от ткани на различных длинах волн. Конкретно авторы изобретения обнаружили, что отношение между рассеянием инфракрасного и видимого света от ткани внутри тела и, в частности, сердечной ткани четко изменяется по мере абляции ткани с резким увеличением соотношения рассеяния от инфракрасного света к видимому. Таким образом, подходящий чувствительный оптический блок в зонде для абляции (таком как сердечный катетер для абляции) может быть использован для оценки образования поражения в режиме реального времени во время процедуры абляции. Термин «рассеяние» используется в настоящем описании и в формуле изобретения в его широком общепринятом смысле, включая в себя по существу как отраженное, так и переданное излучение, которое достигает оптического датчика через рассматриваемую ткань или, иными словами, как прямое, так и обратное рассеяние.
В описанных вариантах осуществления по меньшей мере один чувствительный оптический блок размещен вдоль дистального сегмента зонда, который введен в тело пациента. Этот чувствительный блок содержит (по меньшей мере) два источника излучения, которые испускают оптическое излучение в различных соответствующих диапазонах длин волн по направлению к ткани в непосредственной близости от дистального сегмента в теле. Оптический датчик в чувствительном блоке принимает оптическое излучение, которое рассеивается от ткани в различных диапазонах длин волн и выводит электрические сигналы в ответ на интенсивность излучения. Термин «оптическое излучение», используемый в настоящем описании и формуле изобретения, включает в себя видимое, инфракрасное и ультрафиолетовое излучение. Как правило (хотя и не обязательно), источники излучения являются светоизлучающими диодами (светодиодами), один из которых испускает инфракрасное излучение и другой видимый свет в различных соответствующих временных интервалах. Источники излучения и датчик в чувствительном блоке могут быть расположены в непосредственной близости друг к другу или альтернативно они могут быть разнесены в различные места вдоль дистального сегмента.
Блок управления, соединенный с зондом, сравнивает сигналы, которые датчик выводит в ответ на разброс интенсивности излучения, принятого в различных диапазонах длин волн, и генерирует указание на состояние ткани на основе этого сравнения. Это указание, как правило, может содержать оценку образования поражения в процессе абляции ткани, выполняемой зондом. Указание может быть основано, например, на соотношении рассеяния от инфракрасного света к видимому, которое, как обнаружили авторы настоящего изобретения, резко возрастает по мере абляции ткани.
На фиг. 1 представлено схематичное изображение системы 20 для лечения путем абляции сердца в соответствии с вариантом осуществления настоящего изобретения. Оператор 28 (такой как кардиолог, осуществляющий хирургическое вмешательство) вводит инвазивный зонд, такой как катетер 22, через сосудистую систему пациента 26 в камеру сердца 24 пациента. Например, для лечения мерцательной аритмии оператор может продвинуть катетер в левое предсердие и привести дистальный сегмент 30 катетера в контакт с тканью миокарда, которую необходимо подвергнуть абляции.
Катетер 22 соединен на его проксимальном конце с пультом управления 32, который используется в качестве блока управления при приложении и мониторинге желаемого лечения под контролем оператора 28. Пульт управления 32 содержит генератор радиочастотной (РЧ) энергии 34, который подает электрическую энергию с помощью катетера 22 к дистальному сегменту 30 для абляции ткани-мишени. Схема мониторинга 36 обеспечивает указание состояния ткани в непосредственной близости от дистального сегмента 30 путем обработки сигналов, выводимых на одном или более чувствительных оптических блоках вдоль дистального сегмента, как описано ниже, и может отображать это указание на экране дисплея 38. Как правило, орошающий насос (не показан) подает охлаждающую текучую среду, такую как физиологический раствор, через катетер 22 для орошения ткани, лечение которой осуществляется с помощью дистального сегмента 30. На основе информации, предоставленной схемой мониторинга 36, пульт управления 32 может управлять энергией, прилагаемой генератором радиочастотной (РЧ) энергии 34 и/или потоком текучей среды, поступающим от насоса, либо автоматически, либо в ответ на входные сигналы с помощью оператора 28.
Система 20 может иметь в качестве основы, например, систему CARTO, предложенную Biosense Webster Inc. (г. Даймонд-Бар, штат Калифорния), которая обеспечивает широкие возможности для поддержки навигации и управления катетером 22. Однако эти возможности системы, включая подробное описание функций мониторинга и управления пульта управления 32, по существу (кроме функций оптического измерения, описанных в настоящем документе) выходят за рамки настоящей патентной заявки.
На фиг. 2A представлено схематичное изображение дистального сегмента 30 катетера 22 в соответствии с вариантом осуществления настоящего изобретения. В этом примере дистальный сегмент представлен как содержащий дугообразную часть 40, имеющую форму катетера типа «лассо». Такого рода форма катетера широко используется в создании кольцевых поражений вокруг устьев легочных вен, например, для лечения мерцательной аритмии. Для этого дистальный сегмент 30 приводят в контакт с эндокардиальной тканью по всей или по меньшей мере части длины дугообразной части 40. Элементы для абляции в форме электродов 42 размещены вдоль длины дистального сегмента 30 и приводятся в действие с помощью РЧ-энергии от генератора 34 для абляции ткани, с которой они находятся в контакте. Альтернативно дистальный сегмент 30 может содержать другие типы элементов для абляции, такие как мощные ультразвуковые преобразователи или элементы для криоабляции, которые известны в данной области.
Чувствительные оптические блоки 44 размещены вдоль дистального сегмента 30 в местах, которые чередуются между электродами 42. Каждый такой блок 44, как показано на вставке на фиг. 2A, содержит два источника излучения 50 и 52, которые направляют оптическое излучение в различных соответствующих диапазонах длин волн по направлению к ткани миокарда 48 в непосредственной близости от чувствительного блока. Авторы изобретения обнаружили, что для оценки образования поражения преимуществом является то, что источник излучения 50 может испускать инфракрасное излучение, тогда как источник излучения 52 испускает видимый свет, такой как красный свет. Диапазоны длин волн могут иметь соответствующие пиковые интенсивности, например, от 860 до 880 нм и от 710 до 730 нм. В одном варианте осуществления источники 50 и 52 содержат светодиоды с длиной волны эмиссионного центра приблизительно 870 и 720 нм соответственно.
Альтернативно другие комбинации длин волн могут быть полезны для оценки абляции и других указаний, таких как оценка контакта между катетером и тканью тела. Например, может быть полезен выбор длины волны в видимом спектре, который значительно поглощается гемоглобином крови, так как в отсутствие хорошего контакта с тканью разброс интенсивности на этой длине волны будет близок к нулю. При контакте с тканью смещение крови приводит к снижению поглощения, таким образом давая усиленный сигнал, который указывает на контакт с тканью. Более того, после начала абляции потеря насыщенной кислородом крови (в дополнение к другим изменениям оптических свойств ткани) и последующее снижение поглощения могут дать дополнительную информацию о процессе абляции.
Каждый чувствительный блок 44 также содержит оптический датчик 46, такой как фотодиод или другой подходящий чувствительный к излучению элемент, который принимает оптическое излучение, отраженное от ткани 48, и выводит электрические сигналы в ответ на интенсивность принятого излучения. Как правило, источники излучения 50 и 52 уплотнены по времени, так что соответствующие сигналы, выводимые датчиком 46, вследствие отраженного излучения на двух диапазонах длин волн могут быть четко распознаны. Необязательно чувствительный блок 44 может содержать три или более источников излучения, каждый со своей испускаемой длиной волны, так что датчик 46 может измерять отражательную способность ткани с более точным разрешением длины волны и/или в более широком диапазоне длин волн. Источники излучения 50, 52 и датчик 46, как правило, встроены в дистальный сегмент 30 в подходящей прозрачной герметичной оболочке, такой как прозрачный биосовместимый пластик.
Схема мониторинга 36 принимает сигналы, которые выводятся датчиком 46, и сравнивает уровни сигнала в результате рассеяния излучения при различных длинах волн источников 50 и 52 для получения указания на уровень абляции ткани 48. Таким образом, пульт управления 32 может оценить поражение, которое образуется в процессе абляции, и может отображать эту оценку на дисплее 38. Как правило, как показано ниже, это сравнение уровней сигнала основано на соотношении сигналов в результате рассеяния излучения при различных длинах волн источников 50 и 52, но альтернативно или дополнительно другие математические отношения могут быть использованы при анализе сигналов.
В варианте осуществления, представленном на фиг. 2A, множество чувствительных оптических блоков 44 размещено в различных соответствующих местах, отстоящих друг от друга вдоль дугообразной части 40 дистального сегмента 30. Альтернативно катетер 22 может содержать только один чувствительный оптический блок такого рода, но использование множества чувствительных блоков позволяет пульту управления 32 оценивать образование поражения на более широком участке. Для расширения участка оценки дополнительно до областей между различными чувствительными оптическими блоками вдоль длины дистального сегмента схема мониторинга 36 может управлять источниками излучения 50, 52 в соседних чувствительных блоках 44 для их попеременной работы, так что датчик 46 в одном из чувствительных оптических блоков может измерять рассеяние излучения, включая как передачу, так и отражение от источников излучения в соседнем(их) чувствительном(ых) блоке(ах). Это рассеяние происходит в ткани 48 между соседними чувствительными блоками 44 и, таким образом, указывает на образование поражения в этих промежуточных областях.
На фиг. 2B представлено схематичное изображение дистального сегмента 30 катетера 22 в соответствии с альтернативным вариантом осуществления настоящего изобретения. В этом варианте осуществления источники 50, 52 и датчики 46 отстоят друг от друга в различных местах вдоль длины дугообразной части 40. Любая комбинация пары источников 50, 52 и датчика 46 может рассматриваться как чувствительный оптический блок в этой конфигурации для осуществления выборки рассеяния от области ткани между выбранными источниками и датчиком.
Хотя на фиг. 2А и 2В изображено конкретное количество чувствительных оптических блоков 44, размещенных в определенных местах и конфигурациях вдоль дистального сегмента 30, в альтернативных вариантах осуществления по существу может быть использовано любое количество таких чувствительных оптических блоков и, возможно, только один чувствительный оптический блок. Более того, хотя на фиг. 2А и 2В представлен катетер типа «лассо», в других вариантах осуществления чувствительные оптические блоки данного рода могут быть установлены на других типах катетеров и других инвазивных зондах, которые имеют любую подходящую конфигурацию, для применения не только в сердце, но и в других органах и участках тела.
На фиг. 3 представлен график спектрального соотношения принятых сигналов, которые измеряются с помощью катетерной системы с использованием чувствительного оптического блока 44, как функция времени во время процедуры абляции в соответствии с вариантом осуществления настоящего изобретения. Источниками излучения 50 и 52 в этом примере являются светодиоды, испускающие диапазоны длин волн, которые имеют пиковые интенсивности при 870 нм и 720 нм соответственно. Вертикальная ось показывает соотношение (отмечено на чертеже как I1/I2) интенсивности рассеяния от ткани 48 при двух различных длинах волн на основе сигналов, выводимых датчиком 46. На этом чертеже представлена эффективность этого соотношения интенсивности при оценке абляции ткани.
В первоначальный период времени до начала абляции (от T0 до T1) исходное соотношение интенсивности рассеяния для ткани, которая не была подвергнута абляции, составляет приблизительно 5:1. РЧ-энергия подается на электрод катетера, начиная с момента времени T1. В процессе образования поражения при абляции соотношение постепенно увеличивается до приблизительно 40:1. В момент времени Т2 РЧ-энергия выключается, а катетер перемещается таким образом, чтобы чувствительный блок 44 был обращен к другому участку ткани, который не был подвергнут абляции, а соотношение возвращается к предыдущему значению приблизительно 5:1. Когда катетер извлекают из ткани в момент времени T3, датчик 44 принимает рассеянное излучение только от клеток крови в камере сердца, а соотношение интенсивности падает почти до нуля.
На фиг. 4 представлено схематичное изображение в разрезе дистального сегмента 30 катетера для абляции и измерения в соответствии с другим вариантом осуществления настоящего изобретения. В этом варианте осуществления колпачок, прикрепленный к дистальному концу вставной трубки 58 катетера, содержит внешнюю стенку 62, которая перфорирована отверстиями 66, и внутреннюю стенку 60, содержащуюся внутри внешней стенки. Через просвет 68 подается орошающая текучая среда в полость 64, которая образована между внешней стенкой 62 и внутренней стенкой 60, а орошающая текучая среда выходит из полости через отверстия 66. Как правило, стенки 60 и 62 содержат тонкие оболочки из металлического материала, которые разъединяются друг от друга небольшими металлическими разделителями (не показаны), вокруг которых текучая среда может протекать в полость 64. Проводник 70 подает электрическую РЧ-энергию от пульта управления 32 в колпачок, который используется в качестве электрода для абляции ткани, с которой внешняя стенка 62 находится в контакте.
Чувствительные оптические блоки 72 смонтированы на внутренней стенке 60 так, чтобы источники 50, 52 испускали оптическое излучение через отверстия 66 по направлению к ткани, которая находится в непосредственной близости от колпачка, а датчики 46 принимают отраженное излучение через отверстия. Источники 50, 52 и датчик 46 могут быть введены в углубления на внутренней стенке, как показано на чертеже. Эта конфигурация вставки может быть полезна для направления излучения, испускаемого источниками вовне по направлению к ткани, а также ограничивает угловой размер отраженного излучения, которое регистрируется датчиком.
Хотя ряд конкретных конфигураций чувствительного оптического блока представлен и описан выше, альтернативные конфигурации, которые можно использовать для аналогичных целей, будут очевидны специалистам в данной области после прочтения приведенного выше описания и считаются находящимися в рамках объема настоящего изобретения. Таким образом, следует понимать, что описанные выше варианты осуществления приведены лишь в качестве примера и настоящее изобретение не ограничено конкретно изображенным и описанным выше в настоящем документе. Напротив, объем настоящего изобретения включает в себя как комбинации, так и подкомбинации различных вышеописанных в настоящем документе особенностей, а также их варианты и модификации, которые могут быть предложены специалистами в данной области после ознакомления с приведенным выше описанием и которые не были описаны на предшествующем уровне техники.
1. Медицинское устройство для измерения оптических свойств ткани в теле, содержащее зонд, имеющий дистальный сегмент, выполненный с возможностью введения в тело пациента, причем зонд содержит по меньшей мере один чувствительный оптический блок, который размещен вдоль дистального сегмента и содержит:
первый и второй источники излучения, выполненные с возможностью испускать оптическое излучение в различных соответствующих первом и втором диапазонах длин волн по направлению к ткани в теле в непосредственной близости от дистального сегмента; и
оптический датчик, выполненный с возможностью принимать оптическое излучение в первом и втором диапазонах длин волн, которое рассеивается от ткани, и выводить первый и второй электрические сигналы в ответ на интенсивность принятого оптического излучения.
2. Устройство по п. 1, в котором первый диапазон длин волн является инфракрасным диапазоном, а второй диапазон длин волн является диапазоном видимого света.
3. Устройство по п. 2, в котором пиковая интенсивность первого диапазона длин волн находится между 860 и 880 нм, а пиковая интенсивность второго диапазона длин волн находится между 710 и 730 нм.
4. Устройство по п. 2, дополнительно содержащее блок управления, соединенный для выполнения сравнения первого и второго сигналов, а также для вывода показания на состояние ткани в ответ на указанное сравнение.
5. Устройство по п. 4, в котором дистальный сегмент зонда содержит элемент для абляции, который выполнен с возможностью абляции ткани, и причем показание предоставляет оценку поражения, образованного в ткани с помощью элемента для абляции.
6. Устройство по п. 5, в котором элемент для абляции содержит электрод, выполненный с возможностью приведения в контакт с тканью и абляции ткани путем приложения радиочастотной энергии к ткани, и причем блок управления выполнен с возможностью предоставлять оценку поражения в процессе образования поражения во время приложения радиочастотной энергии.
7. Устройство по п. 6, в котором дистальный сегмент зонда выполнен с возможностью приведения в контакт с эндокардиальной тканью и абляции эндокардиальной ткани в сердце пациента.
8. Устройство по п. 4, в котором показание основано на соотношении первого и второго сигналов.
9. Устройство по п. 1, в котором первый и второй источники излучения содержат светоизлучающие диоды, которые встроены в дистальный сегмент.
10. Устройство по п. 1, в котором по меньшей мере один чувствительный оптический блок содержит множество чувствительных оптических блоков, которые размещены в различных соответствующих местах вдоль дистального сегмента.
11. Устройство по п. 10, в котором множество чувствительных оптических блоков содержит по меньшей мере первый и второй чувствительные оптические блоки, которые отстоят друг от друга вдоль дистального сегмента, и
причем устройство содержит блок управления, который выполнен с возможностью взаимодействовать с первым и вторым чувствительными оптическими блоками таким образом, чтобы измерять сигналы, выводимые оптическим датчиком на первый чувствительный оптический блок в ответ на излучение, испускаемое попеременно источниками излучения в каждом из первого и второго чувствительных оптических блоков.
12. Устройство по п. 1, в котором дистальный сегмент содержит колпачок, содержащий внешнюю стенку, перфорированную одним или более отверстиями, и внутреннюю стенку, содержащуюся внутри внешней стенки, на которой по меньшей мере один чувствительный оптический блок смонтирован таким образом, чтобы испускать оптическое излучение по направлению к ткани и принимать его из ткани через отверстия во внешней стенке.
13. Устройство по п. 12, в котором внешняя стенка содержит проводящий материал, который выполнен с возможностью приведения в контакт с тканью и приложения электрической энергии к ткани таким образом, чтобы выполнить абляцию ткани, в то время как орошающая текучая среда протекает через полость между внутренней и внешней стенками и выходит из полости через одно или более отверстий.
14. Способ оптической оценки поражения ткани, содержащий:
введение дистального сегмента зонда в тело пациента;
приведение в действие первого и второго источников излучения, размещенных вдоль дистального сегмента, для испускания оптического излучения в различных соответствующих первом и втором диапазонах длин волн по направлению к ткани в теле в непосредственной близости от дистального сегмента;
прием оптическим датчиком, размещенным вдоль дистального сегмента, оптического излучения в первом и втором диапазонах длин волн, которое рассеивается от ткани; и
обработку первого и второго электрических сигналов, выводимых оптическим датчиком в ответ на интенсивность принятого оптического излучения в первом и втором диапазонах длин волн соответственно для оценки состояния ткани.
15. Способ по п. 14, в котором первый диапазон длин волн представляет собой инфракрасный диапазон, а второй диапазон длин волн представляет собой диапазон видимого света.
16. Способ по п. 14 и содержащий абляцию ткани с использованием зонда, в котором обработка первого и второго электрических сигналов содержит оценку образования поражения в ткани.
17. Способ по п. 16, в котором абляция ткани содержит приложение радиочастотной энергии к ткани, и причем образование поражения оценивается в процессе образования поражения во время приложения радиочастотной энергии.
18. Способ по п. 16, в котором введение дистального сегмента содержит введение катетера в сердце пациента таким образом, чтобы выполнить абляцию эндокардиальной ткани в сердце.
19. Способ по п. 14, в котором первый и второй источники излучения содержат светоизлучающие диоды, которые встроены в дистальный сегмент.
20. Способ по п. 14, в котором приведение в действие первого и второго источников излучения и прием оптического излучения содержат испускание и прием оптического излучения множеством чувствительных оптических блоков, которые размещены в различных соответствующих местах вдоль дистального сегмента.
21. Способ по п. 20, в котором множество чувствительных оптических блоков содержит по меньшей мере первый и второй чувствительные оптические блоки, которые отстоят друг от друга вдоль дистального сегмента, и
причем способ содержит измерение сигналов, выводимых оптическим датчиком на первый чувствительный оптический блок в ответ на излучение, испускаемое попеременно источниками излучения в каждом из первого и второго чувствительных оптических блоков.
22. Способ по п. 14, в котором дистальный сегмент содержит колпачок, содержащий внешнюю стенку, перфорированную одним или более отверстиями, и внутреннюю стенку, содержащуюся внутри внешней стенки и на которой первый и второй источники излучения и оптический датчик смонтированы таким образом, чтобы испускать оптическое излучение по направлению к ткани и принимать его из ткани через отверстия во внешней стенке.
23. Способ оптической оценки поражения ткани, содержащий:
приложение радиочастотной (РЧ) электрической энергии таким образом, чтобы образовать поражение на участке ткани внутри тела пациента;
измерение первого разброса интенсивности на участке в инфракрасном диапазоне излучения и второго разброса интенсивности на участке в красном диапазоне излучения при приложении электрической РЧ-энергии; и
оценку образования поражения путем сравнения первого разброса интенсивности и второго разброса интенсивности.
24. Способ по п. 23, в котором пиковая интенсивность инфракрасного диапазона излучения находится между 860 и 880 нм, а пиковая интенсивность красного диапазона излучения находится между 710 и 730 нм.
25. Способ по п. 23, в котором сравнение первого разброса интенсивности и второго разброса интенсивности содержит вычисление соотношения сигналов, которые соответствуют первому и второму разбросу интенсивности.
26. Способ по п. 23, в котором приложение электрического РЧ-излучения содержит абляцию эндокардиальной ткани с помощью дистального сегмента катетера, который введен в сердце пациента, и причем первый и второй разбросы интенсивности измеряются с использованием чувствительного оптического блока на дистальном сегменте.