Способ определения вероятности наличия нестабильных атеросклеротических бляшек в коронарных артериях у пациентов с коронарным атеросклерозом
Иллюстрации
Показать всеИзобретение относится к области медицины, а именно к кардиологии, и касается способа определения вероятности наличия нестабильных атеросклеротических бляшек в коронарных артериях у пациентов с коронарным атеросклерозом. Способ заключается в том, что в сыворотке крови пациента с коронарным атеросклерозом определяют значения воспалительных биомаркеров: С-реактивного белка, интерлейкина-6, интерлейкина-8, моноцитарного хемоаттрактантного протеина-1, и окислительный биомаркер - тест FORT, полученные значения сравнивают с пороговым значением соответствующего биомаркера: для С-реактивного белка равное 10 мкг/мл, для интерлейкина-6 равное 10 пг/мл, для интерлейкина-8 равное 12 пг/мл, для моноцитарного хемоаттрактантного протеина-1 равное 480 пг/мл, для теста FORT равное 2,3 ммоль/л. При наличии, как минимум, четырех значений биомаркеров больше порогового значения соответствующего биомаркера говорят о вероятности наличия нестабильных бляшек в коронарных артериях у пациента с коронарным атеросклерозом. Данный способ позволит на ранней стадии определить возможность развития осложнений ИБС, ускорить темпы дополнительного обследования и выбор тактики лечения пациента. 2 табл., 3 пр.
Реферат
Изобретение относится к области медицины, а именно к кардиологии, и может быть использовано для ранней диагностики осложнений ишемической болезни сердца (ИБС), таких как острый коронарный синдром, и выбора тактики лечения данного заболевания.
Распространенность и смертность от осложнений сердечно-сосудистых заболеваний, таких как инфаркт миокарда, нестабильная стенокардия и внезапная сердечная смерть, объединенных общим термином «острый коронарный синдром» (ОКС), стоит на первом месте во многих странах мира, в том числе и в России [1].
Существует множество методов исследования, позволяющих оценить состояние сосудов сердца:
1. Эхокардиография или ультразвуковое исследование (УЗИ) - это популярный неинвазивный метод обследования сердца и сосудов с использованием ультразвука. Данное исследование позволяет определять эластичность и жесткость сосудистых стенок, целостность и функциональное состояние внутренней поверхности кровеносных сосудов, изменение структуры и толщины стенок сосуда. При обнаружении атеросклеротических тромбов и бляшек возможно определение их локализации, эхогенности, состояния поверхности.
2. Ультразвуковое сканирование позволяет с большой точностью оценить состояние крупных сосудов сердца, чего нельзя сказать о более мелких сосудах сердца и это является недостатком метода. Кроме того, атеросклеротические образования затрудняют прохождение ультразвуковой волны и могут искажать результаты. А также УЗИ-исследование зависит от квалификационного уровня врача-исследователя.
3. Коронарография (коронароангиография) - это рентгенологическое исследование с применением контрастного препарата, которое позволяет диагностировать все поражения коронарного русла, включая тяжелые многососудистые поражения, с высокой точностью. Такое обследование считается стандартом диагностики ИБС, так как позволяет точно установить место и степень спазма, стеноза или закупорки коронарных артерий сердца.
Недостатком данного метода является его инвазивный характер и высокий риск развития различных осложнений при выполнении исследования. Кроме того, следует учесть ограничение доступности данного метода в реальной врачебной практике. Наличие подобной аппаратуры возможно лишь в крупных специализированных сердечно-сосудистых центрах.
4. Компьютерная томография (КТ) - это современный метод исследования внутренних органов человека с использованием рентгеновского излучения. Для повышения информативности КТ выполняют с использованием контрастного вещества (в частности, при изучении сосудов и полых органов).
Недостаток метода - в его дороговизне и наличии специальной аппаратуры. Как правило, такую аппаратуру имеют только крупные медицинские центры. Кроме того, КТ дает лучевую нагрузку на ткани, поэтому его нельзя применять многократно.
5. Магнитно-резонансная томография (МРТ) основана на принципе получения массива данных и моделирования на его основе трехмерного изображения органа с помощью электромагнитных волн. Проведение МРТ позволяет обнаружить те изменения в сосудах, которые происходят при атеросклерозе и недоступны другим методам диагностики: наличие атеросклеротических бляшек; их размер, форму, стабильность; степень сужения сосуда в месте расположения бляшки; распространенность процесса; наличие тромбов; аномалии развития сосудов.
Недостатком метода является большая стоимость и длительное время исследования. Подобные исследования проводятся в специализированных клиниках с участием высококвалифицированных специалистов.
Известен «Способ диагностики поражения коронарного русла» (патент РФ №2261657, А61В 8/00), при котором во время стресс-эхокардиографии с физической нагрузкой определяют нарушения регионарной сократимости миокарда левого желудочка. На основе изменения скоростей движения базального сегмента передней стенки и срединного сегмента боковой стенки левого желудочка диагностируют поражение передней межжелудочковой ветви и огибающей ветви левой коронарной артерии.
Недостатком данного способа является использование дорогостоящей аппаратуры, участие высококвалифицированных специалистов для выполнения сложных диагностических исследований, что вносит ограничения по внедрению данного способа в реальную клиническую практику.
Известен «Способ диагностики поражения коронарного русла» (патент РФ №2180520, А61В 8/06, A61N 1/3), заключающийся в том, что во время проведения стресс-эхокардиографических проб с чреспищеводной электрокардиостимуляцией или добутамином регистрируют ударный объем (УО). При его снижении на первых ступенях пробы с чреспищеводной электрокардиостимуляцией на 30% и более по сравнению с исходным значением или снижении на последних ступенях пробы с добутамином диагностируют тяжелое многососудистое поражение коронарного русла.
Недостатком способа является проведение объемных диагностических процедур с использованием дорогостоящей аппаратуры и высококвалифицированных специалистов и требует большого количества времени на проведение. Данная методика позволяет диагностировать тяжелое многососудистое поражение. Но во время проведения исследования возможны осложнения, неблагоприятные для пациентов, вплоть до проведения реанимационных мероприятий.
Следует отметить, что во всех случаях клинического проявлений коронарного атеросклероза и ИБС пусковым механизмом служит нарушение целостности эндотелия на участке изъязвления/деструкции покрышки нестабильной атеросклеротической бляшки (АСБ) и последующее тромбообразование, приводящее к окклюзии коронарной артерии (КА), ишемии и некрозу миокарда [2, 3].
Известно, что стабильная АСБ характеризуется толстой покрышкой, гомогенным липидным ядром, отсутствием воспалительных изменений, а нестабильная АСБ - тонкой покрышкой (толщина <65 мкм) или участком истонченной покрышки с очаговой деструкцией эндотелия, воспалительной клеточной инфильтрацией (более 25 клеток в поле зрения длиной 0,3 мм), рыхлым липидным ядром (>40% объема АСБ) с участками некроза [3-5].
Важную роль в развитии нестабильной АСБ играет воспалительно-деструктивный процесс [6-10], во время которого происходит значительная инфильтрация нестабильных АСБ моноцит/макрофагами (МФ) и Т-лимфоцитами (Т-ЛФ), секретирующими провоспалительные цитокины, в том числе интерлейкин-1 (ИЛ-1β), интерлейкин-6 (ИЛ-6), интерлейкин-8 (ИЛ-8), интерлейкин-18 (ИЛ-18), фактор некроза опухоли альфа (ФНО-α) и другие. ИЛ-1β и ФНО-α индуцируют образование эндотелиальными клетками молекул адгезии, приводя к снижению антиадгезивных и антикоагуляционных свойств эндотелия, ИЛ-6 - цитотоксический фактор дифференцировки Т-ЛФ - стимулирует синтез и секрецию основных белков острой фазы воспаления, ИЛ-8 стимулирует продукцию моноцит / МФ факторов, активирующих хемотаксис нейтрофилов и Т-ЛФ в атеросклеротические очаги, ИЛ-18, секретируемый Т-ЛФ, активирует моноцит / МФ, инициирует процессы апоптоза [6-10].
А также активированные МФ секретируют ряд хемоаттрактантов, в том числе моноцитарный хемотаксический протеин (МСР-1), эндотелиально-моноцитарный активирующий полипептид (ЕМАР-II), молекулы межклеточной адгезии (sICAM-1), молекулы адгезии эндотелиоцитов (sVCAM-1). МСР-1, экспрессирующийся МФ в ответ на воздействие на них цитокинов ФНО-α, ИЛ-1β и ИЛ-6, является моноцит- и Т-ЛФ-специфическим хемоаттрактантом [3, 11-14].
Согласно данным ряда исследований, у пациентов с ОКС в крови наблюдаются повышенные уровни таких воспалительных цитокинов и биомаркеров, как ИЛ-1β, ИЛ-6, ФНО-α, С-реактивный белок (СРБ), выявлены их независимые ассоциации с развитием атеросклероза и ОКС [15-18].
Ведущим патогенетическим компонентом сердечно-сосудистых заболеваний атеросклеротического генеза, включая ИБС и инфаркт миокарда, является окислительный стресс с усилением генерации активных кислородных метаболитов (АКМ). При развитии окислительного стресса все основные классы биомолекул, включая липиды, белки и нуклеиновые кислоты, могут стать критическими элементами повреждающего действия АКМ, что приводит к их патологической окислительной модификации. В возникновении и развитии атеросклеротического очага одна из ключевых ролей принадлежит образованию в крови и в сосудистой стенке богатых ХС окисленно модифицированных липопротеинов низкой плотности [19-21].
Задачей заявленного изобретения является создание неинвазивного, доступного и недорогого биохимического способа определения вероятности наличия нестабильных атеросклеротических бляшек в коронарных артериях, что может быть использовано для ранней диагностики осложнений ишемической болезни сердца у пациентов с коронарным атеросклерозом, позволит ускорить темпы дополнительного обследования и выбора тактики лечения пациентов.
Сущность данного способа заключается в том, что для определения вероятности наличия нестабильных атеросклеротических бляшек в коронарных артериях у пациентов с коронарным атеросклерозом в сыворотке крови пациента определяют значения воспалительных биомаркеров: С-реактивного белка, интерлейкина-6, интерлейкина-8, моноцитарного хемоаттрактантного протеина-1, и окислительный биомаркер - тест FORT, полученные значения сравнивают с пороговым значением соответствующего биомаркера: для С-реактивного белка равное 10 мкг/мл, для интерлейкина-6 равное 10 пг/мл, для интерлейкина-8 равное 12 пг/мл, для моноцитарного хемоаттрактантного протеина-1 равное 480 пг/мл, для теста FORT равное 2,3 ммоль/л, и при наличии, как минимум, четырех значений биомаркеров больше порогового значения соответствующего биомаркера говорят о вероятности наличия нестабильных бляшек в коронарных артериях у пациента с коронарным атеросклерозом.
Способ осуществляется следующим образом.
У обследуемого пациента в сыворотке крови путем лабораторных исследований определяют окислительный биомаркер - тест FORT, воспалительные биомаркеры: вч-СРБ, ИЛ-6, ИЛ-8, МСР-1, и сравнивают с пороговыми значениями этих биомаркеров.
Статистический анализ проведенных ранее [9-10] исследований позволил определить условную пороговую границу по каждому обозначенному показателю на основании построения гистограмм распределения. Увеличение частоты встречаемости пациентов с наличием нестабильных атеросклеротических бляшек для показателя МСР-1 наблюдается при значениях выше 480 пг/мл. Пороговое значение для ИЛ-6 составило 10 пг/мл. Распределение результатов пациентов по показателю ИЛ-8 дает нам основание для определения порогового значения 12 пг/мл. Ориентиром для оценки критического уровня СРБ в крови была концентрация 10 мкг/мл. Для результатов теста FORT повышенными считают значения более 2,3 ммоль/л.
Повышение четырех и более показателей из исследуемого лабораторно-биохимического комплекса свидетельствует о вероятности наличия нестабильных атеросклеротических бляшек в коронарных артериях у больных с коронарным атеросклерозом.
Предлагаемый способ был разработан на основе исследования группы пациентов с коронарным атеросклерозом. В группу вошли 62 пациента 48-72 лет (средний возраст 55,4±3,9 года) с коронарографически верифицированным коронарным атеросклерозом, со стабильной стенокардией напряжения II-III функционального класса, поступившие в Клинику ФГУ ННИИПК Росмедтехнологий на операцию коронарного шунтирования. У пациентов, поступивших на операцию, в ходе операции по интраоперационным показаниям была проведена эндартерэктомия из КА.
Каждый материал эндартерэктомии, содержащий интима-медиа КА, был продольно и поперечно симметрично разделен на несколько фрагментов для проведения гистологических и биохимических исследований. Гистологический анализ фрагментов интима-медиа КА после макроскопического описания образцов (распространенность АСБ, степень сужения просвета артерии, кровоизлияния в структуры АСБ, участки обызвествления, тромбы) и стандартной окраски гематоксилином и эозином и по Ван Гизону проводили на бинокулярном микроскопе Axiostar Plus. После гистологического анализа фрагментов интима-медиа у 38 пациентов были определены только стабильные АСБ, у 24 пациентов - только нестабильные АСБ. Стабильные и нестабильные АСБ дифференцировали согласно описанным критериям [3-5].
В гомогенатах фрагментов интима-медиа и в сыворотке крови методом иммуноферментного анализа определяли уровни провоспалительных цитокинов ФНО-α, ИЛ-6, ИЛ-8 (Bender MedSystems наборы), вч-СРБ, хемоаттрактанта МСР-1.
Прямую оценку окислительного стресса (тест FORT - Free Oxygen Radicals Testing) проводили на анализаторе «FORM Plus CR3000» («Callegary», Италия). Выраженность окислительного стресса (тест FORT) оценивалась по выделению активных форм кислорода с использованием колориметрической регистрации. Метод основан на способности ионов металла катализировать в присутствии гидроперекисей образование свободных радикалов.
Результаты исследований, полученные ранее [9, 10], показали, что для нестабильных АСБ, по сравнению с другими стадиями развития атеросклеротических очагов (липидное пятно, стабильные молодые и фиброзные АСБ), характерны наибольшие концентрации ИЛ-6 и ИЛ-8 (15,9±1,1 и 37,1+4,8 пг/мг белка соответственно), хемоаттрактанта МСР-1 - 401,7+39,8 пг/мл [9, 10]. Несмотря на то что уровень вч-СРБ в крови более 2,0 мкг/мл считается повышенным [18], у пациентов с нестабильными АСБ критическим уровнем вч-СРБ в крови принята концентрация 10 мкг/мл.
Для определения в крови значимых биомаркеров нестабильности атеросклеротических очагов коронарных артерий статистический анализ результатов проводили в 2 этапа.
Сначала для поиска ассоциаций между показателями в сосудистой стенке КА и в крови все пациенты, согласно результатам гистологических исследований, были разделены на 2 группы:
1 группа - пациенты, у которых во фрагментах интима-медиа и КА обнаружены только стабильные АСБ;
2 группа - пациенты, у которых во фрагментах интима-медиа и КА обнаружены только нестабильные АСБ.
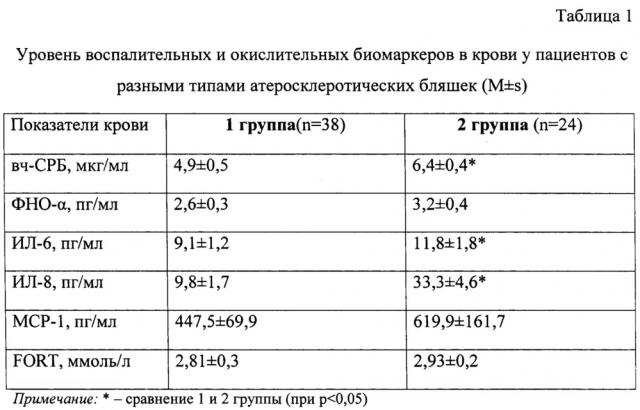
Результаты исследований в сыворотке крови приведены в таблице 1.
Концентрации вч-СРБ и ИЛ-6 в сыворотке крови у пациентов 2-й группы оказались выше в 1,3 раза, чем у пациентов 1-й группы. Эти данные соответствуют [9, 10] результатам исследования содержания воспалительных цитокинов на разных стадиях развития атеросклеротических очагов. Аналогичные, но значительно более выраженные различия между группами выявлены для концентрации в крови ИЛ-8. Так, у пациентов 2 группы этот показатель был выше более чем в 3 раза, по сравнению с пациентами 1 группы. Полученные данные подчеркивают значимое место этого цитокина, стимулирующего продукцию моноцитов /МФ [7, 14], среди биомаркеров дестабилизации атеросклеротических очагов не только в сосудистой стенке, но и в крови.
Также были выявлены повышенные значения МСР-1 в крови у пациентов с наличием нестабильных АСБ в коронарных артериях (таблица 1).
На втором этапе статистической обработки данных проводили корреляционный анализ между показателями воспалительных биомаркеров в крови и воспалительных биомаркеров в сосудистой стенке с учетом непараметрического распределения признаков. Результаты приведены в таблице 2.
Примечание: * при р<0,05; ** - при р<0,001
Обсуждая полученный результат, важно отметить, что вч-СРБ - белок острой фазы воспаления - в основном синтезируется гепатоцитами под влиянием ИЛ-6, однако может также продуцироваться МФ и лимфоцитами в АСБ [7, 14]. В настоящем исследовании определить источник повышенного уровня вч-СРБ в крови (вч-СРБ из гепатоцитов или вч-СРБ из сосудистой стенки) было сложно. Скорее всего, существовали оба источника: поскольку в нашем исследовании, как и в других [7, 10, 14, 22], уровни ИЛ-6 и вч-СРБ, кроме корреляции вч-СРБ в сосудистой стенке и ИЛ-6 в крови (таблица 2), коррелировали между собой (r=0,521; р<0,01) в крови и в сосудистой стенке (r=0,379; р<0,01). Следует отметить, что с показателем нестабильность АСБ в КА коррелировали в крови только вч-СРБ, ИЛ-6 (слабые связи) и ИЛ-8 (средняя сила связи). Выявлены также корреляции в крови ИЛ-8 с содержанием в сосудистой стенке ФНО-α и МСР-1 (таблица 2).
Повышение окислительных процессов в организме, в частности окислительная модификация ЛНП способствуют прогрессированию атеросклеротического процесса в сосудах [20-23]. Реакции перекисного окисления липидов являются свободнорадикальными и постоянно происходят в организме. Активность процессов ПОЛ можно оценивать по концентрации МДА или определять общую степень окислительного стресса в крови.
В исследовании при определении общей оценки окислительного стресса в крови (тест FORT) авторы изобретения получили следующие результаты: у пациентов 2 группы уровень окислительных повреждений составил 2,93±0,2 ммоль/л, а у пациентов 1 группы - 2,81±0,3 ммоль/л. При этом в ранее проведенных исследованиях определили, что у пациентов без ИБС уровень окислительных повреждений в среднем составляет 1,6±0,3 ммоль/л [23].
Клинические примеры
Пример 1. Больной К. (№21), мужчина, возраст 57 лет. Клинически, лабораторно и инструментально подтвержден диагноз: ишемическая болезнь сердца. Проведен биохимический анализ сыворотки крови:
ИЛ-6 - 26,74 пг/мл
ИЛ-8 - 2,85 пг/мл
вч-СРБ - 18,35 мкг/мл
МСР-1 -490,89 пг/мл
FORT - 3,11 ммоль/л
Полученные значения сравнили с пороговыми значениями:
ИЛ-6 - 10 пг/мл
ИЛ-8 - 12 пг/мл
вч-СРБ - 10 мкг/мл
МСР-1 - 480 пг/мл
FORT - 2,3 ммоль/л
Из исследуемого комплекса у пациента повышены четыре показателя, что свидетельствует о высокой вероятности наличия нестабильных АСБ в коронарных артериях.
Гистологическое исследование образца фрагмента интима-медиа КА, полученного в ходе эндартерэктомии по интраоперационным показаниям, подтвердило наличие в коронарных сосудах нестабильных атеросклеротических бляшек.
Пример 2. Больной М. (№22), мужчина, возраст 63 года. Клинически, лабораторно и инструментально подтвержден диагноз: ишемическая болезнь сердца.
Проведены биохимические методы исследования:
ИЛ-6 - 36,68 пг/мл
ИЛ-8 - 9,07 пг/мл
вч-СРБ - 17,24 мкг/мл
МСР-1 - 614,01 пг/мл
FORT - 2,87 ммоль/л
Полученные значения сравнили с пороговыми значениями:
ИЛ-6 - 10 пг/мл
ИЛ-8 - 12 пг/мл
вч-СРБ - 10 мкг/мл
МСР-1 - 480 пг/мл
FORT - 2,3 ммоль/л
Из исследуемого комплекса у пациента повышены значения четырех показателей, что свидетельствует о высокой вероятности наличия нестабильных АСБ в коронарных артериях.
Гистологическое исследование образца фрагмента интима-медиа КА, полученного в ходе эндартерэктомии, подтвердило наличие в коронарных сосудах нестабильных атеросклеротических бляшек.
Пример 3. Больной С. (№73), мужчина, возраст 67 лет. Клинически, лабораторно и инструментально подтвержден диагноз: ишемическая болезнь сердца.
Проведены биохимические методы исследования:
ИЛ-6 - 9,8 пг/мл
ИЛ-8 - 21,42 пг/мл
вч-СРБ - 0,16 мкг/мл
МСР-1 - 383,16 пг/мл
FORT - 3,28 ммоль/л
Полученные значения сравнили с пороговыми значениями:
ИЛ-6 - 10 пг/мл
ИЛ-8 - 12 пг/мл
вч-СРБ - 10 мкг/мл
МСР-1 - 480 пг/мл
FORT - 2,3 ммоль/л
Из исследуемого комплекса у пациента повышены значения двух показателей, что свидетельствует о низкой вероятности наличия нестабильных АСБ в коронарных артериях.
Гистологическое исследование образца фрагмента интима-медиа КА, полученного в ходе эндартерэктомии, подтвердило наличие в коронарных сосудах только стабильных атеросклеротических бляшек.
Таким образом, были выявлены ключевые окислительные и воспалительные биомаркеры крови, характеризующие наличие нестабильных атеросклеротических бляшек в коронарных артериях.
Предлагаемый способ позволяет определить у пациентов с коронарным атеросклерозом вероятность наличия нестабильных атеросклеротических бляшек в коронарных артериях. Данный способ неинвазивный, безопасный, не требующий больших финансовых затрат, может быть выполнен в условиях клинической биохимической лаборатории.
Кроме того, данный способ позволит на ранней стадии определить возможность развития осложнений ИБС, ускорить темпы дополнительного обследования и выбор тактики лечения пациента.
Литература
1. Оганов Р.Г., Погосова Г.В. Современная стратегия первичной профилактики и лечения сердечно-сосудистых заболеваний // Кардиология, 2007; 12:4-9.
2. Holschermann Н., Tillmanns Н., Bode С. Pathophysiology of acute coronary syndrome. // Hamostaseologie, 2006; 26(2):99-103.
3. Shah P.K. Cellular and molecular mechanisms of plaque rupture. / High-risk atherosclerotic plaques: mechanisms, imaging, models, and therapy. Edited by L.M. Khachigian. // CRC Press, New York, 2005; 1-19.
4. Waksman R., Seruys P.W. Handbook of the vulnerable plaque. // London, 2004; p. 1-48.
5. Naghavi M., Libby P., Falk E. et al. From vulnerable plaque to vulnerable patient. A call for new definitions and risk assessment strategies: part I. // Circulation, 2003; 108(14):1664-1672.
6. Virmani R., Burke A.P., Farb A., Kolodgie F.D. Pathology of the vulnerable plaque. // J. Am. Coll. Cardiol, 2006; 47(8): 13-18.
7. Libby P., Okamoto Y., Rocha V.Z., Folco E. Inflammation in atherosclerosis: transition from theory to practice. // Circ. J, 2010; 74(2): 213-220.
8. Moreno P.R. Vulnerable plaque: definition, diagnosis, and treatment. // Cardiol. Clin, 2010; 28(1): 1-30.
9. Рагино Ю.И., Чернявский A.M., Полонская Я.В. и др. Активность воспалительно-деструктивных изменений в процессе формирования нестабильной атеросклеротической бляшки. // Кардиология, 2007; 9: 62-67.
10. Рагино Ю.И., Чернявский A.M., Полонская Я.В. и др. Изменение содержания провоспалительных цитокинов и деструктивных металлопротеиназ в процессе развития атеросклеротического очага до нестабильной бляшки. // Кардиология, 2009; 6: 43-50.
11. Braunersreuther V., Mach F., Steffens S. The specific role of chemokines in atherosclerosis. // Thromb. Haemost., 2007; 97(5): 714-721.
12. Wang X., Connolly T.M. Biomarkers of vulnerable atheromatous plaques: translational medicine perspectives. // Adv. Clin. Chem., 2010; 50: 1-22.
13. Schwarz M.A., Zheng H., Liu J. et al. Endothelial-monocyte activating polypeptide II alters fibronectin based endothelial cell adhesion and matrix assembly via alpha5 beta 1 integrin. // Exp. Cell Res., 2005; 311(2): 229-239.
14. Muhlestein J.B. Effect of antiplatelet therapy on inflammatory markers in atherothrombotic patients. // Thromb. Haemost, 2010; 103(1): 71-82.
15. Empana J.-P., Canoui-Poitrine F., Luc G. et al. on behalf of the PRIME Study Group. Contribution of novel biomarkers to incident stable angina and acute coronary syndrome: the PRIME Study. // Eur. Heart J, 2008, 29: 1966-1974.
16. Luc G., Bard J.M., Juhan-Vague I. et al. PRIME Study Group. C-reactive protein, interleukin-6, and fibrinogen as predictors of coronary heart disease: the PRIME Study. // Arterioscler Thromb Vasc Biol, 2003; 23: 1255-1261.
17. Bonaterra G.A., Zugel S., Kinscherf R. Novel systemic cardiovascular disease biomarkers. // Curr. Mol. Med, 2010; 10(2): 180-205.
18. Диагностика и коррекция нарушений липидного обмена с целью профилактики и лечения атеросклероза. Российские рекомендации (V пересмотр) //Атеросклероз и дислипидемии, 2012. 4(9): 5-53.
19. Меньшикова Е.Б., Панкин В.З., Зенков Н.К., Бондарь И.А., Круговых Н.Ф., Труфакин В.А. Окислительный стресс. Прооксиданты и антиоксиданты // М.: Слово, 2006; 556 с.
20. Воевода М.И., Рагино Ю.И., Каштанова Е.В., Семаева Е.В., Иванова М.В., Чернявский A.M., Никитин Ю.П. Липидный спектр крови и резистентность к окислению липопротеинов сыворотки крови у больных коронарным атеросклерозом в Западной Сибири // Бюл. СО РАМН, 2003; 3(109): 47-50.
21. Yoshida Н., Kisugi R. Mechanisms of LDL oxidation. Clin. Chim. Acta, 2010; 411 (23-24): 1875-1882.
22. Рагино Ю.И., Чернявский A.M., Полонская Я.В., Волков A.M., Каштанова E.B., Цымбал С.Ю., Половникова Е.М. Воспалительно-деструктивные биомаркеры нестабильности атеросклеротических бляшек: исследования сосудистой стенки и крови // Кардиология, 2012; 5(52): 37-41.
23. Стахнева Е.М., Каштанова Е.В., Полонская Я.В., Каменская О.В., Садовский Е.В., Кургузов А.В., Чернявский А.М., Рагино Ю.И. Оценка окислительного стресса и степени антиоксидантной способности у пациентов с коронарным атеросклерозом // Молекулярная медицина. 2016; 2(14): 56-59.
Способ определения вероятности наличия нестабильных атеросклеротических бляшек в коронарных артериях у пациентов с коронарным атеросклерозом, характеризующийся тем, что в сыворотке крови пациента определяют значения воспалительных биомаркеров: С-реактивного белка, интерлейкина-6, интерлейкина-8, моноцитарного хемоаттрактантного протеина-1, и окислительный биомаркер - тест FORT, полученные значения сравнивают с пороговым значением соответствующего биомаркера: для С-реактивного белка равное 10 мкг/мл, для интерлейкина-6 равное 10 пг/мл, для интерлейкина-8 равное 12 пг/мл, для моноцитарного хемоаттрактантного протеина-1 равное 480 пг/мл, для теста FORT равное 2,3 ммоль/л и при наличии, как минимум, четырех значений биомаркеров больше порогового значения соответствующего биомаркера говорят о вероятности наличия нестабильных бляшек в коронарных артериях у пациента с коронарным атеросклерозом.