Способ получения термочувствительного радиофармпрепарата
Иллюстрации
Показать всеИзобретение относится к области ядерной медицины, а именно к способу получения термочувствительного радиофармпрепарата, который представляет собой раствор интерполимерного носителя радионуклида, включающему следующие стадии: 1) синтез сополимера-носителя на основе N-изопропилакриламида и аллиламина; 2) этерификацию аминных групп сополимера-носителя диангидридом диэтилентриаминпентауксусной кислоты; 3) мечение радионуклидом 153Sm; 4) выделение радиоактивной сополимерной фракции из реакционного объема смеси меченой полимерной путем элюирования ацетатным буфером в хроматографической колонке; 5) смешивание выделенной фракции с сополимером-носителем водного раствора полимера-загустителя поли-N-изопропилакриламида, причем произведение характеристической вязкости [η]пз в дл/г и концентрации Спз поли-N-изопропилакриламида в воде в г/дл отвечает безразмерному соотношению 5<Спз*[η]пз<10. Изобретение обеспечивает получение термочувствительной системы, включающей полимерный носитель радионуклида, причем радионуклид должен оказывать необходимое терапевтическое действие на опухоль и не обладать подвижностью, которая бы позволила ему сразу после введения или со временем выйти за пределы компактной полимерной фазы. 3 ил., 4 табл., 5 пр.
Реферат
Изобретение относится к области ядерной медицины, радиофармацевтики, радиофармакологии, более узко - к сфере локальной радиотерапии.
В медицинской практике радиотерапии злокачественных опухолей активно используется брахитерапия, основанная на введении радиоактивных источников непосредственно в опухоль. Подвижность носителей радионуклидов в окрестности места инъекции препарата, способствующая перемещению радиоактивности по отделам организма, может быть эффективно ограничена за счет их связывания в полимерном геле. Предпочтение отдается (со)полимерам, в водном растворе которых происходит обратимый фазовый золь-гель переход, вызываемый изменением в достаточно узком интервале факторов среды. Термочувствительный водный полимерный раствор смешивается при комнатной температуре с эффективным количеством биоактивного агента с целью сформировать композицию, способную обратимо превращаться в теплокровном животном в гелеобразное депо лекарств, когда температура раствора поднимается до температуры животного выше температуры фазового золь-гель перехода Тфр. Это свойство позволяет использовать такую композицию при хирургических операциях на теплокровном животном, вводя ее в область вскрытия. Лекарствами могут служить противораковые агенты, гормоны, антибиотики, иммуноактиваторы, терапевтические пептиды и протеины. Поскольку термочувствительность позволяет формировать гель путем инъекции раствора, то не требуется хирургическая процедура для имплантирования лекарственного депо в нужный отдел организма. Физические свойства мягкого гидрогеля уменьшают нагрузку на соседние ткани.
Особенно привлекательны препараты, в которых в качестве терапевтического противоопухолевого средства используются радионуклиды, прикрепленные химически к термочувствительной цепи или иммобилизованные в физическом геле, образовавшемся в водных растворах в процессе термотропного золь-гель перехода при нагревании от комнатной до температур, близких к температуре человеческого тела. Водный раствор термочувствительного биосовместимого (со)полимера, гомогенный и маловязкий при комнатной температуре, после фазового перехода становится достаточно плотным гелем с содержащимися в нем атомами радионуклида и представляет собой локальный источник излучения для брахитерапии. Таким образом, максимальную дозу излучения удается доставить непосредственно в пораженный орган, практически не облучая прилегающие ткани, что является решением парадигмы идеального облучения в лучевой терапии.
Из конкретных технических решений, наиболее близких к рассматриваемой проблеме, обращают на себя внимание следующие разработки. Радиогелевая система, описанная в патентах [1-8], включает инжектируемый водный раствор биоразлагаемого полимера, в котором диспергированы микросферы солей 90Y коллоидных размеров. Раствор после инъекции в опухоль быстро нагревается до температуры тела и затем превращается в трехмерную сетку, в которой иммобилизованы микросферы солей 90Y. Высокоэнергетические электроны, излучаемые радионуклидом, эффективно облучают раковые клетки в объеме мишени с очень малыми потерями энергии на облучение соседних тканей. Инжектируемый радиогель выгодно использовать, когда опухоль не может быть удалена хирургически, как, например, в ряде случаев рака печени, мозга, головы и шеи, почек и поджелудочной железы.
В патентах [4-6] изучены сополимеры, состоящие из биосовместимого гидрофильного полиэтиленгликоля (PEG) и биоразлагаемого полиэфирного гидрофобного компонента с различной макромолекулярной архитектурой: триблок-сополимер PEG-b-PLGA-b-PEG или графт-сополимеры вида PEG-g-PLGA и PLGA-g-PEG, где PLGA - DL-молочная кислота-со-гликолевая кислота. Графт-сополимеры имеют в воде разную структуру мицелл. В PEG-g-PLGA сердцевину образуют гидрофобные боковые ветви PLGA, а оболочку - скелетные гидрофильные цепи PEG. Поверхностно-активные свойства привитых сополимеров служат дополнительным фактором, увеличивающим растворимость гидрофобного терапевтического средства. В биомедицинских приложениях важно, чтобы компоненты носителя были биосовместимы, а биоразлагаемая компонента не индуцировала орошение соседних тканей продуктами разложения. Последние оказывают негативное денатурирующее воздействие на протеин/полипептидные лекарства, которые с развитием генной инженерии становятся обычным терапевтическим средством. Поэтому возникает необходимость в создании носителей лекарств с различным сроком стабильности. Свойства короткоживущих (меньше недели) носителей проявляют гели графт-сополимера PEG-g-PLGA, а долговременных (один-два месяца) - гели PLGA-g-PEG. Примечательно, что изменение соотношения между PEG и PLGA в сополимерах влияет на следующие важные свойства растворенного сополимера: скорость выделения лекарства из геля, термочувствительность к гелеобразованию, вязкость раствора при комнатной температуре и плотность геля выше физиологических температур. Например, вязкость 22% водного раствора графт-сополимера PEG-g-PLGA (47 мол. % PEG, Mw = 11000) при 20°С составляет 22 мПа⋅с, и раствор легко набирается в шприц со стандартной иглой. Температура фазового разделения Тфр, ассоциируемая с резким возрастанием динамической вязкости, для этой системы была оценена в 30°С и мало зависела от концентрации в пределах 20-25 мас. %. Реальная часть комплексной динамической вязкости 22% водного раствора в результате термотропного перехода увеличивается в 103 раз с 0,05 до 50 Па⋅с, а модуль упругости достигает 10-100 Па. Согласно фазовой диаграмме критическая концентрация гелеобразования (ККГ), выше которой в растворе появляется гель-фаза, составляет 16 мас. %. Ниже ККГ наблюдается течение, даже когда вязкость растет с увеличением температуры. При увеличении температуры сверх Тфр гель проявляет синерезис - макрофазовое разделение, когда некоторое количество воды выделяется из гель-фазы. Присутствие гель-фазы вблизи температуры тела делает эту систему подходящей для доставки лекарств путем инъекции, в месте которой образующийся гель удерживает биоактивные агенты, способные медленно выделяться. Компактный гель сохраняется одну неделю, делая систему кандидатом на роль короткосрочного переносчика противораковых и других лекарств.
В графт-сополимере PLGA-g-PEG (40 мол. % PEG, Mw = 7800) Тфр ≈ 40°С, когда молекулярная масса PEG колеблется в пределах 600-1000. Если же содержание PEG снижается до 20%, Тфр падает до 20°С. Во время золь-гель перехода PEG становится более гидрофобным вследствие дегидратации и изменения степени водородного связывания между молекулами воды и полимера. Гель сохраняется в крысе в течение двух месяцев в отличие от предыдущего сополимера, который распадается за 1 неделю.
Модель золь-гель перехода в этой системе можно представить следующим образом. В растворе при комнатной температуре степень ассоциации мицелл недостаточна, чтобы сформировать трехмерную сетку. Процессом гелеобразования управляет энтропия, а молекулярным драйвером являются гидрофобные взаимодействия PLGA-сегментов. Энтропия молекул воды уменьшается в присутствии гидрофобной компоненты, площадь поверхности гидрофобных сегментов минимизируется в воде. Гидрофобные взаимодействия возрастают с увеличением температуры, и ассоциация полимера уменьшает движение PEG-компоненты, вызывая образование сетки на длинных масштабах, то есть геля. Степень ассоциации достаточна, чтобы удерживать избыток воды при физиологических температурах. Это скорее гель, чем сильно вязкая жидкость. При дальнейшем увеличении температуры и усилении длинномасштабных взаимодействий возрастает смешение компонентов внутри полимера, вызывая макрофазовое разделение между водой и полимером.
В качестве биоразлагаемого полимерного поставщика лекарств рассматриваются также полипептид/полиэтиленгликольные сополимеры. Подходящие полипептиды для этой цели должны включать две или более аминокислоты, которые отличаются по степени гидрофильности. Рассмотренная выше полимерная система PEG-g-PLGA выделяет в результате гидролиза молочную и гликолевую кислоты, что в свою очередь может вызвать деградацию чувствительных к кислоте лекарств и денатурацию протеинсодержащих агентов. Полиэфир PLGA чувствителен к гидролизу, поэтому препараты на его основе нужно хранить при пониженных температурах. Так как пептидная связь более устойчива к гидролизу чем эфирная, то сополимеры, содержащие пептидные блоки, более стабильны во времени, лучше хранятся при комнатной температуре и их разложение ускоряется после инъекции в организм за счет пролитических ферментов. Выделяющиеся в результате разложения полипептидов нейтральные аминокислоты не влияют на рН среды и функционирование поставщика биоактивных агентов. Полипептидные доставщики имеют более высокую температуру стеклования, чем полиэфирные PEG/PLGA системы, и их удобнее использовать в виде порошка, чем полиэфирсодержащие пасты. Полипептидные системы доставки могут быть особенно продуктивны in situ в качестве терможелирующих депо для доставки протеинов, клеток и других агентов, чувствительных к кислоте.
В патентах [1-3], [7-8] носители терапевтических агентов представляют собой статистический сополимер, линейные цепи которого состоят из чередующихся последовательностей звеньев термочувствительного N-изопропилакриламида (НИПА) и гидрофильного сомономера - акриловой кислоты (АК) или 2-диметиламинэтилакрилата (ДМАЭА). В качестве терапевтического агента используются соли радиоактивного иттрия 90Y. Коллоидные частицы солей субмикронного размера благодаря большой удельной поверхности и ионно-координационным связям со звеньями АК или ДМАЭА формируют узлы пространственной полимерной сетки. Было найдено, что 2% раствор сополимера НИПА/АК с содержанием АК около 2 мол. % способен сформировать обратимый гель без всяких признаков синерезиса воды. Недостаток этой разработки состоит в том, что заряженные гидрофильные звенья сомономеров АК или ДМАЭА, необходимые для создания узлов трехмерной сетки, смещают Тфр сополимера с 32,5°С, присущую гомополимеру поли-N-изопропилакриламиду (ПНИПА), в окрестность физиологических температур (36-37°С при содержании АК 2 мол. %). Как показали эксперименты на животных, при незначительном удалении системы от бинодали за счет не совсем благоприятного соотношения температуры тела и Тфр наблюдается распространение радионуклида по всему организму.
В цикле работ [9-13] ионно-координационные связи между полимерным носителем и радионуклидом заменяли более сильными ковалентными или хелатными связями за счет введения тирозинсодержащих звеньев в цепь термочувствительного полимера при радикальной полимеризации НИПА или винилкапролактама (ВКЛ) либо с использованием инициатора, содержащего тирозиновые группы, либо сомономера типа N-метилакрилоил-L-тирозинамида (МАТАМ). Модифицированные тем или иным способом цепи термочувствительного сополимера подвергали мечению в водном растворе Na125I или Na131I в присутствии окислителя хлорамина Т. Отделение высокомолекулярных фракций от низкомолекулярных реагентов смеси проводили с помощью элюирования фосфатным буфером в хроматографической колонке, заполненной сефадексом, с последующим измерением радиоактивности фракций. Выяснилось, что только половина активного йода во время мечения ковалентно связывается с тирозин-содержащим модификатором цепи, а другая часть в виде хлористого йода или йодидов с большой вероятностью образует физические комплексы с термочувствительным полимером, особенно с поли-N-винилкапролактамом (ПВКЛ). В результате вдвое снижается эффективность мечения по сравнению с ПНИПА-содержащими препаратами. Испытания на стабильность йодированных радиофармацевтических препаратов (РФП) на основе ПВКЛ-МАТАМ показали, что в первый день радиоактивность высокомолекулярных фракций падает почти на 80% от исходного значения, а затем не изменяется в течение недели, то есть препарат плохо очищается в результате однократного прохода через колонку. Предложено очищать препарат за счет одновременного введения в систему три(гидроксиметил)аминоэтана (ТГОМАЭ) и аскорбиновой кислоты и двукратного пропускания через колонку. Аскорбиновая кислота восстанавливает до йодида входящие в комплекс йодиновые специи, а ТГОМАЭ, будучи комплексообразующим агентом для йодиновых соединений, как и ПВКЛ, сдвигает равновесие в сторону очищения полимера.
В йодсодержащих РФП на основе ПНИПА комплексообразование йодидов с цепью также снижает радиохимическую чистоту (РХЧ) препарата. Об этом свидетельствует наша разработка [14], преследующая цель создания термочувствительного йодсодержащего РФП с РХЧ ~ 95-98%. Матрицей РФП служит полимерно-белковый коньюгат - продукт привитой сополимеризации НИПА и глобулярного белка - бычьего сывороточного альбумина. К белковым молекулам ковалентно присоединены атомы радиоактивного йода. Водный раствор РФП обладает способностью совершать фазовый переход вблизи температуры человеческого тела, благодаря чему препарат превращается в компактный источник локального облучения. Основная масса анионов йода во время мечения окисляется до катионов и присоединяется к реакционным группам, инкорпорированным в термочувствительные макромолекулы. Наряду с этим позитивным процессом в реакционной среде благодаря значительной концентрации амидных групп имеет место негативный процесс, в котором анион йода включается в систему водородных связей между мостиковыми молекулами воды и карбонильными группами мономерных звеньев. Без принятия специальных мер образующиеся в процессе мечения паразитные тройные ПНИПА-131Г-гидратные комплексы консервируются в препарате, не разрушаются на стадии колоночного фракционирования и после введения РФП в организм, распадаясь, становятся источником радиоактивного загрязнения. Удаление радиоактивных йодидных комплексов достигается в хроматографической колонке за счет введения в элюент стимулирующих добавок, преимущественно неорганических солей, служащих агентами деградации тройных комплексов и обладающих коэффициентом дестабилизации γ = - dТфр/dСs из интервала γ = 30-60 град⋅л/моль, где Тфр - температура фазового перехода в растворе, содержащем стимулирующую добавку; Cs - концентрация добавки.
Недостатком разработки мы считаем системное противоречие, корнем которого является соединение в одну макромолекулу двух функционально различных последовательностей, отдельных звеньев или групп, одни из которых ответственны за проявление термотропного перехода, а другие - за включение с помощью тех или иных химических связей терапевтических агентов, например, радионуклидов. С одной стороны, чем меньше молекулярная масса ПНИПА, тем легче он выводится из организма. С другой стороны, повышенная молекулярная масса способствует превращению исходного водного раствора в более плотный гель в результате термотропного перехода. Желание уплотнить полимерную фазу за счет увеличения концентрации исходного раствора сталкивается с ограничениями по вязкости исходного раствора.
Указанных недостатков лишен двухкомпонентный полимерный носитель радионуклида - прототип [15]. В качестве полимерного носителя радионуклидов используются интерполимерные комплексы, составленные из макромолекул термочувствительного ПВКЛ и белковых молекул казеина или йодказеина, несущих ковалентно связанные изотопы, в том числе радиоактивные. Водный раствор ПВКЛ обладает способностью претерпевать фазовый переход вблизи физиологических температур, а белковые молекулы, обвиваемые цепями ПВКЛ с образованием прочных интерполимерных комплексов, удерживаются в геле, благодаря чему меченый радионуклидами белок осуществляет радиационное разрушение опухоли. Недостатком разработки является тот факт, что наиболее удачные реализации основаны на использовании в качестве сокомпонента интерполимерных комплексов макромолекул ПВКЛ с высокой молекулярной массой ~ 106, которые не поддаются выводу из организма.
Техническая задача, решаемая в предлагаемом изобретении, заключается в создании термочувствительной системы, включающей полимерный носитель радионуклида, удовлетворяющей главному требованию брахитерапии: содержащийся в препарате радионуклид должен одновременно оказывать необходимое терапевтическое действие на опухоль и не обладать подвижностью, которая бы позволила ему сразу после введения или со временем выйти за пределы компактной полимерной фазы.
Поставленная техническая задача в настоящем изобретении решается с помощью покомпонентного разделения основных функций РФП. С этой целью сначала изготовляется термочувствительный сополимер НИПА и аллиламина (ААм), который затем подвергается этерифицированию по аминным группам хелатирующим агентом диангидридом диэтилентриаминпентауксусной кислоты (ДАДТПА) и последующей реакции мечения радионуклидом 153Sm3+ за счет образования хелатных [ДТПА*153Sm3+] комплексов. Отделение в реакционной смеси меченой сополимерной компоненты от низкомолекулярных активных и неактивных соединений осуществляется путем элюирования ацетатным буфером на хроматографической колонке, заполненной набухшим сефадексом. Колоночный элюат, содержащий активные сополимерные фракции, оказывается слишком разбавленным (Ссп < 1 мас. %), чтобы напрямую быть использованным в качестве РФП, однако он может служить растворителем для приготовления более концентрированного раствора полимера-загустителя. Роль загустителя состоит в создании флуктуационной «квазисетки», которую формируют контакты остатков мономерных групп, принадлежащих разным цепям. Раствор с концентрацией, при которой начинается перекрывание клубков, называется полуразбавленным. В полуразбавленном концентрационном режиме независимой динамической единицей становится не отдельная цепь, а блоб. Полуразбавленный раствор при комнатной температуре представляет собой плотноупакованную систему блобов - фрагментов макромолекулы между контактами с другими макромолекулами, среднеквадратичный размер которых равен корреляционной длине ячейки флуктуационной «квазисетки». После фазового перехода флуктуационная сетка полуразбавленного раствора полимера-загустителя трансформируется в компактный конгломерат полимерных цепей. Относительно короткие цепи сополимера-носителя, иммобилизованные в пространственной сетке зацеплений полимерной фазы, теряют способность выпутываться из нее. Функцию загустителя может выполнять ПНИПА с оптимальными молекулярно-массовым распределением (ММР) и концентрацией в растворе для инъекции. Ограничения сверху по молекулярной массе вызваны желанием облегчить процесс выхода полимерных клубков из организма через почечные каналы.
Синтез и свойства сополимера-носителя радионуклида и полимера-загустителя. Синтез (со)полимеров на основе НИПА и ААм проводили методом радикальной (со)полимеризации в диоксане с использованием 2,2'-Азобисизобутиронитрила (АИБН) в качестве инициатора. Марки и качество реактивов приведены в таблице 1.
Из реакционной смеси в стеклянных ампулах удаляли кислород продувкой аргоном в течение 30-45 мин либо вакуумированием в сочетании с трехкратным циклом замораживание-размораживание, отпаивали и помещали в термостат при заданной температуре. Через определенные промежутки времени ампулы вынимали, охлаждали, вскрывали и содержимое высаживали в диэтиловый эфир (ДЭЭ). Осадок отфильтровывали, высушивали, затем повторно растворяли в свежеперегнанном тетрагидрофуране (ТГФ), осаждали ДЭЭ, отфильтровывали, высушивали под вакуумом при температуре 50-60°С и рассчитывали степень конверсии Ψ. Содержание ААм в сополимере ХАам определяли из спектров оптического поглощения комплексов TNBS с аминной группой сополимера в водном растворе буры [18].
Характеристическую вязкость [η] водных растворов (со)полимерных образцов измеряли с помощью вискозиметра Уббелоде при 20°С в присутствии 0,5 М LiNO3 (таблица 2). При расчете средневязкостной молекулярной массы сополимеров ПНИПА с небольшим содержанием ААм (≤1,5 мол. %) применяли уравнения Марка-Куна-Хаувинка [η] = 4,7⋅10-4 Mw0,61 [19].
Молекулярно-массовое распределение (ММР) и гидродинамический объем макромолекул. Для оценки параметров ММР в работе использовали прибор WATERS, снабженный тремя хроматографическими колонками высокого разрешения HR4, HR5 и HR6. Колонки заполнены полистирольным гелем. Набор позволяет определять ММР образцов полистирола (ПС) в интервале молекулярной массы (ММ) = 5⋅103-1⋅107 без проведения дополнительной коррекции на приборное уширение. Растворителем служил тетрагидрофуран (ТГФ), элюирование проводили при 30°С со скоростью 0,8 мл/мин. Концентрация растворов 0,05-0,2 мас. %. Метод гельпроникающей хроматографии (ГПХ) осуществляет эксклюзионное фракционирование макромолекул по их гидродинамическим объемам f = M[η] согласно универсальной калибровочной зависимости lgf = C1-C2V, связывающей гидродинамический объем макромолекул и объем удерживания V. Постулируется, что при одинаковых процедурных условиях ГПХ для макромолекул исследуемого полимера и полистирольных ПС-стандартов, выходящих с одним и тем же удерживаемым объемом, равны их гидродинамические объемы. Переводной множитель, или Q-фактор представляет собой коэффициент пропорциональности между ММ полимерной цепи и ее контурной длиной [20]. В рамках модели свободно-сочлененной гауссовой цепи справедливо соотношение Q = sM0/A (M0 - молекулярная масса мономерного звена, s - число звеньев в сегменте, А - размер сегмента), так что при оценке Q нет необходимости рассматривать конкретное строение полимерной цепи. Классические значения sПС ≈ 7,9, АПС ≈ 2 нм [21] позволяют определить QПС ≈ 410 нм-1, а именно по ПС-стандартам чаще всего калибруют колонки для ГПХ. Собственно отношение Q* = Q/QПС и является переводным множителем при вычислении средних ММ исследуемого полимера: Mw = Q*MwПС, Mn = Q*MnПС. Подставляя литературные значения SПНИПА = 62, АПНИПА = 14 нм, SПВП = 14,5, АПВП = 3,65 нм, рассчитанные по данным [16, 22], получаем оценочные значения Q* ≈ 1,2 и 1,1 для ПНИПА и поливинилпирролидона (ПВП) соответственно. Отсюда следует, что гидродинамические объемы макромолекулярных клубков ПВП и ПНИПА с равными ММ в пределах погрешности одинаковы. Медико-биологическими исследованиями установлено, что введенные в организм макромолекулы ПВП с ММ меньше 30000 выходят через почки в течение нескольких дней. Макромолекулы с ММ из интервала 30000-100000 выделяются гораздо медленнее - в течение нескольких месяцев [23]. Поскольку оба полимера не способны к биоразложению, можно считать, что схожим образом протекает биологическое фракционирование цепей ПНИПА, для которого количественные сведения об этом процессе в литературе отсутствуют. Таким образом, с точки зрения вывода из организма ПНИПА и ПВП «биоэквивалентны». Значение этого вывода трудно переоценить, т.к. он позволяет осуществить последний шаг на пути принятия решения о практическом применении термочувствительного терапевтического препарата на основе ПНИПА и заменяет трудоемкие и дорогостоящие эксперименты.
Пространственная сетка зацеплений в растворах ПНИПА. Калориметрическое изучение фазового перехода показало [16], что размер независимой кинетической единицы гидратированной макромолекулы ПНИПА при переходе из разбавленной фазы в фазу, обогащенную полимером, составляет 63 звена, что соответствует молекулярной массе Мкооп ≈ 7000. По данным поступательной диффузии и светорассеяния статистический сегмент Куна ПНИПА включает в себя 62 звена. Таким образом, размеры кинетического и статистического сегментов макромолекулы ПНИПА практически совпадают [16]. Фазовое расслоение водных растворов ПНИПА при нагревании сопровождается дегидратацией макромолекул и фиксируется в виде резко возрастающей оптической мутности раствора в узком интервале температур с хорошо выраженной начальной точкой. Можно предположить, что такое поведение обусловлено сильным взаимодействием совокупности молекул воды, образующих кооперативную единицу гидратной структуры макромолекулы. По-видимому, гибкость полимерной цепи нарушает непрерывность гидратной оболочки в областях изгибов полимерной цепи. Этим и объясняется довольно редкое явление совпадения кинетического сегмента и статистического сегмента Куна в водных растворах ПНИПА.
Макроскопическое динамическое поведение макромолекул описывается с помощью модели межцепных топологических узлов - зацеплений с большим, но ограниченным временем жизни [17]. Эта модель применима локально в полуразбавленных и гомогенно в концентрированных растворах. Эффекты зацеплений наблюдаются лишь для цепей, ММ которых превышают критическое значение Мкр. Эмпирическим путем найдена связь между Мкр и Мз, где Мз равно молекулярной массе участков цепи между узлами сетки зацеплений: Мкр ≈ 2Мз. Логично допустить, что в случае гидратной структуры ПНИПА в воде Мкооп ≈ Мз. Тогда Мкр ≈ 14000. В этой связи показателен эксперимент, описанный в [1], согласно которому удаление из ПНИПА фракций с ММ < 12000-14000 за счет диализа через мембраны с соответствующим максимальным размером пор способствует формированию компактного геля по достижении Тфр, в противном случае образуется молочная дисперсия.
Полуразбавленные водные растворы, аналогичные тем, что предполагается использовать в качестве РФП, "меченые" неактивными атомами 152Sm, тестировали на способность при комнатной температуре всасываться шприцем со стандартными иглами с диаметром 0,4-0,8 мм. Параметры растворов и характеристики растворенных макромолекул в сочетании с концентрационной и молекулярно-массовой зависимостями динамической вязкости полимерных растворов в различных режимах предопределяют результаты тестирования [24]. Разбавленные растворы, в которых одиночная цепь движется независимо от других цепей, для наших целей не годятся, так как не способны превратиться в единый конгломерат перепутанных цепей. В полуразбавленных растворах взаимодействие цепей приводит к появлению нового класса движений - коллективных движений сегментов разных цепей, за счет чего происходит выравнивание флуктуаций концентраций. Коллективные моды являются драйвером переходных процессов при распаде и характеризуются коэффициентом кооперативной диффузии, пропорциональным концентрации раствора. Здесь мы ограничимся поведением нейтральных (незаряженных) макромолекул в полуразбавленных растворов, область которых ограничена критическими значениями концентраций перекрывания клубков (с* - пороговая концентрация разбавленного режима) и перепутывания (се - граница концентрированного режима) цепей. До опубликования работы [25] было принято считать, что с* и се совпадают. Теперь установлено, что полимерные растворы нейтральных макромолекул в области 5≤се/с*≤10 ведут себя как полуразбавленные (система блобов [24]), но цепи в них не перепутаны. Все определяется степенью топологических ограничений взаимного движения цепей. Феноменологически найдено, что начало перепутывания происходит, когда каждый полимерный клубок перекрывается с (n) другими, где значение 5≤n≤10 зависит от вида полимера. При концентрации перепутывания се вязкость раствора оценивается как ( - вязкость растворителя) и для нейтральных, и для заряженных полимеров. В режиме неперепутанных полуразбавленных нейтральных макромолекул в хорошем растворителе имеют место закономерности: се ≈ n8/5с* ≈ 10с*, Перепутывание увеличивает показатель степенной зависимости втрое: [24] и приводит к неприемлемо высокой абсолютной вязкости раствора термочувствительных полимеров при комнатной температуре, не позволяющей осуществлять мембранную фильтрацию и использовать стандартные иглы для инъекции. Фазовый переход в организме вызывает коллапсирование полимерной фазы, за счет чего вероятность контактов между цепями значительно увеличивается, и узлы зацеплений становятся фактором, благоприятствующим удерживанию цепей-носителей радионуклидов в трехмерной сетке.
Температуры нижней критической температуры растворения (НКТР) ПНИПА и его сополимеров Тфр оценивали из зависимостей оптической плотности водных растворов от температуры интервальным методом на спектрофотометре Agilent 8453 UV-vision. Диапазон Тфр (со)полимерных образцов в настоящей работе составлял 32,5-34°С.
Введение хелаторов в цепь достигалось посредством реакции этерификации аминных групп сополимера в фосфатном буфере (рН ≈ 8) в присутствии ДАДТПА при комнатной температуре с перемешиванием в течение 6-7 часов. Реакционный продукт разделяли на предварительно проградуированной колонке, заполненной набухшим сефадексом, с использованием воды в качестве подвижной фазы. Остатки не вошедшего в цепь ДАДТПА удаляли из водного раствора путем диализа. Полимерные фракции после диализа подвергались лиофильной сушке. Содержание аминных групп в сополимере определяли до и после этерификации.
Радиоактивное мечение этерифицированного сополимера проводили в ацетатном буфере (рН = 5,4), смешанного с радиоактивным солянокислым раствором 153SmCl3, в течение 1 час. Реакционную смесь разделяли с помощью элюирования ацетатным буфером на колонке, отделяли радиоактивные сополимерные фракции, измеряли их объемную радиоактивность на гамма-спектрометре. Эффективность мечения определяли как отношение суммарной радиоактивности в сополимерных фракциях к радиоактивности в реакционной смеси. Для определения РХЧ использовали метод тонкослойной хроматографии (ТСХ), включающий хроматографирование радиоактивных фракций на пластинах «Silufol» в водных растворах сульфата аммония и последующее измерение радиоактивности фрагментов пластины с помощью гамма-спектрометра или всей пластины на гамма-сканере.
Испытания на термостабильность. В отдельном флаконе готовили 1-2 мл раствора полимера-загустителя ПНИПА с концентрацией Спз ≈ 10-20 мас. %, причем в качестве растворителя использовали колоночную сополимерную фракцию с радиоактивностью ~ 50-100 МБк/мл и концентрацией сополимера-носителя Сспн ~ 0,7 мас. %. Флакон с испытуемым раствором и стеклянный цилиндр с притертой пробкой, содержащий отмеренный объем физраствора, выдерживали в термостате при 37°С в течение 15 мин. Далее открытый флакон с гелем погружали в сосуд с нагретым физраствором, затыкали пробкой и устанавливали в термостате. Через фиксированные промежутки времени (t) отбирали контрольные пробы физраствора и измеряли их радиоактивность. В дальнейшем регистрировали следующие данные: a(t) - радиоактивность отобранной пробы объемом 1 мл через время t (час) и доля выделившейся из геля в объем физраствора радиоактивности с учетом естественного распада q(t) = а(t)⋅Vф⋅100/Анехр (-t/Tp) (%), где Тр = 67 час - характеристическое время распада. Испытания на термостабильность длились 3-4 суток.
Изобретение иллюстрируется графиками, поясняющими частные случаи выполнения:
на фиг. 1 - ММР образцов (со)полимеров серий ТНХ и ТПЗ: 1 - ТНХ-2, 2 - ТНХ-1, 3 - ТПЗ-1 (таблица 2);
на фиг. 2 - хроматограмма РФП-образца из примера 2, полученная на гамма-сканере «Радиометр Scan-Ram». Подвижная фаза - 1М водный раствор сернокислого аммония;
на фиг. 3 - хроматограмма РФП-образца из примера 5, полученная на гамма-сканере «Радиометр Scan-Ram». Подвижная фаза - 1М водный раствор сернокислого аммония.
Примеры. Нижеследующие примеры демонстрируют предмет изобретения.
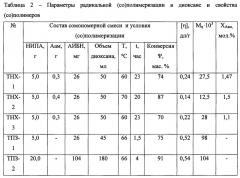
Пример 1 - положительный. Оптимальные термочувствительные носители хелаторов (ТНХ) и термочувствительные полимер-загустители (ТПЗ), концентрация полимера-загустителя С* = 15 мас. %. В данном примере для приготовления РФП использовали сополимер ТНХ-1 (таблица 2). Параметры его ММР рассчитывали по унимодальной диаграмме ГПХ в ТГФ с использованием калибровки по ПС-стандартам (фиг. 1, кривая 2) и переводного множителя Q* = 1,2: Mw = 30000, Mn = 20000, Mw/Mn = 1,5. Отметим, что Mw сополимера-носителя более чем вдвое превышает Мкр ≈ 14000, то есть его цепи способны участвовать в образовании пространственной сетки вместе с полимером-загустителем.
ТПЗ-1 (таблица 2) представлял собой гомополимер ПНИПА и был синтезирован, как и образцы серии ТНХ, методом радикальной полимеризации НИПА в отсутствие ААм. Параметры ММР полимера-загустителя (фиг. 1, кривая 3): Mw = 102000, Mn = 75000, Mw/Mn = 1,36.
Связывание хелаторов с цепью сополимера ТНХ-1 (80 мг) достигалось посредством реакции этерификации аминных групп в 4 мл фосфатного буфера (рН = 8,22) в присутствии 15 мг ДАДТПА при комнатной температуре с перемешиванием в течение 7 часов. Реакционный продукт разделяли на предварительно проградуированной колонке длиной 230 мм и диаметром 18 мм, заполненной набухшим сефадексом 50f, с использованием воды в качестве подвижной фазы. Полимерные фракции выходили в интервале удерживаемого объема V* = 12-30 мл, в то время как ДТПА - в районе V* ≈ 45 мл. Концентрация вводимого в колонку раствора Сп ≈ 2 мас. % была ниже значения, соответствующего точке кроссовера С* = 1/[η] ≈ 4% (таблица 2). Полимерные фракции подвергались лиофильной сушке. Эффективность этерификации была близка к полной. Остатки не вошедшего в цепь ДТПА удаляли из раствора в воде с помощью мембранного диализа, полноту которого контролировали методом комплексонометрического титрования в аммиачном буфере (рН = 9,25) раствором Zn2+ и эриохромом черным Т.
Радиомечение этерифицированного лиофилизованного сополимера (88 мг) проводили в течение 1 час в 2 мл ацетатного буфере (рН = 5,4), смешанного с 1 мл солянокислого раствора 153SmCl3, обладающего активностью 2,5 ГБк. Далее реакционную смесь разделяли на колонке путем элюирования ацетатным буфером, измеряли на гамма-спектрометре методом точечных источников объемную радиоактивность полимерных фракций: 610 МБк первой в интервале V* = 15-21 мл и 385 МБк второй в интервале V* = 21-27 мл. Эти данные позволяют оценить эффективность радиомечения ~ 40%. Микрообъемы полимерных фракций на пластинах «Silufol» хроматографировали в водных растворах сульфата аммония (1М) и после сушки определяли как «дискретное» значение РХЧ (95%) - путем разрезания полоски на 10 одинаковых фрагментов и измерения их активности на полупроводниковом спектрометре гамма-излучения «Гамма-1П», так и «непрерывное» значение РХЧ - экспресс-методом на гамма-сканере «Радиометр Scan-Ram» (97%).
Чтобы оценить термостабильность РФП, в отдельном флаконе растворяли 0,15 г лиофилизованного гомополимера ТПЗ-1 в 0,85 мл первой колоночной фракции (Спз ≈ 15 мас. %, при [η]пз = 0,52 дл/г произведение [η]пзСпз ≈ 8, что ниже порога перепутывания се/с* ≈ 10) с объемной радиоактивностью 40 МБк/мл. Флакон с раствором и стеклянный сосуд с притертой пробкой, содержащий 80 мл физраствора (содержание ионов: Na+- 150 mM, Са2+ - 1 mM, Mg2+ - 10 mM, H2PO4 - 1 mM), одновременно помещали в термостат при 37°С и выдерживали 15 мин. Далее открытый флакон со сколлапсировавшим терморадиогелем погружали в сосуд с нагретым физраствором, затыкали пробкой и устанавливали в термостате. Через 1 час в отобранной пробе физраствора объемом 1 мл была обнаружена радиоактивность а = 1,5 кБк/мл, что соответствует q = 0,3% в расчете на начальную объемную радиоактивность в цилиндре (Ан = 0,5 МБк/мл). В последующие трое суток дополнительного выделения радиоактивности из геля в физраствор не зафиксировали. Образец следует признать оптимальным как с точки зрения РХЧ, так и термостабильности в организме и пригодным для доклинических испытаний.
Пример 2 - отрицательный. Влияние низкомолекулярности полимера-носителя. Сополимер ТНХ-2, используемый в качеств