Способ определения хрома (iii) и железа (iii)
Иллюстрации
Показать всеИзобретение относится к аналитической химии и касается способов определения ионов хрома (III) и железа (III) в растворе при совместном присутствии. Способ определения концентрации ионов хрома (III) и железа (III) при совместном присутствии в растворе включает добавление к анализируемому раствору, содержащему ионы хрома (III) и железа (III), 4 мл раствора трилона Б (концентрацией 80 г/л), нагревание полученной смеси на кипящей водяной бане в течение 10 мин, охлаждение смеси до комнатной температуры, добавление к охлажденной смеси 0,5 мл водного раствора аммиака, доведение дистиллированной водой до 25 мл, определение оптической плотности раствора и вычисление концентрации ионов по калибровочным зависимостям, при этом измерение оптической плотности производят при 660 нм для ионов хрома (III) и при 315 нм для ионов железа (III). 39 пр., 3 табл.
Реферат
Изобретение относится к аналитической химии и касается методов определения хрома(III) и железа(III) при совместном присутствии.
Известен метод спектрофотометрического определения хрома в огнеупорных кирпичах. Первоначально анализируемый образец переводят в раствор, используя карбонатно-боратный метод сплавления. Плав растворяют в разбавленной серной кислоте. [Bennett H., Marshall K. The separation and determination of chromium sesqui oxide in chrome ore sand chrome-bearing refractories // Analyst. – 1963. – Vol. 88, Iss. 1052. – P. 877-881]. При выполнении метода из раствора плава производят экстракцию ионов хрома(VI) с помощью амберлитовых смол в хлороформе. Экстракт обрабатывают раствором КОН при этом хромат-ионы переходят в водную фазу, которую в дальнейшем последовательно обрабатывают раствором Na2SO3, раствором трилона Б и водным раствором аммиака до выделения осадка, который растворяют добавлением разбавленной уксусной кислоты. Полученный раствор кипятят 10…15 минут. Оптическую плотность измеряют при 550 нм после охлаждения раствора. По величине оптической плотности вычисляют концентрацию ионов хрома. Недостатками этого способа является его многостадийность и длительность.
Известен способ определения железа(II) и хрома(VI) путём титрования на автоматическом титраторе. Концентрацию железа(II) определяют с помощью дифференцирования кривой титрования анализируемого раствора раствором церия(IV), а концентрацию хрома(VI) – с помощью дифференцирования кривой титрования анализируемого раствора раствором соли железа(II) [Katsumata H., Teshima N., Kurihara M., Kawashima T. Potentiometric flow titration of iron(II) and chromium(VI) based on flow rate ratio of a titrant to a sample // Talanta. – 1999. – Vol. 48, Iss. 1. – P. 135-141]. Недостатком метода является сложность обработки экспериментальных кривых и невозможность одновременного определения ионов хрома и железа.
Известен способ хроматографического определения хрома(III) и хрома(VI), в котором в качестве элюента используется 0,001 M раствор трилона Б с рН 4,0. При выполнении анализа в течение 13 минут регистрируют хроматограмму с УФ-детектором с длиной волны 350 нм, затем заменяют его на детектор с длиной волны 220 нм. Для расчета концентрации хрома(III) и хрома(VI) проводят вычисление площадей хроматографических пиков отвечающих за присутствие ионов хрома(III) и хрома(VI) [Geddes A.F., Tarter J.G. The ion chromatographic determination of Cr(III)-Cr(VI) using an edta eluant // Analytical Letters. – 1988. – Vol. 21, Iss. 5. – P. 857-867]. Недостатком указанного способа являются сложность процедуры регистрации хроматограммы и большая продолжительность анализа.
Известен спектрофотометрический способ определения хрома(VI) с помощью метода Н-точки, который можно использовать при условии постоянства изменений спектров в выбранном спектральном диапазоне [Lazo P., Cullaj A., Lubonja F. Spectrophotometric determination of hexavalent chromium after complex formation with EDTA using H-point method // Asian Journal of Chemistry. – 2000. – Vol. 12, Iss. 3. – P. 745-752]. Первоначально раствор фильтруют от твердых частиц. Раствор, который не должен быть кислым, чтобы предотвратить восстановление хрома(VI). Для этого при необходимости рН раствора доводят до 6,7…7,3. Спектрофотометрируют после образования комплексов с трилоном Б. Для того чтобы исключить влияние железа(II), железа(III) и хрома(III) используют метод Н-точки. При реализации метода измеряют оптические плотности серии растворов при различных длинах волн и строят зависимости оптической плотности от известных концентраций ионов хрома в растворах и затем находят точку пересечения полученных прямых (Н-точка). Абсцисса этой точки позволяет вычислить концентрацию хрома(VI) в присутствии ионов железа(II), железа(III) и хрома(III). Недостатками указанного метода является длительность и сложность обработки экспериментальных данных, и невозможность определения катионов железа.
Наиболее близким (прототип) является метод определения хрома [Рудомёткина Т.Ф., Иванов В.М. Фотометрическое определение хрома в природных и промышленных объектах в форме этилендиаминтетраацетата // Вестн. Моск. ун-та. Сер. 2. Химия. – 2013. – Т. 54, № 3. – С. 164-167], который заключается в том, что к анализируемому раствору, содержащему 3…5 мг хрома, добавляют 10 мг аскорбиновой кислоты и 5 мл раствора этилендиаминтетраацетата, устанавливают рН 4,7…4,8, разбавляют раствор до известного объема и нагревают на кипящей водяной бане в течение 10…15 минут. После охлаждения измеряют оптическую плотность относительно воды при 540 нм. А содержание хрома(III) определяют по расчетной формуле, вводя поправки на содержание железа. Недостатком указанного способа является невозможность прямого определения хрома(III) по величине оптической плотности при 540 нм, так как на результаты анализа сильное влияние оказывают посторонние катионы. Это приводит к необходимости использования аскорбиновой кислоты для маскировки мешающих определению катионов металлов.
Задачей предлагаемого изобретения является возможность определения катионов хрома(III) и железа(III) при совместном присутствии в растворе без использования маскирующего реагента. Технический результат заключается в том, что предлагаемое изобретение позволяет определять концентрацию хрома(III) и железа(III) при совместном присутствии с высокой точностью и не требует использования маскирующего реагента.
Указанный технический результат достигается следующим образом. К анализируемому раствору, содержащему катионы хрома(III) и железа(III) добавляют заданный объём раствора трилона Б (концентрацией 80 г/л) и нагревают на кипящей водяной бане в течение заданного времени. К охлажденной до комнатной температуры реакционной смеси добавляют заданный объём концентрированного водного раствора аммиака и объём раствора доводят до известной величины. Полученный раствор для определения ионов хрома(III) фотометрируют при 660 нм, а для определения ионов железа(III) – при 315 нм после предварительно разбавления анализируемого раствора. По калибровочным зависимостям вычисляют концентрацию хрома(III) и железа(III) в фотометрируемом растворе.
Пример 1. Для построения калибровочной зависимости к 0,1 мл раствора хромокалиевых квасцов, который содержит 1 мг хрома(III) добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 660 нм. Оптическая плотность при 660 нм, которую измеряют в кюветах с толщиной рабочего слоя 2 см, составила 0,103.
Пример 2. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 2 мг хрома(III) составляет 0,2 мл. Оптическая плотность раствора при 660 нм составила 0,206.
Пример 3. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 3 мг хрома(III) составляет 0,3 мл. Оптическая плотность раствора при 660 нм составила 0,305.
Пример 4. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 4 мг хрома(III) составляет 0,4 мл. Оптическая плотность раствора при 660 нм составила 0,405.
Пример 5. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 5 мг хрома(III) составляет 0,5 мл. Оптическая плотность раствора при 660 нм составила 0,497.
Пример 6. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 6 мг хрома(III) составляет 0,6 мл. Оптическая плотность раствора при 660 нм составила 0,597.
Пример 7. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 7 мг хрома(III) составляет 0,7 мл. Оптическая плотность раствора при 660 нм составила 0,698.
Пример 8. Для построения калибровочной зависимости в условиях примера 1, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 8 мг хрома(III) составляет 0,8 мл. Оптическая плотность раствора при 660 нм составила 0,799.
На основании результатов измерения оптической плотности (примеры 1-8) были вычислены коэффициенты калибровочной зависимости в виде полинома первого порядка:
| С = 406.94∙А660 – 2.7039, R² = 0,9999 | (1) |
где С – концентрация хрома(III) в фотометрируемом растворе, мг/л;
А660 – оптическая плотность при 660 нм.
Как видно, калибровочная зависимость представляет собой прямую, коэффициент парной корреляции (R² = 0,9999) близок к 1. Для оценки применимости калибровочной зависимости (1) были проанализированы растворы с известными концентрациями ионов хрома(III) и железа(III).
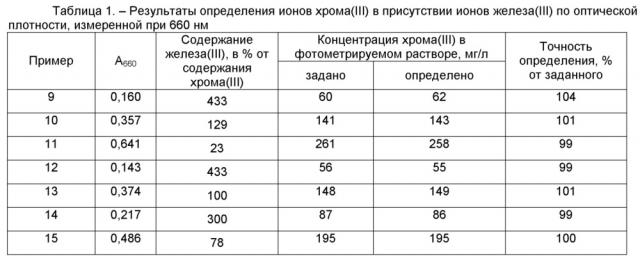
Пример 9. Для определения концентрации хрома путём смешения готовят раствор из 0,15 мл раствора хромокалиевых квасцов, который содержит 1,5 мг хрома(III) и 0,65 мл раствора сульфата железа(III), который содержит 6,5 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 660 нм. Оптическая плотность при 660 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,160. Используя измеренную величину оптической плотности при 660 нм, по калибровочной зависимости вычисляют концентрацию хрома(III) в фотометрируемом растворе. Заданная концентрация хрома(III) составляет 60 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 62 мг/л, что составляет 104 % от заданной концентрации.
Пример 10. Определение концентрации хрома в условиях примера 9, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,35 мл (3,5 мг хрома(III)), а объём раствора сульфата железа(III) – 0,45 мл (4,5 мг железа(III)). Оптическая плотность при 660 нм составила 0,357. Заданная концентрация хрома(III) составляет 141 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 143 мг/л, что составляет 101 % от заданной концентрации.
Пример 11. Определение концентрации хрома в условиях примера 9, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,65 мл (6,5 мг хрома(III)), а объём раствора сульфата железа(III) – 0,15 мл (1,5 мг железа(III)). Оптическая плотность при 660 нм составила 0,641. Заданная концентрация хрома(III) составляет 261 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 258 мг/л, что составляет 99 % от заданной концентрации.
Пример 12. Для определения концентрации хрома путём смешения готовят раствор из 0,15 мл раствора хромокалиевых квасцов, который содержит 1,35 мг хрома(III), и 0,65 мл раствора сульфата железа(III), который содержит 5,85 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 660 нм. Оптическая плотность при 660 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,143. Используя измеренную величину оптической плотности при 660 нм, по калибровочной зависимости вычисляют концентрацию хрома(III) в фотометрируемом растворе. Заданная концентрация хрома(III) составляет 56 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 55 мг/л, что составляет 99 % от заданной концентрации.
Пример 13. Определение концентрации хрома в условиях примера 12, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,4 мл (3,6 мг хрома(III)), а объём раствора сульфата железа(III) – 0,4 мл (3,6 мг железа(III)). Оптическая плотность при 660 нм составила 0,374. Заданная концентрация хрома(III) составляет 148 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 149 мг/л, что составляет 101 % от заданной концентрации.
Пример 14. Для определения концентрации хрома путём смешения готовят раствор из 0,2 мл раствора хромокалиевых квасцов, который содержит 2,2 мг хрома(III), и 0,6 мл раствора сульфата железа(III), который содержит 6,6 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 660 нм. Оптическая плотность при 660 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,217. Используя измеренную величину оптической плотности при 660 нм, по калибровочной зависимости вычисляют концентрацию хрома(III) в фотометрируемом растворе. Заданная концентрация хрома(III) составляет 87 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 86 мг/л, что составляет 99 % от заданной концентрации.
Пример 15. Определение концентрации хрома в условиях примера 14, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,45 мл (4,95 мг хрома(III)), а объём раствора сульфата железа(III) – 0,35 мл (3,85 мг железа(III)). Оптическая плотность при 660 нм составила 0,486. Заданная концентрация хрома(III) составляет 195 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 195 мг/л, что составляет 100 % от заданной концентрации.
Пример 16. Для построения калибровочной зависимости по оптической плотности при 540 нм к 0,1 мл раствора хромокалиевых квасцов, который содержит 1 мг хрома(III), добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 540 нм. Оптическая плотность при 540 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,166.
Пример 17. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 2 мг хрома(III), составляет 0,2 мл. Оптическая плотность раствора при 540 нм составила 0,329.
Пример 18. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 3 мг хрома(III), составляет 0,3 мл. Оптическая плотность раствора при 540 нм составила 0,487.
Пример 19. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 4 мг хрома(III), составляет 0,4 мл. Оптическая плотность раствора при 540 нм составила 0,642.
Пример 20. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 5 мг хрома(III), составляет 0,5 мл. Оптическая плотность раствора при 540 нм составила 0,775.
Пример 21. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 6 мг хрома(III), составляет 0,6 мл. Оптическая плотность раствора при 540 нм составила 0,928.
Пример 22. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 7 мг хрома(III), составляет 0,7 мл. Оптическая плотность раствора при 540 нм составила 1,088.
Пример 23. Для построения калибровочной зависимости в условиях примера 16, отличающийся тем, что объём раствора хромокалиевых квасцов, который содержит 8 мг хрома(III), составляет 0,8 мл. Оптическая плотность раствора при 540 нм составила 1,221.
На основании результатов измерения оптической плотности (примеры 16-23) были вычислены коэффициенты калибровочной зависимости в виде полинома первого порядка:
| С = 267,31∙А540 – 7,2846, R² = 0,9994 | (2) |
где С – концентрация хрома(III) в фотометрируемом растворе, мг/л;
А540 – оптическая плотность при 540 нм.
Для оценки применимости калибровочной зависимости (2) были проанализированы растворы с известными концентрациями ионов хрома(III) и железа(III).
Пример 24. Для определения концентрации хрома путём смешения готовят раствор из 0,4 мл раствора хромокалиевых квасцов, который содержит 4 мг хрома(III), и 0,4 мл раствора сульфата железа(III), который содержит 4 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 540 нм. Оптическая плотность при 540 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,658. Используя измеренную величину оптической плотности при 540 нм, по калибровочной зависимости вычисляют концентрацию хрома(III) в фотометрируемом растворе. Заданная концентрация хрома(III) составляет 161 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 169 мг/л, что составляет 105 % от заданной концентрации.
Пример 25. Определение концентрации хрома в условиях примера 24, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,65 мл (6,5 мг хрома(III)), а объём раствора сульфата железа(III) – 0,15 мл (1,5 мг железа(III)). Оптическая плотность при 540 нм составила 0,940. Заданная концентрация хрома(III) составляет 261 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 244 мг/л, что составляет 93 % от заданной концентрации.
Пример 26. Для определения концентрации хрома путём смешения готовят раствор из 0,1 мл раствора хромокалиевых квасцов, который содержит 0,9 мг хрома(III), и 0,7 мл раствора сульфата железа(III), который содержит 6,3 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 540 нм. Оптическая плотность при 540 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,228. Используя измеренную величину оптической плотности при 540 нм, по калибровочной зависимости вычисляют концентрацию хрома(III) в фотометрируемом растворе. Заданная концентрация хрома(III) составляет 37 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 54 мг/л, что составляет 145 % от заданной концентрации.
Пример 27. Определение концентрации хрома в условиях примера 26, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,25 мл (2,25 мг хрома(III)), а объём раствора сульфата железа(III) – 0,55 мл (4,95 мг железа(III)). Оптическая плотность при 540 нм составила 0,424. Заданная концентрация хрома(III) составляет 93 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 106 мг/л, что составляет 114 % от заданной концентрации.
Пример 28. Для определения концентрации хрома путём смешения готовят раствор из 0,4 мл раствора хромокалиевых квасцов, который содержит 4,4 мг хрома(III), и 0,4 мл раствора сульфата железа(III), который содержит 4,4 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Полученный раствор фотометрируют при 540 нм. Оптическая плотность при 540 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,701. Используя измеренную величину оптической плотности при 540 нм, по калибровочной зависимости вычисляют концентрацию хрома(III) в фотометрируемом растворе. Заданная концентрация хрома(III) составляет 173 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 180 мг/л, что составляет 104 % от заданной концентрации.
Пример 29. Определение концентрации хрома в условиях примера 28, отличающееся тем, что объём раствора хромокалиевых квасцов составляет 0,25 мл (2,75 мг хрома(III)), а объём раствора сульфата железа(III) – 0,55 мл (6,05 мг железа(III)). Оптическая плотность при 540 нм составила 0,497. Заданная концентрация хрома(III) составляет 108 мг/л. Определенная концентрация хрома(III) в фотометрируемом растворе составила 126 мг/л, что составляет 116 % от заданной концентрации.
Результаты определения концентрации хрома(III) в растворах при 660 нм, приведенные в таблице 1, свидетельствуют о хорошей точности определения. А результаты определения концентрации хрома(III) в растворах при 540 нм, приведенные в таблице 2, свидетельствуют о том, что точность определения ионов хрома(III) без использования маскирующего реагента является невысокой.
Ниже приведены результаты, которые использованы при построении калибровочной зависимости для определения железа(III) в растворах.
Пример 30. Для построения калибровочной зависимости к 0,05 мл раствора железа(III), который содержит 0,5 мг железа(III), добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5 %), объём раствора доводят дистиллированной водой до 25 мл. Затем полученный раствор разбавляют в 25 раз и фотометрируют при 315 нм. Оптическая плотность при 315 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,115.
Пример 31. Для построения калибровочной зависимости в условиях примера 30, отличающийся тем, что объём раствора железа(III), который содержит 1.5 мг железа(III), составляет 0,15 мл. Оптическая плотность раствора при 315 нм составила 0,284.
Пример 32. Для построения калибровочной зависимости в условиях примера 30, отличающийся тем, что объём раствора железа(III), который содержит 3 мг железа(III), составляет 0,3 мл. Оптическая плотность раствора при 315 нм составила 0,515.
Пример 33. Для построения калибровочной зависимости в условиях примера 30, отличающийся тем, что объем раствора железа(III), который содержит 7,5 мг железа(III), составляет 0,75 мл. Оптическая плотность раствора при 315 нм составила 0,925.
Пример 34. Для построения калибровочной зависимости к 0,5 мл раствора железа(III), который содержит 4,5 мг железа(III), добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5%), объем раствора доводят дистиллированной водой до 25 мл. Затем полученный раствор разбавляют в 25 раз и фотометрируют при 315 нм. Оптическая плотность при 315 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,702.
Пример 35. Для построения калибровочной зависимости в условиях примера 34, отличающийся тем, что объем раствора железа(III), который содержит 5,4 мг железа(III), составляет 0,6 мл. Оптическая плотность раствора при 315 нм составила 0,790.
На основании результатов измерения оптической плотности (примеры 30-35) были вычислены коэффициенты калибровочной зависимости в виде полинома четвертого порядка:
где С' - концентрация железа(III) в фотометрируемом растворе, мг/л;
A315 - оптическая плотность при 315 нм.
Для оценки применимости калибровочной зависимости (3) были проанализированны растворы с известными концентрациями ионов хрома(III) и железа(III).
Пример 36. Для определения концентрации железа путем смешения готовят раствор из 0,6 мл раствора хромокалиевых квасцов, который содержит 6 мг хрома(III), и 0,2 мл раствора сульфата железа(III), который содержит 2 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5%), объем раствора доводят дистиллированной водой до 25 мл. Затем полученный раствор разбавляют в 25 раз. Оптическая плотность при 315 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,363. Используя измеренную величину оптической плотности при 315 нм, по калибровочной зависимости вычисляют концентрацию железа(III) в фотометрируемом растворе. Заданная концентрация железа(III) составляет 4,8 мг/л. Определенная концентрация железа(III) в фотометрируемом растворе составила 4,8 мг/л, что составляет 100% от заданной концентрации.
Пример 37. Определение концентрации железа в условиях примера 36, отличающееся тем, что объем раствора хромокалиевых квасцов составляет 0,35 мл (3,5 мг хрома(III)), а объем раствора сульфата железа(III) - 0,45 мл (4,5 мг железа(III)). Оптическая плотность при 315 нм составила 0,707. Заданная концентрация железа(III) составляет 10,9 мг/л. Определенная концентрация железа(III) в фотометрируемом растворе составила 10,9 мг/л, что составляет 100% от заданной концентрации.
Пример 38. Для определения концентрации железа путем смешения готовят раствор из 0,25 мл раствора хромокалиевых квасцов, который содержит 2,25 мг хрома(III), и 0,55 мл раствора сульфата железа(III), который содержит 4,95 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5%), объем раствора доводят дистиллированной водой до 25 мл. Затем полученный раствор разбавляют в 25 раз. Оптическая плотность при 315 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,753. Используя измеренную величину оптической плотности при 315 нм, по калибровочной зависимости вычисляют концентрацию железа(III) в фотометрируемом растворе. Заданная концентрация железа(III) составляет 11,9 мг/л. Определенная концентрация железа(III) в фотометрируемом растворе составила 12,0 мг/л, что составляет 101% от заданной концентрации.
Пример 39. Для определения концентрации железа путем смешения готовят раствор из 0,2 мл раствора хромокалиевых квасцов, который содержит 2,2 мг хрома(III), и 0,6 мл раствора сульфата железа(III), который содержит 6,6 мг железа(III), к которому добавляют 4 мл раствора трилона Б (концентрацией 80 г/л). Полученную смесь нагревают на кипящей водяной бане в течение 10 минут. После охлаждения добавляют 0,5 мл водного раствора аммиака (концентрацией 23,5%), объем раствора доводят дистиллированной водой до 25 мл. Затем полученный раствор разбавляют в 25 раз. Оптическая плотность при 315 нм, которую измеряли в кюветах с толщиной рабочего слоя 2 см, составила 0,869. Используя измеренную величину оптической плотности при 315 нм, по калибровочной зависимости вычисляют концентрацию железа(III) в фотометрируемом растворе. Заданная концентрация железа(III) составляет 15,9 мг/л. Определенная концентрация железа(III) в фотометрируемом растворе составила 15,7 мг/л, что составляет 99% от заданной концентрации.
Результаты определения концентрации железа(III) в растворе в присутствии ионов хрома(III) сведены в таблице 3.
Таким образом, полученные результаты свидетельствуют о том, что предлагаемое изобретение позволяет определять концентрацию хрома(III) и железа(III) при совместном присутствии с высокой точностью и не требует использования маскирующего реагента.
Способ определения концентрации ионов хрома (III) и железа (III) при совместном присутствии в растворе, включающий добавление к анализируемому раствору, содержащему ионы хрома (III) и железа (III), 4 мл раствора трилона Б (концентрацией 80 г/л), нагревание полученной смеси на кипящей водяной бане в течение 10 мин, охлаждение смеси до комнатной температуры, добавление к охлажденной смеси 0,5 мл водного раствора аммиака, доведение дистиллированной водой до 25 мл, определение оптической плотности раствора и вычисление концентрации ионов по калибровочным зависимостям, при этом измерение оптической плотности производят при 660 нм для ионов хрома (III) и при 315 нм для ионов железа (III).