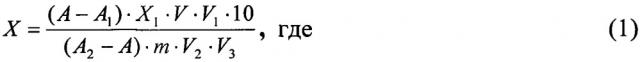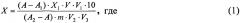Способ определения витамина в2 в кондитерских изделиях
Иллюстрации
Показать всеИзобретение относится к области пищевой промышленности, в частности к кондитерской отрасли, и может быть использовано для контроля качества кондитерских изделий. Способ определения витамина B2 в кондитерских изделиях включает последовательное проведение кислотного и ферментного гидролиза пробы с последующей фильтрацией, фотолиз, флюориметрическое определение и обработку результатов, при этом перед фотолизом проводят концентрирование водной фазы, полученной после фильтрации, путем твердофазной экстракции. Изобретение повышает точность и снижает минимальный порог определения массовой доли витамина В2 в кондитерских изделиях. 1 пр.
Реферат
Изобретение относится к области пищевой промышленности, в частности к кондитерской отрасли, и может быть использовано для контроля качества кондитерских изделий.
Известен способ определения витамина В2 в молочных продуктах детского питания, предусматривающий проведение кислотного гидролиза навески пробы, отделение белков фильтрованием, отбор из раствора фильтрата аликвотных частей, введение в три из них стандартного раствора витамина В2, измерение интенсивности флюоресценции и определение количества содержащегося в продукте витамина В2 путем построения графика зависимости интенсивности флюоресценции от количества введенного в аликвотную часть пробы витамина В2. (см. патент РФ 2109279 G01N 33/04 1995 г.) Способ сокращает длительность проведения анализа, обеспечивает уменьшение загрязнения окружающей среды, но не позволяет проводить определение витамина В2 в кондитерских изделиях.
Известны государственные стандарты: ГОСТ 31483-2012 «Премиксы. Определение содержания витаминов: B1 (тиаминхлорида), В2 (рибофлавина), В3 (пантотеновой кислоты), В5 (никотиновой кислоты и никотинамида), В6 (пиридоксина), В9 (фолиевой кислоты), С (аскорбиновой кислоты) методом капиллярного электрофореза», ГОСТ 55482-2013 «Мясо и мясные продукты. Метод определения содержания водорастворимых витаминов», ГОСТ 32903-2014 «Продукция соковая. Определение водорастворимых витаминов: тиамина (B1), рибофлавина (В2), пиридоксина (В6) и никотинамида (РР) методом обращенно-фазовой высокоэффективной жидкостной хроматографии», существуют колориметрический и флюориметрический методы определения витамина В2 [Методы определения витаминов.; ВНИВИ. - М.: Пищепромиздат, 1951. - 96 с.].
Указанные государственные стандарты также не предусматривают определение витаминов в кондитерских изделиях. Их основным недостатком является высокий минимальный порог определения массовой доли витамина В2.
Наиболее близким является ГОСТ 29139-91 «Мука, хлеб и хлебобулочные изделия пшеничные витаминизированные. Метод определения витамина В2 (рибофлавина)», согласно которому освобождаются связанные формы рибофлавина кислотным и ферментативным гидролизом, экстракционно очищается полученный гидролизат от соединений, мешающих флюориметрическому определению, переводится при облучении в щелочной среде рибофлавин в люмифлавин, извлекается люмифлавин хлороформом и измеряется интенсивность флюоресценции люмифлавина в сравнении со стандартным раствором с помощью флюориметра, который обеспечивает длины волн возбуждения в области 350-480 нм и флюоресценции 400-650 нм.
Однако данный способ не позволяет определять массовую долю витамина В2 ниже 0,1 мг на 100 г продукта.
Технической задачей предлагаемого изобретения является повышение точности и снижение минимального порога определения массовой доли витамина В2 в кондитерских изделиях.
Для достижения поставленной задачи предложен способ определения витамина В2 в кондитерских изделиях, включающий последовательное проведение кислотного, ферментного гидролиза пробы, с последующей фильтрацией, фотолиз, флюориметрическое определение и обработку результатов, при этом перед фотолизом проводят концентрирование водной фазы, полученной после фильтрации, путем твердофазной экстракции.
Концентрирование водной фазы, полученной после фильтрации, путем твердофазной экстракции обеспечивает снижение минимального порога определения массовой доли витамина В2 в кондитерских изделиях и повышает точность измерений.
Способ осуществляют следующим образом.
Для определения витамина В2 берут навеску 10,0-12,0 г, и добавляют 150 см3 раствора соляной кислоты 0,1 моль/дм3. Все помещают в коническую колбу вместимостью 250 см3, для проведения кислотного гидролиза на кипящей водяной бане в течение 35-45 мин. Охлаждают раствор до комнатной температуры, доводят до значения рН до 4,4-4,6 насыщенным раствором уксуснокислого натрия, затем добавляют 0,005-0,010 г фермента α-амилазы и 2-3 капли бензола. Колбу с раствором помещают в термостат на 14-16 часов при температуре 34-39°C. Затем охлаждают гидролизат до комнатной температуры. Количественно переносят гидролизат в мерную колбу вместимостью 250 см3, доводят объем раствора до метки дистиллированной водой и фильтруют. Контрольный раствор готовят по указанной процедуре, но без использования навески исследуемой пробы.
К 100 см3 полученного фильтрата добавляют 2 см3 раствора серной кислоты с концентрацией 0,3 г/см3 и 0,5-10 см3 раствора марганцовокислого калия с концентрацией 0,03 г/см3 до получения малинового окрашивания, которое не исчезает в течение 30 сек.
Затем по каплям добавляют раствор перекиси водорода с концентрацией 3% до обесцвечивания фильтрата. Полученный раствор переносят в делительную воронку, добавляют 30-50 см3 хлороформа и встряхивание в течение 1 мин.
После разделения слоев водную фазу используют для концентрирования витамина методом твердофазной экстракции.
Для этого картридж с 200-1000 мг сорбента С18-Е обрабатывают 2-10 см3 этилового спирта и 4-20 см3 дистиллированной воды, пропускают через сорбент 20-100 см3 водной фазы, содержащей рибофлавин. Десорбцию витамина В2 проводят 2-10 см3 смеси этилового спирта и воды, приготовленной в соотношении 9:1. Промывку картриджа проводят 2-10 см3 этилового спирта, затем 4-20 см3 дистиллированной воды. Концентрирование проводят до получения требуемого объема элюата.
Аналогичным образом концентрируют контрольный раствор.
В две колбы добавляют по 4 см3 элюата, в одну из которых добавлены 2 см3 стандартного раствора рибофлавина с концентрацией 0,001 г/см3.
В третью колбу добавляют 4 см3 сконцентрированного контрольного раствора. Во все три колбы добавляют по 4 см3 раствора гидроокиси натрия с концентрацией 7 моль/дм3, перемешивают содержимое и облучают их светодиодной лампой мощностью 30 Вт с расстояния 15 см в течение 10 мин.
Во все колбы добавляют по 4 см3 ледяной уксусной кислоты и затем по 3-5 см3 хлороформа, закрывают пробками и встряхивают в течение 2 мин.
После расслоения отбирают пипеткой 2-3 см3 хлороформного (нижнего) слоя, который фильтруют через бумажный фильтр с безводным сернокислым натрием в стеклянную склянку. Проводят измерение интенсивности флюоресценции растворов люмифлавина. Массовую долю рибофлавина X (мг/100 г) рассчитывают по формуле:
А - интенсивность флюоресценции испытуемого раствора без добавления стандартного раствора витамина В2, ед. пр.;
A1 - интенсивность флюоресценции контрольного раствора, ед. пр.;
А2 - интенсивность флюоресценции испытуемого раствора с добавлением стандартного раствора витамина В2, ед. пр.;
X1 - массовая доля добавленного витамина В2, мг;
m - масса анализируемой пробы, г;
V - общий объем гидролизата, см3 (V=250 см3);
V1 - объем гидролизата после окисления, см3;
V2 - объем гидролизата, используемый для очистки от примесей, см3;
V3 - объем гидролизата, используемый для облучения, см3;
10 - коэффициент пересчета.
Технический результат заключается в концентрировании раствора витамина В2 с помощью твердофазной экстракции и снижении минимального порога определения в кондитерских изделиях.
Пример 1.
Навеску измельченного сахарного печенья массой 10,05 г помещают в коническую колбу вместимостью 250 см3 и добавляют 150 см3 раствора соляной кислоты 0,1 моль/дм3. Кислотный гидролиз осуществляют на кипящей водяной бане в течение 40 мин. По окончании гидролиза колбу охлаждают до комнатной температуры и с помощью насыщенного раствора уксуснокислого натрия доводят рН до 4,5±0,1. К гидролизату добавляют навеску α-амилазы массой 0,007 г, 2-3 капели бензола, затем колбу помещают в термостат при температуре 37°C на 14-16 часов. По окончании ферментного гидролиза гидролизат охлаждают до комнатной температуры, количественно переносят в мерную колбу вместимостью 250 см3, доводят объем до метки дистиллированной водой и фильтруют. Общий объем гидролизата V=250 см3.
Аналогично готовят контрольный раствор, используя тоже количество ферментного препарата и реактивов, но без навески исследуемой пробы. К 100 см3 (V2) фильтрата с помощью пипетки при перемешивании добавляют 2 см3 раствора серной кислоты 0,3 г/см3 и раствор марганцовокислого калия с концентрацией 0,03 г/см3 до получения малинового окрашивания, которое не исчезает в течение 30 сек. Затем добавляют 3%-й раствор перекиси водорода до обесцвечивания фильтрата.
Объем израсходованного раствора марганцовокислого калия составил 0,65 см3, объем раствора перекиси водорода составил 0,2 см3. Таким образом, объем гидролизата после окисления составляет V1=100,0+2,0+0,65+0,2=102,85 см3.
Полученный раствор переносят в делительную воронку, добавляют 40 см3 хлороформа и встряхивают в течение 1 мин. После разделения водную фазу используют для концентрирования витамина В2 с помощью твердофазной экстракции.
Картридж с 1000 мг сорбента С18-Е обрабатывают 10 см3 этилового спирта и 20 см3 дистиллированной воды. Пропускают через сорбент 100 см3 водного раствора витамина В2, выделенного из образца печенья. Десорбируют витамина В2 10 см3 смеси этилового спирта и воды, приготовленной в соотношении 9:1. Промывают картридж 10 см3 этилового спирта, затем 20 см3 дистиллированной воды.
Аналогичным образом концентрируют контрольный раствор.
В две колбы наливают по 4 см3 (V3) элюата, в одну из которых добавляют 2 см3 рабочего стандартного раствора рибофлавина 0,001 г/см3. X1=0,002 мг. В третью колбу наливают 4 см3 сконцентрированного контрольного раствора.
Во все три колбы добавляют по 4 см3 раствора гидроокиси натрия с концентрацией 7 моль/дм3, закрывают колбы пробками, перемешивают содержимое и облучают их светодиодной лампой с мощностью 30 Вт с расстояния 15 см в течение 10 мин. По окончании облучения растворы во всех колбах подкисляют 4 см3 ледяной уксусной кислоты, добавляют к ним по 4 см3 хлороформа, закрывают пробками и встряхивают в течение 2 мин. После расслоения отбирают пипеткой 2,5 см3 хлороформного (нижнего) слоя, фильтруют через бумажный фильтр с безводным сернокислым натрием в стеклянную склянку.
Интенсивность флюоресценции испытуемого раствора печенья без добавления стандартного раствора витамина В2 (А) составила 0,013 ед. пр. Интенсивность флюоресценции контрольного раствора (A1) составила 0,001 ед. пр. Интенсивность флюоресценции испытуемого раствора, полученного из образца печенья с добавлением стандартного раствора витамина В2 (А2), составила 0,046 ед. пр.
Массовую долю витамина В2 в печенье определяют по формуле (1):
Способ определения витамина В2 в кондитерских изделиях, включающий последовательное проведение кислотного и ферментного гидролиза пробы с последующей фильтрацией, фотолиз, флюориметрическое определение и обработку результатов, отличающийся тем, что перед фотолизом проводят концентрирование водной фазы, полученной после фильтрации, путем твердофазной экстракции.