Элюирующая матрица и ее применения
Иллюстрации
Показать всеГруппа изобретений относится к области медицины, а именно к иммунологии, и предназначена для лечения аутоиммунных расстройств. Элюирующая матрица, пригодная для имплантации в организм субъекта, включает как минимум одну клетку, экспрессирующую белок. Клетка инкапсулирована в пористую полимерную матрицу, высвобождающую CXCL12-полипептид. Скорость высвобождения CXCL12-полипептида из матрицы составляет как минимум 1,0 нг/мл/ч, чтобы отталкивать эффекторные T-клетки, окружающие матрицу в течение одного месяца после имплантации. Также элюирующая матрица характеризуется a) толщиной матрицы 200-500 мкм и концентрацией CXCL12-полипептида в матрице от 100 нг/мл до 1 мкг/мл; b) такой пористостью, что агенты, регулирующие концентрацию глюкозы в сыворотке субъекта с диабетом I типа, диффундируют через матрицу; c) выработкой инсулина указанными островковыми клетками, где инсулин высвобождается через матрицу со скоростью, достаточной для регулирования концентрации глюкозы в крови указанного субъекта. Использование группы изобретений повышает эффективность лечения аутоиммунных заболеваний благодаря специфическому модулированию иммунитета на ограниченном участке организма. 2 н. и 41 з.п. ф-лы, 8 ил., 1 табл., 5 пр.
Реферат
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Трансплантация является потенциальным подходом к лечению индивидуумов с аутоиммунными расстройствами, такими как сахарный диабет I типа (T1DM), но его применимость ограничена острым и хроническим иммунным отторжением трансплантированных клеток (N. Papeta et al. Transplantation 83, 174 (Jan 27, 2007); A. M. Shapiro et al. The New England journal of medicine 355, 1318 (Sep 28, 2006); J. S. Kaddis et al. JAMA 301, 1580 (Apr 15, 2009); R. P. Robertson. The New England journal of medicine 350, 694 (Feb 12, 2004); R. B. Jalili et al. Diabetes 59, 2219 (Sep, 2010); and V. Vaithilingam, The review of diabetic studies: 7, 62 (Spring, 2010)). В настоящее время с иммунным отторжением борются непрерывным подавлением системного иммунитета, т.е. подхода, который не демонстрирует достоверной долговременной эффективности, но при этом подвергает реципиента повышенным рискам инфекции и рака (A. G. Mallett, G. S. Korbutt. Tissue engineering. Part A 15, 1301 (Jun, 2009); N. Sakata et al. World journal of gastrointestinal pathophysiology 3, 19 (Feb 15, 2012); M. C. Poznansky et al. The Journal of clinical investigation 109, 1101 (Apr, 2002); and M. C. Poznansky et al. Nature medicine 6, 543 (May, 2000)). Были бы желательны альтернативные виды терапии, которые могли бы преодолеть необходимость в системном подавлении иммунитета благодаря специфическому модулированию иммунитета на ограниченном участке организма.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Полипептиды CXCL12 способны отталкивать эффекторные T-клетки, при этом мобилизуя иммуносупрессорные регуляторные T-клетки (T-супрессоры) на данном участке организма. В последнее время было установлено, что полипептиды CXCL12 способны преодолевать как острое, так и хроническое иммунное разрушение имплантированной матрицы сайт-специфичным образом, устраняя необходимость в одновременном системном подавлении иммунитета.
В одном из аспектов, настоящее изобретение относится к композициям, включающим как минимум одну клетку, инкапсулированную в матрицу, высвобождающую полипептид CXCL12 (далее по тексту иногда именуемую «элюирующей матрицей»).
В некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, может характеризоваться высвобождением полипептида CXCL12 со скоростью, достаточной для подавления действия эффекторных T-клеток. Например, в некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, может характеризоваться высвобождением полипептида CXCL12 со скоростью как минимум примерно 1,0 нг/мл/ч. В некоторых вариантах осуществления, полипептид CXCL12 может высвобождаться из матрицы, элюирующей полипептид CXCL12, со скоростью как минимум примерно 1,5 нг/мл/ч, как минимум примерно 2 нг/мл/ч, как минимум примерно 2,5 нг/мл/ч, как минимум примерно 3 нг/мл/ч, как минимум примерно 4 нг/мл/ч, как минимум примерно 5 нг/мл/ч или более. В некоторых вариантах осуществления, полипептид CXCL12 может высвобождаться со скоростью от примерно 1 нг/мл/ч до примерно 3 нг/мл/ч. В некоторых вариантах осуществления, полипептид CXCL12 может высвобождаться со скоростью примерно 1,75 нг/мл/ч. Только в качестве примера, композиция по настоящему изобретению может характеризоваться способностью отталкивать эффекторные T-клетки in vitro в камере Бойдена.
Полипептид CXCL12 может присутствовать в элюирующей матрице по настоящему изобретению в любой концентрации. В некоторых вариантах осуществления, концентрация полипептида CXCL12 может быть оптимизирована, например, для достижения желаемой скорости высвобождения и/или продолжительности высвобождения полипептида CXCL12 из элюирующей матрицы. В некоторых вариантах осуществления, полипептид CXCL12 может находиться в матрице в концентрации примерно 100 нг/мл. В некоторых вариантах осуществления, полипептид CXCL12 может находиться в матрице в концентрации от примерно 100 нг/мл до примерно 1 мкг/мл. В некоторых вариантах осуществления, концентрация полипептида CXCL12 в элюирующей матрице может сохраняться на уровне от примерно 100 нг/мл до примерно 1 мкг/мл в течение от примерно 3 месяцев до примерно 2 лет. В некоторых вариантах осуществления, концентрация полипептида CXCL12 в элюирующей матрице может сохраняться на уровне от примерно 100 нг/мл до примерно 1 мкг/мл в течение от примерно 3 месяцев до примерно 2 лет после имплантации композиции в организм субъекта. В некоторых вариантах осуществления, сохраняющаяся в матрице концентрация полипептида CXCL12 может составлять примерно 100-200 нг/мл.
Для формирования матрицы, высвобождающей полипептид CXCL12, полипептиды CXCL12 могут быть предварительно введены в элюирующую матрицу или вырабатываться in situ в элюирующей матрице. Например, в некоторых вариантах осуществления, полипептиды CXCL12 в матрице по настоящему изобретению может продуцироваться клетками, секретирующими полипептид CXCL12, или клетками, сконструированными для секреции полипептидов CXCL12. В одном из вариантов осуществления, полипептиды CXCL12 в матрице могут вырабатываться островковыми клетками, находящимися в матрице.
В некоторых вариантах осуществления, полипептиды CXCL12, находящиеся в элюирующей матрице по настоящему изобретению, могут включать аминокислотные последовательности, соответствующие виду субъекта, подвергаемого лечению. Например, в некоторых вариантах осуществления, полипептид CXCL12 может включать человеческий полипептид CXCL12.
Матрица, высвобождающая полипептид CXCL12, может характеризоваться различными структурами матрицы. Например, в некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, может образовывать капсулу. В некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, может иметь форму твердой или вспененной матрицы. В некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, может образовывать многокамерную или многослойную матрицу. В этих вариантах осуществления, клетка(и) и полипептид CXCL12 могут находиться в одной и той же или в разных камерах или слоях матрицы, высвобождающей полипептид CXCL12, по настоящему изобретению.
Толщина матрицы, высвобождающей полипептид CXCL12, может варьироваться, чтобы соответствовать потребностям различных применений. Только в качестве примера, толщину матрицы, высвобождающей полипептид CXCL12, можно регулировать для достижения быстрого высвобождения или медленного высвобождения полипептида CXCL12 из матрицы. В некоторых вариантах осуществления, толщина матрицы может составлять от примерно 200 до примерно 500 микронов.
Клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может быть отобрана или получена из любого источника, любого биологического вида и/или ткани любого типа. Дополнительно или в качестве альтернативы, клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может дифференцироваться из стволовых клеток в клетки определенного типа. В некоторых вариантах осуществления, клетка(и) инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может быть аутологической. В некоторых вариантах осуществления, клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может являться аллогенной клеткой (клетками) или ксеногенной клеткой (клетками).
В некоторых вариантах осуществления, клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может сохранять свои функции и/или активность в течение желаемого периода времени, например, после имплантации композиции в организм субъекта. В некоторых вариантах осуществления, клетка(и) может сохранять свои функции и/или активность по крайней мере в течение примерно 1 месяца или более, в т.ч., например, как минимум примерно 2 месяцев, как минимум примерно 3 месяцев или более. В некоторых вариантах осуществления, клетка(и) может сохранять свои функции и/или активность по крайней мере в течение примерно 1 месяца или более после имплантации композиции по настоящему изобретению в организм субъекта.
В зависимости от типов клеток, инкапсулированных в матрицу, высвобождающую полипептид CXCL12, эти клетки могут осуществлять различные функции и/или проявлять различную активность. В некоторых вариантах осуществления, клетка(и) инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может регулировать уровень глюкозы в крови субъекта. Например, после имплантации, клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может выделять инсулин, реагируя на уровень глюкозы в окружающей среде. В этих вариантах осуществления, клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может включать островковую клетку. Эта островковая клетка может являться клеткой, продуцирующей инсулин, островковой клеткой, полученной из индуцированной плюрипотентной стволовой клетки (iPS), свиной островковой клетки, человеческой островковой клетки или любых комбинаций клеток перечисленных типов.
В некоторых вариантах осуществления, клетка(и), инкапсулированная в матрицу, высвобождающую полипептид CXCL12, может быть удалена. В некоторых вариантах осуществления, эта клетка(и) может быть помещена в матрицу, высвобождающую полипептид CXCL12, in vivo.
Матрица, высвобождающая полипептид CXCL12, может включать как минимум один или несколько биосовместимых биополимеров. Эти биосовместимые полимеры могут быть биоразрушаемыми или не разрушаемыми. Биосовместимые полимеры могут являться полимерами на основе углеводов, на основе белков и/или синтетическими полимерами. В некоторых вариантах осуществления, биосовместимые полимеры можно выбирать таким образом, чтобы они были инертны в отношении инкапсулированных клеток (например, не стимулировали или не ингибировали передачу клеточных сигналов) и являлись проницаемыми для полипептида CXCL12, который должен вымываться из матрицы, и, необязательно, проницаемыми для целевой молекулы, которая должна оказывать влияние на клетки. В некоторых вариантах осуществления, биосовместимый полимер можно выбрать таким образом, чтобы средний размер пор элюирующей матрицы по настоящему изобретению отсеивал молекулы с массой превышающей примерно 130КДа.
В некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, может включать альгинатный гель. Этот альгинатный гель может включать маннуроновую кислоту (M) и гулуроновую кислоту (G), причем соотношение (M/G) подбирают так, чтобы добиться свойств, подходящих для индивидуальных применений. Примеры свойств альгинатного геля, которые можно оптимизировать за счет соотношения M/G, включают, не ограничиваясь этим, пороговую молекулярную массу, пористость, размер пор, прочность геля (напряжение сдвига) и/или профиль высвобождения полипептида CXCL12.
В некоторых вариантах осуществления, альгинатный гель может иметь высокое содержание маннуроновой кислоты. В некоторых вариантах осуществления, альгинатный гель может включать маннуроновую кислоту (M) и гулуроновую кислоту (G), при соотношении (M/G) равном примерно 1 или превышающем 1. В некоторых вариантах осуществления, концентрация альгинатного геля может меняться от примерно 1% масса/объем до примерно 5% масса/объем. В некоторых вариантах осуществления, концентрация алгинатного геля может составлять примерно 2% масса/объем.
В некоторых вариантах осуществления, композиция по настоящему изобретению может дополнительно включать слой клеток, которые способны экспрессировать полипептид CXCL12. В некоторых вариантах осуществления, клетки, экспрессирующие полипептид CXCL12, могут включать мезотелиальные клетки.
В некоторых вариантах осуществления, композиция по настоящему изобретению может дополнительно включать рассасывающийся слой полипептида CXCL12 поверх элюирующей матрицы.
В некоторых вариантах осуществления, композиции могут иметь такой состав, чтобы они являлись композициями, подходящими для инъекций.
В различных вариантах осуществления, композиции по настоящему изобретению могут быть имплантированы или введены с помощью инъекции в целевой участок организма субъекта для лечения заболевания или расстройства. В некоторых вариантах осуществления, композиции могут включать как минимум одну островковую клетку, инкапсулированную в матрицу, высвобождающую полипептид CXCL12. Соответственно, в некоторых вариантах осуществления, композиция, например, для лечения диабета, может быть охарактеризована как композиция, включающая аллотрансплантат или ксенотрансплантат островковых клеток, инкапсулированных в матрицу, высвобождающую полипептид CXCL12, где матрица имеет следующие характеристики: (a) толщина матрицы составляет 200-500 микронов, и концентрация полипептида CXCL12 в матрице составляет от примерно 100 нг/мл до примерно 1 мкг/мл; (b) пористость матрицы такова, что агенты, регулирующие концентрацию глюкозы в сыворотке субъекта с диабетом I типа, диффундируют через матрицу; и (c) выработка инсулина островковыми клетками основана на взаимодействии агентов с островковыми клетками, где инсулин высвобождается через матрицу со скоростью, достаточной для регулирования концентрации глюкозы в сыворотке или ее уровня в крови субъекта. Толщину матрицы, концентрацию CXCL12 и/или скорость высвобождения можно отрегулировать таким образом, чтобы подавить разрушение островковых клеток в течение периода как минимум или вплоть до примерно 4 месяцев, тем самым обеспечивая регулирование уровня глюкозы в крови субъекта в течение этого периода. В некоторых вариантах осуществления, толщину матрицы, концентрацию CXCL12 и/или скорость высвобождения можно отрегулировать таким образом, чтобы подавлять разрушение островковых клеток в течение периода примерно 6 месяцев или более.
В другом аспекте, в изобретении описаны также способы доставки островковых клеток в организм субъекта, которому это необходимо. Этот способ включает имплантацию композиций по одному или нескольким вариантам осуществления композиций, описанным в заявке, в организм субъекта, где островковые клетки регулируют уровни глюкозы в крови субъекта в течение определенного периода времени. Только в качестве примера, островковые клетки, инкапсулированные в матрицу, высвобождающую полипептид CXCL12, после имплантации в организм субъекта способны регулировать уровни глюкозы в крови субъекта в течение периода как минимум примерно 1 месяц или более, в т.ч., например, как минимум примерно 2 месяца, как минимум примерно 3 месяца, как минимум примерно 6 месяцев, как минимум примерно 9 месяцев, как минимум примерно 1 год, как минимум примерно 2 года или более.
В некоторых вариантах осуществления, островковые клетки, инкапсулированные в матрицу, высвобождающую полипептид CXCL12, способны поддерживать или восстанавливать концентрацию глюкозы в сыворотке субъекта натощак от примерно 80 мг/дл до примерно 120 мг/дл.
В некоторых вариантах осуществления, матрица, высвобождающая полипептид CXCL12, не разрушается эффекторными T-клетками или макрофагами.
В некоторых вариантах осуществления, в месте имплантации могут присутствовать регуляторные T-клетки. В некоторых вариантах осуществления, в месте имплантации могут отсутствовать эффекторные T-клетки. Только в качестве примера, присутствие регуляторных T-клеток или отсутствие эффекторных T-клеток, можно измерить с помощью цитометрии в потоке или иммуногистохимии.
В некоторых вариантах осуществления, субъекту может осуществляться неоднократная имплантация композиции, включающей как минимум одну островковую клетку, инкапсулированную с матрицу, высвобождающую полипептид CXCL12.
Еще один аспект настоящего изобретения относится к способам пополнения численности островковых клеток в организме субъекта, у которого имеется хранилище островковых клеток в форме ксенотрансплантата, при наличии такой необходимости. Этот способ включает (a) оценку времени полужизни островковых клеток, имеющихся в организме субъекта; (b) доставку островковых клеток в организм субъекта так, чтобы статистическое время полужизни островковых клеток соответствовало терапевтическому уровню, который обеспечит контроль уровней глюкозы в крови субъекта в течение определенного периода времени; и (c) повторение стадий (a) и (b), исходя из периода полужизни островковых клеток. В некоторых вариантах осуществления, время полужизни островковых клеток, имеющихся в организме субъекта, можно оценить или измерить, отслеживая изменения уровня глюкозы в крови субъекта. Например, возвращение содержания глюкозы в крови на диабетические уровни может указывать на необходимость пополнения численности островковых клеток в организме субъекта.
Кроме того, настоящее изобретение относится к композициям, включающим матрицу, высвобождающую полипептид CXCL12. Эта матрица может характеризоваться: (a) пористостью, такой что полипептид CXCL12 медленно вымывается из композиции и проникает на активный участок аутоиммунного заболевания; (b) агентом, который препятствует миграции матрицы после введения, так чтобы основная часть матрицы оставалась в месте введения и около него; где концентрация полипептида CXCL12 и скорость его вымывания выбраны таким образом, чтобы подавлять дальнейшее развитие указанного аутоиммунного заболевания. В некоторых вариантах осуществления, композиции по настоящему изобретению можно вводить инъекцией. В этих вариантах осуществления, композиции могут иметь такой состав, чтобы они были пригодными для инъекций.
Другие особенности и преимущества настоящего изобретения будут ясны из подробного описания и формулы изобретения. Таким образом, другие аспекты настоящего изобретения описаны в дальнейшей части заявки и входят в объем изобретения.
КРАТКОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНОГО МАТЕРИАЛА
Приведенное ниже по тексту подробное описание изобретения, данное в качестве примера и не претендующее на ограничение объема изобретения конкретно описанными вариантами осуществления, может быть понято при помощи приложенных чертежей, которые включены в текст заявки посредством ссылки.
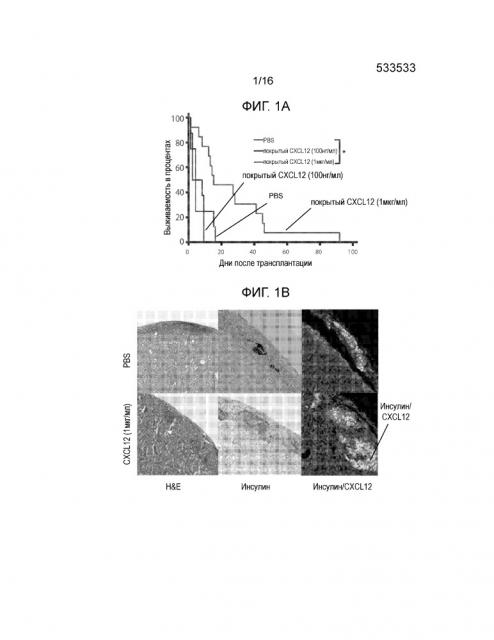
Фиг.1A-1D демонстрируют, что покрытие аллогенных островков полипептидом CXCL12 с высокой концентрацией отсрочивает отторжение. Фиг.1A представляет собой кривую выживаемости, демонстрирующую долю аллотрансплантированных островков после трансплантации. Островки мышей BALB/C подвергали действию CXCL12 в концентрации примерно 100 нг/мл и примерно 1 мкг/мл или только PBS и трансплантировали под почечную капсулу диабетических мышей-реципиентов C57BL/6, обработанных STZ. Повторное наступление гипергликемии рассматривалось как показатель отторжения трансплантата, тогда как сохранение нормогликемии считалось признаком выживания аллотрансплантата. Покрытие островков примерно 1 мкг/мл, но не 100 нг/мл полипептида CXCL12 статистически достоверно увеличивало время отторжения трансплантата по сравнению с PBS контрольными образцами (p=0,012, логарифмический ранговый критерий) (12 животных на группу). Фиг.1B представляет собой группу изображений, демонстрирующих аллотрансплантаты островков. Репрезентативное окрашивание гематоксилином и эозином (H&E) участков подкапсульных трансплантатов островков продемонстрировало уменьшенную инфильтрацию мононуклеарных клеток для островков, покрытых ~1 мкг/мл CXCL12, по сравнению с непокрытым контролем (левая группа изображений). Обработка областей островковых трансплантатов, покрытых ~1 мкг/мл CXCL12 и PBS, для выявления инсулина продемонстрировала большее количество функциональных островков и более высокий уровень секреции инсулина у островков, покрытых CXCL12, по сравнению с PBS контролем (средняя группа изображений). Кроме того, флуоресцентное окрашивание продемонстрировало доказательство окрашивания CXCL12 в образцах, обработанных CXCL12, по сравнению с контрольными образцами (правая группа изображений). Совместное окрашивание CXCL12 и инсулина проявляется в виде более ярких пятен на темных участках. Фиг.1C представляет собой гистограмму, количественно отображающую число клеток CD3+, присутствующих в трансплантатах островков, по данным иммуноокрашивания CD3, и приведенные данные демонстрируют, что наблюдается статистически достоверное уменьшение инфильтрации клеток CD3+ в область трансплантата в случае трансплантатов, покрытых ~1 мкг/мл CXCL12 (p=0,001) по сравнению с непокрытыми контрольными образцами (6 животных на группу). Фиг.1D представляет собой гистограмму, количественно отображающую число клеток FoxP3+, присутствующих в трансплантатах островков, по данным окрашивания FoxP3, и приведенные данные указывают на статистически достоверное увеличение локализации клеток FoxP3+ на трансплантатах, покрытых 1 мкг/мл CXCL12 по сравнению с PBS контролем (p=0,0016)(n=6).
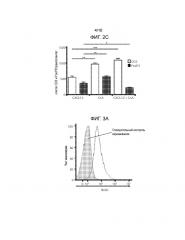
Фиг.2A-2C демонстрируют, что обработка аллогенных островков, покрытых CXCL12, низкими дозировками CsA не увеличивает выживаемость трансплантатов. На Фиг.2A показана кривая выживаемости, построенная на основании доли мышей, оставшихся не диабетическими, после трансплантации покрытых или не покрытых CXCL12 островков с обработкой или без обработки CsA. Наблюдалось достоверное уменьшение времени выживаемости трансплантата через 23 дня после трансплантации, если покрытие CXCL12 сочеталось с обработкой CsA (p=0,0245, логарифмический ранговый критерий). Фиг.2B представляет собой группу изображений, на которых показаны результаты иммуногистохимического окрашивания для выявления CD3, FoxP3 и инсулина в каждых исследованных условиях. Результаты окрашивания согласуются с данными по выживаемости, показанными на фиг.2A, и демонстрируют уменьшение инфильтрации клеток CD3+ и увеличение инфильтрации клеток FoxP3+, а также повышенную экспрессию инсулина в островках, покрытых CXCL12, по сравнению с островками, обработанными CXCL12+CsA. Фиг.2C представляет собой гистограмму, количественно отображающую число клеток CD3+ и FoxP3+, присутствующих в островковых трансплантатах, для каждого из трех исследованных условий. В трансплантатах, обработанных CXCL12+CsA, наблюдалось статистически достоверное уменьшение числа клеток FoxP3+ (p=0,0188) и увеличение числа клеток CD3+ (p=0,0002), по сравнению с трансплантатами, покрытыми только CXCL12.
На Фиг.3A-3C показано, что покрытие CXCL12 не влияет на количество C57BL/6-специфичных T-клеток CD4. Селезенки удаляли у мышей C57BL/6 через 10 дней после пересадки трансплантатов островков BALB/c и спленоциты стимулировали спленоцитами BALB/c, обработанными митомицином-C в присутствии 1 мМ BrdU. Затем клетки окрашивали для определения захвата BrdU. На Фиг.3A показано включение BrdU в спленоциты по сравнению с отрицательным окрашиванием контроля (затеменная область). На Фиг.3B показано, что отсутствовала разница с точки зрения включения BrdU в клетки у мышей, имевших островки без покрытия (линия), и островки, покрытые CXCL12 (затемненная область). Фиг.3C представляет собой гистограмму, демонстрирующую среднее число алло-специфичных T-клеток CD4 на селезенку в каждой группе мышей, и полученные результаты показывают, что покрытие островков CXCL12 не модулирует системный иммунный ответ на аллогенную ткань (n=3).
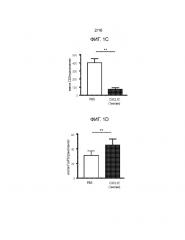
На фиг.4A-4C показаны экспериментальные данные для сингенных островков мышей NOD/LtJ, покрытых CXCL12 или обработанных PBS, трансплантированных под почечную капсулу диабетических NOD/LtJ мышей, обработанных STZ. Фиг.4A представляет собой кривую выживаемости, демонстрирующую долю мышей, которые сохранили не диабетический статус после трансплантации; имеется статистически достоверная разница между островками, обработанными CXCL12 и PBS (логарифмический ранговый критерий, p=0,017), что указывает на более продолжительное выживание и функционирование трансплантированных сингенных островков, покрытых CXCL12. Фиг.4B представляет собой гистограмму, количественно отображающую число клеток CD3+ в трансплантированных островках, и эти данные показывают, что существует статистически достоверное ослабление инфильтрации клеток CD3+ в трансплантаты островков, покрытых CXCL12 (p=0,0081). Фиг.4C представляет собой гистограмму, количественно отображающую количество клеток FoxP3+ в трансплантатах островков, и приведенные данные показывают, что наблюдается статистически достоверное увеличение локализации клеток FoxP3+ в островках, покрытых CXCL12, по сравнению с островками, обработанными PBS (p=0,0019).
На Фиг.5A-5D продемонстрированы данные для сингенных островков мышей NOD/LtJ, покрытых CXCL12 или обработанных PBS, трансплантированных под почечную капсулу мышей NOD/LtJ со спонтанным диабетом. Фиг.5A представляет собой кривую выживаемости, демонстрирующую долю мышей, которые сохранили не диабетический статус после трансплантации; статистически достоверная разница между островками, обработанными CXCL12 и PBS отсутствует (логарифмический ранговый критерий, p=0,24). Фиг.5B представляет собой группу изображений полученных в результате H&E окрашивания (левая группа изображений), демонстрирующих уменьшение инфильтрации мононуклеарных клеток в трансплантированные островки, покрытые 1 мкг/мл CXCL12 (левая группа изображений) и иммунофлуоресцентного окрашивания для выявления инсулина и CXCL12 (правая группа изображений), демонстрирующая повышение уровней обоих белков в трансплантатах, покрытых CXCL12. Фиг.5C представляет собой гистограмму, количественно отображающую число клеток CD3+ в трансплантированных островках, и приведенные данные показывают, что хотя различия в выживаемости отсутствуют, существует статистически достоверная разница в инфильтрации клеток CD3+ в трансплантаты островков, покрытые CXCL12 (p=0,0015). Фиг.5D представляет собой гистограмму, количественно отображающую количество клеток FoxP3+ в трансплантатах островков, и приведенные данные показывают, что наблюдается статистически достоверное увеличение локализации клеток FoxP3+ в островках, покрытых CXCL12, по сравнению с островками, обработанными PBS (p=0,0019).
Фиг 6A-6F демонстрируют, что включение CXCL12 в Ca-LVM альгинатные капсулы отсрочивает отторжение аллогенных и ксеногенных островков, трансплантированных в брюшную полость. Фиг.6A представляет собой график, демонстрирующий кинетику высвобождения CXCL12 из бесклеточного, поперечно-сшитого кальцием ~3,3% альгинатного инкапсулирующего материала с течением времени in vitro. Концентрация CXCL12 в несшитом альгинате натрия составляла 1 мкг/мл; значительное количество CXCL12 было потеряно в сшивающем растворе CaCl2 (n=3). Не существует различий в профилях высвобождения CXCL12 для концентраций альгината от 1,5% до 3,3% (данные не показаны). Начальная скорость высвобождения CXCL12 из капсул, включающих 1,5% альгината, в течение первых 24 часов составляла 1,75 нг/мл/ч +/-0,01 нг/мл/ч, и через четыре дня имела место стабилизация скорости высвобождения на уровне 0,18 нг/мл/ч +/-0,002 нг/мл/ч. Фиг.6B представляет собой гистограмму, демонстрирующую электростатическое взаимодействие между CXCL12 и капсулой из альгината, сшитого барием. Левая группа рисунков показывает, что в гранулах остается значительно меньшее количество CXCL12 после инкубирования с 1М NaCl по сравнению с инкубированием в отсутствии NaCl. Правая группа рисунков показывает, что достоверно большие количества CXCL12 вымываются в среду после инкубирования с 1М NaCl по сравнению с инкубированием в среде без NaCl (n=3, p*<0,05). Фиг.6C представляет собой гистограмму, отображающую активность каспазы-3, которая демонстрирует, что выключение CXCL12 статистически достоверно уменьшает активность каспазы-3 в инкапсулированных мышиных островках (p=0,0019 для ~100 нг/мл CXCL12 и p=0,00028 для ~1 мкг/мл CXCL12 относительно контроля). Мышиные островки инкапсулировали в Ca-LVM или Ca-LVM, содержащем либо ~100 нг/мл, либо ~1 мкг/мл CXCL12 (Ca-LVM-CXCL12), затем культивировали in vitro в течение 48 часов и после этого определяли активность каспазы-3. Фиг.6D представляет собой график выживаемости, показывающий долю выживших после пересадки аллотрансплантатов островков. Включение 1 мкг/мл CXCL12 в инкапсулирующий материал Ca-LVM отсрочивает отторжение аллогенных островков (n=12) для обеих групп (p=0,0237, критерий Гехана-Бреслоу-Вилкоксона). Фиг.6E представляет собой график выживаемости, демонстрирующий долю выживших после пересадки аллотрансплантатов островков. Включение ~1 мкг/мл CXCL12 также отсрочивает отторжение инкапсулированных аллогенных островков, пересаженных в организм алло-сенсибилизированных мышей NOD/LtJ (капсулы Ca-LVM, n=7; капсулы Ca-LVM-CXCL12, n=9; p=0,0066, критерий Гехана-Бреслоу-Вилкоксона). Фиг.6F представляет собой график выживаемости, демонстрирующий долю выживших после пересадки аллотрансплантатов островков. Включение 1 мкг/мл CXCL12 статистически достоверно отсрочивает отторжение инкапсулированных свиных ксеногенных островков, трансплантированных диабетическим мышам C57BL/6 (p=0,0389, логарифмический ранговый критерий). Контрольные и экспериментальные группы: капсулы Ca-LVM, капсулы Ca-LVM-10 нг/мл CXCL12, капсулы Ca-LVM-100 нг/мл CXCL12 (n=6), капсулы Ca-LVM-1 мкг/мл CXCL12 (p*<0,01)(размер группы=6) (критерий Гехана-Бреслоу-Вилкоксона).
На фиг.7A-7G показано миграционное поведение субпопуляций T-клеток в ответ на CXCL12 и связанную с ним экспрессию CXCR4. Фиг.7A и фиг.7C представляют собой гистограммы, демонстрирующие миграционную реакцию T-клеток CD3+CD8+. Фиг.7B и фиг.7D представляют собой гистограммы, демонстрирующие миграционную реакцию T-клеток CD3+CD4+CD25hi. Миграционные реакции клеток количественно определяли, как реакцию на CXCL12, островки, покрытые CXCL12 (I-CXCL12), и островки, инкапсулированные в CXCL12 (E-CXCL12). Во всех трех случаях CXCL12 применялся в концентрации ~1 мкг/мл. T-клетки CD8+ и CD4+CD25Hi подвергались незначительному хемотаксису при воздействии ~1 мкг/мл CXCL12 (M/CXCL12) и островков, покрытых или инкапсулированных CXCL12. T-клетки CD8+, но не CD4+CD25Hi, подвергались фугетаксису или химическому отталкиванию при воздействии островков, покрытых или инкапсулированных в CXCL12. Минимальные уровни как хемотаксиса, так и фугетаксиса были зарегистрированы для T-клеток CD8+ или CD4+CD25Hi при взаимодействии с островками, которые не были покрыты CXCL12 (I-Cont) или островками, инкапсулированными без добавок (E-Cont). (ns=статистически недостоверно; *p<0,05; **p<0,005, критерий Стьюдента). Для объяснения обнаруженных различий в миграционных реакциях, сравнивали экспрессию CXCR4 на T-клетках CD4+, CD8+ и регуляторных T-клетках. На Фиг.7E показан пример стратегии гейтирования для T-клеток CD8+ и регуляторных T-клеток. Фиг.7F представляет собой график, демонстрирующий среднюю интенсивность флуоресценции (MFI) при экспрессии CXCR4. Вычисляли процентную долю популяции каждых клеток, экспрессирующих CXCD4, и типовая гистограмма, представленная на фиг.7G, показывает увеличение экспрессии CXCR4 клетками Treg по сравнению с T-клетками CD4+CD25- и CD8+ (p<0,0001, критерий Стьюдента).
Фиг.8 представляет собой график, демонстрирующий кинетику удерживания CXCL12 инкапсулирующим материалом, содержащим сшитый кальцием 3,3% альгинат, в зависимости от времени in vitro. Концентрация CXCL12 в несшитом альгинате натрия составляла 1 мкг/мл (n=3). Не было зафиксировано различий в профилях высвобождения CXCL12 при концентрациях альгината от 1,5% до 3,3% (данные не показаны).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Если не указано иное, все технические и научные термины, использованные в тексте заявки, имеют те же значения, которые обычно придаются им рядовым специалистом в той области техники, к которой относится настоящее изобретение. В случае противоречия, преимущество будет иметь определение, включенное в настоящую заявку.
Термин «альгинат», известный также как «альгиновая кислота», в настоящей заявке обычно относится к углеводному полимеру (например, полисахариду), включающему как минимум два уроната сахаров.
Термин «аллогенный» означает принадлежащий особям того же вида или полученный из особей того же вида.
Термин «аллотрансплантат» относится к трансплантату клеток или ткани, полученному из особей того же вида.
Термин «ксеногенный» означает принадлежащий особям другого вида или полученный из особей другого вида.
Термин «ксенотрансплантат» относится к трансплантату клеток или ткани, полученному из особей другого вида.
Термин «эффекторная T-клетка» относится к дифференцированным T-клеткам, способным осуществлять специфичный иммунный ответ за счет высвобождения цитокинов.
Термин «регуляторная T-клетка» относится к T-клеткам, которые уменьшают или подавляют иммунный ответ B-клеток или других T-клеток на антиген.
Под «полипептидом CXCL12 или SDF-1» подразумевается белок или его фрагмент, который связывается с CXCL12-специфичными антителами и который обладает способностью вызывать хемотаксис или фугетаксис. Способность вызывать хемотаксис или фугетаксис определяют путем исследования направления миграции T-клеток (например, к интересующему агенту или от него). Смотрите, например, Poznansky et al., Nature Medicine 2000, 6:543-8.
Субъект представляет собой позвоночное животное, включая всех членов класса млекопитающих, в т.ч. человека, домашних и сельскохозяйственных животных, а также животных, содержащихся в зоопарках, спортивных и комнатных животных, например, мышей, кроликов, свиней, овец, коз, крупный рогатый скот и высших приматов.
Термины «лечить», «лечение» и т.п. в настоящем описании относятся к ослаблению или облегчению расстройства и/или связанных с ним симптомов. Следует понимать, хотя это и не исключается, что лечение расстройства или состояния не требует, чтобы расстройство, состояние или связанные с ним симптомы были полностью устранены.
В настоящей заявке термины «включает», «включающий», «содержащий», «имеющий» и т.п. могут иметь значение, приписываемое им патентным законодательством США и могут означать «содержит», «содержащий» и т.п.; аналогично, фразы «состоящий в основном из» или «состоящий в основном» имеют смысл приписываемый им в патентном законодательстве США и эти термины являются не ограничивающими, допускающими присутствие компонентов помимо перечисленных, если основные или новые характеристики описываемого предмета изобретения не подвергаются изменению из-за присутствия чего-либо кроме указанных компонентов, но при этом исключаются варианты осуществления известного уровня техники.
Другие определения будут приведены в тексте описания в связи с контекстом.
Композиции и способы по настоящему изобретению
Композиции по настоящему изобретению направлены на матрицу, высвобождающую полипептид CXCL12, в которой инкапсулирована как минимум одна клетка.
Полипептиды CXCL12 известны в технике. Смотрите, например, Poznansky et al., Nature Medicine 2000, 6:543-8. Отметим, что термины CXCL12 и SDF-1 могут являться взаимозаменяемыми. В одном из вариантов осуществления, полипептид CXCL12 имеет по крайней мере 85%, 90%, 95% или 100% идентичность аминокислотной последовательности NP 001029058 и проявляет активность хемокина или способность вызывать фугетаксис. Типовые примеры изоформ SDF1 приведены в таблице 1 (ниже по тексту):
| Таблица 1 | |||
| Изоформы человеческого SDF1 | |||
| Название | Учетный номер | Версии учетного номера | Последовательность |
| SDF-1 альфа | NP_954637 | NP_954637.1GI:40316924 | MNAKVVVVLV LVLTALCLSD GKPVSLSYRC PCRFFESHVA RANVKHLKIL NTPNCALQIV ARLKNNNRQV CIDPKLKWIQ EYLEKALNK |
| SDF-1бета | P48061 | P48061.1GI:1352728 | MNAKVVVVLV LVLTALCLSD GKPVSLSYRC PCRFFESHVA RANVKHLKIL NTPNCALQIV ARLKNNNRQV CIDPKLKWIQ EYLEKALNKR FKM |
| SDF-1 гамма | NP_001029058 | NP_001029058.1GI:76563933 | MNAKVVVVLV LVLTALCLSD GKPVSLSYRC PCRFFESHVA RANVKHLKIL NTPNCALQIV ARLKNNNRQV CIDPKLKWIQ EYLEKALNKG RREEKVGKKE KIGKKKRQKK RKAAQKRKN |
| SDF-1 дельта | Yu et al. Identification and expression of novel isoforms of human stromal cell-derived factor 1. Gene (2006) vol. 374 pp. 174-9 | MNAKVVVVLV LVLTALCLSD GKPVSLSYRC PCRFFESHVA RANVKHLKIL NTPNCALQIV ARLKNNNRQV CIDPKLKWIQ EYLEKALNNL ISAAPAGKRV IAGARALHPS PPRACPTARA LCEIRLWPPP EWSWPSPGDV | |
| SDF-1 эпсилон | Yu et al. Identification and expression of novel isoforms of human stromal cell-derived factor 1. Gene (2006) vol. 374 pp. 174-9 | MNAKVVVVLV LVLTALCLSD GKPVSLSYRC PCRFFESHVA RANVKHLKIL NTPNCALQIV ARLKNNNRQV CIDPKLKWIQ EYLEKALNNC | |
| SDF-1 фи | Yu et al. Identification and expression of novel isoforms of human stromal cell-derived factor 1. Gene (2006) vol. 374 pp. 174-9 | MNAKVVVVLV LVLTALCLSD GKPVSLSYRC PCRFFESHVA RANVKHLKIL NTPNCALQIV ARLKNNNRQV CIDPKLKWIQ EYLEKALNKI WLYGNAETSR |
В другом варианте осуществления, типовой полипептид CXCL12/SDF-1 имеет следующую последовательность: mnakvvvvlvlvltalclsdgkpvslsyrcpcrffeshvaranvkhlkilntpncalqivarlknnnrqvcidpklkwiqeylekalnkgrreekvgkkekigkkkrqkkrkaaqkrkn.
В еще одном варианте осуществления, полипептид CXCL12 имеет по крайней мере 85%, 90%, 95% или 100% идентичность аминокислотной последовательности изоформе дельта полипептида CXCL12 и проявляет активность хемокина или способность вызывать фугетаксис. Типовая изоформа дельта полипептида CXCL12 имеет последовательность: MNAKVVVVLVLVLTALCLSDGKPVSLSYRCPCRFFESHVARANVKHLKILNTPNCALQIVARLKNNNRQVCIDPKLKWIQEYLEKALNNLISAAPAGKRVIAGAR