Пероральная система доставки вещества белковой природы (варианты), защитная оболочка системы доставки (варианты)
Иллюстрации
Показать всеГруппа изобретений относится к медицине и касается пероральной системы доставки лекарственного вещества белковой природы из липосом, включенных в частицы поперечносшитого природного полисахарида, выбранного из поперечносшитого поливалентным металлом пектина и поперечносшитого полианионом хитозана. Группа изобретений также касается защитной оболочки указанной пероральной системы доставки. Группа изобретений обеспечивает увеличение биодоступности лекарственного вещества белковой природы. 3 н. и 13 з.п. ф-лы, 17 ил., 2 табл., 15 пр.
Реферат
Область изобретения
Изобретение относится к фармацевтике, а именно к системам доставки лекарственных веществ белковой природы.
В настоящем изобретении используется уникальная методика двойного ининкапсулирования для защиты, контролируемого высвобождения активного вещества и улучшения биодоступности биомолекул в желудочно-кишечном тракте.
Уровень техники
В наши дни в результате развития сферы биотехнологий на коммерческом уровне производится огромное количество пептидных и белковых препаратов. Клиническая разработка препаратов таких типов невозможна без специального технического оснащения, в отличие от традиционно используемых препаратов на основе малых молекул. Пероральный прием препаратов является самым распространенным способом приема, но он, как правило, невозможен в случае пептидных и белковых препаратов. Основной причиной низкой биодоступности биопрепаратов при пероральном приеме является досистемное ферментативное расщепление и затрудненное проникновение в кишечную мембрану. В последние десятилетия был досконально изучен механизм всасывания макромолекулярных препаратов из желудочно-кишечного тракта (ЖКТ), а также барьеры, препятствующие всасыванию в ЖКТ. Были испытаны различные методы преодоления этих барьеров и стратегии разработки безопасных и эффективных систем для перорального приема белков. Пероральный прием пептидов и белков все еще вызывает значительные трудности и является объектом многих фармакологических исследований.
Для увеличения биодоступности биологических препаратов при пероральном приеме может быть эффективна стратегия, включающая в себя повышение уровня проникновения или использование ингибиторов протеазы в качестве добавок. Эта стратегия также может повысить воспроизводимую биодоступность. Несмотря на то что эти методы могут успешно применяться в лаборатории, они все еще не признаются большинством практикующих врачей и регулирующих органов. Использование ингибиторов ферментов в ходе долгосрочной терапии остается спорным вопросом из-за возможного всасывания нежелательных белков, нарушения усвоения питательных белков и стимуляции секреции протеазы в результате ответной регуляции. Была изучена стратегия модулирования проницаемости плотных контактов для стимулирования параклеточного переноса молекул препарата. Токсин ZOT (Zonula Occludens toxin), хитозан, тиолированные полимеры и Pz-пептид демонстрируют выраженную способность к повышению всасывания макромолекулярных препаратов. Однако вероятно, данная стратегия также может вызвать вопросы, связанные с безопасностью. После открытия плотного контакта стимулируется перенос не только препаратов, но также потенциально токсичных или нежелательных молекул, присутствующих в ЖКТ.
Поэтому в данном случае подходящим вариантом может быть использование систем-носителей для доставки частиц, таких как гидрогели, наночастицы, микросферы, и систем доставки лекарственных средств на основе липидов (например, наноэмульсий, липосом и твердых липидных наночастиц), которые направлены на защиту пептидов и белков от ферментативного распада и которые способны модулировать перенос препарата.
Одна из наиболее важных задач исследований доставки лекарственных веществ в нужную точку организма заключается в разработке нано- и микросистем, способных доставлять лекарственные вещества в нужную точку в заданных участках тела с требуемым высвобождением при каждом конкретном случае лечения и в правильной лекарственной форме.
Обычно системы доставки лекарственных веществ в виде микрочастиц, предназначенные для орального приема, включают в себя технологии приготовления лекарственных веществ в форме гранул, микрокапсул, липосом, микрочастиц и наночастиц, которые обеспечивают модулированное высвобождение и всасывание данного лекарственного средства [1].
Очень быстро растет использование полимерных материалов для медицинских целей. Полимеры нашли применение в различных областях биомедицины, таких как: имплантация (вживление) медицинских устройств и искусственных органов, инженерия тканей, протезирование, офтальмология, стоматология, репарация кости, системы доставки лекарственных веществ в нужную точку организма. Среди них использование природных биополимеров для самого широкого круга применений в науке о жизни обладает такими преимуществами как биосовместимость и биоразлагаемость, обеспечивающими таким образом экологическую безопасность и возможность получения широкого ряда модифицируемых химическим и ферментативным путем производных веществ для конкретных случаев применения.
Метод ионотропного гелеобразования, при котором для формирования гранул используются природные полисахариды, очень прост и осуществляется в обычных условиях. Обратимое физическое сшивание путем электростатического взаимодействия вместо химического сшивания предотвращает возможную токсичность реагентов и другие нежелательные эффекты.
Использование этой технологии для разработки системы доставки лекарственного препарата с контролируемым высвобождением обладает несколькими преимуществами:
- Маскировка вкуса,
- Улучшение стабильности формуляции при длительном хранении,
- Улучшение стабильности формуляции в желудочно-кишечном тракте,
- Улучшение адгезионных свойств этих формуляций со слизистой оболочкой,
- Селективная доставка лекарственного препарата в конкретном месте организма,
- Устранение опасности интоксикации в связи с их способностью равномерно распределяться по всему желудочно-кишечному тракту,
- Улучшение биодоступности,
- Улучшение терапевтической эффективности.
Полисахариды [2, 3] как класс природных полимеров привлекли очень большое внимание в области разработок систем доставки лекарственных средств в организме частично из-за их биосовместимости и биоразлагаемости. Альгинат, представляющий собой природный биополимер, находит все возрастающее применение в различных областях. Он успешно использовался в течение многих лет в пищевой промышленности и в промышленности производства напитков как загуститель, желирующее вещество и коллоидный стабилизатор. Он также обладает несколькими уникальными свойствами, которые открыли для него область применения в качестве матрицы для ининкапсулирования и/или доставки к тканям целого ряда белков, лекарственных веществ и клеток. Эти свойства включают в себя: (i) создание относительно инертной водной среды внутри этой матрицы; (ii) процесс упаковки в капсулу при умеренной комнатной температуре без использования органических растворителей; (iii) высокую проницаемость геля, которая обеспечивает высокие скорости диффузии макромолекул; (iv) возможность регулирования этой проницаемости с помощью простых операций покрытия оболочкой; и (v) растворение и биоразложение этой системы при нормальных физиологических условиях [4].
Альгинат - это водорастворимый линейный полианионный полисахарид, экстрагируемый из крупной бурой водоросли, состоящий из чередующихся звеньев остатков связанной в положении 1-4 α-L-гулуроновой и β-D-маннуроновой кислоты [5]. Гелевые гранулы получают путем преобразования альгината из золя в гель, осуществляемого перекрестным сшиванием альгината, в основном, двухвалентными катионами. Гулуроновая кислота ответственна за образование геля из альгината с помощью этих катионов в растворе. Матрица из альгината, состоящая из открытой решетки, образует пористые гранулы.
Другим примером природных полисахаридов является хитозан - биосовместимый, биоразлагаемый, нетоксичный линейный сополимер, состоящий из звеньев β (1-4)-связанных 2-амино-2-деокси-D-глюкозы (D-глюкозамин) и 2-ацетамидо-2-деокси-D-глюкозы (N-ацетил-D-глюкозамин), и обладающий структурным сходством с целлюлозой (состоит из звеньев β (1-4)-связанной D-глюкозы). Хитозан - это N-деацетилированное производное хитина, хотя это N-деацетилирование никогда не бывает законченным, в котором ряд аминогрупп является доступным, что превращает его в поликатионный полисахарид. В зависимости от объема/степени деацетилирования, встречаются различные марки хитозана. Из-за своего свойства гелеобразования он используется при разработке системы доставки лекарственных веществ к тканям [6].
Пектины представляют собой семейство растительных полисахаридов, которые также обладают гелеобразующей способностью. D-галактуроновая кислота, связанная вместе с помощью α 1→4 гликозидных связей образует макромолекулярные звенья. Полигалактуроновые звенья выстроены в тройную винтовую спираль и прерываются связями с β, L-рамнозой. Полигалактуроновая кислота частично этерифицирована метальными группами, а свободные кислотные группы могут быть частично или полностью нейтрализованы катионными ионами. Соотношение этерифицированных групп галактуроновой кислоты к суммарному количеству групп галактуроновой кислоты - называемое степенью этерификации СЭ - имеет жизненно важное влияние на свойства пектина, такие как растворимость, гелеобразование и тенденция к связыванию двухвалентными ионами. СЭ в 50% делит коммерческие пектины на пектин с высоким содержанием сложного эфира (ВМ) и на пектин с низким содержанием сложного эфира (НМ). Эти две группы пектина желатинируются разными механизмами. Катионные ионы могут реагировать со свободными карбоксильными группами в цепях пектина с низким содержанием метоксильных групп, приводя к образованию структуры геля с поперечными связями, которая не растворима в воде. Нерастворимость поперечно-связанного пектината в водных средах вместе со склонностью пектина к ферментативному разложению делает этот поперечно-связанный пектинат кандидатом для различных систем доставки лекарственных средств к тканям, в особенности для доставки лекарственных средств в область толстой кишки.
Гранулы на основе полисахаридов можно производить различными способами. Один из способов их приготовления - это способ ионотропного гелеобразования. При способе ионотропного гелеобразования полисахариды вводят в реакцию с противоионами. Из-за образования комплексных соединений между противоположно заряженными продуктами реакции полисахариды подвергаются ионному гелеобразованию и выпадают в осадок, образуя сферические частицы. Эти гранулы обычно отделяют фильтрованием, промывают дистиллированной водой и сушат.
При остальных способах используются чувствительные к температуре полимеры, которые подвергаются спонтанному гелеобразованию в зависимости от чувствительного к температуре фазового перехода.
Свойства гранул из катион-связанных альгинатов, например, зависят от структуры, состава и молекулярного веса полимерных гранул [7]. Гибкость полимерного раствора зависит от концентрации звеньев a-D-маннуроновой кислоты и a-L-глуроновой кислоты в ряду MG>MM>GG. Гранулы с самой низкой сжимаемостью, с большей пористостью, механической прочностью и наивысшей стабильностью в отношении одновалентных катионов состоят главным образом из a-L-глуроновой кислоты, со средним содержанием не менее 70% и со средней длиной звена a-L-глуроновой кислоты 15. В то время как гелевые элементы, приготовленные с низким содержанием a-L-глуроновой кислоты, будут более эластичными, то те, которые приготовляются с высоким содержанием а-глуроновой кислоты, будут более хрупкими. В дополнение к этому, альгинат будет образовывать стабильные гелевые элементы в температурном диапазоне 0-100°С, однако чем выше температура в ходе формования, тем менее жесткими будут получаемые гелевые элементы. Полимер из альгината обладает очень сильной биоадгезионной способностью, что вновь делает его жизнеспособным кандидатом для доставки лекарственных средств к слизистым оболочкам желудочно-кишечного тракта.
Хитозан - это слабое основание, и он нерастворим в воде и в органических растворителях, однако, он растворим в разбавленном водном растворе кислоты (рН<6,5), что может преобразовывать звенья глюкозамина в растворимую форму . Он выпадает в осадок в щелочном растворе или с помощью полианионов и образует гель при более низком рН [8]. Его средний молекулярный вес находится в диапазоне от 3800 до 2.000.000, и он подвергается деацетилированию в диапазоне от 66 до 95%. Размер частиц, плотность, вязкость, степень деацетилирования и молекулярный вес являются важными характеристиками хитозана, которые влияют на свойства фармацевтических составов на основе хитозана. Такие свойства, как биоразлагаемость, низкая токсичность и хорошая биосовместимость, делают его пригодным для использования в биомедицине и фармакологии благодаря силам молекулярного притяжения, возникающим в результате электростатического взаимодействия между положительно заряженным хитозаном и отрицательно заряженными слизистыми поверхностями [8].
Гранулы диаметром более 1,0 мм обычно приготавливают капельным методом, путем переноса в виде капель раствора полимера и какого-то лекарственного вещества в перемешиваемый раствор для образования поперечных связей [9]. Размер иглы и вязкость раствора полимера будут определять диаметр получаемой гранулы, при этом при большей игле и при более вязких растворах будут производиться гранулы большего диаметра. Наряду с этим вязкость полимера также часто влияет на форму вырабатываемых гранул. При возрастании концентрации полимера вырабатываемые гранулы становятся более сферическими.
Когда требуются гранулы меньше 0,2 мм в диаметре, можно использовать три методики для получения микрогранул: технология вибрирующего сопла, коацервация и эмульгирование.
Обычно при технологии вибрирующего сопла микрогранулы получают из хорошо перемешиваемых растворов соответствующего раствора полимера и вещества, которые загружаются в шприц, установленный на насосе или через сосуд под давлением. Технология вибрирующего сопла основана на принципе, основанном на том, что струи ламинарного потока жидкости разбиваются на капельки одинаковых размеров с помощью наложенной вибрации. Выбираемая частота вибрации определяет качество получаемых капелек. Размер шариков задают предварительно в диапазоне от 0,15 мм до 2 мм со сферической формой, при узком разбросе размеров (стандартное отклонение <5%) и с производительностью до 6.000 гранул в секунду. Цепочка из капелек заряжается электростатически, что заставляет капельки отталкиваться друг от друга, устраняя таким образом возможность слипания. Капельки падают в отверждающий раствор, в котором гранулы быстро полимеризуются, или в охлаждающую камеру, в которой гранулы затвердевают. В случае приготовления микрогранул размер гранул может регулироваться типом полимера, диаметром сопла, производительностью шприцевого насоса и расстоянием между соплом и поверхностью раствора, обеспечивающего образование поперечных связей.
Другая методика приготовления микрогранул - это комплексная коацервация противоположно заряженных полиэлектролитов. С помощью этой методики при специфических условиях концентрации полиионов, рН и ионной силы эта смесь будет разделяться на плотную фазу, способную к слиянию, и на разбавленную равновесную фазу. Например, комплексная коацервация между альгиновой кислотой и хитозаном была достигнута распылением раствора альгината натрия в раствор хитозана, проводя к получению прочных микрогранул, которые оставались стабильными в широком диапазоне рН [10].
Заключение в капсулы активных компонентов, таких как ферменты, лекарственные препараты, витамины, масла, клетки, наночастицы, нанолипосомы, можно выполнять путем ионотропного и зависящего от температуры гелеобразования. В зависимости от заключаемого в капсулу объекта, например, водо- и маслорастворимого, гранула может делиться на матричные гранулы и капсулы с содержимым на масляной основе и с водорастворимой полимерной оболочкой, соответственно. Поведение молекул в отношении диффузии внутри и вне гранулы может модифицироваться путем добавления дополнительной мембраны.
Существует три механизма выделения активного элемента, связанные с заключением лекарственного вещества в капсулы в виде матриц на основе полисахаридов: диффузия заключаемого в капсулу лекарственного вещества через поры полимерной структуры и его высвобождение в результате разложения полимера.
В ходе исследования с помощью электронного микроскопа были выявлены размеры пор гранул альгината кальция в диапазоне диаметров от 5 до 300 нм. Диффузия небольших молекул не зависит от матрицы, в то время как диффузия более крупных молекул, таких как белки, также как и заключенных в капсулу объектов, например, липосом и наночастиц (НЧ), будет зависеть от молекулярного веса альгинатной матрицы и от размера пор. Увеличение концентрации альгината внутри гранул может снизить скорость диффузии крупных молекул и из альгинатных гранул. Кроме того, гели с более крупными звеньями α-L-глуроновой кислоты дают структуры с более крупными порами и обеспечивают наиболее высокие скорости диффузии белков. В дополнение к этому, на скорость диффузии может влиять заряд заключенного в матрицу белка. Белок с четким положительным зарядом будет создавать различные виды взаимодействия с отрицательно заряженным полимером и будет ингибировать диффузию из этой матрицы [11].
Заключенные в капсулу объекты могут высвобождаться вследствие разложения геля альгината с поперечными связями. Агент, способствующий образованию хелатных соединений, таких как лактат, цитрат, фосфат, или высокая концентрация ионов могут быть использованы для удаления создающих поперечные связи двухвалентных ионов, что приводит к разрушению матричного геля [12].
Как было описано в предыдущем разделе, высвобождение в ткани заключенных в гранулы объектов регулируется диффузией и/или разложением матрицы на полимерной основе, и эти объекты можно охарактеризовать иначе как зависимые от разбухания матрицы. Поведение в отношении разбухания зависит от рН.
Гранулы, например, на основе альгинатов слегка разбухают в желудке, что дает незначительное выделение лекарственного вещества при рН 1-4, однако разбухание постепенно усиливается при уровне рН в кишечнике, что приводит к глубокому высвобождению лекарственного вещества [13, 14]. Другая система, то есть с гелевыми гранулами из смеси альгината и хитозана, приготовленными на основе двойного перекрестного сшивания, когда гомогенный раствор альгината и хитозана в разных пропорциях вводили в виде капель вначале в раствор хлористого кальция (агент поперечного сшивания альгината), а затем во второй агент поперечного сшивания - сульфат натрия, - давала сравнимый рисунок выделения лекарственного вещества. Результаты этого исследования продемонстрировали, что незначительное высвобождение (1-3%) получали в моделируемых жидких средах желудка (SGF, 4 часа), в то время как 50-80% этого лекарственного вещества выделялось в моделируемых жидких средах кишечника (SIF, 3 часа), а 87-97% - в моделируемых жидких средах толстой кишки (SCF, 3 часа), что показало, что гранулы с двойными поперечными связями имеют потенциально низкую способность выделения лекарственного вещества, специфичного для кишечника или толстой кишки [15].
Высвобождение активных беков и пептидов в полностью работоспособном состоянии в целевую точку организма часто ограничивается технологией и физиологическими барьерами желудочно-кишечного тракта (ЖКТ). Один путь решения этих затруднений заключается в капсулировании, которое может стабилизировать биологически активные вещества во время технологических процессов и при хранении, обеспечивать защиту от низкого рН и ферментативного разложения после применения и регулировать высвобождение заключенного в капсулу биологически активного вещества в требуемой целевой точке организма. Липосомы (фосфолипидные пузырьки) являются одной такой платформой, которая используется для инкапсулирования и управляемого высвобождении лекарственного вещества и которая успешно и в течение длительного времени используется в производстве фармацевтических препаратов [16, 17], косметических средств [18] и пищевых продуктов [19, 20]. Показано, что в этих целях используют в основном большие однослойные однослойные липосомы (LUV) в диапазоне размеров 50-200 нм, так как этот диапазон размеров представляет собой компромисс между эффективностью дозировки липосом (которая возрастает с возрастанием размера), стабильностью липосом (которая снижается при увеличении размера) и способностью проникновения в клетки (которая снижается с увеличением размера).
В частности, наноразмерные биоразлагаемые системы для доставки лекарственных веществ (СДЛВСДЛВ, <1 μM) обладают следующими преимуществами:
- Они могут обеспечивать наличие как олеофильной, так и водной среды в одной системе, и поэтому они пригодны для ининкапсулирования гидрофобных, амфипатических и гидрофильных лекарственных веществ.
- Они биосовместимы из-за их биоразлагаемости и низкой токсичности.
- Они могут служить в качестве механизма для управляемого высвобождения лекарственных препаратов в жидких средах организма.
- Они могут вводиться в организм многими путями, включая внутривенный, оральный, внутримышечный, подкожный, глазной и легочный.
Что касается высвобождения белков в нужной точке организма, то затруднения по стабильности в ЖКТ представляют собой главный недостаток, связанный с оральным использованием липосом [21]. Эта нестабильность возникает вследствие значительных колебания уровней рН и присутствия липаз и солей желчных кислот в желудочной и кишечной жидкости, при этом все вышеперечисленное может дестабилизировать липосомы [22]. Однако полностью функциональные пептиды и белки, которые денатурируются физиологическими условиями в ЖКТ, как сообщалось, захватываются пейеровыми бляшками в кишечнике если они доставляются с помощью липосом, хотя только в очень малых концентрациях [23].
В течение длительного времени предпринимаются усилия по преодолению сложностей в отношении нестабильности липосом, предназначенных для орального приема, путем нанесения на липосомы полимерных покрытий [24-27] или сахаросодержащими цепочками муцина или полиэтиленгликолем или путем получения липосом с гелевым заполнителем [28-31], в то время как гелеобразующий полимер заполняет липосомы и затем подвергается поперечному сшиванию на месте. Когда альгинат включали в состав заполнителя многослойных липосом (MLV), это приводило к повышению стабильности при кислотной рН; однако, при нейтральной рН этот альгинат вызывал разбухание и агрегацию липосом [32].
СОКРАЩЕНИЯ
СДЛВ - система доставки лекарственных веществ
БСА - бычий сывороточный альбумин
ФИТС - флуоресцеинизотиоцианат
СЭМ - сканирующий электронный микроскоп
MTS - 3-(4,5-диметилтиазол-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолий
Рарр - коэффициент видимой проницаемости.
ДПФХ - 1,2-дипальмитоил-sn-глицеро-3-фосфохолин
ДМФХ - 1,2-димиристоил-sn-глицеро-3-фосфохолин
ДОФЭ - 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламин
ДМФА - Fluorenylmethyloxycarbonyl (9-флуоренилметилоксикарбонил)
ТФК - трифторуксусная кислота
ДДВ - бидистиллят воды
ЭИ эффективность ининкапсулирования
КЗ - коэффициент загрузки
СП - содержание препарата
ИПД - индекс полидисперсности
ИКС - искусственная кишечная среда
ВП - высвобождение препарата
ФЛ - фосфолипиды
ПЭГ - полиэтиленгликоль
ДСФЭ дистеарилфосфатидилэтаноламин
DE частично деэтерифицированный пектин.
Краткое описание фигур
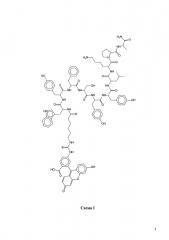
Схема 1 Меченый пептид.
Рис.1 ВЭЖХ хроматограмма неочищенного пептида-ФИТЦ 10-мера, сделанная хроматографом Alliance Waters с использованием многоволнового детектора флуоресценции 2475 на длине волны: 485/528 нм и анализ МС время-пролетной ионизацией лазерной десорбции с использованием матрицы.
Рис. 2 ВЭЖХ хроматограмма очищенного продукта. Чистота пептидов и Mw были определена прибором Voyager DE-Pro MALDI-TOF (ABI) (В) с использованием α-циано 4-гидроксикоричной кислоты в 0,1% ТХК: АЦН (1:1) в качестве матрицы в линейно-положительном режиме.
Рис. 3 - Хроматограмма высокоэффективной жидкостной хроматографии 10-звенного полимерного пептида-ФИТС, инкапсулированного в большие однослойные липосомы, полученная на хроматографе Alliance Waters с использованием многоволнового флуоресцентного детектора модели 2475 на длине волны 485/528 нм.
На Рис. 4А отображены пустые однослойные липосомы LUV на основе ДМФХ, меченных оптической меткой LR-PE (х 88К); на В и С - анализ ПЭМПЭМ однослойных липосом на основе ДМФХ и ДПФХ, соответственно, меченных оптической меткой LR-PE, с инкапсулированным пептидом - ФИТСФИТС (х 88К); на D и Е отображены однослойные липосомы однослойные LUV на основе DМРС:ДОФЕ и DРРС:ДОФЕ, соответственно, меченные оптической меткой LR-PE, с инкапсулированным пептидом -ФИТС (х 88К).
Рис. 5 отображает анализ ПЭМ однослойных липосом LUV: А отображает однослойные липосомы LUV на основе ДМФХ:РF 127, меченных оптической меткой LR-PE, с инкапсулированным пептидом - ФИТС (х 25К); В отображает однослойные липосомы LUV на основе ДПФХ:РF 127, меченных оптической меткой LR-PE, с инкапсулированным пептидом - ФИТС (х 25К).
Рис. 6 отображает накопительную кинетику высвобождения лекарственного вещества, бычего сывороточного альбумина БСА-ФИТС (А) и пептида-ФИТС (В) из однослойных липосом LUV в SIF, согласно описанию в разделе Методики.
Рис. 7 отображает влияние составов однослойных липосом LUV, в который загружен пептид - ФИТС, на жизнеспособность клеток Сасо-2, с оценкой согласно методике MTS.
Рис. 8 отображает распределение в клетках Сасо-2 х пептида - ФИТС (зеленый) через 4 часа инкубирования с различными составами: (L27) LUV на основе ДМФХ; (L28) LUV на основе ДПФХ; (L28) LUV на основе способствующих слиянию ДМФХ/ДОФЕ; (L29) LUV на основе способствующих слиянию ДПФХ/ДОФЕ; (L35) LUV на основе ДМФХ. Обработанные клетки Сасо-2 анализировали с помощью Софокусного лазерного сканирующего микроскопа Fluoview 300 (CLSM, компания Olympus, Пенсильвания, США). Примечание: Красное окрашивание свидетельствует о распределении LUV, меченного с помощью LR-PE.
Рис. 9 отображает лиофилизованные гранулы хитозана с заключенными в него липосомами, наблюдаемые с помощью Сканирующего электронного микроскопа для окружающей среды (ESEM).
Рис. 10 отображает влажные гранулы из хитозана, наблюдаемые с помощью оптического микроскопа с увеличением 40.
Рис. 11 отображает накопительную кинетику высвобождения LUV, LR-PE, микрогранул на основе пектина (пектин - LUV) и микрогранул на основе хитозана (хитозан - LUV) в FaSSGF.
Рис. 12 отображает накопительную кинетику высвобождения LUV (А) и пептида - ФИТС (В) из гранулна основе хитозана в SIF, согласно описанию в разделе Методики.
Рис. 13 отображает влажные гранулы из пектина, наблюдаемые с помощью оптического микроскопа с увеличением 40.
Рис. 14 отображает влияние рН на плотность на кросс-линкера в пектинате кальция (СаР) (А) и концентрации CaCl2 на плотность на кросс-линкера в приготовленных матрицах СаР, (В) - оценка с помощью беспламенной Земановской атомной абсорбционной спектроскопии.
Рис. 15 отображает влияние времени инкубирования (А-30 секунд, В-60 секунд и С-30 минут) и увеличения концентраций CaCl2 (кружки 0,1%, треугольники 1,0% и квадратики 10,0% вес/объем) на стабильность in situ приготовленных матриц СаР, что выражается выделением свободного пектина в среду разбавителя, что определяется с помощью GPC. Отображаются средние значения по 3 измерениям.
Рис. 16 отображает суммарную фракцию пектина (A-DE 30%, B-DE 16%), растворяемого (% от исходного количества) при 1-20 минутах в среде растворителя, как функцию концентрации фосфатов, что определяется с помощью GPC. Отображаются средние значения по 3 измерениям.
Рис. 17 отображает накопительную кинетику высвобождения БСА-ФИТС из гранул на основе пектина в SIF, согласно описанию в разделе Методики.
Краткое изложение существа изобретения
В настоящем изобретении используется уникальная методика двойного ининкапсулирования для защиты, контролируемого высвобождения лекарственного вещества и улучшения биодоступности биомолекул, которые способны подвергаться ферментативному разложению в желудочно-кишечном тракте. Данные системы содержат липосомы, задача которых состоит в защите и улучшении биодоступности заключенной в капсулу биомолекулы, которые в свою очередь заключаются во второй объект, состоящий из гранул, состоящих из природных полисахаридов, что позволяет, с одной стороны, защитить липосомы от суровых условий окружающей среды и позволяет управлять высвобождением липосом, с другой стороны. Гранулы важны для создания сцепляющихся со слизистой оболочкой систем, которые представляют собой мощный инструмент для увеличения времени нахождения заключенных в капсулу веществ в организме, позволяя таким образом перенос заключенного в капсулу лекарственного вещества сквозь кишечные клетки и улучшение биодоступности биомолекул. Предлагаемая технология является развитием липосомальных лекарственных форм и предназначена для создания возможности пероральной доставки липосом в неизменном виде. Преимуществом является - стабильности липосом и заключенного в них лекарственного вещества в верхних отделах ЖКТ, т.к. в чистом виде липосомы разрушаются в верхних отделах ЖКТ в чрезвычайно короткий промежуток времени. Липосомы являются средством доставки лекарственного вещества, предназначенным для переноса действующего вещества в клетку или за какой-либо барьер, в данном изобретении описывается частный способ доставки липосом в кишечник, кроме того, позволяющий использовать липосомы в твердой лекарственной форме.
В одном аспекте изобретение относится к пероральной системе доставки лекарственного вещества белковой природы, из липосом, включенных в частицы поперечносшитого природного полисахарида.
Пероральная система доставки обеспечивает уменьшение вдвое степень разрушения действующего вещества белковой природы в желудочном соке в течение 30 минут, относительно степени разрушения вещества белковой природы, инкапсулированного только в липосомы.
Пероральная система доставки обеспечивает уменьшение на 70% степень разрушения действующего вещества белковой природы в желудочном соке в течение 30 минут, относительно степени разрушения вещества белковой природы, инкапсулированного только в липосомы.
Для получения частиц предпочтительно используют пектин с низкой степенью этерификации, наиболее предпочтительно со степенью этерификации 10-40%.
Для поперечного сшивания могут быть использованы соли поливалентных металлов, предпочтительно соли Са+2 или Al+3, наиболее предпочтительно соли Са+2.
Для получения частиц может быть использован хитозан, а для поперечного сшивания - полианионы, например - триполифосфат.
В другом аспекте пероральная система доставки лекарственного вещества белковой природы обеспечивает высвобождение веществ белковой природы в кишечной среде, предпочтительно в течение 1-48 ч.
Еще изобретение относится к защитной оболочке пероральной системы доставки состоящей из пектина поперечносшитого поливалентным металлом при следующем содержании в системе доставки в масс. % (за 100% принята сухая масса системы доставки):
| пектин | 50-99 |
| поливалентный металл | 0,33-5,28 |
Предпочтительно защитная оболочка состоит из пектина поперечносшитого поливалентным металлом при следующем содержании в масс. %:
| пектин | 70-80 |
| поливалентный металл | 1,32-5,28 |
Предпочтительно в качестве поливалентного металла использован Са+2 или Al+3, наиболее предпочтительно - Са+2.
Другой вариант защитной оболочки пероральной системы доставки состоит из хитозана поперечносшитого полианионом при следующем содержании в системе доставки (за 100% принята сухая масса системы доставки) в масс. %:
| хитозан | 50-99 |
| полианион | 1-4 |
Предпочтительно защитная оболочка состоит из хитозана поперечносшитого полианионом при следующем содержании в масс. %:
| хитозан | 70-80 |
| полианион | 2 |
Предпочтительно в качестве полианиона использован триполифосфат.
В противоположность обычному капельному методу [9], который страдает от нескольких недостатков, которые заключаются: (i) в относительно большом размере получаемых гранул, в диапазоне от 1 до 10 мм, что зависит главным образом от размера иглы сопла, вязкости используемого полимера матрицы и прочности перекрестно-сшивающего агента; (ii) в высокой вариабельности размеров, вызванной ручным процессом изготовления и разным расстоянием между иглой сопла и раствором перекрестно-сшивающего агента, который задается в различных вариантах приготовления; и (iii) в высокой вариабельности кинетики высвобождения лекарственного вещества в ткани, вызванной вариабельностью размеров приготавливаемых гранул Более успешно может быть использована наложенная вибрация, что способствует разделению капелек на объекты равного размера. Наложенная вибрация» или «технология вибрирующего сопла» - представляет собой техническое решение, состоящее из мембраны расположенной над выпускным соплом, причем мембрана вибрирует с регулируемой частотой и постоянной амплитудой, тем самым дозирует объем капли раствора выбрасываемой из сопла. Использование наложенной вибрации позволяет преодолеть недостатки и делает возможной:
- Перевод данной технологии на промышленные масштабы производства,
- Воспроизводимое формирование гранул с размером гранул от 0,08 до 2 мм при равномерном и узком по диапазону разбросе размеров (разброс размеров <5%),
- Гибкость - Формирование гранулы и капсулы с помощью одного и того же инструмента одноэтапно,
- Одношаговое нанесение покрытия на гранулу с дополнительной оболочкой для регулирования высвобождением лекарственного вещества в ткань,
- Приготовление стерильных составов и манипулирование ими в стерильных условиях,
- Уменьшение вариабельности в высвобождении лекарственных веществ.
В настоящем изобретении использован метод наложенной вибрации для формирования составов гранул с размерами от 0,08 до 2 мм на основе природных полисахаридов с помощью ионотропного гелеобразования, имеющего целью инкапсулирование составов на базе липосом, содержащих долю терапевтических веществ, таких как белки и пептиды.
Данное изобретение также относится к фармацевтическим соединениям, образующим микрогранулы, состоящие из природных полисахаридов, некоторого количества липидного соединения согласно данному изобретению, причем это количество достаточно для достижения определенного биологического эффекта на целевом участке организма. Фармацевтический состав согласно изобретению обычно содержит активную субстанцию, пептид, белок, небольшую молекулу, которая отвечает за биологическую активность орально вводимого наполнителя. Этот фармацевтический состав согласно изобретению обычно содержит, в дополнение к указанному липидному соединению, физиологически приемлемый носитель. Этот физиологически приемлемый носитель, используемый согласно данному изобретению, в общем относится к инертным, нетоксичным твердым или жидким веществам, предпочтительно не реагирующим с этим биологически активным липидом согласно данному изобретению.
Для ионотропного гелеобразования могут использоваться природные полисахариды, такие как пектин, альгинат, хитозан, триметилхитозан, каррагенан, карбоксиметилцеллюлоза, сульфат целлюлозы, гиалуроновая кислота, декстрансульфат, относящиеся к типу разбухающих. Противоионы, используемые для ионотропного гел