Налмефен для уменьшения потребления алкоголя у конкретных целевых популяций
Иллюстрации
Показать всеИзобретение относится к применению налмефена в лечении алкогольной зависимости у пациента с алкогольной зависимостью, где указанное применение уменьшает потребление алкоголя, при этом указанный пациент имеет уровень риска, связанный с употреблением алкоголя (DRL), составляющий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин; и у указанного пациента сохраняется высокий DRL, составляющий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, после периода наблюдения, следующего за начальным оцениванием, составляющего 1-2 недели. 14 з.п. ф-лы, 12 ил., 6 табл.
Реферат
Область изобретения
Настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий уровень риска, связанного с употреблением алкоголя. Настоящее изобретение также относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется высокий DRL после периода наблюдения, следующего за начальным оцениванием.
Предпосылки изобретения
Налмефен [17-(циклопропилметил)-4,5-альфа-эпокси-6-метиленморфинан-3,14-диол] имеет следующую общую формулу:
и может быть получен при помощи способов, хорошо известных в данной области, например, путем первоначального получения налтрексона из нороксиморфона, как описано в WO 2012/059103, и последующего получения налмефена из налтрексона, например, с помощью реакции Виттига, как описано в WO 2010/136039. Полное содержание каждой из WO 2012/059103 и WO 2010/136039 включено в данный документ посредством ссылки.
Налмефен представляет собой известный модулятор опиоидной системы с определенным μ-, δ- и κ-рецепторным профилем, который может ингибировать фармакологические эффекты как вводимых агонистов опиоидных рецепторов, так и эндогенных агонистов, производимых опиоидной системой. Клиническая применимость налмефена основана на его способности быстро и селективно устранять эффекты указанных агонистов опиоидных рецепторов.
Налмефен был разработан в первую очередь для применения в контроле алкогольной зависимости. В двойном слепом плацебо-контролируемом исследовании был показан хороший эффект введения суточной пероральной дозы налмефена, составлявшей 20-80 мг (Mason et al., Arch. Gen. Psychiatry, (1999), Vol. 56: 719-724); тогда как в другом исследовании не сообщалось о доказательствах превосходства налмефена над плацебо в исследовании, в котором оценивали суточные дозы налмефена, составлявшие 5, 20 и 40 мг (Anton et al., J. Clin. Psychopharmacol, (2004), Vol. 24(4): 421-428). В недавнем исследовании был показан хороший эффект налмефена по сравнению с плацебо при приеме дозы налмефена, составлявшей 20 мг, в тот момент, когда пациент испытывал тягу к алкоголю (Karhuvaara et al., Alcohol. Clin. Exp. Res., (2007), Vol. 31 (7): 1179-1187).
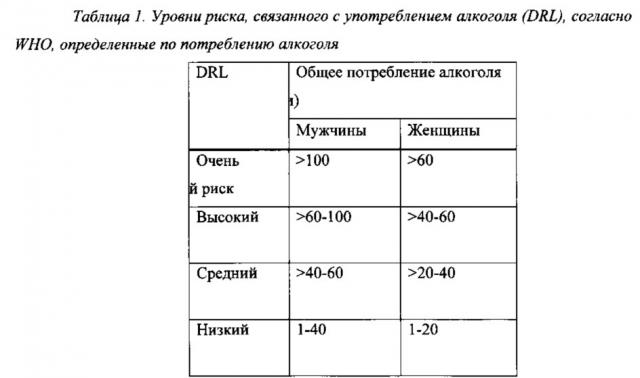
Согласно независимым доказательствам высокие уровни потребления алкоголя связаны с повышенным риском вреда для здоровья, а также нежелательными социальными последствиями. Всемирная организация здравоохранения (WHO) определила уровни риска, связанного с употреблением алкоголя (DRL), исходя из потребления алкоголя в International Guide for Monitoring Alcohol Consumption and Related Harm. 2000. World Health Organization, полное содержание которой включено в данный документ посредством ссылки. См. Таблицу 1.
Уровни риска согласно Таблице 1 можно оценивать, например, путем расчета среднего суточного потребления алкоголя в г/сутки в течение месяца, как, например, в течение 4 недель.
Существует необходимость в новом средстве лечения для применения в уменьшении потребления алкоголя. Уменьшение потребления алкоголя, вероятно, принесет пользу, связанную со снижением риска вреда для здоровья и снижением количества нежелательных социальных последствий.
Краткое описание изобретения
Настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, при этом указанное применение включает следующие этапы:
a) идентификацию пациента с алкогольной зависимостью, i) который имеет высокий DRL и ii) у которого сохраняется высокий DRL после периода наблюдения, следующего за начальным оцениванием, и
b) введение терапевтически эффективного количества налмефена пациенту, идентифицированному на этапе a), при этом указанный налмефен вводят по мере необходимости, в частности, каждые сутки, в которые пациент ощущает риск употребления алкоголя, предпочтительно за 1-2 часа до предполагаемого времени употребления.
Краткое описание графических материалов
На Фигурах 1-12 показано изменение числа суток употребления алкоголя в большом количестве (HDD) и общего потребления алкоголя (ТАС) (г/сутки) за месяц по сравнению с исходным уровнем в каждом исследовании. Результаты показаны для общей исследуемой популяции, для пациентов с высоким DRL на исходном уровне, для общей исследуемой популяции за исключением пациентов, рано уменьшивших потребление (ER), и для пациентов с высоким DRL на исходном уровне и при рандомизации.
На Фигурах 1а-12а показано изменение HDD за месяц по сравнению с исходным уровнем. Ось X: время (месяцы); ось Y: изменение HDD.
На Фигурах 1b-12b показано изменение ТАС (г/сутки) за месяц по сравнению с исходным уровнем. Ось X: время (месяцы); ось Y: изменение ТАС (г/сутки).
(---□--- = плацебо, -■- = налмефен, * = P-значение <0,05). “В” означает исходный уровень, “R” означает рандомизацию.
Фигура 1а: исследование 12014А, общая исследуемая популяция, изменение HDD за месяц.
Фигура 1b: исследование 12014А, общая исследуемая популяция, изменение ТАС за месяц.
Фигура 2а: исследование 12014А, высокий DRL на исходном уровне, изменение HDD за месяц.
Фигура 2b: исследование 12014А, высокий DRL на исходном уровне, изменение ТАС за месяц.
Фигура 3а: исследование 12014А, общая исследуемая популяция за исключением ER, изменение HDD за месяц.
Фигура 3b: исследование 12014А, общая исследуемая популяция за исключением ER, изменение ТАС за месяц.
Фигура 4а: исследование 12014А, высокий DRL на исходном уровне и при рандомизации, изменение HDD за месяц.
Фигура 4b: исследование 12014А, высокий DRL на исходном уровне и при рандомизации, изменение ТАС за месяц.
Фигура 5а: исследование 12023А, общая исследуемая популяция, изменение HDD за месяц.
Фигура 5b: исследование 12023А, общая исследуемая популяция, изменение ТАС за месяц.
Фигура 6а: исследование 12023А, высокий DRL на исходном уровне, изменение HDD за месяц.
Фигура 6b: исследование 12023А, высокий DRL на исходном уровне, изменение ТАС за месяц.
Фигура 7а: исследование 12023А, общая исследуемая популяция за исключением ER, изменение HDD за месяц.
Фигура 7b: исследование 12023А, общая исследуемая популяция за исключением ER, изменение ТАС за месяц.
Фигура 8а: исследование 12023А, высокий DRL на исходном уровне и при рандомизации, изменение HDD за месяц.
Фигура 8b: исследование 12023А, высокий DRL на исходном уровне и при рандомизации, изменение ТАС за месяц.
Фигура 9а: исследование 12013А, общая исследуемая популяция, изменение HDD за месяц.
Фигура 9b: исследование 12013А, общая исследуемая популяция, изменение ТАС за месяц.
Фигура 10а: исследование 12013А, высокий DRL на исходном уровне, изменение HDD за месяц.
Фигура 10b: исследование 12013А, высокий DRL на исходном уровне, изменение ТАС за месяц.
Фигура 11а: исследование 12013А, общая исследуемая популяция за исключением ER, изменение HDD за месяц.
Фигура 11b: исследование 12013А, общая исследуемая популяция за исключением ER, изменение ТАС за месяц.
Фигура 12а: исследование 12013А, высокий DRL на исходном уровне и при рандомизации, изменение HDD за месяц.
Фигура 12b: исследование 12013А, высокий DRL на исходном уровне и при рандомизации, изменение ТАС за месяц.
Определения
На протяжении всего данного описания предполагается, что термин “налмефен” включает любые формы соединения, такие как свободное основание и фармацевтически приемлемые соли. Свободное основание и фармацевтически приемлемые соли включают безводные формы и сольватированные формы, как, например, гидраты. Безводные формы и сольваты включают аморфные и кристаллические формы. В конкретном варианте осуществления налмефен находится в форме гидрохлорида. В более конкретном варианте осуществления налмефен находится в форме дигидрата гидрохлорида. На протяжении всей настоящей заявки в случае, если для налмефена определена доза, указанная доза рассчитана в пересчете на свободное основание, т.е. если доза налмефена составляет 18 мг, то это соответствует 18 мг налмефена в виде свободного основания.
Применяемый в данном документе термин “общее потребление алкоголя”, сокращенно ТАС, означает среднее суточное общее потребление алкоголя, измеряемое в г/сутки в течение месяца (= 28 суток).
Применяемый в данном документе термин “сутки употребления алкоголя в большом количестве”, сокращенно HDD, означает сутки с общим потреблением алкоголя, составляющим ≥60 г чистого спирта для мужчин и ≥40 г для женщин.
Применяемый в данном документе термин “дозирование по мере необходимости” означает, что в каждые сутки, в которые пациент ощущает риск употребления алкоголя, следует принимать одну дозу налмефена, предпочтительно за 1-2 часа до предполагаемого времени употребления. Если пациент начал употреблять алкоголь, не приняв налмефен, пациенту следует принять одну дозу как можно скорее после этого.
Применяемый в данном документе термин “уровень риска, связанного с употреблением алкоголя”, сокращенно DRL, определяется по критериям WHO согласно Таблице 1 ниже.
Уровни риска, связанного с употреблением алкоголя, согласно Таблице 1 можно оценивать, например, путем расчета среднего суточного потребления алкоголя в г/сутки в течение определенного периода, такого как 1 неделя или дольше, такого как 2 недели или дольше, такого как 3 недели или дольше, такого как 4 недели или дольше, такого как 1 месяц или дольше, такого как 2 месяца или дольше, такого как 3 месяца или дольше, такого как 4 месяца или дольше, такого как 5 месяцев или дольше, такого как 6 месяцев или дольше, такого как приблизительно 1 год. Оценивание DRL может быть проведено специалистами и/или врачами, как, например, врачами общей практики и/или другими медицинскими работниками, на основании оценок пациентами потребления ими алкоголя. В трех проводимых Lundbeck исследованиях фазы III, описанных в примерах (12014А, 12023А и 12013А), DRL измеряли посредством оценивания среднего суточного потребления алкоголя в г/сутки в течение 4-недельного периода до начального визита. После 1-2-недельного периода наблюдения уровень риска, связанного с употреблением алкоголя, повторно оценивали посредством оценивания среднего суточного потребления алкоголя в г/сутки в течение указанного 1-2-недельного периода наблюдения.
На протяжении всей настоящей заявки предполагается, что термин “высокий риск” или “по меньшей мере высокий риск” включает две группы, определяемые как “высокий риск” и “очень высокий риск” согласно уровням риска, связанного с употреблением алкоголя, по WHO, приведенным в Таблице 1, т.е. пациенты, имеющие уровень риска, связанного с употреблением алкоголя, соответствующий общему потреблению алкоголя, составляющему >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин. В настоящем изобретении не проводится различие между пациентами с высоким и очень высоким уровнями риска, связанного с употреблением алкоголя, и если термины “высокий уровень риска, связанного с употреблением алкоголя” или “высокий DRL” применяются в пункте формулы изобретения или в варианте осуществления настоящего изобретения, то предполагается, что они включают как группу, определяемую как “высокий риск”, так и группу, определяемую как “очень высокий риск” в соответствии с уровнями риска, связанного с употреблением алкоголя, по WHO, приведенными в Таблице 1.
Применяемый в данном документе термин “пациент, рано уменьшивший потребление”, сокращенно ER, означает пациента, включенного в три проводимых Lundbeck исследования фазы III (12014А, 12023А и 12013А), который значительно уменьшил потребление алкоголя в период между скринингом и рандомизацией. Более конкретно, пациенты, определенные как ER, уменьшили потребление ими алкоголя от высокого или среднего DRL до уровня ниже среднего уровня риска, связанного с употреблением алкоголя, т.е. потребление алкоголя указанными пациентами составляло 0-40 г/сутки для мужчин и 0-20 г/сутки для женщин, определенное как среднее суточное потребление алкоголя в 1-2-недельный период между скринингом и рандомизацией.
Применяемый в данном документе термин “период наблюдения в соответствии с клинической практикой” означает наблюдение после начального оценивания DRL. Указанный период составляет предпочтительно 1-2 недели, наиболее предпочтительно приблизительно 2 недели.
Применяемый в данном документе термин “взрослый” означает лицо в возрасте по меньшей мере 16 лет, в частности в возрасте по меньшей мере 18 лет.
Применяемый в данном документе термин “подросток” означает лицо в возрасте 12-18 лет, в частности в возрасте 12-16 лет.
Применяемые в данном документе термины “мотивационная поддержка” и “консультирование, направленное на повышение приверженности к лечению и уменьшение потребления алкоголя” означает психологические вмешательства, усиливающие мотивацию, и они могут применяться взаимозаменяемо с терминами “психосоциальная поддержка” или “психосоциальное вмешательство, направленное на приверженность лечению и уменьшение потребления алкоголя”. Указанная мотивационная поддержка может оказываться специалистом и/или врачом, в частности, врачом общей практики и/или другими медицинскими работниками. Одним примером таких вмешательств является модель BRENDA, которая представляет собой ограниченное во времени ориентированное на пациента клиническое мотивационное вмешательство, которое дополняет применение лекарственного препарата и направлено на изменение поведения и повышение приверженности к лечению. Модель BRENDA была описана Starosta et al., J. Psychiatr. Pract. (2006), Vol. 12(2): 80-89, полное содержание которой включено в данный документ посредством ссылки. Термин “начальная мотивационная поддержка” означает, что такие усиливающие мотивацию вмешательства осуществляются в отношении пациента до лечения налмефеном. Термин “текущая мотивационная поддержка” означает, что такие усиливающие мотивацию вмешательства осуществляются в отношении пациента одновременно с лечением налмефеном, например, периодически.
Применяемый в данном документе термин “фармацевтическая композиция” относится к дозированной форме, такой как лекарственная форма для перорального применения, такой как твердая лекарственная форма для перорального применения, обычно таблетки или капсулы. В предпочтительном варианте осуществления указанная лекарственная форма подходит для дозирования по мере необходимости. Указанная фармацевтическая композиция обычно содержит терапевтически эффективное количество налмефена и один или несколько фармацевтически приемлемых носителей. Термин “фармацевтические композиции по настоящему изобретению” относится ко всем фармацевтическим композициям, охватываемым формулой изобретения и описанием.
Применяемый в данном документе термин “стандартная лекарственная форма” относится к составленной единице фармацевтической композиции, например, одной таблетке или капсуле.
Применяемый в данном документе термин “терапевтически эффективное количество” соединения означает количество/дозу соединения или фармацевтической композиции, достаточное/достаточную для того, чтобы вызвать эффективный ответ (т.е. биологический или медицинский ответ ткани, системы, животного или человека, к которому стремится исследователь, ветеринар, врач или другой клиницист) при введении пациенту. “Терапевтически эффективное количество” будет меняться в зависимости, помимо прочего, от заболевания и его тяжести, а также от возраста, веса, физического состояния и ответной реакции пациента, подлежащего лечению. Кроме того, “терапевтически эффективное количество” может меняться в случае, если соединение по настоящему изобретению объединено с одним или несколькими соединениями. В таком случае количество данного соединения может быть меньшим, таким как субэффективное количество. В одном варианте осуществления “терапевтически эффективное количество” налмефена составляет 18 мг.
Применяемые в данном документе термины “лечение” и “осуществление лечения” относятся к контролю пациента и уходу за ним с целью борьбы с состоянием, таким как заболевание или нарушение. Предполагается, что термин включает полный спектр видов лечения данного состояния, от которого страдает пациент, в частности, введение активного соединения для облегчения симптомов или осложнений, для замедления прогрессирования заболевания, расстройства или состояния, для облегчения или смягчения симптомов и осложнений и/или для излечения или устранения заболевания, расстройства или состояния, а также для предупреждения состояния, при этом предупреждение следует понимать как контроль пациента и уход за ним с целью борьбы с заболеванием, состоянием или нарушением, и предусматривает введение активных соединений для предупреждения появления симптомов или осложнений.
Термин “алкогольная зависимость” является общеизвестным термином для специалиста в данной области. В пересмотренной 4-й редакции Диагностического и статистического руководства по психическим расстройствам (DSM-IV-TR) (Diagnostic and Statistical Manual of Mental Disorders, 4th edition text revision, American Psychiatric Publishing, 2000). Применяемый в данном документе термин “алкогольная зависимость” определяется как наличие ухудшения в трех или более из семи сфер жизни, связанного с алкоголем, в одном и том же 12-месячном периоде. Эти ухудшения включают 1) привыкание, 2) абстинентный синдром, 3) алкоголь часто принимается в больших количествах или в течение более длительного периода, чем предполагалось, 4) устойчивое желание или безуспешные попытки сократить или контролировать употребление алкоголя, 5) очень много времени тратится на действия, необходимые для получения алкоголя, употребления алкоголя или избавления от его эффектов, 6) важные социальные, профессиональные или оздоровительные действия прекращаются или сокращаются по причине употребления алкоголя, 7) употребление алкоголя продолжается, несмотря на знание о наличии постоянной или периодически возникающей физической или психологической проблеме, которая, вероятно, была вызвана или усугубилась из-за употребления алкоголя.
Термин “ретроспективная хронологическая шкала” (TLFB) означает способ получения оценок суточного употребления алкоголя. При помощи средств для запоминания, в частности, календарь, пациенты предоставляют ретроспективные оценки количества выпитых стандартных доз алкоголя за каждые сутки. В трех проводимых Lundbeck исследованиях фазы III (12014А, 12023А и 12013А) TLFB характеризовалась следующим подходом. Сутки определяли как 24-часовой период, начинающийся в 6.00 до полудня и заканчивающийся в 6.00 до полудня на следующее утро. Во время скринингового визита каждый пациент должен был предоставить ретроспективную оценку его/ее суточного употребления алкоголя в течение предыдущего месяца (месяц определяли как период продолжительностью 28 последовательных суток). Во время каждого последующего визита пациент должен был предоставить информацию о его/ее употреблении алкоголя со времени предыдущего визита. Если пациент пропускал визит, то TLFB, которую составляли во время следующего визита, продлевали для охвата суток, данные по которым должны были быть зарегистрированы во время пропущенного визита. Пациенты могли применять свои личные календари, помогающие им вспомнить об употреблении ими алкоголя, или они могли применять календарь, предоставленный им исследовательским центром для личного пользования. Календари следовало применять только в качестве средств для запоминания, помогающих пациентам составлять TLFB. Пациентов просили сообщать об употреблении ими алкоголя в расчете на стандартные единицы согласно национальному определению стандартной единицы. Стандартные национальные единицы были определены в картах пересчета стандартных доз алкоголя, выдаваемых пациентам.
“Печеночную недостаточность” можно оценивать с помощью системы балльной оценки по шкале Чайлда-Пью согласно Child and Turcotte JG. Surgery and portal hypertension, в The liver and portal hypertension. Edited by CG Child. Philadelphia: Saunders 1964: 50-64, полное содержание которой включено в данный документ посредством ссылки. Согласно данной системе пациентов можно классифицировать как имеющих, например, “умеренную или тяжелую форму печеночной недостаточности”.
“Почечную недостаточность” можно оценивать путем измерения рассчитанной скорости общей фильтрации (eGFR), как описано в Stevens et al., N. Engl. J. Med. (2006) 354: 2473-2483, полное содержание которой включено в данный документ посредством ссылки. Пациентов классифицируют как имеющих “тяжелую форму почечной недостаточности” при eGFR <30 мл/мин. на 1,73 м2.
Подробное описание изобретения
Эффективность налмефена в уменьшении потребления алкоголя у пациентов с алкогольной зависимостью (DSM-IV) была оценена в двух исследованиях эффективности (исследование 12014А и исследование 12023А) и одном исследовании безопасности (исследование 12013А), как описано в примерах. Все три исследования были рандомизированными, двойными слепыми, с параллельными группами и плацебо-контролируемыми.
В исследования включали амбулаторных пациентов в возрасте ≥18 лет с первичным диагнозом “алкогольная зависимость”. Пациент подходил для участия в исследовании, если в течение 4 недель, предшествующих скрининговому визиту (исходный период), он/она имел/имела >6 HDD, по меньшей мере средний DRL (рассчитанный как среднее суточное потребление алкоголя в г/сутки, т.е. составляющее >40 г/сутки для мужчин и >20 г/сутки для женщин, рассчитанное как среднее суточное потребление алкоголя в течение 4-недельного периода, предшествующего скрининговому визиту) и ≤14 последовательных суток отказа от употребления алкоголя. Способ ретроспективной хронологической шкалы (TLFB) применяли для получения оценок суточного употребления алкоголя пациентами.
Во время начального визита (скринингового визита) оценивали клиническое состояние, социальную ситуацию пациентов и особенности потребления ими алкоголя. После 1-2-недельного периода наблюдения уровень риска, связанного с употреблением алкоголя, повторно оценивали путем расчета среднего суточного потребления алкоголя в г/сутки в течение 1-2-недельного периода наблюдения, и лечение налмефеном начинали вместе с консультированием, направленным на мотивирование пациентов к приверженности к лечению и к изменению их поведения, связанного с употреблением алкоголя.
Эффективность налмефена измеряли с применением двух комбинированных первичных конечных точек: изменения числа суток употребления алкоголя в большом количестве (HDD) за месяц и изменения среднего суточного общего потребления алкоголя (ТАС) в расчете на месяц (= 28 суток). В двух 6-месячных исследованиях эффективности и в 12-месячном исследовании безопасности налмефен превосходил плацебо в уменьшении числа HDD и ТАС к месяцу 6 (см. Таблицу 6 и Фигуры 1, 5 и 9).
Авторы настоящего изобретения обнаружили, что у пациентов с высоким DRL на исходном уровне, т.е. с потреблением алкоголя, составляющим >60 г/сутки у мужчин и >40 г/сутки у женщин на исходном уровне (на основе среднего суточного потребления алкоголя в г/сутки в течение 4-недельного периода, предшествующего начальному визиту), эффект налмефена в отношении HDD и ТАС был более явно выраженным по сравнению с эффектом плацебо, чем в общей популяции, т.е. налмефен обладал лучшим эффектом в данной группе пациентов, чем в общей исследуемой популяции (см. Таблицу 6 и Фигуры 2, 6 и 10). Таким образом, в одном аспекте настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий уровень риска, связанного с употреблением алкоголя, т.е. уровень риска, связанного с употреблением алкоголя, соответствующий >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин. В одном варианте осуществления настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет по меньшей мере высокий уровень риска, связанного с употреблением алкоголя, согласно критериям WHO, в частности, высокий или очень высокий уровень риска, связанного с употреблением алкоголя, согласно критериям WHO.
Более того, авторы настоящего изобретения наблюдали, что заметная часть пациентов, включенных в три исследования фазы III (18%, 33% и 39% в исследованиях 12014А, 12023А и 12013А, соответственно), значительно уменьшила потребление ими алкоголя в течение 1-2-недельного периода наблюдения между скринингом и рандомизацией, т.е. эти пациенты уменьшили потребление ими алкоголя от высокого или среднего DRL до DRL ниже среднего в течение 1-2-недельного периода наблюдения между скринингом и рандомизацией. Этих пациентов характеризовали как пациентов, рано уменьшивших потребление (ER). Было обнаружено, что в группе пациентов, не относящихся к ER, эффект налмефена в отношении HDD и ТАС был более явно выраженным по сравнению с эффектом плацебо, чем в общей популяции, т.е. налмефен обладал лучшим эффектом в данной группе пациентов, чем в общей исследуемой популяции (см. Таблицу 6 и Фигуры 3, 7 и 11). Соответственно, в другом аспекте настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется уровень потребления алкоголя после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели. В одном варианте осуществления настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, у которого сохраняется по меньшей мере средний DRL после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели.
Было обнаружено, что у пациентов с высоким DRL как на исходном уровне, так и при рандомизации; т.е. у пациентов, которые имели высокий DRL на исходном уровне на основе среднего суточного потребления алкоголя в г/сутки в течение 4-недельного периода, предшествующего начальному визиту, и у которых сохранялся высокий DRL в течение 1-2-недельного периода наблюдения между скринингом и рандомизацией; эффект налмефена в отношении HDD и ТАС был еще более явно выраженным по сравнению с эффектом плацебо, чем в общей популяции, т.е. налмефен обладал особенно хорошим эффектом в этой группе пациентов по сравнению с его эффектом в общей исследуемой популяции (см. Таблицу 6 и Фигуры 4, 8 и 12). Соответственно, в одном варианте осуществления настоящее изобретение относится к налмефену для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий уровень риска, связанного с употреблением алкоголя, т.е. потребление алкоголя, составляющее >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин, и который продолжает иметь высокий уровень риска, связанного с употреблением алкоголя, после периода наблюдения в соответствии с клинической практикой.
В одном варианте осуществления пациенты согласно настоящему изобретению имеют диагноз “алкогольная зависимость” согласно критериям DSM-IV-TR. В одном варианте осуществления пациенты согласно настоящему изобретению имеют диагноз “алкоголизм” согласно критериям DSM-V.
В отдельном аспекте настоящее изобретение относится к способу проведения клинического исследования для оценивания эффективности средства лечения в отношении уменьшения потребления алкоголя, при этом способ включает следующие этапы:
a) скрининг пациентов на основании их уровня риска, связанного с употреблением алкоголя,
b) повторное оценивание уровня риска, связанного с употреблением алкоголя, после периода наблюдения, в частности, 1-2-недельного периода наблюдения, в частности, 2-недельного периода наблюдения,
c) исключение из исследования пациентов, которые значительно уменьшили потребление ими алкоголя в период наблюдения согласно этапу b).
В дополнительном варианте осуществления указанные пациенты, выбранные для скрининга согласно этапу а), имеют первичный диагноз “алкогольная зависимость” по DSM-IV или “алкоголизм” по DSM-V. В другом дополнительном варианте осуществления указанные пациенты, исключаемые на этапе с), уменьшили потребление ими алкоголя по уровню риска, связанного с употреблением алкоголя, от высокого DRL до DRL ниже среднего или от высокого DRL до DRL ниже высокого.
Согласно настоящему изобретению налмефен или его фармацевтически приемлемую соль можно вводить посредством любого подходящего пути, т.е. перорально или парентерально, и они могут быть представлены в любой форме, подходящей для такого введения, например, в форме таблеток, капсул, порошков, сиропов или растворов или дисперсий для инъекции. В другом варианте осуществления и в соответствии с целью настоящего изобретения налмефен вводят в форме твердой фармацевтической единицы, допустимо в виде таблетки или капсулы, или в форме суспензии, раствора или дисперсии для инъекции. Дополнительно, налмефен можно вводить с фармацевтически приемлемым носителем, в частности, вспомогательным средством и/или разбавителем.
Способы получения твердых или жидких фармацевтических препаратов известны в данной области техники. См., например, Remington: The Science and Practice of Pharmacy, 21st ed., Lippincott Williams & Wilkins (2005). Таким образом, таблетки можно изготовить путем смешивания активных ингредиентов с обычным носителем, в частности, вспомогательным средством и/или разбавителем, и последующего прессования смеси в таблеточной машине. Неограничивающие примеры вспомогательных средств и/или разбавителей включают кукурузный крахмал, лактозу, тальк, стеарат магния, желатин, лактозу, камеди и т.п. Также можно применять любые другие вспомогательные средства или добавки, такие как красители, ароматизаторы и консерванты, при условии, что они совместимы с активными ингредиентами. Таким образом, фармацевтические композиции по настоящему изобретению обычно содержат терапевтически эффективное количество налмефена и один или несколько фармацевтически приемлемых носителей. Подходящий состав для перорального применения на основе налмефена описан в WO 2012/059103.
Без ограничения настоящего изобретения каким-либо образом подразумевается, что любой из аспектов или вариантов осуществления этой патентной заявки подходит для лекарственных препаратов или фармацевтических композиций, описанных в данном документе.
Налмефен можно вводить в виде лекарственной формы для перорального применения, в частности, в виде твердой лекарственной формы для перорального применения, обычно таблеток или капсул, или в виде жидкой лекарственной формы для перорального применения. Налмефен можно вводить в лекарственной форме с немедленным высвобождением или в лекарственной форме с контролируемым или замедленным высвобождением. В целях удобства, налмефен можно вводить перорально в стандартных лекарственных формах, в частности, в таблетках или капсулах, содержащих активный ингредиент в количестве от приблизительно 1 до приблизительно 100 мг, в частности, от 5 до 50 мг. Обычно фармацевтическая композиция содержит от 10 мг до 20 мг, в частности, приблизительно 10 мг, приблизительно 11 мг, приблизительно 12 мг, приблизительно 13 мг, приблизительно 14 мг, приблизительно 15 мг, приблизительно 16 мг, приблизительно 17 мг, приблизительно 18 мг, приблизительно 19 мг или приблизительно 20 мг, налмефена. В предпочтительном варианте осуществления фармацевтическая композиция содержит приблизительно 18 мг налмефена. В одном варианте осуществления стандартная лекарственная форма содержит налмефен в терапевтически эффективном количестве.
В одном варианте осуществления налмефен принимают по мере необходимости, то есть в каждые сутки, в которые пациент ощущает риск употребления алкоголя, следует принимать одну дозу налмефена, предпочтительно за 1-2 часа до предполагаемого времени употребления. В одном варианте осуществления, если пациент начал употреблять алкоголь, не приняв налмефен, пациенту следует принять одну дозу налмефена как можно скорее после этого.
В одном варианте осуществления налмефен находится в форме дигидрата гидрохлорида.
Налмефен согласно настоящему изобретению предназначен для применения в дозировании у людей, являющихся взрослыми или подростками. В одном варианте осуществления налмефен предназначен для применения в дозировании у людей в возрасте 12 лет или старше, в частности, 14 лет или старше, в частности, 16 лет или старше, в частности, 18 лет или старше.
Все литературные источники, в том числе публикации, патентные заявки и патенты, цитируемые в данном документе, настоящим включены посредством ссылки во всей своей полноте и в той же степени, как если бы каждый литературный источник был отдельно и конкретно обозначен как включенный посредством ссылки и приведен во всей своей полноте в данном документе (в максимальной степени, допускаемой законом), вне зависимости от любого другого отдельно сделанного в любом месте данного документа включения конкретных документов.
Использование в контексте описания настоящего изобретения форм единственного числа следует понимать как охватывающие как единственное, так и множественное число, если в данном документе не указано иное или это однозначно не противоречит контексту. Например, выражение “соединение” следует понимать как относящееся к различным “соединениям” согласно настоящему изобретению или конкретному описываемому аспекту, если не указано иное.
Описание в данном документе любого аспекта или аспектов настоящего изобретения с использованием терминов, таких как “включающий”, “имеющий”, “в том числе” или “содержащий” по отношению к элементу или элементам предназначено для подтверждения аналогичного аспекта или аспекта настоящего изобретения, который “состоит из”, “состоит главным образом из” этого конкретного элемента или элементов или “по сути содержит” их, если не указано иное или это однозначно не противоречит контексту (например, композиция, описанная в данном документе как содержащая определенный элемент, должна также пониматься как описывающая композицию, состоящую из этого элемента, если не указано иное или это однозначно не противоречит контексту).
Следует понимать, что различные аспекты, варианты осуществления, реализации и признаки настоящего изобретения, упомянутые в данном документе, могут быть заявлены по отдельности или в любом сочетании.
Варианты осуществления согласно настоящему изобретению
Раскрыты следующие варианты осуществления изобретения. Первый вариант осуществления обозначен Е1, второй вариант осуществления обозначен Е2 и так далее.
Е1. Налмефен для применения в уменьшении потребления алкоголя у пациента с алкогольной зависимостью, который имеет высокий DRL.
Е2. Налмефен согласно варианту осуществления 1, где указанный пациент имеет DRL, соответствующий потреблению >60 г/сутки чистого спирта для мужчин и >40 г/сутки для женщин.
Е3. Налмефен согласно любому из вариантов осуществления 1-2, где указанный DRL оценивается путем расчета среднего суточного потребления алкоголя в г/сутки в течение периода, предшествующего оцениванию, где указанный период составляет 1 неделю или больше, в частности, 2 недели или больше, в частности, 3 недели или больше, в частности, 4 недели или больше, в частности, 1 месяц или больше, в частности, 2 месяца или больше, в частности, 3 месяца или больше, в частности, 4 месяца или больше, в частности, 5 месяцев или больше, в частности, 6 месяцев или больше, в частности, приблизительно 1 год.
Е4. Налмефен согласно любому из вариантов осуществления 1-3, где указанный пациент был идентифицирован как имеющий высокий DRL.
Е5. Налмефен согласно любому из вариантов осуществления 1-4, где указанный пациент продолжает иметь высокий DRL, несмотря на начальную мотивационную поддержку.
Е6. Налмефен согласно любому из вариантов осуществления 1-4, где у указанного пациента сохраняется высокий DRL после периода наблюдения в соответствии с клинической практикой, такого как период наблюдения продолжительностью 1-2 недели, такого как период наблюдения продолжительностью приблизительно 2 недели.
Е7. Налмефен согласно любому из вариантов осуществления 1-5, где у указанного пациента сохраняется высокий DRL после периода наблюдения продол