Способ идентификации нетоксигенных штаммов холерных вибрионов о1 серогруппы с помощью пцр для выделения генетических детерминант
Иллюстрации
Показать всеИзобретение относится к медицинской микробиологии. Изобретение может быть использовано при изучении нетоксигенных штаммов холерных вибрионов различного происхождения на молекулярно-биологическом уровне с целью установления их роли в этиологии спорадических случаев и вспышек диарейных заболеваний. Сущность предлагаемого изобретения заключается в том, что для проведения ПНР используют 14 генов, оптимально определяющих генотип нетоксигенных штаммов V. cholerae O1 серогруппы, а именно: rstA, tcpA, int, nanH, vce, rtxC, acd-rtxA, vcsN, vspD, vasK, pbd-vgrG3, acd-vgrG1, mshA, stn/sto. Реакцию проводят отдельно для каждого гена в 10 мкл смеси с праймерами, соответствующими определенному гену, и осуществляют амплификацию на программируемом многоканальном термостате при определенных режимах. После окончания реакции смесь окрашивают бромистым этидием и разделяют электрофоретически в 2% агарозном геле, приготовленном на трис-ацетатном либо трис-боратном буфере, затем в трансэллюминаторе считывают длину амплификата каждого фрагмента, которые имеют следующие размеры: rstA - 1009 п.н., tcpA -471 п.н., int - 458 п.н., nanH- 585 п.н., vce - 1009 п.н., rtxC - 417 п.н., acd-rtxA - 660 п.н., vcsN - 508 п.н., vspD - 422 п.н., vasK - 614 п.н., pbd-vgrG3 - 422 п.н., acd-vgrG1 - 735 п.н., mshA - 432 п.н., stn/sto - 172 п.н., анализ результатов проводят, сравнивая выделенные детерминанты нуклеотидных последовательностей генов исследуемого штамма с длиной амплификата контрольных штаммов: V. cholerae O1 № M - 878 и №14863, а также ПЦР-амплификат этого гена, полученного на матрице ДНК штамма V. cholerae nonO1/non O139 (NRT 36), затем полученный результат сравнивают с табличными значениями общей характеристики генотипов нетоксигенных штаммов O1 серогруппы, по которому определяют идентичность генотипа. При этом реакционная смесь для ПЦР имеет следующий состав: 10-х буфер для амплификации (рН 8,8) - 1 мкл; 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл; 2,5 мМ раствор прямого и обратного праймеров определенного гена - 1 мкл; ДНК-матрица исследуемого штамма - 1 мкл; TAQ-полимераза (5 ед./мкл) - 0,1 мкл; деионизированная вода - 6,9 мкл. Кроме того, амплификацию проводят при следующих режимах: для определения генов rstA, ACD-rtxA, tcpA, int, nanH vce, mshA, vasK, acd-vgrG1, pbd-vgrG3: денатурация - 94°C, 3 мин (1 цикл); отжиг - 58°C, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл); для определения гена rtxC, vcsN2, vspD: денатурация - 94°С, 3 мин (1 цикл); отжиг - 55°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл); для определения гена : денатурация - 94°С, 3 мин (1 цикл); отжиг - 50°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл). 2 з.п. ф-лы, 6 табл., 3 пр.
Реферат
Изобретение относится к медицинской микробиологии и может быть использовано при изучении нетоксигенных штаммов холерных вибрионов различного происхождения на молекулярно-биологическом уровне с целью установления их роли в этиологии спорадических случаев и вспышек диарейных заболеваний.
В настоящее время актуальной остается проблема обнаружения, при ежегодных мониторинговых исследованиях холеры, на фоне эпизодических выделений единичных токсигенных штаммов Vibrio cholerae El Tor из объектов окружающей среды и от человека (заносы), в связи с этим отмечается обнаружение нетоксигенных культур этих микроорганизмов, в основном в водных экосистемах. Наряду с этим встречаются изоляты из клинического материала. В среднем по данным референс-центра по мониторингу холеры на территории Российской Федерации за период 2000-2016 гг. - по 53 штамма в год.
Вместе с тем, следует учитывать, что геном холерного вибриона высокопластичен, что обусловливает генетическую неоднородность популяций, обнаруживаемых на различных территориях. Следовательно, при выделении нетоксигенных штаммов V. cholerae O1 возникает необходимость разработки подхода к их актуализации, связанного с установлением их генотипов, то есть выявления сходств/различий со штаммами как вновь выделенными, так и обнаруженными ранее, а также установление их происхождения (занос/переживание).
Известен способ определения генетического родства штаммов холерных вибрионов (1), основанный на методике секвенирования генов и заключающийся в том, что при проведении ПЦР используют праймеры на гены rig, gmhD и orf2, фланкирующие кластер генов биосинтеза О-антигена, при этом эти праймеры имеют свои последовательности, а родственные связи проводят, сравнивая нуклеотидные последовательности генов исследуемого штамма по количеству единичных нуклеотидных замен с данными, представленными в GenBank, или с последовательностями аналогичных генов у других холерных вибрионов.
Однако при ежегодном выделении десятков нетоксигенных изолятов V. cholerae и при необходимости проведения эпидрасследоваий по факту их выделения для определения генотипа с высокой разрешающей силой этот способ длителен по времени и громоздок в плане выполнения манипуляций.
Наиболее близким по технологической задаче является способ определения генетического родства холерных вибрионов (2), включающий выделение ДНК холерных вибрионов, проведение полимеразной цепной реакции (ПЦР) с помощью олигонуклеотидных праймеров на гены gyrH, pgm, recA, tcpA, ctxA, ctxB, определение нуклеотидных последовательностей полученных в ПЦР генов, сравнение этих последовательностей с последовательностями аналогичных генов у других холерных вибрионов или с данными GenBank, дифференциацию вибрионов различных филогенетических групп.
Недостатком прототипа является то, что он имеет возможность проводить исследования вирулентных штаммов холерных вибрионов, у которых в геноме присутствуют гены вирулентности tcpA, ctxA, ctxB. Это объясняется тем, что использование генов gyrH, pgm, recA позволяют дифференцировать филогенетически удаленные между собой вибрионы и устанавливать родство изучаемых штаммов с эпидемически значимыми вибрионами O1 и O139 серогрупп.
Использовать этот способ для идентификации нетоксигенных штаммов холерных вибрионов O1 серогруппы с наименьшими затратами времени и средств не представляется возможным.
Технической задачей предлагаемого изобретения является разработка нового способа, позволяющего с высокой достоверностью и в короткие сроки определять генотип исследуемых нетоксигенных штаммов холерных вибрионов O1 серогруппы.
Поставленная задача достигается тем, что в известном способе идентификации нетоксигенных штаммов холерных вибрионов O1 серогруппы с помощью ПЦР для выделения генетических детерминант, включающем выделение ДНК исследуемого штамма, проведение ПЦР, амплификацию фрагментов генов, определение нуклеотидной последовательности фрагментов генов, анализ результатов, способ отличает то, что для проведения ПЦР используют 14 генов, оптимально определяющих генотип нетоксигенных штаммов V. cholerae O1 серогруппы, а именно: rstA, tcpA, int, nanH, vce, rtxC, acd-rtxA, vcsN, vspD, vasK, pbd-vgrG3, acd-vgrG1, mshA, stn/sto, при этом реакцию проводят отдельно для каждого гена в 10 мкл смеси с праймерами, соответствующими определенному гену, и осуществляют амплификацию на программируемом многоканальном термостате при определенных режимах, после окончания реакции смесь окрашивают бромистым этидием и разделяют электрофоретически в 2% агарозном геле, приготовленном на трис-ацетатном буфере, затем в трансэллюминаторе считывают длину амплификата каждого фрагмента, которые имеют следующие размеры: rstA - 1009 п.н., tcpA - 471 п.н., int - 458 п.н., nanH - 585 п.н., vce - 1009 п.н., rtxC - 417 п.н., acd-rtxA - 660 п.н., vcsN - 508 п.н., vspD - 422 п.н., vasK - 614 п.н., pbd-vgrG3 - 422 п.н., acd-vgrG1 - 735 п.н., mshA - 432 п.н., stn/sto - 172 п.н., анализ результатов проводят, сравнивая выделенные детерминанты нуклеотидных последовательностей генов исследуемого штамма с длиной амплификата контрольных штаммов: V. cholerae O1 № М - 878 и №14863, а также ПЦР-амплификат этого гена, полученного на матрице ДНК штамма V. cholerae nonO1/non 0139 (NRT 36), затем полученный результат сравнивают с табличными значениями общей характеристики генотипов нетоксигенных штаммов O1 серогруппы, по которому определяют идентичность генотипа.
При этом реакционная смесь для ПЦР имеет следующий состав:
- 10-х буфер для амплификации (рН 8,8) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров определенного гена - 1 мкл
- ДНК-матрица исследуемого штамма - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
Кроме того, амплификацию проводят при следующих режимах:
- для определения генов rstA, ACD-rtxA, tcpA, int, nanH vce, mshA, vasK, acd-vgrG1, pbd-vgrG3: денатурация - 94°C, 3 мин (1 цикл); отжиг - 58°C, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена rtxC, vcsN2, vspD: денатурация - 94°С, 3 мин (1 цикл); отжиг - 55°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена : денатурация - 94°С, 3 мин (1 цикл); отжиг - 50°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл).
Способ осуществляют следующим образом.
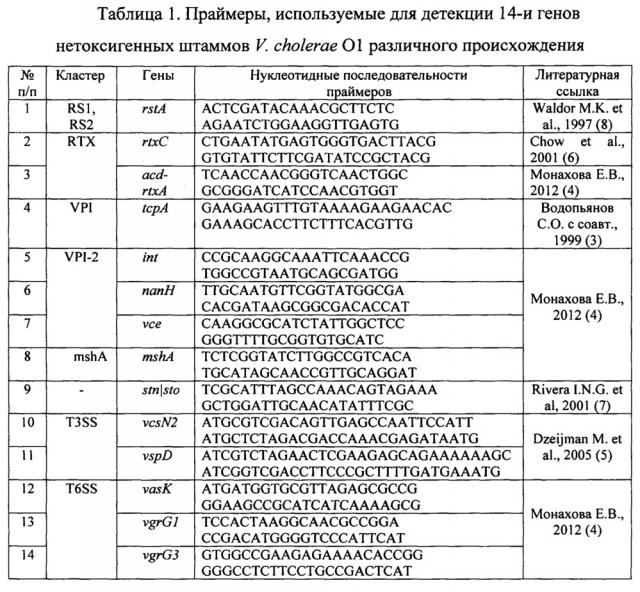
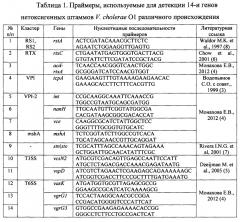
Для проведения способа используют табл. 1, 2, 3, разработанные в ФКУЗ Ростовском-на-Дону противочумном институте Роспотребнадзора.
Табл. 1 - праймеры, используемые для детекции 14-ти генов, нетоксигенных штаммов V. cholerae O1 различного происхождения.
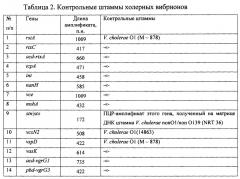
Табл. 2 - сформирована с указанием 14 генов, длины их амплификата, соответствующих контрольным штаммам.
Табл. 3 - составлена из 81 ПЦР-генотипа, включающего 408 нетоксигенных штамма холерных вибрионов различного происхождения, при этом каждый ПЦР-генотип имеет уникальный набор генов, отличающихся между собой по наличию/отсутствию от 3 до 9 генов.
Для постановки ПЦР суточные агаровые культуры холерных вибрионов суспендируют в дистиллированной воде до 1×109 мк.кл./мл и обеззараживают прогреванием при 99°С в течение 30 мин. Клетки осаждают центрифугированием при 10000 об/мин в течение 5 мин и используют прозрачные супернатанты в качестве ДНК-матриц. Реакцию проводят отдельно для каждого гена в 10 мкл смеси следующего состава:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) -1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров - 1 мкл (синтез праймеров осуществлен в «Евроген» (Москва), НПФ «Литех» (Москва) и ООО «СибЭнзим» (Новосибирск) (см. табл. 1);
- исследуемая ДНК-матрица - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
Амплификацию проводят на программируемом многоканальном термостате «Терцик» («ДНК-Технология», Москва) при следующих режимах:
- для определения генов rstA, ACD-rtxA, tcpA, int, nanH vce, mshA, vasK, acd-vgrG1, pbd-vgrG3: денатурация - 94°C, 3 мин (1 цикл); отжиг - 58°C, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена rtxC, vcsN2, vspD: денатурация - 94°С, 3 мин (1 цикл); отжиг - 55°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена : денатурация - 94°С, 3 мин (1 цикл); отжиг - 50°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл).
По окончании реакции смеси окрашивают бромистым этидием и разделяют электрофоретически в 2% агарозном геле, приготовленном на трис-ацетатном либо трис- боратном буфере, и в трансэллюминаторе считывают длину амплификата каждого фрагмента, которые имеют следующие размеры: размеры: rstA - 1009 п.н.; tcpA - 471 п.н.; int - 458 п.н.; nanН - 585 п.н.; vce - 1009 п.н.; rtxC - 417 п.н.; acd-rtxA - 660 п.н.; vcsN - 508 п.н.; vspD - 422 п.н.; vasK - 614 п.н.; pbd-vgrG3 - 422 п.н.; acd-vgrG1 - 735 п.н.; mshA - 432 п.н.; stn/sto - 172 п.н.
Анализ результатов проводят, сравнивая выделенные детерминанты нуклеотидных последовательностей генов исследуемого штамма с длиной амплификата контрольных штаммов: (см.табл. 2) V. cholerae O1 №№ М - 878, 14863, а также ПЦР-амплификат этого гена, полученного на матрице ДНК штамма V. cholerae nonO1/non O139 (NRT 36). Полученный результат затем сравнивают с табличными значениями общей характеристики генотипов нетоксигенных штаммов O1 серогруппы (см. табл. 3) по которому определяют идентичность генотипа.
Пример 1. Проведение идентификации с установлением ПЦР-генотипа нетоксигенного штамма V. cholerae O1 №16337, который был прислан в референс-центр по мониторингу холеры для прохождения идентификации и получен из МЖК с ЦПВ ФКУЗ Ростовский-на-Дону противочумный институт Роспотребнадзора. Исследуемую культуру высевают на чашку щелочного агара (рН 8,0±0,2) и инкубируют при 37°С в течение 24 ч.
Для постановки ПЦР исследуемую суточную агаровую нетоксигенную культуру холерного вибриона суспендируют в дистиллированной воде до 1×109 мк.кл./мл и обеззараживают прогреванием при 99°С в течение 30 мин. Клетки осаждают центрифугированием при 10000 об/мин в течение 5 мин и используют прозрачные супернатанты в качестве ДНК-матриц.
Реакцию проводят отдельно для каждого гена в 10 мкл смеси.
Смесь состоит из следующих компонентов:
1. При использовании праймера для детекции гена rstA:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (rstA) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
2. При использовании праймера для детекции гена acd-rtxA:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (acd-rtxA) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
3. При использовании праймера для детекции гена tcpA:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (tcpA) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
4. При использовании праймера для детекции гена int:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (int) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
5. При использовании праймера для детекции гена nanH:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (nanH) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
6. При использовании праймера для детекции гена vce:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (vce) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
7. При использовании праймера для детекции гена mshA:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (mshA) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
8. При использовании праймера для детекции гена vasK:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (vasK) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
9. При использовании праймера для детекции гена acd-vgrG1:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (acd-vgrG1) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
10. При использовании праймера для детекции гена pbd-vgrG3:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (pbd-vgrG3) - 1 мкл (табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
11. При использовании праймера для детекции гена rtxC:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (rtxC) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
12. При использовании праймера для детекции гена vcsN2:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (vcsN2) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
13. При использовании праймера для детекции гена vspD:
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров (vspD) - 1 мкл (см. табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
14. При использовании праймера для детекции гена :
- 10-х буфер для амплификации (рН 8,8) (коммерческий-НПЦ Вектор) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров () - 1 мкл (табл. 1);
- исследуемая ДНК-матрица штамма №16337 - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
Амплификацию проводят на программируемом многоканальном термостате «Терцик» («ДНК-Технология», Москва) при следующих режимах:
- для определения генов rstA, acd-rtxA, tcpA, int, nanH, vce, mshA, vasK, acd-vgrGl, pbd-vgrG3: денатурация - 94°C, 3 мин (1 цикл); отжиг - 58°C, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена rtxC, vcsN2, vspD: денатурация - 94°С, 3 мин (1 цикл); отжиг - 55°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена : денатурация - 94°С, 3 мин (1 цикл); отжиг - 50°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл).
По окончании реакции смеси окрашивают бромистым этидием и разделяют электрофоретически в 2% агарозном геле, приготовленном на трис-ацетатном либо трис-боратном буфере и визуализируют в УФ свете.
Амплифицированные в ПЦР фрагменты генов имеют следующие размеры: rstA - 1009 п.н.; tcpA - 471 п.н.; int - 458 п.н.; nanH - 585 п.н.; vce - 1009 п.н.; rtxC - 417 п.н.; acd-rtxA - 660 п.н.; vcsN - 508 п.н.; vspD - 422 п.н.; vasK - 614 п.н.; pbd-vgrG3 - 422 п.н.; acd-vgrG1 - 735 п.н.; mshA - 432 п.н.; stn/sto - 172 п.н. (см. табл. 2).
Определенные с помощью вышеуказанных манипуляций нуклеотидные последовательности генов: rstA; tcpA; int; nanH; vce; rtxC; acd-rtxA; vcsN; vspD; VasK; pbd-vgrG3; acd-vgrG1; mshA; stn/sto, нетоксигенного штамма холерного вибриона O1 №16337 сравнивают с последовательностями этих генов у контрольных штаммов V. cholerae O1 №№ М - 878, 14863 и ПЦР - амплификата гена stn/sto, полученного на матрице ДНК штамма V. cholerae nonO1/non O139 (NRT 36) (см.табл. 2).
Полученный результат сравнивают с оригинальными данными ПЦР-генотипов табл. 3. Последовательности вышеуказанных генов нетоксигенного штамма V. cholerae O1 №16337 соответствуют генотипу G4 (см. табл. 4).
Пример 2. Проведение идентификации с установлением генотипа нетоксигенного штамма V. cholerae Ol №18108 проводится аналогично примеру 1. Полученные нуклеотидные последовательности генов: rstA; tcpA; int; nanH; vce; rtxC; acd-rtxA; vcsN; vspD; vasK; pbd-vgrG3; acd-vgrG1; mshA; stn/sto сравнивают с последовательностью этих генов у контрольных штаммов V. cholerae O1 №№ М - 878, 14863 и ПЦР - амплификата гена stn/sto, полученного на матрице ДНК штамма V. cholerae nonO1/non O139 (NRT 36) (табл. 2).
Полученный результат сравнивают с оригинальными данными ПЦР-генотипов табл. 3. Последовательности вышеуказанных генов нетоксигенного штамма V. cholerae O1 №18108 соответствуют генотипу G4 (см. табл. 5).
Пример 3. Проведение идентификации с установлением генотипа нетоксигенного штамма V. cholerae O1 №19786 проводится аналогично примеру 1. Полученные нуклеотидные последовательности генов: rstA; tcpA; int; nanH; vce; rtxC; acd-rtxA; vcsN; vspD; vasK; pbd-vgrG3; acd-vgrG1; mshA; stn/sto сравнивают с последовательностью этих генов у контрольных штаммов V. cholerae O1 №№ М - 878, 14863 и ПЦР - амплификата гена stn/sto, полученного на матрице ДНК штамма V. cholerae nonOl/non 0139 (NRT 36) (табл. 2).
Полученный результат сравнивают с оригинальными данными ПЦР-генотипов табл. 3. Последовательности вышеуказанных генов нетоксигенного штамма V. cholerae O1 №19786 соответствуют генотипу D4 (см. табл. 6).
В результате проведенной идентификации 3-х нетоксигенных штаммов V. cholerae O1 №№16337, 18108, 19786, выделенных в 1993, 1999 и 2015 гг. соответственно, из реки Агура на территории Краснодарского края, было установлено, что изоляты №№16337 и 18108 принадлежали к одному генотипу G10, что свидетельствует об их персистентном потенциале. Что касается штамма №19786, то он принадлежал к генотипу D4, ранее не встречавшемуся на данной территории, что позволяет нам судить о вероятном заносе.
Использование предлагаемого изобретения позволяет с высокой достоверностью и в короткие сроки осуществлять идентификацию нетоксигенных штаммов холерных вибрионов O1 серогруппы за счет систематизации изолятов в прикладном аспекте и определять путем ПЦР оптимально минимального количества и сочетания генетических детерминант факторов патогенности, применение которых дает возможность с наименьшей затратой времени и средств оценить родственные связи нетоксигенных культур V. cholerae O1.
Таким образом, заявляемый способ дает ответ с высокой дискриминирующей силой о сходстве/различии, происхождении нетоксигенных штаммов, выделенных на территориях Российской Федерации.
Источники информации
1. Патент RU №2393231, класс C12Q 1/68, C12R 1/63. Способ определения генетического родства штаммов холерных вибрионов методом секвенирования генов, фланкирующих кластер генов биосинтеза О-антигена. Бюл. №18 от 27.06.2010 г.
2. Kotetishvili М., Stine О.С., Chen Y. et al. Multilocus sequence typing has better discriminatory ability for typing Vibrio cholerae than does pulsed-field gel electrophoresis and provides a measure of phylogenrtic relatedness // J. Clinical Microbiology. - 2003. - Vol. 41. - P. 2191-2196.
3. Водопьянов C.O., Мишанькин Б.Н., Олейников И.П. и др. Разработка способа выявления гена tcpA холерного вибриона биотипа эльтор и сероварианта O139 Бенгал с помощью полимеразной цепной реакции // Биотехнология. - 1999. - №6. - С. 19-23.
4. Монахова Е.В. Факторы патогенности нехолерогенных штаммов холерных вибрионов // Автореф. дис. … докт. биол. наук. - Ростов-на-Дону. - 2012. - 46 с.
5. Dzeijman М., Serruto D., Tarn V.C. et al. Genomic characterization of non-O1, non-O139 Vibrio cholerae reveals genes for a type III secretion system // Proc. Natl. Acad. Sci. - 2005. - Vol. 102, N9. - P. 3465-3470. - P. 1526-1530.
6. Chow K.H., Ng N.K., Yuen K.Y., Yam W.C. Detection of RTX toxin in Vibrio cholerae by PCR // J. Clin. Microbiol. - 2001. - Vol. 39, N7. - P. 2594-2597.
7. Rivera I.N.G., Chun J., Huq A. et al. Genotypes associated with virulence in environmental isolates of Vibrio cholerae // Appl. Environ. Microbiol. - 2001. - Vol. 67, N6. - P. 2421-2429.
8. Waldor M.K., Rubin E.J., Gregory D.N. et al. Regulation, replication and integration functions of the Vibrio cholerae СТХ are encoded by region RS2 // Mol. Microbiol. - 1997. - Vol. 24. - P. 917-926.
1. Способ идентификации нетоксигенных штаммов холерных вибрионов О1 серогруппы с помощью ПЦР для выделения генетических детерминант, включающий выделение ДНК исследуемого штамма, проведение ПЦР, амплификацию фрагментов генов, определение нуклеотидной последовательности фрагментов генов, анализ результатов, отличающийся тем, что для проведения ПЦР используют 14 генов, оптимально определяющих генотип нетоксигенных штаммов V. cholerae O1 серогруппы, а именно: rstA; tcpA; int; nanH; vce; rtxC; acd-rtxA; vcsN; vspD; vasK; pbd-vgrG3; acd-vgrG1; mshA; stn/sto, при этом реакцию проводят отдельно для каждого гена в 10 мкл смеси с праймерами, соответствующими определенному гену, и осуществляют амплификацию на программируемом многоканальном термостате при определенных режимах, после окончания реакции смесь окрашивают бромистым этидием и разделяют электрофоретически в 2% агарозном геле, приготовленном на трис-ацетатном либо трис-боратном буфере, затем в трансэллюминаторе считывают длину амплификата каждого фрагмента, которые имеют следующие размеры: rstA - 1009 п.н.; tcpA - 471 п.н.; int - 458 п.н.; nanH - 585 п.н.; vce - 1009 п.н.; rtxC - 417 п.н.; acd-rtxA - 660 п.н.; vcsN - 508 п.н.; vspD - 422 п.н.; vasK - 614 п.н.; pbd-vgrG3 - 422 п.н.; acd-vgrG1 - 735 п.н.; mshA - 432 п.н.; stn/sto - 172 п.н.; анализ результатов проводят, сравнивая выделенные детерминанты нуклеотидных последовательностей генов исследуемого штамма с длиной амплификата контрольных штаммов: V. cholerae O1 №№ М - 878, 14863, а также ПЦР-амплификат этого гена, полученного на матрице ДНК штамма V. cholerae nonO1/non O139 (NRT 36); полученный результат затем сравнивают с табличными значениями общей характеристики генотипов нетоксигенных штаммов О1 серогруппы, по которому определяют идентичность генотипа.
2. Способ по п. 1, отличающийся тем, что реакционная смесь для ПЦР имеет следующий состав:
- 10-х буфер для амплификации (pH 8,8) - 1 мкл;
- 2,5 мМ раствор смеси дезоксинуклеотидтрифосфатов (dNTR) - 1 мкл;
- 2,5 мМ раствор прямого и обратного праймеров определенного гена – 1 мкл.
- ДНК-матрица исследуемого штамма - 1 мкл;
- TAQ-полимераза (5 ед./мкл) - 0,1 мкл;
- деионизированная вода - 6,9 мкл.
3. Способ по п. 1, отличающийся тем, что амплификацию проводят при следующих режимах:
- для определения генов rstA, ACD-rtxA, tcpA, int, nanH vce, mshA, vasK, acd-vgrG1, pbd-vgrG3: денатурация - 94°С, 3 мин (1 цикл); отжиг - 58°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена rtxC, vcsN2, vspD : денатурация - 94°С, 3 мин (1 цикл); отжиг - 55°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл);
- для определения гена stn|sto: денатурация - 94°С, 3 мин (1 цикл); отжиг - 50°С, 30 сек; синтез - 72°С, 30 сек (30 циклов); досинтез - 72°С, 3 мин (1 цикл).