Способ выделения пространственных изомеров n,n´-диметилгликолурила
Иллюстрации
Показать всеИзобретение относится к способу выделения пространственных изомеров N,N’-диметилгликолурила, а именно 2,6-диметилгликолурила и 2,8-диметилгликолурила, включающему препаративное разделение реакционной смеси, полученной путем взаимодействия двух частей N-метилмочевины и одной части глиоксаля, методом жидкостной хроматографии, характеризующемуся тем, что в качестве стационарной фазы октадецилсилильного силикагеля и элюентов используют водно-ацетонитриловую смесь следующего состава, мас.%: ацетонитрил 2–8, вода 92-8. Технический результат заключается в получении высокочистых реагентов, которые используются для тонкого органического синтеза. 2 пр., 1 ил.
Реферат
Изобретение относится к способам выделения и очистки веществ от близкородственных соединений методом жидкостной хроматографии.
Способ предназначен для выделения чистых 2,6-диметилгликолурила и 2,8-диметилгликолурила, которые могут быть использованы в качестве стандартных образцов примесей при контроле качества субстанции тетраметилтетраазабициклооктандиона и препаратов на его основе, в качестве высокочистых регентов для тонкого органического синтеза, получения супрамолекулярных соединений (кукурбитурилов и бамбусурилов).
Известен способ (патент RU 2108098, опубл. 10.04.1998 г.) получения и выделения 2,4,6,8-тетраметилгликолурила. Выделение продукта из реакционной массы производится путем нейтрализации реакционной массы с дальнейшей обработкой диэтиловым эфиром, отделением водной фазы, добавлением хлороформа, отделением органической фазы, отгонкой хлороформа, репульпацией остатка с диэтиловым эфиром, фильтрацией и сушкой осадка при комнатной температуре. В ходе процесса выделяется сумма гомологов и изомеров N-метил-замещенных производных гликолурила. Недостатком данного способа является невозможность выделения индивидуальных изомеров.
Существует способ (патент US 2654763, МПК C07D 487/04 опубл. 06.10.1953) получения С,С/-диметилгликолурилов путем проведения реакции нитрозирования метилэтилкетона, и последующей конденсации с мочевиной. Однако в данном способе не предусмотрена возможность получения и выделения N,N/-диметилгликолурилов.
Существует способ выделения близких к гликолурилам по строению веществ - N-замещенных производных гексаазаизовюртцитана (патент RU 2146676, МПК C07D, опубл. 20.03.2000). Недостатком данного способа является невозможность выделения пространственных изомеров.
В качестве прототипа выбран способ [A. Wu, J.С. Fettinger, L. Isaacs Glycoluril derivatives form hydrogen bonded tapes rather than cucurbit [n] uril congeners, Tetrahedron, v. 58, I. 49, 2002] разделения пространственных изомеров N-арил-замещенных гликолурилов методами тонкослойной хроматографии и нормально-фазовой жидкостной колоночной хроматографии низкого давления. Хроматографическое разделение пространственных изомеров проводят с использованием немодифицированного силикагеля в качестве стационарной фазы, и смеси хлороформа и метанола в объемном соотношении (50:1). Недостатком данного метода является невозможность его применения для разделения N,N'-диметилгликолурилов вследствие неселективности нормально-фазовых хроматографических систем по отношению к N-метил-производным гликолурила. В нормально-фазовом режиме хроматографии на немодифицированных силикагелях разделение пространственных изомеров N,N'-диметилгликолурилов не обеспечивается.
Задачей настоящего изобретения является разработка способа выделения пространственных изомеров N,N'-диметилгликолурила: 2,6-диметилгликолурила и 2,8-диметилгликолурила пригодного для получения чистых индивидуальных веществ.
Решение поставленной задачи достигается тем, что для выделения пространственных изомеров N,N'-диметилгликолурила: 2,6-диметилгликолурила и 2,8-диметилгликолурила, используется препаративное разделение реакционной смеси, полученной путем взаимодействия двух частей N-метилмочевины и одной части глиоксаля, методом жидкостной хроматографии с использованием в качестве стационарной фазы октадецилсилильного силикагеля (C18) и злюентов на основе водно-ацетонитриловых смесей следующего состава, %:
| Ацетонитрил | 2-8 |
| Вода | 92-98 |
Таким образом, в отличие от прототипа, описанный способ позволяет выделять в чистом виде пространственные изомеры 2,6-диметилгликолурил и 2,8-диметилгликолурил.
Ниже приведены примеры конкретного осуществления изобретения.
Пример 1
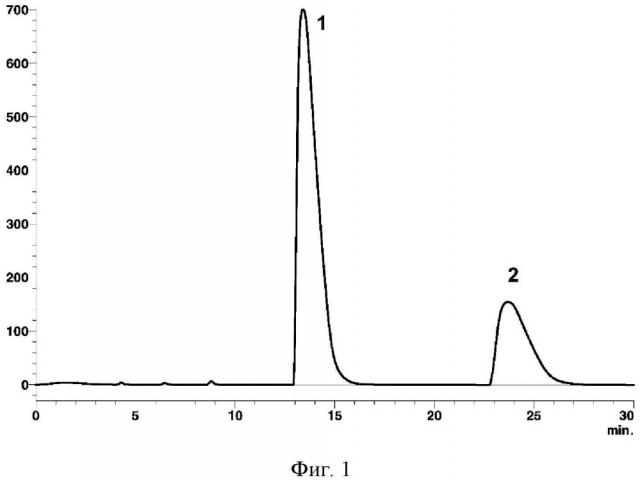
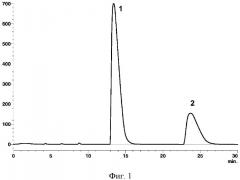
Из 500 мг высушенной реакционной массы, полученной путем взаимодействия двух частей N-метилмочевины и одной части глиоксаля, готовят 3 мл водного раствора. Фильтруют и хроматографируют 2 мл раствора с использованием жидкостного хроматографа Shimadzu LC-20 Prominence со спектрофотометрическим детектором (фиг. 1 Хроматограмма: 1 - 2,6-диметилгликолурил, 2 - 2,8-диметилгликолурил).
Выделяют 10 мл фракции пика 2,6-диметилгликолурила, представляющей собой водно-ацетонитриловый раствор очищенного пространственного изомера 2,6-диметилгликолурила. Отгоняют растворитель, полученную фракцию высушивают.
Масса высушенного образца 2,6-диметилгликолурила составляет около 200 мг. Хроматографическая чистота полученного образца составляет 98,2%.
Структура выделенного 2,6-диметилгликолурила подтверждена методом 1Н-ЯМР-спектроскопии (5,091 ppm (s, 2Н), 2,605 ppm (s, 6Н), 7,542 ppm (s, 2Н)), жидкостной хромато-масс-спектрометрии высокого разрешения (сигнал 171,0880 а.е.м., соответствующий молекулярному иону диметилгликолурила).
Пример 2
Из 500 мг высушенной реакционной массы, полученной путем взаимодействия двух частей N-метилмочевины и одной части глиоксаля, готовят 3 мл водного раствора. Фильтруют и хроматографируют 2 мл раствора с использованием жидкостного хроматографа Shimadzu LC-20 Prominence со спектрофотометрическим детектором. Выделяют 10 мл фракции пика 2,8-диметилгликолурила, представляющей собой водно-ацетонитриловый раствор очищенного пространственного изомера 2,8-диметилгликолурила. Отгоняют растворитель, полученную фракцию высушивают.
Масса высушенного образца 2,8-диметилгликолурила составляет около 70 мг. Хроматографическая чистота полученного образца составляет 99,6%.
Структура выделенного 2,8-диметилгликолурила подтверждена методом 1Н-ЯМР-спектроскопии (5,170-5,191 ppm (d, 1Н); 5,101-5,122 ppm (d, 1Н), 2,781 ppm (s, 6Н), 7,397 ppm (s, 2Н)), жидкостной хромато-масс-спектрометрии высокого разрешения (сигнал 171,0877 а.е.м., соответствующий молекулярному иону диметилгликолурила).
Способ выделения пространственных изомеров N,N'-диметилгликолурила, а именно 2,6-диметилгликолурила и 2,8-диметилгликолурила, включающий препаративное разделение реакционной смеси, полученной путем взаимодействия двух частей N-метилмочевины и одной части глиоксаля, методом жидкостной хроматографии, отличающийся тем, что в качестве стационарной фазы октадецилсилильного силикагеля и элюентов используют водно-ацетонитриловую смесь следующего состава, мас.%:
| Ацетонитрил | 2-8 |
| Вода | 92-98 |