Способ подавления роста микроорганизмов антигенами-экстрактами из гельминтов
Иллюстрации
Показать всеИзобретение относится к области медицинской и ветеринарной паразитологии и микробиологии. Способ подавления роста микроорганизмов предусматривает приготовление антигенов-экстрактов из гельминтов Anisakis simplex и Dirofilaria immitis и получение чистой культуры микроорганизмов, в качестве которых использовали Escherichia coli, Proteus vulgaris, Micrococcus sp., путем смыва суточной культуры с поверхности плотной агаризованной среды с последующей стандартизацией на основе коммерческих стандартов мутности №5 и №10, утвержденных ВОЗ как первичный эталон мутности для оптической стандартизации бактериальных взвесей. Проводят проверку экстрактов из гельминтов на стерильность и определяют в них содержание белка. Проводят посев микроорганизмов на мясопептонный агар, вносят на поверхность агара бумажные диски, пропитанные антигенами-экстрактами из гельминтов Anisakis simplex и Dirofilaria immitis, с последующей оценкой результатов по наличию выраженной зоны задержки роста микроорганизмов вокруг бумажных дисков, пропитанных соответствующими экстрактами. 4 ил.
Реферат
Изобретение относится к области медицинской и ветеринарной паразитологии и микробиологии, в частности может быть использовано для изучения воздействия гельминтов на микрофлору в условиях in vitro. Предложенный способ предусматривает приготовление антигенов-экстрактов из гельминтов, контроль их на стерильность и содержание белка; приготовление суточной культуры микроорганизмов, определение количества клеток по стандарту мутности, газонный посев на чашки Петри с мясопептонным агаром (МПА), внесение в чашки Петри стерильных дисков из фильтровальной бумаги, смоченных антигенами-экстрактами гельминтов. После этого проводят термостатирование культуры в течение 12 ч при температуре +37°С. Линейкой измеряют диаметр зоны стерильности вокруг диска. Формирование выраженной зоны стерильности означает наличие биологически-активных компонентов в составе антигенов-экстрактов исследуемых гельминтов, подавляющих рост культуры микроорганизмов.
Использованы культуры микроорганизмов: Escherichia coli, Proteus vulgaris, Micrococcus sp.
Антигены гельминтов: антигены-экстракты из Anisakis simplex (A. simplex), Dirofilaria immitis (D. immitis).
Изобретение может быть использовано для оценки взаимодействия культур микроорганизмов и антигенов-экстрактов из гельминтов в условиях in vitro.
Цель изобретения сводится в установлении подавления микроорганизмов, выращенных на плотной питательной среде - мясопептонном агаре (МПА), антигенами-экстрактами из гельминтов.
Известно, что продукты метаболизма гельминтов воздействуют на клетки макроорганизма, прежде всего это отражается на клетках крови, кроветворных органов, в частности костного мозга, половых желез, также на клетках эмбрионов (Ильинских Н.Н.., 1974; Бекиш В.Я., 2001; Сивкова Т.Н., 2011; Manna G.K., Samar С., 1975; Hamada et. al., 1992; Rosin M.P. et al., 1994; Herrera L.A. et. al., 2000).
Гельминты оказывают неблагоприятное влияние на нормальную микрофлору организма хозяина, вызывая дисбиоз (Янгуразова З.А, Нурхаметов Х.Г., 1976; Акбаев М.Ш., 1995 и др.), который осложняет течение паразитарного заболевания и нередко обусловливает длительную дисфункцию кишечника (Зайков С.В., 2009; Панасюк Д.И. и др., 1978; Гончаров С.К., 1991; Маннапова Р.Т., 1998; Матусявичус А.П., Шимкус К.А., 1983 и др.).
Наиболее близким к заявляемому техническому решению является исследование на культурах клеток микроорганизмов (Береснева Е.В., 2003; Беляева М.И. и др., 2011), где авторы использовали способ культивирования половозрелых гельминтов в жидкой питательной среде с добавлением микроорганизмов и оценивали их взаимодействие. Недостатком этого способа является отсутствие возможности постоянно получать половозрелых гельминтов и долгое время поддерживать их в активном состоянии.
Предлагаемый способ основан на установлении подавления роста микроорганизмов in vitro под воздействием антигенов-экстрактов из гельминтов.
Предлагаемый нами способ включает следующие этапы:
1) получение антигенов-экстрактов из гельминтов A. simplex, D. immitis, контроль их на стерильность и содержание белка;
2) получение суточной культуры микроорганизмов, приготовление смывов, определение концентрации по стандарту мутности;
3) посев микроорганизмов на МПА, внесение в каждую культуру микроорганизмов бумажного диска, пропитанного антигеном-экстрактом одного вида, культивирование в термостате;
4) учет результатов.
1. Получение антигенов-экстрактов из гельминтов A. simplex, D. immitis, контроль их на стерильность и содержание белка.
Биоматериал из гельминтов A. simplex, извлеченных из тушек рыбы, тщательно многократно промывают проточной водой, затем обрабатывают растворами антибиотиков и противогрибкового препарата из расчета 2000 ЕД/мл пенициллина, 1 мг/мл стрептомицина и 2500 ЕД/мл нистатина, промывают стерильным физиологическим раствором, измельчают и замораживают при минус 18°С. Антиген-экстракт из A. simplex готовят путем гомомогенизации, многократного замораживания и оттаивания измельченного гельминтного материала до получения гомогенной массы, которую заливают стерильным забуференным физиологическим раствором (рН 7,2) и экстрагируют белки при температуре +4°С в течение 18 часов. Полученный гомогенат центрифугируют при 12000 об/мин. в центрифуге с охлаждением Optima TLX в течение 15 мин. Надосадочную жидкость - антиген-экстракт хранят при температуре минус 18°С и используют для дальнейших исследований.
Аналогичным способом получают антиген-экстракт из гельминтов D. immitis, выделенных из сердца спонтанно зараженных собак при патолого-анатомическом вскрытии.
Контроль на стерильность. Для обнаружения контаминации бактериями, грибами и микоплазмами пробу антигена-экстракта из каждого вида гельминта - A. simplex и D. immitis, высевают на МПА, мясопептонный бульон (МПБ) и мясопептонный печеночный бульон (МППБ) по одной пробирке. Для выявления грибковой контаминации антигены-экстракты высевают на агар Сабуро в две чашки Петри. На микоплазменную контаминацию пробу антигенов-экстрактов высевают на универсальную плотную среду для выделения микоплазм (ООО «Научно-производственная фирма Диагност-Мед») согласно инструкции в две чашки Петри.
Контроль ведут в течение трех пассажей на этой же среде. Посевы на МПА, МПБ и МППБ выдерживают в течение 10 суток при +37°С, посевы на полужидком агаре - 14 дней при +37°С, и на среде Сабуро - 15 дней при +23°С. При обнаружении хотя бы одного из контаминантов партию антигена-экстракта считают нестерильной и в дальнейшей работе не используют.
Определение содержания белка. Концентрацию белка в полученных антигенах-экстрактах из A. simplex и D. immitis определяют на биохимическом полуавтоматическом анализаторе StatFax 1904+ (AWARENESS technology inc) с использованием набора реактивов Spinreact, S.A. согласно инструкции. В качестве контроля используют фосфатно-солевой буферный раствор.
2. Получение суточной культуры микроорганизмов, приготовление смывов, определение концентрации по стандарту мутности.
Для соблюдения бактериального стандарта мутности используют отраслевые стандартные образцы ОСО 42-28-85-02, разработанные Государственным институтом стандартизации и контроля им. Л.А. Тарасевича.
Биомассу клеток получают способом смыва суточной культуры с поверхности плотной агаризованной среды. Соблюдая правила асептики, в пробирку с культурой на скошенном агаре вносят 1-2 мл физиологического раствора. Пробирку закрывают пробкой и, слегка взбалтывая, получают смыв культуры. Полученную суспензию инкубируют 20-40 мин в термостате при температуре +37°С.
Затем проводят стандартизацию суспензии клеток.
Для этого используют коммерческие стандарты мутности №5 и №10. Международный стандарт мутности или стеклянный стандарт мутности утвержден Всемирной организацией здравоохранения (ВОЗ), как первичный эталон мутности для оптической стандартизации бактериальных взвесей. Он соответствует мутности взвеси бактерий Борде-Жангу (коклюшных бактерий), содержащей 109 клеток в 1 мл, т.е. равный 10 единицам мутности; представляет собой взвесь частиц стекла пирекс. Порядок работы с ним:
- изучают инструкции к набору;
- ампулу тщательно перемешивают;
- затем ампулу вскрывают;
- содержимое переносят в одну из пробирок набора;
- далее проводят стандартизацию
Если в инструкции не указано иного, то 10 ЕД соответствует количеству микроорганизмов в единице объема 5×108, а стандарт 5 ЕД соответствует количеству клеток в единице объема 2,5×108. Эти единицы справедливы для энтеробактерий, неферментирующих микроорганизмов, стафилококков и ряда других: при практически одинаковой оптической плотности нет существенных различий в числе бактерий в единице объема. Для других микроорганизмов, существенно отличающихся по размерам, необходимо дополнительно уточнять единицы (Винникова О.И. и др., 2011).
3. Посев микроорганизмов на МПА, внесение в каждую культуру микроорганизмов бумажного диска, пропитанного антигеном-экстрактом одного вида, культивирование в термостате.
Диско-Диффузионный Метод (ДДМ) определения чувствительности основан на способности антигенов-экстрактов диффундировать из пропитанных ими бумажных дисков в питательную среду, оказывая влияние на рост микроорганизмов, посеянных на поверхность агара.
Перед заполнением расплавленной средой чашки Петри устанавливают на строго горизонтальную поверхность. После заполнения чашки оставляют при комнатной температуре для застывания. Перед инокуляцией контролируют отсутствие конденсата жидкости на внутренней поверхности крышек.
Для изготовления дисков с соответствующим антигеном-экстрактом используют отдельные стандартные бумажные диски, которые пропитывают антигеном-экстрактом A. simplex или D. immitis отдельно. Диски готовят из фильтров обеззоленных ФС, ООО «Бавер». Масса золы 1 фильтра 0,00047 г.
При определении чувствительности ДДМ используют стандартный инокулюм, соответствующий по плотности 0,5 по стандарту МакФарланда и содержащий примерно 1,5×108 КОЕ/мл. Инокулюм используют в течение 15 минут после приготовления. Инокулюм наносят пипеткой на поверхность чашки Петри с питательной средой в объеме 1-2 мл, равномерно распределяют по поверхности покачиванием, после чего удаляют избыток инокулюма пипеткой. Приоткрытые чашки подсушивают при комнатной температуре в течение 10-15 мин.
Не позднее чем через 15 мин после инокуляции микроорганизмов на поверхность питательной среды в каждую культуру исследуемых микроорганизмов наносят один диск с антигеном-экстрактом. Аппликацию дисков проводят с помощью стерильного пинцета. Расстояние от диска до края чашки оставляют 15-20 мм.
Непосредственно после аппликации диска чашки Петри помещают в термостат кверху дном и инкубируют при температуре +35°С в течение 12 ч.
4. Учет результатов.
После окончания инкубации чашки помещают кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом в 45° (учет в отраженном свете). Диаметр зон задержки роста измеряют с точностью до 1 мм штангенциркулем или линейкой.
При измерении зон задержки роста ориентируются на зону полного подавления видимого роста.
При определении чувствительности ДДМ роящихся штаммов протея, зона подавления роста может быть затянута тонкой вуалеобразной пленкой, которая не мешает установлению границы зоны и не учитывается при регистрации результатов (МУК 4.2.1890-04).
Наличие выраженной зоны задержки роста свидетельствует о подавлении размножения микроорганизмов антигеном-экстрактом из гельминтов.
Пример №1. Извлеченных из тушек рыбы личинок A. simplex 3-й стадии тщательно многократно промывали проточной водой, затем обрабатывали растворами антибиотиков (пенициллин, стрептомицин и нистатин), из расчета 2000 ЕД/мл, 1 мг/мл и 2500 ЕД/мл соответственно и снова промывали стерильным физиологическим раствором и замораживали при минус 18°С. После гомогенизации, многократного замораживания и оттаивания полученный гомогенат заливали стерильным забуференным физиологическим раствором (рН 7,2) в соотношении 1:3 и экстрагировали белки при температуре +4°С в течение 18 часов. После центрифугирования гомогенной экстрагированной массы из гельминтов в центрифуге с охлаждением Optima TLX в течение 15 мин при 12000 об/мин, полученный антиген-экстракт хранили при температуре минус 18°С и использовали в дальнейших исследованиях.
Контроль на стерильность. Для обнаружения контаминации бактериями, грибами и микоплазмами пробу антигена-экстракта из личинок анизакид высевали на МПА, МПБ и МППБ по одной пробирке. Для выявления грибковой контаминации антиген высевали на агар Сабуро в две чашки Петри, а на микоплазменную контаминацию - на универсальной плотной среде для выделения микоплазм (ООО «Научно-производственная фирма Диагност-Мед») согласно инструкции в две чашки Петри.
Контроль вели в течение трех пассажей на этой же среде. Посевы на МПА, МПБ и МППБ выдерживали в течение 10 суток при +37°С, посевы на полужидком агаре - 14 дней при +37°С и на среде Сабуро - 15 дней при +23°С. При обнаружении хотя бы одного из контаминантов партию антигена-экстракта считали нестерильной, и в дальнейшей работе не использовали.
Определение содержания белка. Концентрацию белка в полученном антигене-экстракте определяли на биохимическом полуавтоматическом анализаторе StatFax 1904+ (AWARENESS technology inc) с использованием набора реактивов Spinreact, S.A. согласно инструкции. В качестве контроля использовали фосфатно-солевой буферный раствор. Содержание белка соответствовало 3,6 г/л.
Стерильным антигеном-экстрактом A. simplex пропитывали диски из фильтровальной бумаги, которые затем использовали для нанесения на чашки Петри с культурой E. coli, P. vulgaris и Micrococcus sp.
Суточные культуры этих микроорганизмов (каждый в отдельности) смывали стерильным физиологическим раствором с поверхности скошенного МПА. Пробирки закрывали пробкой и, слегка взбалтывая, получали смывы культуры. Полученные суспензии инкубировали 20-40 мин в термостате при температуре +37°С. Затем проводили определение мутности суспензии микроорганизмов. Десять единиц соответствовали количеству микроорганизмов в единице объема 5×108.
Перед заполнением расплавленной средой чашки Петри устанавливали на строго горизонтальную поверхность. После заполнения чашки оставляли при комнатной температуре для застывания. Перед инокуляцией контролировали отсутствие конденсата жидкости на внутренней поверхности крышек.
Инокулюмы микроорганизмов использовали в течение 15 минут после приготовления. Инокулюмы каждый в отдельности наносили пипеткой на поверхность чашки Петри с питательной средой в объеме 1-2 мл, равномерно распределяли по поверхности покачиванием, после чего удаляли избыток инокулюмов пипеткой. Приоткрытые чашки подсушивали при комнатной температуре в течение 10-15 мин. Каждую культуру микроорганизмов исследовали отдельно с антигеном-экстрактом из A. simplex.
Не позднее чем через 15 мин после инокуляции на поверхность питательной среды с культурой E. coli, P. vulgaris и Micrococcus sp. отдельно наносили бумажный диск с антигеном-экстрактом A. simplex. Аппликацию диска проводили с помощью стерильного пинцета. Расстояние от диска до края чашки оставляли 15-20 мм.
Непосредственно после аппликации диска чашки Петри помещали в термостат кверху дном и инкубировали при температуре +35°С в течение 12 ч.
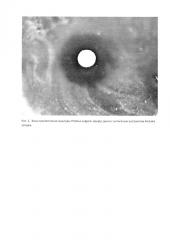
После окончания инкубации, чашки помещали кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом в 45° (учет в отраженном свете). Диаметр зон задержки роста измеряли с точностью до 1 мм штангенциркулем или линейкой. При измерении зон задержки роста ориентировались на зону полного подавления видимого роста. На фотографии эта зона проявляется темной окружностью вокруг белого бумажного фильтра (диска) с антигеном-экстрактом.
В результате культивирования E. coli в течение 12 часов вокруг бумажного фильтра-диска с антигеном-экстрактом A. simplex формировалась зона просветления диаметром 2,12-2,18 см, что свидетельствует о подавлении роста микроорганизмов антигеном-экстрактом из личинок анизакид (рис. 1, Приложение).
После культивирования P. vulgaris в течение 12 часов вокруг бумажного фильтра-диска с антигеном-экстрактом A. simplex формировалась зона просветления диаметром 1,58-1,63 см, что свидетельствует о подавлении роста P. vulgaris антигеном-экстрактом из личинок анизакид (рис. 2).
В результате культивирования Micrococcus sp. в течение 12 часов вокруг бумажного фильтра-диска с антигеном-экстрактом A. simplex формировалась зона просветления диаметром 1,52-1,64 см, что свидетельствует о подавлении роста Micrococcus sp. антигеном-экстрактом из личинок анизакид (рис. 3).
Пример №2. Полученные во время патологоанатомического вскрытия спонтанно зараженных собак половозрелые гельминты Dirofilaria immitis тщательно многократно промывали проточной водой, затем обрабатывали растворами антибиотиков (пенициллин, стрептомицин и нистатин) таким же образом как описано в примере 1. Антиген-экстракт из гельминтов D. immitis готовили аналогичным способом, как из A. simplex. Полученный антиген-экстракт из D. immitis хранили в замороженном состоянии при температуре минус 18°С и использовали в дальнейших исследованиях.
Контроль на стерильность. Для обнаружения контаминации бактериями, грибами и микоплазмами пробу антигена-экстракта из D. immitis высевали на МПА, МПБ и МППБ по одной пробирке. Для выявления грибковой контаминации материал высевали на агар Сабуро в две чашки Петри. На микоплазменную контаминацию пробу антигена-экстракта высевали на универсальной плотной среде для выделения микоплазм (ООО «Научно-производственная фирма Диагност-Мед») согласно инструкции в две чашки Петри.
Контроль вели в течение трех пассажей на этой же среде. Посевы на МПА, МПБ и МППБ выдерживали в течение 10 суток при +37°С, посевы на полужидком агаре - 14 дней при +37°С, и на среде Сабуро - 15 дней при +23°С. При обнаружении хотя бы одного из контаминантов партию экстракта дирофилярий считали нестерильной, и в дальнейшей работе не использовали.
Определение содержания белка. Концентрацию белка в экстракте D. immitis определяли на биохимическом полуавтоматическом анализаторе StatFax 1904+ (AWARENESS technology inc) с использованием набора реактивов Spinreact, S.A. согласно инструкции. В качестве контроля использовали фосфатно-солевой буферный раствор. Содержание белка составило 18,8 г/л.
Полученный антиген-экстракт D. immitis исследовали только на культуре микроорганизмов Micrococcus sp. Пропитывали диск из фильтровальной бумаги этим аонтигеном-экстрактом, который затем наносили на чашки Петри с культурой Micrococcus sp.
Суточную культуру Micrococcus sp. смывали стерильным физиологическим раствором с поверхности скошенного МПА. Пробирку закрывали пробкой и, слегка взбалтывая, получали смыв культуры. Полученную суспензию инкубировали 20-40 мин в термостате при температуре +37°С. Проводили определение мутности суспензии микроорганизмов. Десять единиц соответствовало количеству микроорганизмов в единице объема 5×108.
Перед заполнением расплавленной средой чашки Петри устанавливали на строго горизонтальную поверхность. После заполнения чашки оставляли при комнатной температуре для застывания. Перед инокуляцией контролировали отсутствие конденсата жидкости на внутренней поверхности крышек.
Инокулюм Micrococcus sp. использовали в течение 15 минут после приготовления. Инокулюм наносили пипеткой на поверхность чашки Петри с питательной средой в объеме 1-2 мл, равномерно распределяли по поверхности покачиванием, после чего удаляли избыток инокулюма пипеткой. Приоткрытые чашки подсушивали при комнатной температуре в течение 10-15 мин.
Не позднее чем через 15 мин после инокуляции на поверхность питательной среды с микрококками наносили бумажный диск, пропитанный антигеном-экстрактом D. immitis. Аппликацию диска проводили с помощью стерильного пинцета. Расстояние от диска до края чашки оставляли 15-20 мм.
Непосредственно после аппликации диска чашки Петри помещали в термостат кверху дном и инкубировали при температуре +35°С в течение 12 ч.
После окончания инкубации чашки помещали кверху дном на темную матовую поверхность так, чтобы свет падал на них под углом в 45° (учет в отраженном свете). Диаметр зон задержки роста измеряли с точностью до 1 мм штангенциркулем или линейкой. При измерении зон задержки роста ориентировались на зону полного подавления видимого роста.
В результате культивирования микрококков в течение 12 часов вокруг бумажного диска, пропитанного антигеном-экстрактом D. immitis формировалась зона просветления диаметром 0,85-1,02 см, что свидетельствует о подавлении роста кокков продуктами антигена-экстракта D. immitis (рис. 4).
Источники информации
1. Акбаев М.Ш. Влияние гельминтов на микрофлору пищеварительного канала животных / М.Ш. Акбаев, О.И. Русович, Р.С. Ишимбаева. - М., - 1995. - 18 с.
2. Бекиш В.Я. Воздействие метаболитов мигрирующих личинок аскарид на наследственный аппарат сперматогониев и сперматоцитов хозяина. / В.Я. Бекиш, И.Ю. Малышев // «Фундаментал. науки и прогресс клин. медицины» (Сб. матер. 11 конф. Молодых ученых России). - М. - 2001. - ген 22. - С. 127.
3. Беляева М.И., Бычков В.Г., Кравец Н.В., Мефодьев В.В., Прилукова Л.А., Соловьева О.Г., Хадиева Е.Д., Куликова С.В., Зырянов В.К., Андронова Л.В. Экспериментальные данные о токсическом и ростостимулирующем эффектах Opisthorhis felineus (Rivolta, 1884). - Медицинская паразитология и паразитарные болезни. - 2011. - №2. - С. 39-41.
4. Береснева Е.В. Роль ассоциации энтеропатогенных бактерий и гельминтов в инфекционной патологии птиц. Дисс… канд. вет. наук. - Ставрополь. - 2003. - 144 с.
5. Винникова О.И, Самойлов А.М, Попова Ю.В. Выделение и идентификация бактерий: методические рекомендации для студентов биологического факультета специализации «Микробиология и вирусология» / Сост. О.И. Винникова, А.М. Самойлов, Ю.В. Попова - X.: ХНУ имени В.Н. Каразина, 2011. - 60 с.).
6. Гончаров С.К. Паразитоценоз, ассоциативные паразитозы при энтероколитах у телят // 3 Всесоюзный съезд паразитоценологов. Тез. докладов. - Киев, 1991. - С. 40-45.
7. Зайков С.В. Гельминтозы и аллергические заболевания / С.В. Зайков // Клин. Иммунология. Аллергология. Инфектология. - 2009. - №3/2. - С. 24-35.
8. Ильинских Н.Н. Влияние иммунизации живой вакциной против бруцеллеза на хромосомный аппарат лейкоцитов крови здоровых доноров. / Н.Н. Ильинских // Цитология и генетика. - 1974. - Т. VIII. - №5. - С. 387-390.
9. Маннапова Р.Т. Иммунный статус, микробиоценоз кишечника крупного рогатого скота и метода их коррекции биологически-активными препаратами пчеловодства: Дисс. докт. биол. наук: 03.00.16 / Р.Т. Маннапова. - М., 1998. - 475 с.
10. Матусявичус А.П. Патоморфологические изменения и состав микрофлоры в кишечнике, зараженных аскаридами и эзофагостомумами / А.П. Матусявичус. К.А. Шимкус // Acta parasitologia lituanica. - 1983. - V. 20. C 100-104.
11. Панасюк Д.И. Проблемы ассоциации гельминтов, патологических простейших и микрофлоры при интенсивном ведении животноводства / Д.И. Панасюк, В.В. Филлипов, П.В. Радионов // Обзор. Информация. - М., 1978. - 52 с.
12. Сивкова Т.Н. Получение и характеристика антигенов гельминтов: учебно-методическое пособие / сост. Т.Н. Сивкова, Пермь: М - Во с.-х. РФ, ФГОУ ВПО «Пермская ГСХА» - Пермь: Изд-во ФГОУ ВПО «Пермская ГСХА», 2009. - 14 С.
13. Сивкова Т.Н. Кариопатическое и патоморфологическое действие продуктов метаболизма личинок анизакид: монография / Т.Н. Сивкова, В.К. Бережко; ФГОУ ВПО Пермская ГСХА. - Пермь: Изд-во ФГОУ ВПО Пермская ГСХА, 2011. - 132 с.
14. Янгуразова З.А. Экспериментальные данные по изучению влияния ассоциаций микроорганизмов кишечника на заражаемость животных гельминтами / З.А. Янгузарова, Х.Г. Нурхаметов // Борьба с инвазионными болезнями сельскохозяйственных животных. - Уфа. - 1976. - С. 67-73.
15. Hamada F.M. The mutagenic effect of praziquantel in S. mansoni - infected mice. / F.M. Hamada, A. Abdel-Aziz, F. Badr, A. Moustafa, A. Rashad // Arab. J. Lab. - 1992. - vol. 18. - P. 301-311.
16. Herrera L.A. Possible association between Taenia solium cysticercosis and cancer: increased frequency of DNA damage in peripheral lymphocytes from neurocysticercosis patients / L.A. Herrera, T. Ramirez, U. Rodriguez et al. // Trans. R. Soc. Trop. Med. Hyg. - 2000. - Vol. 94, №1. - P. 61-65.
17. Manna G.K. Bacterial indused done-marrow chromosome aberrationsin mice and their repair. / G.K. Manna, C. Samar // Symp. Struct. Funct. Aspects Chromosomes. - Bombay. - 1975. - Vol. 1. - P. 19.
18. Rosin M.P. Inflammation, chromosomal instability, and cancer: the schistosomiasis model / M.P. Rosin, W.A. Anwar, A. Ward //Cancer Res. - 1994. - Vol. 54, N 7. - P. 1929-1933.
19. МУК 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам. Методические указания. М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2004 г.
Способ подавления роста микроорганизмов антигенами-экстрактами из гельминтов, включающий приготовление антигенов-экстрактов из гельминтов Anisakis simplex и Dirofilaria immitis, получение суточной культуры микроорганизмов Е. coli, P. vulgaris, Micrococcus sp., приготовление смывов, определение концентрации микроорганизмов в смывах по стандарту мутности, посев суточной культуры микроорганизмов в чашки Петри с мясопептонным агаром (МПА), отличающийся тем, что в каждую суточную культуру из Е. coli, P. vulgaris, Micrococcus sp. на МПА в чашках Петри вносят отдельно стандартный бумажный диск из обеззольных фильтров, пропитанный антигеном-экстрактом из A. Simplex, и отдельно в культуру с Micrococcus sp. вносят бумажный диск, пропитанный антигеном-экстрактом из D. immitis, с последующей инкубацией в термостате при 35° в течение 12 часов и по окончании инкубации проведят оценку зоны подавления видимого роста микроорганизмов на основе определения размеров области просветления вокруг бумажных дисков, пропитанных антигенами-экстрактами гельминтов, с точностью до 1 мм, свидетельствующих о подавлении роста микроорганизмов под действием антигенов-экстрактов из гельминтов.