Слитый белок на основе рекомбинантного иммунорегуляторного белка ганодермы и сывороточного альбумина человека, способ его получения, а также его применение
Иллюстрации
Показать всеНастоящее изобретение относится к области биотехнологии, конкретно к рекомбинантному получению слитого белка, состоящего из иммунорегуляторного белка гандермы и человеческого сывороточного альбумина (HSA), и может быть использовано в медицине для лечения лейкопении и как противоопухолевое средство. Получен слитый белок rLZ-8-HSA, в котором С-конец иммунорегуляторного белка ганодермы соединен с человеческим сывороточным альбумином через связывающий пептид. Изобретение позволяет улучшить биологическую активность слитого белка ганодермы rLZ-8-HSA и увеличить периодом его полураспада in vivo по сравнению с rLZ-8. 9 н. и 1 з.п. ф-лы, 4 ил., 7 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Область техники, которой относится изобретение
Настоящее изобретение относится к конструированию, экспрессии, очистке и применению рекомбинантного слитого белка, а более конкретно к способу получения и применения слитого белка на основе рекомбинантного иммунорегуляторного белка ганодермы и человеческого сывороточного альбумина, который используется для лечения заболеваний, таких как лейкопения и опухоли, вызванные химиотерапией.
Описание предшествующего уровня техники
Иммунорегуляторный белок ганодермы (LZ-8) получают из мицелия Ganoderma tsugae. Структура рекомбинантного иммунорегуляторного белка ганодермы содержит: важный N-концевой домен для образования димера и С-концевой домен FNIII; где N-концевой домен rLZ-8 включает α-спираль и β-нить, α-спираль и β-нить N-конца мономера LZ-8 образуют важный гантелевидный димер, связывающий домен через пространство обмена с соответствующими доменами другого LZ-8. Сообщалось, что LZ-8 обладает биологической активностью по иммунорегулированию (ссылаясь на китайский патент CN201110222012.5) и уничтожению опухолевых клеток (ссылаясь на китайский патент ZL200810050206.X).
Обычно основными причинами короткого периода полураспада белковых препаратов являются: 1) гидролиз является одним из способов метаболизма для большинства белков, и наличие белковых ферментов в тканях организма снижает активность белка; 2) почки являются наиболее важным органом в процессе расщепления и метаболизма низкомолекулярного белка; большинство белков, с относительной молекулярной массой менее 69000 Да, могут быть экскретированы путем клубочковой фильтрации; 3) печень играет важную роль в процессе метаболизма белковых лекарственных средств, где лекарственное средство доставляется в клетки печени путем диффузии и переноса носителями, а затем разрушается под действием микросомальных ферментов Р450, протеаз или лизосом в цитозоли; пептиды и белки с более крупными молекулами, абсорбируются клетками печени через эндоцитоз, опосредованный рецептором, прежде чем разрушаются клетками печени. Молекулярная масса димера составляет менее 26 кДа; скорость клиренса может быть высокой; и фармакокинетические параметры являются сложными, чтобы удовлетворить требования фармацевтических разработок. Таким образом, только за счет продолжительного времени действия LZ-8 in vivo путем слияния на уровне генов и других технических методов может быть заложен прочный фундамент для клинического применения. Для того чтобы продлить период полураспада белковых лекарственных препаратов в последние годы исследователи, в основном, проводили исследования с точки зрения аспектов, таких как слияние с альбумином, химическая модификация, микрокапсуляция, конструирование мутантов и гликозилирование. По мере развития исследований, появляются новые разновидности белковых лекарственных препаратов длительного действия.
Технология слияния генов соединяет различные гены, для экспрессии слитого белка со сложными функциями. С помощью технологии слияния генов молекулярные массы пептидных и белковых лекарственных средств увеличиваются или сродство между лекарственным средством и рецептором изменяется таким образом, чтобы продлить период полураспада лекарственных средств. Принцип построения слитого белка является следующим: удаление стоп-кодона кодирующего гена белка, а затем присоединение кодирующего гена другого белка со стоп-кодоном так, чтобы реализовать слияние кодирующих генов двух белков для одновременной экспрессии двух белков. Ген слитого белка обладает высокой стабильностью и может регулироваться и экспрессироваться, его продукт однороден, воздействия на активность белковых и пептидных лекарственных средств малы, и т.д., что обычно обеспечивает подходящий метод для изучения пролонгированного действия пептидных и белковых лекарственных средств.
Традиционно широко изученные слитые гены являются генами сывороточного альбумина человека, генами иммуноглобулина человека (IgG4, IgG1) и т.д. Сывороточный альбумин человека (HSA для краткости) представляет собой белок в плазме крови человека, его не-гликозилированный одноцепочечный полипептид содержит 585 аминокислот, а молекулярная масса составляет 66 кДа. Концентрация HSA в плазме составляет 42 г/л, что составляет приблизительно 60% от общего количества белков плазмы. Человеческий сывороточный альбумин в жидкостях организма, способен транспортировать жирные кислоты, желчные пигменты, аминокислоты, стероидные гормоны, ионы металлов, различные терапевтические молекулы и т.д.; в то время как поддерживается нормальное кровяное давление. Клинически, сывороточный альбумин человека применим для лечения шока и ожога, и может быть использован в качестве вспомогательного средства при потере крови, вызванной хирургическим вмешательством, несчастного случая или кровотечений; сывороточный альбумин человека также может быть использован в качестве компатибилизатора плазмы.
Человеческий иммуноглобулин (IgG) является наиболее распространенным белком в крови человека, период полураспада которого составляет 21 день. Сообщалось, что слияние Fc-фрагмента IgG и других белков может значительно увеличить биологическую активность и период полураспада других белков in vivo, где большинство исследователей выбирают Fc-фрагменты IgG1 и IgG4 в качестве объектов для слияния. Метод широко использовался в некоторых клинически важных клеточных факторах, и растворимых рецепторах, таких как sTNF-αR, LFA3, CTLA-4, IL-2 и IFN-α, со значительным успехом.
С учетом вышеизложенного уровня техники, настоящее изобретение использует технологию рекомбинации генов для слияния иммунорегуляторного белка ганодермы с альбумином сыворотки крови человека и Fc-фрагментом иммуноглобулина человека IgG, соответственно, с тем, чтобы сконструировать эукариотическую экспрессирующую систему. После экспрессии и очистки получают целевой белок, и проводят соответствующие исследования биологической активности и фармацевтические исследования для целевого белка. Результат показывает, что иммунорегуляторный белок ганодермы (LZ-8) значительно отличается от слитого белка HSA в фармацевтической и биологической активности, а также патологическим применением.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Задачей настоящего изобретения является предоставление слитого белка на основе рекомбинантного иммунорегуляторного белка ганодремы и сывороточного альбумина человека, и способа его получения, таким образом, чтобы изучить его применение в лечении заболеваний, таких как лейкопения, вызванная химиотерапией и противоопухолевыми препаратами.
Последовательность слитого белка: в соответствии с настоящим изобретением, слитый белок rLZ-8-HSA иммунорегуляторного белка ганодермы (LZ-8) и HSA состоит из иммунорегуляторного белка ганодермы и HSA; его аминокислотная последовательность представляет собой:
SDTALIFRLAWDVKKLSFDYTPNWGRGNPNNFIDTVTFPKVLTDKAYTYRVAVSGRNLGVKPSYAVESDGSQKVNFLEYNSGYGIADTNTIQVFVVDPDTNNDFIIAQWNGGGGSSMKWVTFISLLFLFSSAYSRGVFRRDAHKSEVAHRFKDLGEENFKALVLIAFAQYLQQCPFEDHVKLVNEVTEFAKTCVADESAENCDKSLHTLFGDKLCTVATLRETYGEMADCCAKQEPERNECFLQHKDDNPNLPRLVRPEVDVMCTAFHDNEETFLKKYLYEIARRHPYFYAPELLFFAKRYKAAFTECCQAADKAACLLPKLDELRDEGKASSAKQRLKCASLQKFGERAFKAWAVARLSQRFPKAEFAEVSKLVTDLTKVHTECCHGDLLECADDRADLAKYICENQDSISSKLKECCEKPLLEKSHCIAEVENDEMPADLPSLAADFVESKDVCKNYAEAKDVFLGMFLYEYARRHPDYSVVLLLRLAKTYETTLEKCCAAADPHECYAKVFDEFKPLVEEPQNLIKQNCELFEQLGEYKFQNALLVRYTKKVPQVSTPTLVEVSRNLGKVGSKCCKHPEAKRMPCAEDYLSVVLNQLCVLHEKTPVSDRVTKCCTESLVNRRPCFSALEVDETYVPKEFNAETFTFHADICTLSEKERQIKKQTALVELVKHKPKATKEQLKAVMDDFAAFVEKCCKADDKETCFAEEGKKLVAASQAALGL (SEQ ID NO:1), в которой аминокислотная последовательность связывающего пептида, соединяющего C-конец иммунорегуляторного белка ганодермы и человеческий сывороточный альбумин представляет собой GGGGSS.
В соответствии с настоящим изобретением, слитый белок rLZ-8-Fc1 иммунорегуляторного белка ганодермы (LZ-8) и Fc-фрагмента человеческого IgG1 состоит из иммунорегуляторного белка ганодермы и Fc-фрагмента IgG1; где его аминокислотная последовательность представляет собой:
RPSDTALIFRLAWDVKKLSFDYTPNWGRGNPNNFIDTVTFPKVLTDKAYTYRVAVSGRNLGVKPSYAVESDGSQKVNFLEYNSGYGIADTNTIQVFVVDPDTNNDFIIAQWNGGGGSSEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (SEQ ID NO.2), аминокислотная последовательность связывающего пептида, соединяющего C-конец иммунорегуляторного белка ганодермы и человеческий сывороточный альбумин представляет собой GGGGSS.
В соответствии с настоящим изобретением, слитый белок RLZ-8-Fc4 иммунорегуляторного белка ганодермы (LZ-8) и Fc-фрагмента человеческого IgG4 состоит из иммунорегуляторного белка ганодермы и Fc-фрагмента IgG4; где его аминокислотная последовательность представляет собой:
RPSDTALIFRLAWDVKKLSFDYTPNWGRGNPNNFIDTVTFPKVLTDKAYTYRVAVSGRNLGVKPSYAVESDGSQKVNFLEYNSGYGIADTNTIQVFVVDPDTNNDFIIAQWNGGGGSSYTQRFKDKAKLTAVTSANTAYMELSSLTNEDSAVYYCSIIYFDYADFIMDYWGQGTTVTVSTASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQXSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPSCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLXGKEYKCKVSXKGLPSSIEKTISXAXGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSXWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK (SEQ ID NO.3), аминокислотная последовательность связывающего пептида, соединяющего C-конец иммунорегуляторного белка ганодермы и человеческий сывороточный альбумин представляет собой GGGGSS.
Конструирование инженерных штаммов, а также экспрессия и очистка целевого белка являются такими, как указано далее: соответственно образование носителей нуклеотидных последовательностей слитого белка на основе LZ-8; использование технологии электротрансформации для получения клетки-хозяина с помощью Pichia pastoris как внеклеточной экспрессии слитого белка; где условия ферментации Pichia pastoris оптимизированы и показатель экспрессии слитого белка улучшен; очистка целевого продукта с помощью таких методов, как аффинная колоночная хроматография с «гравитационным элюированием», молекулярное сито, метод аффинной хроматографии с иммобилизованными хелатами металлов (IMAC), хроматография с гидрофобным взаимодействием (HIC), анионообменная хроматография, где степень чистоты различных полученных слитых белков составляет выше 99%, что предоставляет неочищенные лекарственные препараты для последующих фармакологических экспериментов.
Фармакологические эксперименты являются такими, как указано далее: использование различных слитых белков, в качестве контрастов rLZ-8 для экспериментов по активности, где путем применения метода ELISA результат теста показывает, что биологическая активность слитого белка rLZ-8-HSA выше, чем биологическая активность rLZ-8, который не является слитым, и существует значительная разница, которая является статистически значимой; однако биологические активности rLZ-8-Fc1 и rLZ-8-Fc4 ниже, чем показатель активности rLZ-8, который не является слитым, и существует значительная разница; используя различные слитые белки, в качестве контрастов rLZ-8 для экспериментов по периоду полураспада in vivo, в которых в соответствии с методом ELISA, периоды полураспада различных слитых белков in vivo все значительно повышаются приблизительно до 3 раз относительно периода полураспада rLZ-8; в то же время, используя различные слитые белки в качестве контрастов rLZ-8 для экспериментов по лечению лейкопении, и подсчета белых клеток крови с помощью анализатора клеток цельной крови животных, в которых результат теста показывает, что существует значительное различие между различными слитыми белками и rLZ-8 в лечении лейкопении; причем при одинаковой дозировке, слитый белок rLZ-8-HSA имеет наиболее короткий цикл для стимуляции роста лейкоцитов; и при одинаковом цикле лечения, слитый белок rLZ-8-HSA способствует большему росту белых кровяных клеток. Поэтому HSA больше подходит в качестве партнера слияния для rLZ-8, который способен существенно расширить возможности применения LZ-8 в лечении лейкопении. Согласно экспериментам по ингибированию роста клеток меланомы слитого белка rLZ-8-HSA, показано, что при одинаковой дозировке (в дозировке LZ-8), слитый белок rLZ-8-HSA эффективно ингибирует рост клеток меланомы, что значительно отличается от лечебного эффекта rLZ-8, который не является слитым. В то же время, в соответствии с предпочтительным вариантом осуществления слитого белка rLZ-8-HSA для ингибирования роста опухолевых клеток печени, можно видеть, что при одинаковом цикле лечения, показатель эффективности лечения слитого белка rLZ-8-HSA значительно улучшен, что является неожиданным для изобретателя. В соответствии с настоящим изобретением, предпочтительный вариант слитого белка rLZ-8-HSA для лечения тромбоцитопении также предоставляется. Соответственно, по сравнению с модельной группой, лекарственный препарат rLZ-8-HSA значительно стимулирует пролиферацию тромбоцитов мыши в начале кормления, где разность является чрезвычайно важной. В середине срока кормления, его эффект возвращается к нормальному уровню. Достаточный эффект также наблюдается при лечении экспериментальных животных моделей с тромбоцитопенией, вызванной инъекцией антитромбоцитарной сыворотки.
Благоприятные эффекты настоящего изобретения заключаются в следующем. В соответствии с настоящим изобретением, период полураспада in vivo предложенного слитого белка значительно увеличивается по сравнению с rLZ-8. Слитый белок, сконструированный с помощью технологии слияния генов, будет иметь сниженную биологическую активность целевого белка после того, как получится слитый белок. Однако, в соответствии с настоящим изобретением, биологическая активность слитого белка rLZ-8-HSA, как было экспериментально доказано, является значительно лучше, чем биологическая активность rLZ-8, который не является слитым. К тому же, в соответствии с настоящим изобретением, ферментация слитого белка rLZ-8-HSA с использованием инженерного штамма Pichia pastoris проста в технике исполнения, имеет высокий выход, единственный продукт экспрессии, и не требует усилий в очистке, что обеспечивает благоприятные условия для промышленного производства. Существуют проблемы, такие как продукт экспрессии легко разлагается в процессе ферментации из-за экспрессирующей системы Pichia pastoris. Таким образом, настоящее изобретение контролирует условия ферментации, для значительного уменьшения разложения целевых продуктов в процессе ферментативной экспрессии Pichia pastoris, и повышения выхода. С помощью экспериментов in vivo, настоящее изобретение доказывает, что по сравнению с rLZ-8, который не является слитым, период полураспада in vivo значительно продлевается, в то время как самые низкие дозировки и время начала болезни в изучении лечения лейкопении также улучшены. Меланома и опухоль печени исследованы в качестве примеров противоопухолевого действия, и представлены эксперименты in vivo и in vitro, соответственно. В соответствии с предпочтительными вариантами осуществления меланомы и опухоли печени, терапевтические эффекты в двух экспериментальных методах являются значительно более высокими, чем от rLZ-8, который не является слитым, что является неожиданным для изобретателя. В соответствии с предпочтительным вариантом лечения тромбоцитопении, по сравнению с модельной группой, препарат rLZ-8-HSA значительно стимулирует пролиферацию тромбоцитов мыши в начале кормления, где разность является чрезвычайно важной. В середине срока кормления, его эффект возвращается к нормальному уровню, который является обычно лучшим эффектом слитого белка rLZ-8.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
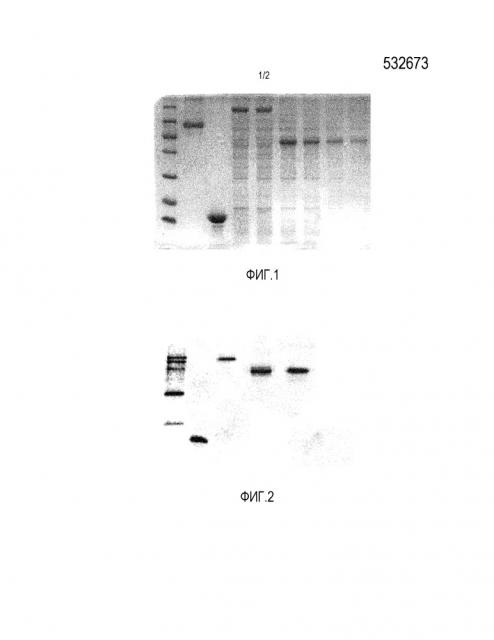
Фиг. 1 иллюстрирует индуцирование экспрессии различных слитых белков в 66 ч и 72 ч; где образец дорожки 1 представляет собой белковый маркер; образец дорожки 2 представляет собой стандартный HSA; образец дорожки 3 представляет собой rLZ-8; образец дорожки 4 представляет собой надосадочную жидкость rLZ-8-HSA после индуцирования в течение 72 ч; образец дорожки 5 представляет собой надосадочную жидкость rLZ-8-HSA после индуцирования в течение 66 ч; образец дорожки 6 представляет собой надосадочную жидкость rLZ-8-Fc1 после индуцирования в течение 72 ч; образец дорожки 7 представляет собой надосадочную жидкость rLZ-8-Fc1 после индуцирования в течение 66 ч; образец дорожки 8 представляет собой надосадочную жидкость rLZ-8-Fc4 после индуцирования в течение 72 ч; образец дорожки 9 представляет собой надосадочную жидкость rLZ-8-Fc4 после индуцирования в течение 66 ч.
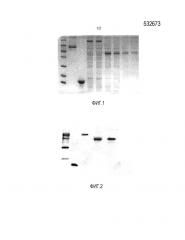
Фиг. 2 представляет собой Вестерн-блоттинг идентифицирующую карту различных слитых белков;
где образец дорожки 1 представляет собой белковый маркер; образец дорожки 2 представляет собой rLZ-8; образец дорожки 3 представляет собой rLZ-8-HSA; образец дорожки 4 представляет собой rLZ-8-Fc1; образец дорожки 5 представляет собой rLZ-8-Fc4.
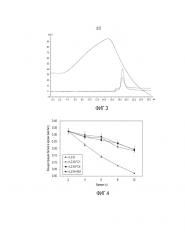
Фиг. 3 представляет собой хроматографическую карту слитого белка rLZ-8-HSA после очистки с помощью молекулярного сита.
Фиг.4 иллюстрирует сравнения периодов полураспада in vivo различных слитых белков и rLZ-8.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНОГО ВАРИАНТА ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Предпочтительный вариант осуществления 1: конструирование и экспрессия инженерных штаммов слитого белка rLZ-8
Конструирование: последовательности целевых фрагментов rLZ8-HSA, rLZ8-Fc1 и rLZ8-Fc4 соответственно синтезируют в соответствии с предпочтительным использованием дрожжевых кодонов, и хранят в плазмиде puc57; конструируют праймер, содержащий маскированные сайты рестрикционного фермента StuI и KpnI; праймер синтезируют следующим образом:
| (1) LZ-8-HSA: | 5' CATAGGCCTTCTGATACTGCTTTGA 3' |
| 5' CGGGGTACCGAATTCCTATTACA 3' | |
| (2) LZ-8-Fc1: | 5' GTTAGGCCTTCTGATACTGCTTTGA 3' |
| 5' TAGGGTACCTCATTTACCAGGGG 3' | |
| (3) LZ-8-Fc4: | 5' CCGAGGCCTTCTGATACTGCTT 3' |
| 5' GATGGTACCTCACGGAGCATGAG 3' |
Получение целевых фрагментов посредством ПЦР, где условия для ПЦР представляют собой: во-первых, 95°С в течение 30 сек; затем 95°С в течение 30 сек, 58°С в течение 30 сек и 72°С в течение 2 мин, при этом вышеуказанные процессы повторяют 30 раз; и, наконец, 72°С в течение 10 мин, и поддерживание при 16°С.
Идентификация с помощью электрофореза в 1% агарозном геле, что фрагменты, соответственно, на 2184bp (LZ-8-HSA), 1064bp (LZ-8-Fc1) и 774bp (LZ-8-Fc4); обработка носителя pPICZa и целевых фрагментов согласно иллюстративному материалу набора для «бесшовного» клонирования и сборки GENEART (Seamless Cloning and Assembly Kit), где молярное соотношение носителя и фрагментов составляет 1:3, где носитель и фрагменты взаимодействуют 5× с буфером и 10× со смесью ферментов в течение 30 минут; превращение 10 мкл продукта присоединения в компетентную кишечную бактерию DH5 альфа; после культивирования при 37°С в течение 30 мин, нанесение продукта присоединения на планшет LB с устойчивостью к блеомицину; выбор одной бактериальной колонии для культивирования при 37°С и встряхивании в течение ночи; центрифугирование бактериальной жидкости при 12000g, и удаление надосадочной жидкости; извлечение рекомбинантной плазмиды с использованием набора для экстракции малых плазмид и анализ ее последовательности; использование двойного ферментативного переваривания и электрофореза, чтобы идентифицировать, верен ли преобразователь; и, наконец, использование праймеров 5'AOX и 3'AOX для проверки правильности последовательности.
Линеаризация рекомбинантной плазмиды с помощью фермента SacI при 37°С в течение приблизительно 1 ч; добавление 33 раза Pichia pastoris для инокулирования в YPD при 30°С, и культивирование с использованием шейкера при 300 об/мин. в течение ночи; увеличение до 500 мл; когда OD600 достигает приблизительно 1,3, получение компетентных дрожжей; выдерживание в ледяной бане в течение 30 минут и ресуспендирование с помощью стерилизованной воды, охлажденной в ледяной бане; центрифугирование при 1500g и температуре 4°С в течение 5 минут, и разделение по 80 мкл компетентных дрожжей на пробирку; добавление 10 мгк линеаризованной плазмиды; выдерживание в ледяной бане в течение 5 мин; перенос в электротрансформирующее устройство и проведение электротрансформации при 1,5 кВ, 50 мкФ, 25 мА; шейкер-культивирование при 30°С в течение 2 ч, нанесение на планшет YPDS с устойчивостью к блеомицину зеоцину, и культивирование при 30°С в течение 3-х дней.
Скрининг: в асептических условиях, отбор 20 моно-клонов каждого слитого белка на планшете YPDS с устойчивостью к блеомицину зеоцину и помещение в 10 мл жидкой культуральной основы YPD для культивирования при 30°C с использованием встряхиваемой колбы при 300 об/мин в течение 12 ч; центрифугирование при 1500g в течение 5 мин и удаление надосадочной жидкости; перемещение в культуральную основу BMGY для культивирования при 30°С с использованием встряхиваемой колбы при 300 об/мин в течение 18 ч; центрифугирование при 1500g в течение 5 мин и удаление надосадочной жидкости; перемещение в культуральную основу BMGY (с 1% метанола) и при добавление 1% метанола один раз в 24 ч; обеспечение индуцирования экспрессии в течение 72 ч; центрифугирование при 1500g в течение 5 мин, и сохранение надосадочной жидкости при -20°С; количественное и качественное описание экспрессии целевых белков посредством SDS-электрофореза и идентификация Вестерн-блоттингом, с тем, чтобы отобрать инженерные штаммы с экспрессией на высоком уровне.
Предпочтительный вариант осуществления 2: способы очистки слитых белков
Так как слитый белок имеет общую структуру LZ-8, способы очистки, такие как аффинная колоночная хроматография с «гравитационным элюированием», молекулярное сито, метод аффинной хроматографии с иммобилизованными хелатами металлов (IMAC), хроматография с гидрофобным взаимодействием (HIC), анионообменная хроматография исследованы в соответствии с характеристиками структуры, где конкретные методы такие как указано далее.
Способы очистки rLZ-8-Fc1 и rLZ-8-Fc4 заключаются в следующем.
Микрофильтрация: центрифугирование ферментационной жидкости при 10000 об/мин для получения надосадочной жидкости, затем очистка (микро-фильтрация) с помощью колонки с полыми волокнами с диаметром отверстий 100 Кд, с тем, чтобы удалить низкомолекулярные соли и сахара, для получения 8 л желтой прозрачной жидкости, содержащей пигмент, нуклеиновые кислоты и белки.
Аффинная колоночная хроматография с «гравитационным элюированием» rProtein Gravitrap: приготовление буферного раствора фазы A: 0,22 M фосфатный буферный раствор, рН 7,7, и 0,15 М хлорид натрия; приготовление буферного раствора фазы B: 0,1 М цитратный буферный раствор, рН 4,0, 0,22 мкм вакуумная фильтрация, дегазация ультразвуком; уравновешивание хроматографической колонки с помощью фосфатного буферного раствора фазы A, где его объем составляет 10 мл; соответственно отбор образца 10 мл предварительно обработанной rLZ-8-Fc1 и rLZ-8-Fc4 ферментативной жидкости и смешивание два раза; (обработка образца: 90 мл ферментативной жидкости и 10 мл 10× фосфатного буферного раствора, 0,22 мкм фильтрация и стерилизованное хранение), промывание хроматографической колонки с помощью фосфатного буферного раствора фазы A, элюирование без смешивания; промывание элюированного образца цитратным буферным раствором фазы B, где его объем составляет 10 мл; ожидание в течение 2 мин, и удаление 1 мл объема в хроматографической колонке; получение образцов с помощью 1,5 мл трубки для центрифугирования, и хранение для анализа; регенерация хроматографической колонки после использования в течение 5 раз, добавление 5 мл 6 М гуанидина гидрохлорида, ожидание в течение 2 мин и промывание хроматографической колонки с помощью фазы А.
Хроматография на молекулярных ситах: использование колонки с наполнителем Superdex 75 (GE, XK16/70, где ее внутренний диаметр 16 мм, высота ее составляет 70 см), где высота наполнения составляет 60 см; анализ с помощью 100 мкл 1%-ного ацетона, где эффективность колонки составляет приблизительно 10000 согласно результату; отбор пробы белка со скоростью потока 2 мг/мл и концентрацией 5 мл, затем элюирование с помощью буферного раствора NaH2PO4-Na2HPO4 (50 мм) с рН 7,5 (показан на фиг.3.); отбор пробы в пике сбора, и проведение электрофореза и анализов ВЭЖХ.
Результаты: после тонкой очистки, чистота белка составляет выше 99% в соответствии с анализом ВЭЖХ, электрофорез SDS-PAGE имеет одну полосу.
Способ очистки rLZ-8-HSA включает стадии:
стадия (1): очистка rLZ-8-HSA с помощью метода аффинной хроматографии с иммобилизованными хелатами металлов (IMAC), где наполнитель IMAC Sepharose 6Fast Flow 1 приобретают у GE; наполнение колонки XK50/30 с высотой наполнения 15 см; замена жидкости для хранения чистой водой; прохождение 0,1 М раствора сульфата меди через хроматографическую колонку, где объем сульфата меди равен объему колонки и вымывание ионов меди, которые не адсорбируются очищенной водой, где объем очищенной воды равен четырем объемам колонки; затем уравновешивание хроматографической колонки с использованием буферного раствора А: 20 ммоль/л фосфат, 0,6 моль/л хлорид натрия и рН 7,3, где надосадочную жидкость, содержащую человеческий сывороточный альбумин, добавляют в фосфат и хлорид натрия для получения 20 ммоль/л фосфата, 0,6 моль/л хлорида натрия, и рН 7,3; затем отбор пробы с помощью хроматографической системы AKTA™ Purify со скоростью потока 50 мл/мин; после отбора пробы, промывка с использованием буферного раствора A, пока степень поглощения не достигнет основной точки; элюирование целевого белка с помощью буферного раствора B: 20 ммоль/л фосфат, 0,6 моль/л хлорид натрия, 0,3 М иминазол и рН 7,5; сбор пика элюирования буферного раствора B;
стадия (2): очистка с помощью хроматографии с гидрофобным взаимодействием (HIC), где пик элюирования буферного раствора В собранный на стадии (1) очищают с помощью хроматографии с гидрофобным взаимодействием; наполнение хроматографической колонки, имеющей диаметр 5 см с использованием фенильной гидрофобной среды для хроматографии Phenyl Sepharose™ 6Fast Flow (высокозамещенной) (от GE), где высота колонки составляет 15 см; где перед использованием, среда уравновешивается с помощью буферного раствора C: 50 ммоль/л фосфат, 0,5 М хлорид натрия, и рН 6,5, и объем буферного раствора C составляет 3 объема колонки; добавление деионизированной воды в буферный раствор B, содержащий целевой белок, который получают на стадии (1), разведение до концентрации 0,5 М NaCl, и доведение значения рН до 6,5 с помощью фосфорной кислоты; отбор проб с использованием хроматографической системы AKTA™ Purify со скоростью потока 50 мл/мин; после отбора проб элюирование с использованием буферного раствора C: 50 ммоль/л фосфат, 0,5 М раствор хлорида натрия и рН 6,5, где объем буферного раствора C составляет 2 объема колонки; сбор элюата пика и элюирование пика с помощью буферного раствора C; элюирование смешанной части с помощью хроматографии с гидрофобным взаимодействием с использованием деионизированной водой, имеющей объем равный двум объемам колонки и слив жидкости элюата; добавление собранной жидкости из гидрофобной хроматографической колонки в тетраборат натрия и раствор хлорида кальция с конечной концентрацией 0,1 М, доведение рН до 9,0 и обработка в течение 0,5-24 ч, затем центрифугирование при 10000 об/мин в течение 20 мин, сбор надосадочной жидкости, и обессоливание с помощью ультрафильтрационной мембраны MILLIPORE 10K; и
стадия (3): доочистка образца с помощью анионообменной хроматографии, загрузка наполнителя Q Sepharose™ High Preformance в хроматографическую колонку с диаметром 2,6 см и высотой 15 см, где объем наполнения составляет 80 мл; промывка с помощью деионизированной воды, где ее объем составляет два объема колонки; затем уравновешивание с использованием буферного раствора E (50 мМpb, рН 7,0), имеющего объем, равный пяти объемам колонки; после отбора проб, промывка буферным раствором E, где его объем составляет два объема колонки; затем элюирование с помощью 0-0,5M NaCl с градиентом, составляющим 10 объемов колонки, и сбор основного пика.
Результаты: после тонкой очистки, чистота белка выше 99% в соответствии с анализом ВЭЖХ, электрофорез SDS-PAGE имеет одну полосу.
Предпочтительный вариант осуществления 3: сравнение различных слитых белков по промотированию пролиферации клеток селезенки мыши
Анализ воздействий слитых белков на пролиферацию клеток селезенки мыши с помощью метода WST-1, который иллюстрирует силу биологической активности, где в соответствии с настоящим изобретением, используются самки мышей BALB/C, вес которых контролируется на 20-22 г; умерщвление мышей путем смещения их шейных позвонков, изъятие селезенок в стерильных условиях, и помещение в планшет с 5×106/мл DMEM, содержащей 10% сыворотки теленка; вскрытие селезенки с помощью пинцета, фильтрация суспензии ткани с помощью марли для удаления тканевых блоков, и получение клеточной суспензии из клеток селезенки; добавление 100 мкл суспензии ткани в 900 мкл 2% ледяной уксусной кислоты для подсчета с помощью микроскопа; доведение концентрации клеток до 5×106/мл с использованием DMEM, содержащей 2% сыворотки теленка; соответственно получение слитых белков и rLZ-8 с тем же градиентом молярной концентрации, где имеются 3 градиентных концентрации, каждая концентрация занимает 9 лунок со 100 мкл на лунку; добавление суспензии ткани с концентрацией 5×106/мл со 100 мкл на лунку; встряхивание для равномерного смешивания, а затем помещение в инкубационное устройство при 37°C, 5% CO2 для инкубирования в течение 24 ч; после инкубации, добавление WST-1 с 20 мкл на лунку; помещение в инкубационное устройство при 37°С, 5% СО2 для инкубирования в течение 3 часов, а затем анализ OD450 (с помощью BIO-RAD); где результаты представлены в таблице 1.
| Таблица 1Биологическая активность различных слитых белков по промотированию клеточной пролиферации (х±s n=9) | ||||
| БелокКонцентрация | rLZ-8 | rLZ-8-Fc1 | rLZ-8-Fc4 | rLZ-8-HSA |
| 5,0×10-9 моль/л | 0,739±0,23 | 0,543±0,26 | 0,452±0,43 | 0,936±0,31* |
| 10,0×10-9 моль/л | 1,197±0,31 | 0,937±0,29 | 0,840±0,27 | 1,680±0,38* |
| 15,0×10-9 моль/л | 1,567±0,27 | 1,114±0,31 | 0,929±0,21 | 2,373±0,35* |
| Примечание: сравнение с rLZ-8, *р<0,05 |
Что качается таблицы 1, с увеличением концентрации белка, воздействие слитых белков на пролиферацию клеток селезенки также увеличивается. При одной и той же концентрации белка, можно сделать вывод из сравнения воздействия на пролиферацию различных слитых белков и rLZ-8, что rLZ-8-HSA лучше, чем rLZ-8 в промотировании пролиферации клеток селезенки, и имеется существенное различие, которое является статистически значимым. Тем не менее, эффекты промотирования rLZ-8-Fc1 и rLZ-8-Fc4 на пролиферацию клеток селезенки мыши значительно уменьшаются. Согласно экспериментальным результатам, что активные точки не подвергаются воздействию при слиянии LZ-8 и HSA, в то время как после слияния LZ-8 и IgG-Fc1 или IgG-Fc4, активность белка уменьшается, что затрудняет активность LZ-8.
Предпочтительный вариант осуществления 4: анализ периодов полураспада различных слитых белков
Использование мышей BALB/C общим весом приблизительно 18-22 г в экспериментах, причем каждая группа состоит из 10 мышей; внутривенно вводят 100 г/кг (исходя из дозы LZ-8) слитого белка, соответственно отбирают пробы крови через 2, 4, 6, 8 и 10 ч после инъекции, рисуя кривую концентрации лекарственного лекарства в единицу времени (как показано на фиг. 4) с использованием полученных результатов, где показано результатами эксперимента, что период полураспада слитого белка значительно продлен (Р<0,0001) судя по rLZ-8, который не является слитым, концентрация его в крови значительно продлена, а период полураспада rLZ-8 у мышей увеличен.
Предпочтительный вариант осуществления 5: исследование слитого белка rLZ-8-HSA в лечении
Использование крыс Wistar в опытах, где используют 18 крыс весом приблизительно 100 г. Способ получения реагентов включает в себя этапы: растворения rLZ-8 в стерильном физиологическом растворе, и разбавления до получения групп дозировок 60 мкг/кг, 30 мкг/кг и 15 мкг/кг; растворения слитого белка rLZ-8-HSA в стерильном физиологическом растворе, и разбавления до получения групп дозировок 60 мкг/кг, 30 мкг/кг и 15 мкг/кг (исходя из дозы LZ-8); разбавления GenLei®Scimax® [инъекция рекомбинантного человеческого гранулоцитарного колониестимулирующего фактора (рчГ-КСФ)], номер партии: 20130403, 75 мкг/ампула, до получения 13,5 мкг/мл и 0,1 мл на крысу с помощью стерильного физиологического раствора; разбавления инъекции Циклофосфамида (CP), номер партии 13020225, 200 мг/ампула, до получения 20 мг/мл и 0,1 мл на крысу с помощью стерильного физиологического раствора, или 20 мг/кг.
Эксперимент имеет группу с низкой дозировкой rLZ-8, группу со средней дозировкой rLZ-8, группу c высокой дозировкой rLZ-8, группу c низкой дозировкой rLZ-8-HSA, группу со средней дозировкой rLZ-8-HSA, группу c высокой дозировкой rLZ-8-HSA, и группу с позитивным контролем с использованием лекарственного средства (использование GenLei®Scimax®). Крысам каждой группы вводили с помощью инъекции циклофосфамид в хвостовую вену в течение трех дней, за исключением того, что стерильный физиологический раствор вводят здоровой контрольной группе, дозировка составляет 20 мг/мл и 0,1 мл на крысу. На третий день отбирают кровь из хвостовой вены, и подсчитывают лейкоциты с помощью цитоанализатора. После успешного моделирования на крыс каждой группы соответственно воздействуют с помощью rLZ-8, трех видов слитых белков, или положительного лекарственного средства (GenLei®Scimax®) с соответствующей дозировкой, и такую же дозировку стерильного физиологического раствора вводят крысам здоровой контрольной группы и СР-группы. Кровь отбирают из хвостовой вены на первый, третий и седьмой дни лечения, и лейкоциты подсчитывают с использованием цитоанализатора. Медицинская эффективность анализируется согласно количественному различию между лейкоцитами до и после воздействия.
| Таблица 2Влияние rLZ-8 на модели крыс с лейкопенией (n=10) | ||||
| группа | количество лейкоцитов до | на первый день лечения | на третий день лечения | на седьмой день лечения |
| здоровая контрольная группа | 14,11×109/л | 14,36×109/л | 13,8×109/л | 12,13×109/л |
| CP-контрольная группа | 5,1×109/л | 5,3×109/л | 5,8×109/л | 9,27×109/л |
| GenLei®Scimax® | 4,55×109/л | 6,4×109/л | 11,83×109/л* | 11,17×109/л |
| rLZ-8(низкая дозировка) | 3,71×109/л | 4,6×109/л | 9,3×109/л* | 11,2×109/л |
| rLZ-8(средняя дозировка) | 3,12×109/л | 5,1×109/л | 9,7×109/л* | 12,78×109/л |
| rLZ-8(высокая дозировка) | 4,09×109/л | 5,4×109/л | 9,6×109/л* | 14,5×109/л |
| rLZ-8-HSA(низкая дозировка) | 3,11×109/л | 8,5×109/л* | 10,8×109/л** |