Локусы fad3 для выполнения операций и соответствующие связывающиеся со специфическими сайтами-мишенями белки, способные к вызову направленных разрывов
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу интегрирования представляющей интерес последовательности нуклеиновой кислоты в ген FAD3 в клетке. Кроме того, раскрыта сайт-специфическая нуклеаза на основе цинковых пальцев для применения в модификации гена FAD3. Изобретение позволяет осуществлять интегрирование представляющей интерес последовательности нуклеиновой кислоты в ген FAD3 с высокой эффективностью. 2 н. и 6 з.п. ф-лы, 20 табл., 24 ил., 9 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка притязает на приоритет предварительной заявки на патент США № 61/697854, поданной 7 сентября 2012, описание которой включено таким образом посредством ссылки в ее полном объеме, и предварительной заявки на патент США № 61/820260, поданной 7 мая 2013, описание которой включено таким образом посредством ссылки в ее полном объеме.
ОБЛАСТЬ ТЕХНИКИ
Настоящее описание относится в целом к композициям и способам для применения в технологии рекомбинантных растений (например, для создания трансгенных растений). Конкретнее, настоящее описание относится к клеткам растений и растениям, включающим локусы в своих геномах, которые могут использоваться для сайт-специфического введения любой представляющей интерес нуклеиновой кислоты.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Многие растения подвергают генетической трансформации с использованием экзогенных нуклеиновых кислот (например, трансгенов) для внесения желаемых признаков, например, для увеличения сельскохозяйственной ценности. Примеры увеличений сельскохозяйственной ценности, которые могут быть достигнуты посредством генетической трансформации, включают: увеличенную пищевую ценность, повышение урожайности, устойчивость к вредителям и болезням, устойчивость к засухе и стрессоустойчивость, улучшение плодоовощного качества (например, улучшение пигментации и/или роста), устойчивость к гербицидам, получение промышленно полезных соединений и/или материалов из растения и/или получение лекарственных средств. Введение клонированных генов в клетки растений и регенерация стабильных фертильных трансгенных растений могут использоваться для стабилизации генетической модификации растения на протяжении множества поколений и, тем самым, делают возможной генную инженерию культурного растения.
В способах генетической трансформации и получения трансгенных растений экзогенная ДНК, как правило, случайным образом вводится в ядерную или пластидную ДНК эукариотической клетки растения, с последующим выделением клеток, содержащих интегрированную экзогенную ДНК, и последующей регенерацией стабильно трансформированного растения. Трансгенные растения, как правило, создавали с помощью технологии трансформации с использованием Agrobacterium. Успехи, достигнутые с помощью этих способов, стимулировали развитие других методов введения представляющей интерес молекулы нуклеиновой кислоты интереса в геном растения, таких как ПЭГ-опосредованное внедрение ДНК в протопласты, бомбардировка микрочастицами и трансформация с использованием нитевидных кристаллов кремния.
Однако во всех этих способах трансформации растений экзогенные нуклеиновые кислоты, включаемые в геном растения, интегрируются случайным образом в геном клетки растения и в непредсказуемом числе копий. Terada et al. (2002) Nat Biotechnol 20 (10): 1030; Terada et al. (2007) Plant Physiol 144 (2): 846; D'Halluin et al. (2008) Plant Biotechnology J. 6 (1): 93. Например, трансгены часто интегрируются в виде повторов последовательности, либо всего трансгена, либо его частей. Такой сложный характер интеграции обычно оказывает отрицательное влияние на уровень экспрессии интегрированной нуклеиновой кислоты (например, в результате разрушения транскрибированной РНК через посттранскрипционные механизмы генного сайленсинга, или путем индукции метилирования интегрированной ДНК). Также расположение сайта интеграции обычно влияет на уровень экспрессии интегрированной нуклеиновой кислоты. Кроме того, интеграция экзогенной ДНК может оказывать разрушительный эффект на область генома, в которой происходит интеграция, и, таким образом, влиять или нарушить нормальное функционирование этой области-мишени с вызовом нежелательных побочных эффектов. Сочетание факторов, включая вышеуказанные, приводит к широкой вариации уровня экспрессии трансгена или экзогенной ДНК (и общей агрономической ценности) между различными трансгенными клетками растений и линиями растений, даже теми, которые созданы с помощью одних и тех же способов. Поскольку интеграция является случайной, эти эффекты не могут быть под контролем специалиста-практика, когда он или она пытается создать новое растение с желаемыми характеристиками.
Приведенные выше соображения делают неизбежным то, что, всякий раз, когда исследуются эффекты введения конкретной экзогенной нуклеиновой кислоты в растение, должно быть создано и проанализировано большое количество трансгенных линий растений с целью получения значимых результатов. Так же при создании трансгенного растения, содержащего конкретную интегрированную нуклеиновую кислоту, для обеспечения трансгенного растения с желаемым фенотипом большая популяция независимо созданных линий трансгенных растений должна быть создана, чтобы сделать возможным отбор линии растений с оптимальной экспрессией нуклеиновой кислоты, и с минимальными побочными эффектами на фенотип в целом и характеристики трансгенного растения или без этих эффектов. Эти практические соображения приобретают дополнительную важность в случае трансгенных растений, созданных в результате вставки множества экзогенных нуклеиновых кислот (т.е. стэкинга генов). В таких растениях, такие явления, как посттранскрипционный генный сайленсинг, могут быть усилены.
Было разработано несколько методов с целью контролирования введения трансгенов в растения. Смотрите, например, Kumar and Fladung (2001) Trends Plant Sci. 6: 155-159. Эти методы основаны на интеграции трансгенов на основе гомологичной рекомбинации, которая была успешно применена как в случае прокариот, так и в случае низших эукариот. Paszkowski et al. (1988) EMBO J. 7: 4021-6. Однако до недавнего времени, в случае растений, преобладающий механизм для интеграции трансгенов был основан на незаконной рекомбинации, которая предполагает небольшую гомологию между подвергающимися рекомбинации цепями ДНК. Следовательно, основной проблемой в этой области является обнаружение и избирательное порождение редких событий гомологичной рекомбинации, которые скрывают гораздо более эффективные события интеграции через незаконную рекомбинацию. Кроме того, даже если избирательное порождение и обнаружение событий направленной гомологичной рекомбинации достигается, событие должно быть направлено в желаемое место в геноме хозяина для получения максимальной выгоды от этой стратегии.
Например, предполагаемая выгода от направленной генетической трансформации заключается в уменьшении вариабельности экспрессии трансгена от события к событию, по сравнению с событиями трансформации, которые имеют место в результате неспецифической интеграции. Дополнительной предполагаемой выгодой является значительное снижение числа событий, необходимых для скрининга введенной нуклеиновой кислоты, сортировки конструкций для трансформации и порождения событий, которые вносят вклад в желательные общие характеристики у результирующего трансгенного растения. Критическим фактором, необходимым для получения этих выгод, является определение конкретных мест в геноме, в которых эффективность трансгена является стойкой, и, если возможно, в которых вредные эффекты на растение-хозяина устранены или сведены к минимуму.
Недавно были описаны способы и композиции для направленного расщепления геномной ДНК. Такие события направленного расщепления могут использоваться, например, для индукции направленного мутагенеза, для индукции направленных делеций клеточных последовательностей ДНК и содействия направленной рекомбинации и интеграции в заданный локус хромосомы. Смотрите, например, Urnov et al. (2010) Nature 435(7042): 646-51; публикации заявок на патенты США № 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20090263900; 20090117617; 20100047805; 20110207221; 20110301073; 2011089775; 20110239315; 20110145940 и публикацию международной заявки WO 2007/014275, описания которых включены посредством ссылки в их полном объеме для всех целей. Расщепление может происходить благодаря использованию специфических нуклеаз, таких как сконструированные нуклеазы на основе цинковых пальцев (ZFN), эффекторные нуклеазы вроде активаторов транскрипции (TALEN), или используя систему CRISPR/Cas вместе со сконструированной CRISPR РНК (РНК в виде коротких палиндромных повторов, регулярно расположенных группами)/трансактивирующей CRISPR РНК («единой направляющей РНК») для проведения специфического расщепления. В публикации заявки на патент США № 20080182332 описывается использование нуклеаз на основе неканонических цинковых пальцев (ZFN) для направленной модификации геномов растений; в публикации заявки на патент США № 20090205083 описывается ZFN-опосредованная направленная модификация локуса EPSPS у растений; в публикации заявки на патент США № 20100199389 описывается направленная модификация локуса Zp15 у растений, а в публикации заявки на патент США № 20110167521 описывается направленная модификация генов растений, участвующих в биосинтезе жирных кислот. Кроме того, в Moehle et al. (2007) Proc. Natl. Acad, Sci. USA 104(9): 3055-3060 описывается использование сконструированных ZFN для направленного добавления генов в конкретный локус. В публикации заявки на патент США № 20110041195 описываются способы получения гомозиготных диплоидных организмов.
Однако остается потребность в композициях и способах для модификации и/или модулирования экспрессии генов FAD3 у растений, в том числе создания растений с направленными вставками желаемых трансгенов в локус FAD3.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
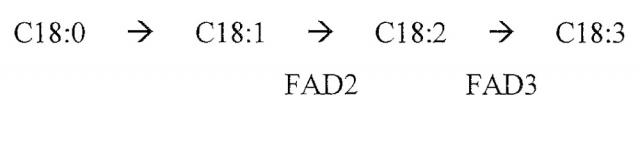
Настоящее изобретение описывает композиции и способы для модуляции экспрессии генов FAD3 (например, у растений, водорослей и грибов) и использование этих локусов в качестве сайтов для направленной интеграции, представляющей интерес последовательности нуклеиновой кислоты (например, экзогенной последовательности нуклеиновой кислоты) в клетку-хозяина. В некоторых вариантах осуществления клетка-хозяин может содержать один или более геномов с одной или более последовательностей FAD3 (например, гомеологов и/или паралогов), некоторые или все из которых могут быть избирательно модифицированы и/или разрушены. В конкретных примерах настоящее изобретение описывает гены FAD3A, FAD3A'', FAD3C' и/или FAD3C, а также соответствующие и или паралоги, в Brassica napus (т.е., В. napus линии DH12075) и их применение в качестве локусов для направленной интеграции представляющей интерес последовательности нуклеиновой кислоты. Как в настоящем документе описано, хотя гены FAD3 вовлечены в биосинтез жирных кислот в организме хозяина, их модификация или разрушение (например, в результате интеграции экзогенной нуклеиновой кислоты в кодирующую последовательность FAD3) неожиданно может не оказывать или оказывать минимальные неблагоприятные эффекты на получающийся в результате организм хозяина.
Также в настоящем документе описывается использование одного или более конкретных локусов FAD3 вместе с полипептидом, способным к осуществлению расщепления и/или интеграции специфических последовательностей нуклеиновых кислот в локусах(ы) FAD3. Примеры использования локусов FAD3 вместе с полипептидом, способным к осуществлению расщепления локусов FAD3 и/или интеграции в них, включают полипептид, выбираемый из группы, состоящей из белков с цинковыми пальцами, мегануклеаз, доменов TAL, TALEN, РНК-направляемой CRISPR-Cas9, рекомбиназ, «лейциновых молний, CRISPr/Cas и других полипептидов, известных специалистам в данной области техники. Конкретные примеры включают химерный («составной») белок, включающий полипептид в виде сайт-специфического ДНК-связывающего домена и полипептида в виде расщепляющего домена (например, нуклеазы), такой как белок ZFN, включающей полипептид «цинковые пальцы» и полипептид с нуклеазной активностью FokI. Например, в настоящем описании представлена демонстрация in vitro и in vivo эффективности и специфичности конкретных ZFN, предназначенных для связывания и вызова двухцепочечных разрывов в FAD3A, FAD3А', FAD3A'', FAD3C, FAD3C', FAD3C'' и в их комбинациях без расщепления соответствующих гомеологов или паралогов. В некоторых вариантах осуществления конкретные локусы FAD3 могут использоваться с любым из вышеуказанных полипептидов для осуществления сайт-специфической интеграции представляющей интерес нуклеиновой кислоты, которая впоследствии экспрессируется в хозяине, оказывая минимальное отрицательное влияние на агрономические характеристики хозяина.
В некоторых аспектах в настоящем документе описываются полипептиды, включающие ДНК-связывающий домен, который специфически связывается с геном FAD3. В некоторых вариантах осуществления такой полипептид может также включать нуклеазный (расщепляющий) домен или половину домена (например, ZFN, рекомбиназу, транспозазу или хоминг-нуклеазу, в том числе хоминг-нуклеазу с модифицированным ДНК-связывающим доменом, домены TAL, TALEN, РНК-направляемую CRISPR-Cas9), и/или лигазный домен, так что полипептид может вызывать направленный двухцепочечных разрыв и/или способствовать рекомбинации представляющей интерес нуклеиновой кислоты в месте разрыва. В конкретных вариантах осуществления ДНК-связывающий домен, который нацелен на локус FAD3, может быть функциональным ДНК-расщепляющим доменом. Вышеуказанные полипептиды могут использоваться в некоторых вариантах осуществления для введения экзогенной нуклеиновой кислоты в геном организма хозяина, демонстрирующего гомологичную рекомбинацию, (например, вида растения или животного) в один или более локусов FAD3. В некоторых вариантах осуществления ДНК-связывающие домены включают белок «цинковые пальцы» с одним или более цинковых пальцев (например, 2, 3, 4, 5, 6, 7, 8, 9 или более цинковых пальцев) и может, что является сконструированным (не встречающимся в природе), связываться с любой последовательностью в гене FAD3. Любой из белков «цинковые пальцы», описанных в настоящем документе, может связываться с сайтом-мишенью в кодирующей последовательности гена-мишени или в соседних последовательностях (например, промоторе или других экспрессионных элементах). В некоторых вариантах осуществления белок «цинковые пальцы» связывается с сайтом-мишенью в гене FAD3, например, представленном в таблице 4. Спиральные участки распознавания приводимых в качестве примера FAD3-связывающих цинковых пальцев приведены в таблице 3. Один или более компонентных связывающих доменов «цинковые пальцы» белка с цинковыми пальцами может быть каноническим (C2H2) цинковым пальцем или неканоническим (например, C3H) цинковым пальцем (например, N-концевой и/или C-концевой цинковый палец может быть неканоническим пальцем).
Также в настоящем документе описываются способы разрушения или редактирования гена FAD3. Кроме того, в настоящем документе описываются генетически модифицированные организмы-хозяева (например, трансгенные растения), полученные с помощью способов в соответствии с вариантами осуществления настоящего изобретения. В конкретных примерах трансгенный организм, полученный с помощью способа в соответствии с вариантом осуществления настоящего изобретения, может представлять собой, без ограничения, водоросли, гриб, однодольное растение, двудольное растение, и т.д.
Вышеизложенные и другие признаки станут более очевидными из нижеследующего подробного описания нескольких вариантов осуществления, которое выполнено со ссылкой на сопроводительные фигуры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фиг. 1, панелях А-Т, представлено совмещение последовательностей генов FAD3 (SEQ ID NO: 7-12), полученное с использованием AlignX®.
На фиг. 2 представлено филогенетическое древо последовательностей генов FAD3, построенное с использованием Jalview v 2.3 на основе расстояний между парами присоединяемых соседей. Отмеченные последовательности соответствуют следующему: FAD3A'/A'' описывается в данной заявке как FAD3A'; гаплотип 2 описывается в данной заявке как FAD3C'; гаплотип 1 описывается в данной заявке как FAD3C''; и гаплотип 3 описывается в данной заявке как FAD3A''.
На фиг. 3 представлена карта плазмиды pDAB107828.
На фиг. 4 представлена карта плазмиды pDAB107829.
На фиг. 5 представлена карта плазмиды pDAS000271.
На фиг. 6 представлена карта плазмиды pDAS000272.
На фиг. 7 представлена карта плазмиды pDAS000273.
На фиг. 8 представлена карта плазмиды pDAS000274.
На фиг. 9 представлена карта плазмиды pDAS000275.
На фиг. 10 представлена карта плазмиды pDAS000031.
На фиг. 11 представлена карта плазмиды pDAS000036.
На фиг. 12 представлена карта плазмиды pDAS000037.
На фиг. 13 представлена карта плазмиды pDAB107827.
На фиг. 14 представлена карта плазмиды pDAB107828.
На фиг. 15 представлена карта плазмиды pDAS000340.
На фиг. 16 представлена карта плазмиды pDAS000341.
На фиг. 17 представлена карта плазмиды pDAS000342.
На фиг. 18 представлена карта плазмиды pDAS000343.
Фиг. 19 является схемой, которая демонстрирует расположения праймеров и их положение относительно инициирующего кодона и стоп-кодона Fad3C. Панель А демонстрирует расположение мест праймеров в случае локуса Fad3C дикого типа. Панель В демонстрирует расположение мест праймеров для подтверждения интеграции донора, а также возможные ориентации, в которых донор мог бы интегрировать в локус Fad3C.
На фиг. 20, панелях А и В, представлены совмещения последовательностей после модификации с использованием указанных ZFN и плазмид-доноров. На фиг. 20А представлено совмещение последовательностей, амплифицированных из стыка tGFP-кассеты pDAS000341 с Fad3C в месте двухцепочечного разрыва, распознаваемом ZFN 8051-2A-28052. «» означает делеции, расположенные в сайтах расщепления. Представлено совмещение SEQ ID NO: 300 - SEQ ID NO: 313. На фиг. 20B представлено совмещение последовательности, амплифицированных из стыка tGFP-кассеты pDAS000343 с Fad3C в месте двухцепочечного разрыва, распознаваемом ZFN 28051-2A-28052 и ZFN 28053-2A-28054. «» означает делеции, расположенные в сайтах расщепления. Представлено совмещение SEQ ID NO: 314 - SEQ ID NO: 327.
На фиг. 21, панелях А и В, представлено совмещение последовательностей, амплифицированных из стыка hph-кассеты pDAS000340 с FAD3C в месте двухцепочечного разрыва, распознаваемом ZFN 28051-2А-28052. «Образец» представляет собой уникальный идентификатор для каждого растения, которое анализировали. «» означает делеции, расположенные в сайтах расщепления. Последовательности, представленные на фиг. 21А, предназначены для 5' стыка, а последовательности, представленные на фиг. 21В, предназначены для 3' стыка. В случае совмещения фиг. 21А представлены SEQ ID NO: 368 - SEQ ID NO: 375. В случае совмещения фиг. 21В представлены SEQ ID NO: 376 - SEQ ID NO: 377.
На фиг. 22 представлено совмещение последовательностей, амплифицированных из стыка hph-кассеты pDAS000342 с FAD3C в месте двухцепочечного разрыва, распознаваемом ZFN 28053-2A-28054. «Образец» представляет собой уникальный идентификатор для каждого растения, которое анализировали. «» означает делеции, расположенные в сайтах расщепления. Последовательности, представленные на фиг. 22, предназначены для 3' стыка. Представлено совмещение SEQ ID NO: 378 - SEQ ID NO: 379.
На фиг. 23, панелях А и В, представлено совмещение последовательностей, амплифицированных из стыка hph-кассеты pDAS000340 с FAD3C в месте двухцепочечного разрыва, распознаваемом ZFN 28051-2A-28052. «» означает делеции, расположенные в сайтах расщепления. Последовательности, представленные на фиг. 23А, предназначены для 5' стыка, а последовательности, представленные в блоке (В), предназначены для 3' стыка. В случае совмещения фиг. 23А представлены SEQ ID NO: 328 - SEQ ID NO: 334. В случае совмещения фиг. 23В представлены SEQ ID NO: 335 - SEQ ID NO: 342.
На фиг. 24, панелях А и В, представлено совмещение последовательностей, амплифицированных из стыка hph-кассеты pDAS000342 с FAD3C в месте двухцепочечного разрыва, распознаваемом ZFN 28053-2A-28054. «» означает делеции, расположенные в сайтах расщепления. Последовательности, представленные на фиг. 24А, предназначены для 5' стыка, а последовательности, представленные на фиг. 24В, предназначены для 3' стыка. В случае совмещения фиг. 24А представлены SEQ ID NO: 343 - SEQ ID NO: 346. В случае совмещения фиг. 24В представлены SEQ ID NO: 347 - SEQ ID NO: 351.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Последовательности нуклеиновых кислот представлены, используя стандартные однобуквенные сокращения для нуклеотидных оснований, как определено в § 1822 37 CFR. Представлена только одна цепь каждой последовательности нуклеиновой кислоты, но комплементарная цепь, как подразумевается, включена при любой ссылке на представленную цепь.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
I. Обзор некоторых вариантов осуществления
Варианты осуществления настоящего изобретения создают подход к направленной интеграции экзогенных нуклеиновых кислот (например, трансгенов) в геном хозяина без оказания сильного неблагоприятного влияния на другие фенотипы хозяина за пределами тех, на которые оказывает влияние интегрированная нуклеиновая кислота. Некоторые варианты осуществления могут использоваться для «стэкинга» множества нуклеиновых кислот в одном геноме хозяина. При таком подходе используется развитие и развертывание четырех взаимосвязанных технологий: технологий таргетинга, позволяющих вводить двухцепочечные разрывы в определенные места в геномной ДНК (смотрите, например, Puchta et al. (1993) Nucleic Acids Res. 21: 5034-40; Sieber and Puchta (2002) Plant Cell 14: 1121-31; D'Halluin et al. (2008) Plant Biotechnol. J. 6 (1): 93-102; Cai et al. (2009) Plant Mol. Biol. 69 (6): 699-709; Shukla et al. (2009) Nature 459 (7245): 437-41); Shan et al. (2103) Nature Biotechnol. 31: 686-680; Le et al. (2013) Nature Biotechnol 31: 688-691; Nekrasov et al. (2013) Nature Biotechnol. 31: 691-693, Ainely et al. (2013) Plant Biotechnol. J. (On Line 19 Aug.); технологий доставки, позволяющих доставлять оптимизированную экзогенную (донорную) нуклеиновую кислоту (Bibikova et al. (2003) Science 300 (5620): 764); технологий интеграции, включающих модификацию генов хозяина (в месте или гомологичной рекомбинации, или путей NHEJ) для увеличения частот HDR или NHEJ для направленной интеграции донорной ДНК; аналитических средств для обогащения и характеристики событий направленной интеграции; и конкретных желаемых положений в геноме хозяина («локусов для выполнения операций»), которые являются генетически хорошо определенными и которые поддерживают стабильную экспрессию гена из поколения в поколение без значительного неблагоприятного влияния на трансформированный организм хозяина. Смотрите также публикации патентов США № 20030232410; 20050208489; 20050026157; 20050064474; 20060188987; 20090263900; 20090117617; 20100047805; 20110207221; 20110301073; 2011089775; 20110239315; 20110145940; 20080182332; 20090205083; 20100199389; 0110167521. Например, в растениях, локусом для выполнения операций является локус, в котором отрицательное влияние на агрономические или связанные с качеством свойства трансгенного растения, в локус которого был вставлен трансген, является незначительным или вообще отсутствует.
В описанных в настоящем документе вариантах осуществления используется неожиданное открытие того, что гены FAD3 растений являются локусами для выполнения операций - направленной вставки экзогенных нуклеиновых кислот (например, гена(ов), некодирующих последовательностей ДНК, таких как сконструированные посадочные площадки (ELP) (заявка на патент США 12/011735) и сконструированная платформа для вставки трансгенов (ETIP) (находящаяся на рассмотрении заявка на патент США № 61/697882) и блок(ы) для трансформации растений). Повсеместный характер локусов FAD3 в растениях и факты, что изменение или нокаут FAD3 в каноле, кукурузе, подсолнечнике, пшенице, хлопчатнике и сое не влечет за собой агрономического или связанного с качеством ухудшения, определяет локусы FAD3 как широкий класс локусов для выполнения операций во всех коммерчески соответствующих видах растений.
В некоторых вариантах осуществления используется сайт-специфический двухцепочечный разрыв ДНК в локусе FAD3, например, в результате доставки и экспрессии специфического в отношении сайта-мишени ДНК-распознающего и расщепляющего белка. В конкретных примерах таким FAD3-специфическим ДНК-распознающим и расщепляющим белком может быть, например, и без ограничения, ZFN; TALEN; РНК-направляемая система CRISPR-Cas9, рекомбиназа (например, Cre, Hin, RecA, Tre и рекомбиназы FLP); мегануклеаза и сконструированный белок, происходящих из любого из указанных выше белков или их эквивалентов. Расщепление может также осуществляться с помощью системы CRISPR/CAS со сконструированной CRISPR РНК/трансактивирующей CRISPR РНК («единой направляющей РНК») для проведения специфического расщепления. В некоторых вариантах осуществления такой двухцепочечный разрыв может быть подвергнут репарации через интеграцию донорной нуклеиновой кислоты в сайт расщепления внутри локуса FAD3 для выполнения операций, например, с помощью репарации с использованием гомологичной ДНК (HDR) или негомологичного соединения концов (NHEJ).
Настоящее изобретение иллюстрирует применимость локусов FAD3 в качестве локусов для выполнения операций, например, с помощью описания локуса FAD3A или 3C в каноле (Brassica napus) и соответствующих FAD3-специфических ZFN, которые могут использоваться для интеграции экзогенной нуклеиновой кислоты в локус FAD3A или 3C.
Варианты осуществления настоящего изобретения решают многие нерешенные проблемы в данной области техники. Например, избирательность способа направленной интеграции, описанного в настоящем документе, может уменьшить или устранить необходимость повторных полевых испытаний, необходимых для устранения нежелательных трансгенных случаев, которые являются дорогостоящими из-за вовлеченных средств и обременительных нормативных требований в этой области. Кроме того, способы направленной вставки ДНК, описываемые в настоящем документе, могут быть особенно полезны в процессе стэкинга трансгенов.
Хотя природная нуклеотидная последовательность в эндогенном локусе FAD3 может быть использована, чтобы непосредственно направить представляющую интерес нуклеиновую кислоту, в некоторых вариантах осуществления нуклеиновая кислота может быть сначала направлена в по меньшей мере один локус FAD3 хозяина, чтобы облегчалась интеграция дальнейших молекул нуклеиновых кислот, представляющих интерес, в геном хозяина. В других примерах могут использоваться нуклеотидные последовательности, не гомологичные природным последовательностям организма хозяина (например, по существу случайным образом сконструированные последовательности нуклеиновых кислот), которые фланкируют сайт распознавания ДНК (например, сайты распознавания цинковых пальцев).
II. Термины
При использовании в этой заявке, включая формулу изобретения, термины в единственном числе и формы единственного числа, «a», «an» и «the», например, включают ссылки на множественное число, если из содержания явно не следует иное. Таким образом, например, ссылка на «plant», «the plant» или «a plant» также относится к множеству растений. Кроме того, в зависимости от контекста, использование термина «plant» может также относиться к генетически сходным или идентичным потомкам этого растения. Аналогичным образом, термин «nucleic acid» может относиться к множеству копий молекулы нуклеиновой кислоты. Аналогично, термин «probe» может относиться к множеству схожих или идентичных молекул зонда.
Числовые диапазоны включают числа, определяющие диапазон, и определенно включают каждое целое число и не являющуюся целым числом дробь в пределах заданного диапазона. Кроме особо оговоренных случаев, все технические и научные термины, используемые в настоящем описании, имеют значение, одинаковое со значением, в котором их обычно понимает специалист со средним уровнем компетентности в данной области техники.
Для облегчения обзора различных вариантов осуществления, описанных в этом описании, дается следующее объяснение специфических терминов:
Выделенный: «Выделенный» биологический компонент (например, нуклеиновая кислота или белок) был по существу отделен, получен отдельно от или очищен от других биологических компонентов в клетке организма, в котором компонент встречается в природе (т.е., другой хромосомной и экстрахромосомной ДНК и РНК, а также белков), при осуществлении химического или функционального изменения компонента (например, нуклеиновая кислота может быть выделена из хромосомы посредством разрыва химических связей, соединяющих нуклеиновую кислоту с оставшейся ДНК в хромосоме). Молекулы нуклеиновых кислот и белки, которые были «выделены», включают молекулы нуклеиновых кислот и белки, очищенные с помощью стандартных способов очистки. Этот термин также охватывает нуклеиновые кислоты и белки, полученные с помощью рекомбинантной экспрессии в клетке-хозяине, а также химически синтезированные молекулы нуклеиновых кислот, белки и пептиды.
Скрещивание: Используемый в настоящем описании в отношении растений термин «скрещивание» или «скрещенное» относится к слиянию половых клеток с помощью опыления для получения потомства (например, клеток, семян и растений). Этот термин охватывает как половые скрещивания (т.е. опыление одного растения другим), так и самоопыления (т.е. самоопыление, например, с помощью пыльцы и яйцеклетки из того же растения).
Возвратное скрещивание: Методы возрастного скрещивания могут использоваться для введения последовательности нуклеиновой кислоты в растение. Этот метод широко использовался в течение многих десятилетий, чтобы привнести новые признаки в растения. Jensen, N., Ed. Plant Breeding Methodology, John Wiley & Sons, Inc., 1988. В типичном протоколе возвратного скрещивания, исходный сорт, представляющий интерес, (рекуррентного родителя) скрещивают со вторым сортом (нерекуррентным родителем), который содержит представляющую интерес последовательность нуклеиновой кислоты, которая должна быть передана. Полученное в результате этого скрещивания потомство затем снова скрещивают с рекуррентным родителем, и процесс повторяют до тех пор, пока не будет получено растение, в котором, по существу, все желаемые морфологические и физиологические характеристики рекуррентного растения не будут восстановлены у преобразованного растения, в дополнение к переданной от нерекуррентного родителя последовательности нуклеиновой кислоты.
Интрогрессия: Используемый в настоящем описании термин «интрогрессия» относится к проникновению аллеля (или модифицированного аллеля, включающего экзогенную нуклеиновую кислоту) в генетический фон в определенный локус. В некоторых вариантах осуществления интрогрессия специфического аллеля в локус может происходить при передаче аллеля по меньшей мере одному потомку через половое скрещивание двух родителей одного и того же вида, причем по меньшей мере один из родителей имеет специфическую форму аллеля в своем геноме. Потомство, содержащее специфический аллель, можно повторно подвергнуть возвратному скрещиванию с линией, имеющей желаемый генетический фон. Полученное в результате возвратного скрещивания потомство можно подвергнуть скринингу в отношении специфической формы аллеля для получения нового сорта, в котором специфическая форма аллеля закреплена в генетическом фоне. В некоторых вариантах осуществления интрогрессия специфического аллеля может произойти в результате рекомбинации между двумя геномами-донорами (например, в слитом протопласте), причем по меньшей мере один из геномов-доноров содержит специфическую форму аллеля в своем геноме. Интрогрессия может включать проникновение специфической формы аллеля, которая может представлять собой, например, и без ограничения, разрушенный или модифицированный аллель; трансген; PTU и ELP.
Зародышевая плазма: Используемый в настоящем описании термин «зародышевая плазма» относится к генетическому материалу отдельного растения, группы растений (например, линии растений, сорта и семейства) и клона, происходящего от растения или группы растений. Зародышевая плазма может быть частью организма или клетки, или же она может быть отделена (например, выделена) из организма или клетки. В общем, зародышевая плазма обеспечивает генетический материал со специфическим молекулярным составом, который является основой для передаваемых по наследству качеств растения. Как в настоящем описании используется, «зародышевая плазма» относится к клеткам конкретного растения; семени; ткани конкретного растения (например, ткани, из которой могут быть выращены новые растения); и не являющимся семенами частям конкретного растения (например, листу, стеблю, пыльце и клеткам). Используемый в настоящем описании термин «зародышевая плазма» является синонимом термина «генетический материал», и он может использоваться для обозначения семени (или другого растительного материала), из которого может быть выращено растение. «Банк зародышевой плазмы» может относиться к организованной коллекции различных семян или другого генетического материала (в которой каждый генотип однозначно определен), из которого можно вырастить известный сорт, и на основе которого можно создать новый сорт.
Ген: Используемый в настоящем описании термин «ген» (или «генетический элемент») может относиться к передаваемой по наследству последовательности геномной ДНК, имеющей функциональную значимость. Геном может быть природная нуклеиновая кислота или нуклеиновая кислота, которая была интегрирована в геном. Термин «ген» может также использоваться для обозначения, например, и без ограничения, кДНК и/или мРНК, кодируемой передаваемой по наследству последовательностью геномной ДНК.
Молекула нуклеиновой кислоты: Используемый в настоящем описании термин «молекула нуклеиновой кислоты» может относиться к полимерной форме нуклеотидов (т.е. рибонуклеотидов, дезоксирибонуклеотидов и/или модифицированной форме любого из вышеуказанных). «Молекула нуклеиновой кислоты», как в настоящем описании используется, является синонимом термина «нуклеиновая кислота» и «полинуклеотид». Этот термин включает как смысловую, так и антисмысловую цепи РНК, кДНК, геномной ДНК и их синтетические формы и смешанные полимеры. Термин включает любую топологическую конформацию, в том числе одноцепочечную, двухцепочечную, отчасти дуплексную, триплексную, шпилечную, замкнутую в круг и запертую конформации. Молекула нуклеиновой кислоты может включать встречающиеся в природе или модифицированные нуклеотиды, или и те и другие. Такие нуклеотиды могут быть связаны друг с другом с помощью, встречающихся в природе и/или не встречающихся в природе нуклеотидных связей.
Молекулы нуклеиновых кислот могут быть химически или биохимически модифицированными или могут содержать дериватизированные нуклеотидные основания, как будет без труда понятно квалифицированным в данной области техники специалистам. Такие модификации включают, например, и без ограничения: метки; метилирование; замещение одного или более встречающихся в природе нуклеотидов аналогом и межнуклеотидные модификации (например, незаряженные связи, например, метилфосфонаты, фосфотриэфиры, фосфорамидаты и карбаматы; заряженные связи, например, фосфоротиоаты и фосфородитиоаты; боковые компоненты, например, пептиды; интеркаляторы, например, акридин и псорален; комплексоны; алкилаторы и модифицированные связи, например, альфа-аномерные нуклеиновые кислоты).
Экзогенная: «Экзогенной молекулой» является молекула, которая не присуща указанной системе (например, зародышевой плазме, сорту, элитному сорту и/или растению), что касается нуклеотидной последовательности и/или расположения в геноме (т.е. локуса) в случае полинуклеотида (и что касается аминокислотной последовательности и/или клеточной локализации в случае полипептида). В вариантах осуществления экзогенные или гетерологичные полинуклеотиды или полипептиды могут представлять собой молекулы, которые были искусственно поданы в биологическую систему (например, клетку растения, ген растения, конкретный вид или сорт растения и/или хромосому растения) и не присущи этой конкретной биологической системе. Таким образом, определение нуклеиновой кислоты «экзогенной» может означать, что нуклеиновая кислота произошла из источника, отличного от встречающегося в природе источника, или это может означать, что нуклеиновая кислота имеет неприродную конфигурацию, генетическую локализацию или расположение элементов.
В противоположность этому, например, «природная» или «эндогенная» нуклеиновая кислота представляет собой нуклеиновую кислоту (например, ген), которая не содержит элемент нуклеиновой кислоты, отличный от тех, которые обычно присутствуют в хромосоме или другом генетическом материале, в которой(ом) нуклеиновая кислота обычно встречается в природе. Транскрипт с эндогенного гена кодируется нуклеотидной последовательностью в ее природном хромосомном локусе, а не искусственно подается в клетку.
Функционально связанные: Первая последовательность нуклеиновой кисло