Вакцина рекомбинантная противотуберкулезная и адъювант для нее
Иллюстрации
Показать всеИзобретение относится к области биотехнологии. Предлагается вакцина рекомбинантная противотуберкулезная, содержащая первый антиген, представляющий собой очищенный рекомбинантный белок Ag85A микобактерии туберкулеза M. tuberculosis, второй антиген, представляющий собой гибридный рекомбинатный белок ESAT6-CFP10 микобактерии туберкулеза M. tuberculosis, и адъювант, включающий в себя первый водорастворимый высокомолекулярный полисахарид декстрана для иммобилизации белков Ag85A и ESAT6-CFP10 указанных антигенов, неметилированный CpG олигонуклеотид с фосфотиоатной связью, и второй водорастворимый высокомолекулярный полисахарид декстрана, отличный от первого водорастворимого высокомолекулярного полисахарида декстрана, для иммобилизации упомянутого CpG олигонуклеотида. Изобретение дает возможность выровнять кинетику взаимодействия отдельных компонентов вакцины с иммунокомпетентными клетками, что повышает эффективность как первичной, так и бустерной вакцинации с использованием предлагаемой вакцины. 2 н. и 10 з.п. ф-лы, 6 ил., 1 табл., 5 пр.
Реферат
Область использования изобретения
Изобретение относится к медицине, а конкретно к средствам для профилактики туберкулеза и поддержания иммунитета к туберкулезу у населения.
Предшествующий уровень
В настоящее время особенно актуальной является проблема поддержания у населения иммунитета к туберкулезу, поскольку иммунитет, сформированный при первичной вакцинации населения (которая выполняется с использованием вакцины БЦЖ (BCG) является протективным и к 20-25 годам практически исчезает. Известно, что БЦЖ защищает от генерализованных инфекций и практически не дает защиты легочной формы инфекции, наиболее распространенной среди больных туберкулезом. В совокупности это приводит к незащищенности населения, как от первичной инфекции, так и от реактивации латентного туберкулеза. При этом следует иметь в виду появление и широкое распространение в странах Юго-Восточной Азии, Китае, Индии и России штаммов Mycobacterium tuberculosis с широкой лекарственной устойчивостью. По оценкам не менее 50 млн. человек латентно инфицированы штаммами, обладающими множественной устойчивостью.
Противотуберкулезные вакцины должны удовлетворять следующим требованиям:
- вакцины должны вызывать стойкий специфический иммунитет;
- иметь минимум побочных эффектов
- быть приемлемыми по цене для повсеместного использования в то м числе в бедных и социально неблагополучных странах.
Наиболее перспективными являются рекомбинантные противотуберкулезные вакцины, использующие белки, полученные с применением генно-инженерных технологий, (рекомбинантные белки), микобактериальный белок Ag85A, микобактериальный белок ESAT6, гибридный белок ESAT6-CFP10, и адъюванты на основе декстранов. На основе этих соединений пытаются экспериментальным путем создать высокоэффективную противотуберкулезную вакцину, подобрав подходящую по составу композицию. Существенную роль играет выбор адъюванта, с помощью которого можно детерминировать развитие определенного вида иммунного ответа (гуморального или клеточно-опосредованного). Для протективного иммунитета против внутриклеточных патогенов, таких как М. tuberculosis, требуется клеточно-опосредованный иммунный ответ, и, следовательно, подходящий адъювант для рекомбинантной вакцины, направленной против туберкулеза, которая должна усиливать Т-клеточный ответ (CD4+) типа Следует отметить, что невозможно заранее предусмотреть, какие свойств будет иметь вакцина, включающая в себя те или иные антигены и специфический адъювант, и подобрать антигены и адъювант можно только путем длительных исследований.
В патенте РФ №2546875, C12N 15/00 от 10.04.2015 описана иммуногенная композиция на основе рекомбинантного белка CFP10 с молекулярной массой 27,3 кДа, слитого с декстрансвязующим доменом (DBD) (CFP-DBD). В качестве адъюванта использован декстрановый носитель. Декстрановый носитель обеспечивает укрупнение антигена и усиливает иммунный ответ на белковые моноантигены. Данная композиция показала, что можно создать иммуногенную композицию с этим антигеном, но в ней не рассматривается возможность повышения эффективности вакцины при введении в композицию второго белкового антигена, например рекомбинантного белка Ag85A и не предлагается способ выбора адъюванта для такой комбинированной вакцины.
В патенте РФ №2539026, C12N 15/00 от 10.01.2015 описана иммуногенная композиция на основе белка ESAT6-CFP10 с молекулярной массой 26,4 кДа, слитого с декстрансвязующим доменом (DBD) (ESAT6-CFP10-DBD). В качестве адъюванта использован декстрановый носитель. Декстрановый носитель обеспечивает укрупнение антигена и усиливает иммунный ответ на белковые моноантигены. Данная композиция показала, что можно создать иммуногенную композицию с этим антигеном, но в ней не рассматривается возможность повышения эффективности вакцины при введении в композицию второго белкового антигена, например рекомбинантного белка Ag85A, и не предлагается способ выбора адъюванта для такой комбинированной вакцины..
В патенте РФ №2520078, C12N 15/00 от 20.06.2014 описана иммуногенная композиция на основе рекомбинантного белка Ag85A молекулярной массой 48,5 кДа, слитого с декстрансвязующим доменом (DBD) (Ag85A-DBD). В качестве адъюванта использован декстрановый носитель. Декстрановый носитель обеспечивает укрупнение антигена и усиливает иммунный ответ на белковые моноантигены. Данная композиция показала, что можно создать иммуногенную композицию с этим антигеном, но в ней не рассматривается возможность повышения эффективности вакцины при введении в композицию второго белкового антигена, например рекомбинантного белка ESAT6-CFP10.
В патенте РФ №2479317, A61K 39/39 от 20.04.2013 описана иммуногенная композиция, включающая два антигена - рекомбинантный белок Ag85A-DBD и рекомбинантный белок ESAT6. Для получения адъюванта применяют синтетический мономиколилглицерин (MMG) на основе алкильных цепей с 8-36 атомами углерода. Наиболее предпочтительно использовать MMG с алкильной цепью из 8-16 атомов углерода. Адъювант с использованием MMG оказался достаточно универсальным при лечении воспалений дыхательных путей и других легочных заболеваний, но необходима иммуногенная композиция, которая будет включать в себя адъювант с более ярко выраженной эффективностью для противотуберкулезной вакцины.
Известна иммуногенная композиция, включающая два антигена - рекомбинантный белок Ag85A и рекомбинантный белок ESAT6-CFP10. В состав адъюванта в известной композиции входят BCG-CpG адъювант, адъювант с использованием соединений алюминия и PolyIC адъювант (полиинозиновая-полицитидиловая кислота), см. заявку CN 104027802 (А) по кл. A61K 39/04, 09.10.2014. Адъювант вакцины содержит несколько компонентов, что дало возможность уменьшить патологические изменения в организме при применении вакцины.
Известна кандидатная противотуберкулезная вакцина Hybrid 1 + IC31, разработанная институтом Statens Serum Institut (SSI) (Дания). Вакцина включает в себя антигены Ag85B и ESAT6 и адъювант IC31. Адъювант IC31, состоит из комбинации 11-мерного антибактериального пептида (KLKL(5)KLK) и синтетического олигодезоксинуклеотида (ODN1a), который является агонистом Toll-подобного рецептора 9 (TLR9) и при этом не содержит мотивов цитозинфосфата гуанина (CpG), являющихся природными лигандами рецептора TLR9. Подтверждено, что адъювант наиболее подходит для вакцин против гриппа и туберкулеза. См., например, публикацию druglib.com>abstract…dissel…vaccine_20100430.html
Несмотря на наличие достаточно большого количества разработок в области создания рекомбинантной вакцины против туберкулеза ни одна из них прошла полного цикла клинических испытаний и не была зарегистрирована в качестве готового продукта. Таким образом, в распоряжении врачей по-прежнему не имеется вакцины, кроме упомянутой БЦЖ. В этой связи, разработки новых вакцин продолжаются, так как необходима эффективная иммуногенная композиция, которая будет включать в себя антигены и адъювант, с более ярко выраженной иммуногенностью и протективностью.
Раскрытие изобретения
Задачей настоящего изобретения является расширение средств по поддержанию иммунитета организма против разных форм туберкулезной инфекции и, прежде всего, против легочной (аэрозольной) формы инфекции. Требуется разработка противотуберкулезной вакцины с повышенной иммуногенностью и протективностью, которая обеспечивает эффективную защиту за счет пролонгированного действия компонентов вакцины на иммунную систему организма путем подбора компонентов адъюванта и оптимального сочетания компонентов адъюванта и антигенов. Задачей изобретения является также разработка противотуберкулезной вакцины, которая одинаково успешно активизирует секрецию интерферона гамма (ИНФ-γ) (функции клеточного иммунитета) и выработку антител класса G к антигенам, входящим в состав вакцины. Еще одной задачей изобретения является разработка противотуберкулезной вакцины с минимальными побочными явлениями, в том числе с минимальным токсическим воздействием на организм.
Для решения указанных задач и достижения иных преимуществ предлагается вакцина рекомбинантная противотуберкулезная, содержащая первый антиген, представляющий собой очищенный рекомбинантный белок Ag85A микобактерии туберкулеза M. tuberculosis, второй антиген, представляющий собой гибридный рекомбинатный белок ESAT6-CFP10 микобактерии туберкулеза, включающий в себя очищенный микобактериальный белок ESAT6, слитый с очищенным микобактериальным белком CFP10, и адъювант, включающий в себя первый водорастворимый высокомолекулярный полисахарид декстрана для иммобилизации белков Ag85A и ESAT6-CFP10 указанных антигенов, неметилированный CpG олигонуклеотид с фосфотиоатной связью, являющийся лигандом рецептора системы врожденного иммунитета TLR9, и второй водорастворимый высокомолекулярный полисахарид декстрана, отличный от первого водорастворимого высокомолекулярного полисахарида декстрана, для иммобилизации упомянутого CpG олигонуклеотида.
Кроме того, в предлагаемой вакцине в качестве первого высокомолекулярного полисахарида декстрана можно использовать полисахарид декстрана с молекулярной массой 500000 Да для иммобилизации рекомбинантных белков Ag85A и ESAT6-CFP10 антигенов, при этом рекомбинантные белки Ag85A и ESAT6-CFP10 антигенов слиты с декстрансвязующим доменом декстрансукразы (DBD).
Кроме того, в прдлагаемой вакцине в качестве второго высокомолекулярного полисахарида декстрана можно использовать модифицированный полисахарид декстрана с молекулярной массой 500000 Да с присоединенным поликатионом диэтиламиноэтила (ДЭАЭ-декстран) для иммобилизации упомянутого CpG олигонуклеотида, при этом в вакцине может быть использован CpG олигонуклеотид с последовательностью 5'-ggGGGACGA:TCGTCgggggg-3' с фосфотиоатной связью.
При этом, в предлагаемой вакцине рекомбинантной противотуберкулезной на 100 массовых частей суммарной массы рекомбинантных белков Ag85A и ESAT6-CFP10 отношение массы очищенного рекомбинантного белка Ag85A и массы очищенного гибридного рекомбинантного белка ESAT6-CFP10 составляет 40/60-60/40 массовых частей, предпочтительно - 45/55-55/45 массовых частей.
При этом, в предлагаемой вакцине масса водорастворимого высокомолекулярного полисахарида декстрана для иммобилизации рекомбинантных белков Ag85A и ESAT6-CFP10 указанных антигенов в 100-800 раз может превышать суммарную массу первого и второго антигенов.
При этом, в предлагаемой вакцине масса модифицированного полисахарида декстрана с молекулярной массой 500000 Да с присоединенным поликатионом диэтиламиноэтила (ДЭАЭ-декстран) для иммобилизации CpG олигонуклеотида может впревышать массу CpG олигонуклеотида в 2,5-4 раза.
Для решения указанных задач и достижения иных преимуществ предлагается также адъювант вакцины рекомбинантной противотуберкулезной, содержащий, первый водорастворимый высокомолекулярный полисахарид декстрана для иммобилизации рекомбинантных белков антигенов Ag85A и ESAT6-CFP10, неметилированный CpG олигонуклеотид с фосфотиоатной связью, являющийся лигандом рецептора системы врожденного иммунитета TLR9, и второй водорастворимый высокомолекулярный полисахарид декстрана, отличный от первого водорастворимого высокомолекулярного полисахарида декстрана, для иммобилизации упомянутого CpG олигонуклеотида с фосфотиоатной связью.
Кроме того, в предлагаемом адъюванте вакцины в качестве первого высокомолекулярного полисахарида декстрана используется полисахарид декстрана с молекулярной массой 500000 Да (декстран 500) для иммобилизации рекомбинантных белков Ag85A и ESAT6-CFP10 антигенов, слитых с декстран-связующим доменом декстрансукразы\
Кроме того, в предлагаемом адъюванте вакцины в качестве второго высокомолекулярного полисахарида декстрана используется поликатион диэтиламиноэтилдекстран (ДЭАЭ-декстран) с молекулярной массой 500000 Да для иммобилизации СрG олигонуклеотида.
Кроме того, в предлагаемом адъюванте на 1 массовую часть CpG олигонуклеотида приходится 6-7 массовых частей поликатион диэтиламиноэтилдекстрана (ДЭАЭ-декстран) с молекулярной массой 500000 Да.
Кроме того, в предлагаемом адъюванте на 100 массовых частей суммарной массы первого водорастворимого высокомолекулярного полисахарида декстрана для иммобилизации рекомбинантных белков антигенов Ag85A и ESAT6-CFP10 и второго водорастворимого высокомолекулярного полисахарида декстрана для иммобилизации упомянутого CpG олигонуклеотида с фосфотиоатной связью приходится 3-10 массовых частей второго водорастворимого высокомолекулярного полисахарида декстрана.
В состав предлагаемой вакцины, содержащей первый антиген, представляющий собой очищенный рекомбинантный белок Ag85A микобактерии туберкулеза M. tuberculosis, второй антиген, представляющий собой гибридный рекомбинатный белок ESAT6-CFP10 микобактерии туберкулеза M. tuberculosis, включающий в себя очищенный микобактериальный белок ESAT6, слитый с очищенным микобактериальным белком CFP10, введен многокомпонентный адъювант включающий в себя первый водорастворимый высокомолекулярный полисахарид декстрана для иммобилизации белков Ag85A и ESAT6-CFP10 указанных антигенов, неметилированный CpG олигонуклеотид с фосфотиоатной связью, являющийся лигандом рецептора системы врожденного иммунитета TLR9, и второй водорастворимый высокомолекулярный полисахарид декстрана, отличный от первого водорастворимого высокомолекулярного полисахарида декстрана, для иммобилизации упомянутого CpG олигонуклеотида, что обеспечивает отдельный эффективный носитель для антигенов - первый водорастворимый высокомолекулярный полисахарид декстрана, депонирующий антигены, и отдельный эффективный носитель для неметилированного CpG олигонуклеотида с фосфотиоатной связью, второй водорастворимый высокомолеуклярный полисахарид декстрана, депонирующий CpG олигонуклеотид с фосфотиоатной связью, что обеспечивает оптимальные условия для равномерной доставки этих компонентов вакцины иммунным клеткам организма и эффективное стимулирование иммунных клеток к действию с выработкой как интерферона гамма (ИНФ-γ), так и антител класса G к антигенам Ag85A и ESAT6-CFP10, входящим в состав вакцины.
Для более эффективной доставки рекомбинантных белков Ag85A и ESAT6-CFP10 антигенов имунным клетка в вакцине в качестве первого высокомолекулярного полисахарида декстрана используется полисахарид декстрана с молекулярной массой 500000 Да (декстран 500), при этом рекомбинантные белки Ag85A и ESAT6-CFP10 антигенов слиты с декстрансвязующим доменом декстрансукразы (DBD), что обеспечивает надежную иммобилизацию указанных белков на поверхности декстрана 500.
Для более эффективной доставки неметилированного CpG олигонуклеотид с фосфотиоатной связью имунным клеткам в вакцине в качестве второго высокомолекулярного полисахарида декстрана используется модифицированный полисахарид декстрана с молекулярной массой 500000 Да с присоединенным поликатионом диэтиламиноэтила (ДЭАЭ-декстран), несущий положительно заряженные аминигруппы, при этом в вакцине использован CpG олигонуклеотид с последовательностью 5'-ggGGGACGA:TCGTCgggggg-3', что обеспечивает надежную иммобилизацию CpG олигонуклеотида на поверхности ДЭАЭ-декстрана. В пследовательности CpG олигонуклеотид присутствует мотив, позволяющий выполнить активацию TLR9 рецепторов различных иммунокомпетентных клеток.
Соотношения ингредиентов вакцины, заявленные в зависимых пунктах формулы изобретения, обеспечивают оптимальные условия для активации иммунных клеток организма и пролонгированное взаимодействие компонентов вакцины с иммунной системой организма (депонирование), достаточное для индукции сильного и продолжительного иммунного ответа.
Сказанное выше сохраняет свою силу и применительно к предлагаемому адъюванту.
Техническийй результат от применения предлагаемой рекомбинантной противотуберкулезной вакцины заключается в том, что рекомбинантный антиген, имеющий в своем составе декстрансвязывающий домен, связывается с матрицей носителя прочно, но не ковалентно. Это способствует постоянному, но медленному выходу антигена из комплекса с субстратом (декстраном) за счет естественной диссоциации, тем самым обеспечивая пролонгированное взаимодействие компонентов вакцины с иммунной системой организма (депонирование), достаточное для индукции сильного и продолжительного иммунного ответа. Специфическое взаимодействие декстрансвязывающих доменов с матрицей (декстраном) обеспечивает высокую плотность упаковки антигена, что, в свою очередь позволяет уменьшить объем препарата для вакцинации и снизить вероятность возникновения нежелательных побочных реакций.
Присутствие в составе вакцинного препарата лигандов рецепторов врожденного иммунитета - CpG ODN приводит к поляризации иммунного ответа по Th1 типу, который играет ключевую роль в формировании протективного иммунитета против туберкулезной инфекции. Оригинальный способ иммобилизации CpG ODN на поверхности молекулы декстрана пролонгирует действие молекулярного адъюванта и повышает эффективность препарата.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
Рисунки в заявке представлены в виде достаточном для понимания принципов изобретения специалистами в данной области и ни в какой мере не ограничивают объема настоящего изобретения.
На фиг. 1 представлено схематичное изображение состава рекомбинантной противотуберкулезной вакцины, в соответствии с настоящим изобретением.
На фиг. 2А-2Г представлены результаты исследований уровня секреции интерферона гамма (ИНФ-γ) изолированными клетками иммунной системы (Т-лимфоцитами) мышей, предварительно иммунизированных антигенами, входящими в состав вакцины в различном диапазоне концентраций вакцины (клеточный иммунитет), в ответ на стимуляцию in vitro соответствующими очищенными антигенами. По оси абсцисс указана доза (количество) антигенов, примененных для иммунизации, по оси ординат - уровень ИНФ-γ, продуцируемого Т-лимфоцитами в ответ на стимуляцию антигенами. Также указан источник лимфоцитов для экспериментов (лимфоузлы, селезенка) и антигены, использованные для стимуляции (Ag85A-DBD и ESAT6-CFP10-DBD). Приведены данные по секреции ИНФ-γ, полученные при стимуляции отрицательным контрольным раствором (стерильным фосфатно-солевым буфером, в норме не индуцирующим выработку ИНФ-γ) - белые столбцы, и исследуемым антигеном - черные столбцы.
На фиг. 3 представлены результаты исследований титра антител IgG в сыворотке крови мышей к антигенам, входящим в состав вакцины: Ag85A-DBD и ESAT6-CFP10-DBD при различных способах иммунизации (показатель гуморального иммунитета). Варианты иммунизации животных (слева направо, отмечены подписями под осью абсцисс): БЦЖ, БЦЖ + вакцина, описываемая в настоящем изобретении (отмечено «ГамТБвак), только вакцины ГамТБвак, только адъювант, входящий в состав вакцины, отрицательный контроль (PBS, фосфатно-солевой буфер). Отдельными столбцами указан уровень антител класса IgG (указаны градациями серого, слева направо): антитела к вакцине БЦЖ, антитела к антигену Ag85A, антитела к антигену ESAT6, антитела к антигену CFP10.
На фиг. 4 показана эффективность предлагаемой вакцины на морских свинках после аэрозольного инфицирования М. Tuberculosis H37Rv (процент выживших животных после инфицирования) Варианты иммунизации: только БЦЖ, только вакцина, описываемая в настоящем изобретении (отмечено «ГамТБвак), комбинированная иммунизация БЦЖ + вакцина ГамТБвак, отрицательный контроль (PBS, фосфатно-солевой буфер).
На фиг. 5А-5Б представлены результаты исследования изменения уровня секреции интерферона гамма (ИНФ-γ) (клеточного ответа) на антигены, входящие в состав предлагаемой вакцины у индивидуальных здоровых добровольцев (р - показатель достоверности результатов).
На фиг. 6А-6Г представлены результаты исследований изменения титра титра IgG к антигенам, входящим в состав вакцины ГамТБвак, DBD-ESAT6-CFP10, CFP10, ESAT6, DBD (р - показатель достоверности результатов). Оценка уровня антител к компонентам вакцины ESAT6-CFP10- DBD- (А) и его составляющих CFP10 (Б), ESAT6 (В) и DBD (Г) проводилась с использованием хМАР технологии. Показан уровень статистической значимости, рассчитанной с использованием критерия Вилкоксона для сопряженных пар. Стрелками отмечены дни введения вакцины.
ПРИМЕРЫ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Следует понимать, что данное описание и рисунки служат только для иллюстрации осуществления изобретения, и не ограничивают объема настоящего изобретения.
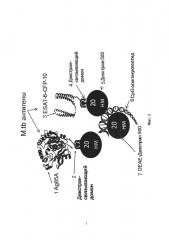
Приведенная композиция вакцины включает (в соответствии с обозначениями на изображении): 1 - очищенный рекомбинантный белок Ag85A микобактерии туберкулеза M. tuberculosis; 2 - декстран-связующий домен декстрансукразы (DBD), с одной стороны, ковалентно соединенный (слитый) с антигеном, а с другой - взаимодействующий с матрицей носителя -высокомолекулярного полисахарида декстрана; 3 - гибридный рекомбинатный белок ESAT6-CFP10 микобактерии туберкулеза, включающий в себя очищенный микобактериальный белок ESAT6, слитый с очищенным микобактериальным белком CFP10; 4 - декстран-связующий домен декстрансукразы (DBD), с одной стороны, ковалентно соединенный (слитый) с антигеном, а с другой - взаимодействующий с матрицей носителя - высокомолекулярного полисахарида декстран; 5 - полисахарид декстрана с молекулярной массой 500000 Да (носитель); 6 - неметилированный CpG олигонуклеотид с фосфотиоатной связью, являющийся лигандом рецептора системы врожденного иммунитета TLR9, иммобилизованный на носителе; 7 - модифицированный полисахарид декстрана с молекулярной массой 500000 Да с присоединенным поликатионом диэтиламиноэтила (ДЭАЭ-декстран).
Как показано на фиг. 1, предлагаемая вакцина включает в себя два антигена. Первый антиген 1 представляет собой очищенный рекомбинантный белок Ag85A (далее, белок Ag85A) микобактерии туберкулеза M. tuberculosis, слитый с декстран-связывающим доменом 2 декстраносукразы Leuconostoc mesenteroides (DBD). Второй антиген 3 представляет собой, гибридный (химерный) рекомбинантный белок ESAT6-CFP10-DBD (далее, белок ESAT6-CFP10-DBD), слитый с декстран-связывающим доменом 4 декстраносукразы Leuconostoc mesenteroides (DBD). Секреторные белки - антигены ESAT-6 (Early secreted antigenic target 6 kDa protein) и CFP-10 (Culture filtrate protein 10), обнаруженные в фильтрате ранней культуры микобактерий, в нативных условиях образуют димер ESAT-6-CFP-10. Вакцина также включает в себя адъювант, в состав которого входят первый компонент 5, представляющий собой первый водорастворимый высокомолекулярный полисахарид декстрана для иммобилизации белков указанных антигенов 1 и 3, второй компонент 6, представляющий собой неметилированный CpG олигонуклеотид с фосфотиоатной связью, являющийся рецептором системы врожденного иммунитета, и третий компонент 7, представляющий собой второй водорастворимый высокомолекулярный полисахарид декстрана, отличный от упомянутого первого водорастворимого высокомолекулярного полисахарида декстрана для компонента 5. Второй водорастворимый высокомолекулярный полисахарид декстрана предназначен для иммобилизаци CpG олигонуклеотида.
Как видно из фиг. 1 для доставки иммунным клеткам белков антигенов Ag85A и ESAT6-CFP10-DBD и для доставки неметилированного CpG олигонуклеотида с фосфотиоатной связью используются разные носители.
Первый носитель представляет собой водорастворимый высокомолекулярный полисахарид декстрана с молекулярной массой 500000 (декстран 500). Декстран 500 был выбран из группы веществ, используемых для адъювантов, включающей в себя: физраствор, декстран 70 несшитый, декстран 70 сшитый, декстран 500 несшитый, декстран 500 сшитый, и 200 сефадекс, на основе обобщенных данных по их патогенному действию на организм, так как декстран 500 показал минимальное патологическое воздействие на организм Декстраны широко используются в медицине, так как они способны длительно циркулировать в сосудистом русле, нормализуя гемодинамику. Это свойство декстранов делает их предпочтительными для использования в качестве носителя белков антигенов Ag85A и ESAT6-CFP10. При использовании в составе вакцины белков антигенов Ag85A-DBD и ESAT6-CFP10-DBD, к которым присоединен декстран-связующий домен декстрансукразы (DBD), каждая молекула белков антигенов Ag85A и ESAT6-CFP10-DBD имеет возможность прочно связаться с молекулой декстрана 500. В результате белки антигенов Ag85A и ESAT6-CFP10-DBD надежно презентуются иммунокомпетентным клеткам. Кроме того, декстран 500 способствует постоянному, но медленному выходу антигена из комплекса с субстратом за счет естественной диссоциации, тем самым обеспечивая пролонгированное взаимодействие компонентов вакцины с иммунной системой организма (депонирование), достаточное для индукции напряженного и продолжительного иммунного ответа.
Второй носитель представляет собой модифицированный полисахарид декстрана с молекулярной массой 500000 Да с присоединенным поликатионом диэтиламиноэтила (ДЭАЭ-декстран). ДЭАЭ-декстран имеет в своем составе положительно заряженные аминогруппы. При использовании в адъюванте вакцины CpG олигонуклеотида с последовательностью 5'-ggGGGACGA:TCGTCgggggg-3', наличие положительно заряженной аминогруппы обеспечивает надежную иммобилизацию CpG олигонуклеотида на поверхности ДЭАЭ-декстрана за счет электростатического взаимодйствия. В последовательности CpG олигонуклеотид присутствует полиG «хвост» с фосфотиоатная связью, что позволяет пролонгировать его взаимодействие с TLR рецепторами денритных клеток.
Использование в адъюванте декстрана 500 и ДЭАЭ-декстрана имеет еще одно преимущество. Белки, входящие в состав вакцины имеют разную молекулярную массу: Ag85A-DBD с присоединенным декстран-связующим доменом имеет молекулярную массу 48,6 кДа, ESAT6-CFP10-DBD с присоединенным декстран-связующим доменом имеет молекулярную массу 39,2 кДА, неметилированный CpG олигонуклеотид имеет молекулярную массу 12 кДа. При использовании в качестве носителя декстрана 500, а также ДЭАЭ декстрана, определяющей в суммарной молекулярной массе блока транспортируемых молекул становится молекулярная масса декстрана (500 кДА) и самый «тяжелый» блок транспортируемых молекул тяжелее самого «легкого» блока транспортируемых молекул только на 6,2%, а с учетом присоединенного поликатиона диэтиламиноэтила эта разница будет еще меньше, что позволит выровнять кинетику взаимодействия отдельных компонентов вакцины с иммунокомпетентными клетками.
Исследование характеристик вакцины
Для проведения исследований использовались лабораторные животные (морские свинки, мыши BALB/c и крысы). Лабораторные животные разделялись на отдельные экспериментальные группы и контрольные группы для сравнения.
Для введения вакцины или контрольного препарата использовалась прививочная доза вакцины или контрольного препарата, смешанная с 0,5 мл. растворителя (0,9% NaCl).
В исследованиях для приготовления предлагаемой противотуберкулезной вакцины и тестовых препаратов антигенов использовались.
1. Предлагаемая вакцина туберкулезная субъединичная рекомбинантная (далее, называемая вакцина ГамТБвак): лиофилизат для приготовления раствора для подкожного введения, представляет собой смесь рекомбинантных белков микобактерий Ag85A и ESAT6-CFP10, слитых с декстран-связывающим доменом DBD, и адъюванта. В состав адъюванта входит водорастворимый высокомолекулярный полисахарид декстран и его модифицированный аналог, несущий положительно заряженные аминогруппы - ДЭАЭ-декстран, на поверхности которого иммобилизованы лиганды рецепторов системы врожденного иммунитета (рецепторы TLR9) - CpG олигонуклеотиды.
Прививочная доза в 0,5 мл растворителя (физраствор 0,9% NaCl) для вакцины ГамТБвак и тестовых препаратов содержит:
1. Белковый антиген Ag85a-DBD (микобактериальный белок Ag85a слитый с декстран-связывающим доменом) - 0,010-0,025 мг.
2. Белковый антиген ESAT6-CFP10-DBD (микобактериальный белок ESAT6, слитый с микобактериальным белком CFP10, слитый с декстран-связывающим доменом) - 0,010-0,025 мг.
При указанных дозах белковых антигенов можно получать противотуберкулезную вакцину с широким диапазоном изменения соотношения масс активных составляющих вакцины (белки - Ag85A и ESAT6-CFP10), так, что в вакцине в 100 массовых частях суммарной массы рекомбинантных белков Ag85A и ESAT6-CFP10 отношение массы очищенного рекомбинантного белка Ag85A и массы очищенного гибридного рекомбинантного белка ESAT6-CFP10 может составлять 35/65-65/35. Это обеспечивает в вакцине ГамТБвак соотношение количества молекул белков Ag85A к количеству молекул белков ESAT6-CFP10 в пределах 0,65-1,25.
3. Декстран с мол. массой 500000 Да - 10 мг;
4. ДЭАЭ-декстран с мол. массой 500000 Да - 0,5 мг;
5. CpG олигонуклеотиды с последовательностью 5'-ggGGGACGA:TCGTCgggggg-3' - 0,0375-0,15 мг;
Антигенный компонент включает в себя рекомбинантные белки Ag85a-DBD и ESAT6-CFP10-DBD (компоненты 1 и 2), адъювант состоит из декстранов и CpG олигонуклеотида (компоненты 3-5).
2. Препараты сравнения
2.1 Препарат сравнения «Антиген»
Комплексный антиген, входящий в состав вакцины для сравнения: лиофилизированный препарат в виде сухого порошка белого цвета во флаконе для приготовления раствора для инъекций в 0,9% NaCl
2.2 Препарат сравнения БЦЖ
В качестве препарата сравнения для оценки иммунологических характеристик субъединичной генно-инженерной вакцины «ГамТБвак» применялась живая туберкулезная вакцина БЦЖ, лиофилизат.
Эксперимент 1
Токсические характеристики адъюванта
При исследовании предлагаемого адъюванта компоненты предлагаемого адъюванта сравнивались с известными препаратами того же назначения.
Препараты вводились контрольной группе мышей двукратно с разовой дозой 1 мл, что соответствует двукратной номинальной дозе вакцины ГамТБвак (0,5 мл с).
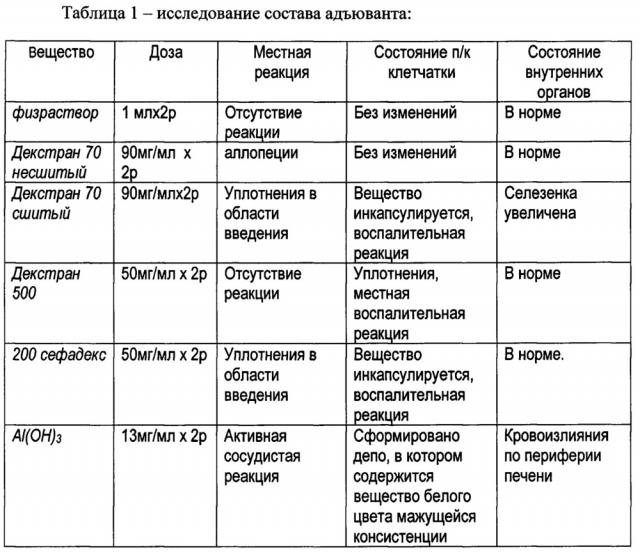
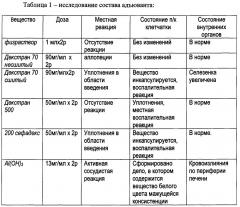
Результаты экспериментов представлены в таблице 1.
Минимальным действием на организм обладает образец - декстран 500, который вызывает только воспалительную реакцию на подкожной клетчатке и декстран 70 несшитый, который имеет только местную реакцию на коже.
Исследования иммуногенности предлагаемой противотуберкулезной вакцины
Инфицирование морских свинок туберкулезом осуществлялось двумя способами:
- внутривенная инъекция вирулентного штамма H37Rv М. Tuberculosis (острая туберкулезная инфекция);
- аэрозольное инфицирование штаммом H37Rv М. Tuberculosis морских свинок и мышей.
Оценка эффективности предлагаемой вакцины ГамТБвак производилась по общепринятой методике с определением
1. уровня секреции интерферона гамма (ИНФ-γ) клетками лимфатических узлов и селезенке после активации отдельными компонентами предлагаемой кандидатной вакцины, самой вакцины и препарата сравнения БЦЖ у иммунизированных мышей,
2. процента выживших инфицированных мышей при введении им отдельных компонентов вакцины, самой вакцины и препарата сравнения БЦЖ.
Эксперимент 2
Исследования иммуногенности предлагаемой противотуберкулезной кандидатной вакцины ГамТБвак выполнялось с использованием на мышах.
На фиг. 2А-2Г представлены результаты определения секреции интерферона гамма (ИНФ-γ) клетками лимфатических узлов и селезенки после активации отдельными компонентами предлагаемой кандидатной вакциныпри различном содержании антигенов (0,05-0,010-0,020 мг) при стимуляции антигенами Ag85A-DBD и ESAT6-CFP10-DBD.
Как видно из представленных результатов антигены в составе предлагаемой вакцины Ag85A-DBD и ESAT6-CFP10-DBD активно стимулируют клеточное звено иммунитета, если в прививочной дозе содержалось 10 мкг или 20 мкг антигенов. Оптимальное количество антигенов в составе вакцины для экспериментов на животных составляет 10 мкг на дозу.
Аналогичные результаты получены при вакцинации предлагаемой прививкой ГамТБвак с увеличением содержания антигенов в прививочной дозе до 25 мкг.
Эксперимент 3
На фиг. 3 представлены результаты исследования гуморального иммунитета при вакцинации и мышей вакциной ГамТБвак.
Исследования выполнены с использованием трех экспериментальных групп и двух контрольных групп. В группе 1 морским свинкам для защиты от туберкулезной инфекции была проведена вакцинация с использованием BCG вакцины. В группе 2 морским свинкам для защиты от туберкулезной инфекции была проведена первичная вакцинация с введением вакцины BCG и бустерная вакцинация с использованием вакцины ГамТБвак. В контрольных группах 3 и 4 вакцинация не проводилась, но морским свинкам и мышам были введены адъювант без антигенов и буферный раствор PBS.
Изучение накопленных в сыворотке крови мышей антител класса G к антигенам, входящим в состав вакцины ГамТБвак DBD-Ag85A и DBD-ESAT6-CFP10 показало, что, как при вакцинации только предлагаемой вакциной ГамТБвак, так и при бустерной вакцинации предлагаемой вакциной ГамТБвак, антигенные слитые белки Ag85A-DBD и ESAT6-CFP10-DBD и БЦЖ в той или иной мере индуцируют существенно большую выработку антител, что подтверждает высокие иммуногенные свойства предлагаемой противотуберкулезной вакцины для подержания гуморального иммунитета против антигенов Ag85A-DBD и ESAT6-CFP10-DBD.
Эксперимент 4
Определение протективной эффективности предлагаемой противотуберкулезной вакцины
Протективная эффективность предлагаемой вакцины оценивалась по количеству морских свинок и мышей, выживших после инфицирования их аэрозольной туберкулезной инфекцией в течение в течение 120 дней после инфицирования их аэрозольной туберкулезной инфекцией.
В экспериментах участвовали 4 экспериментальные группы по 8 животных в каждой группе.
В группе 1 (контрольная группа) морским свинкам ввели TBS. В группе 2 морским свинкам для защиты от туберкулезной инфекции была однократно введена BCG вакцина. В группе 3 морским свинкам для защиты от туберкулезной инфекции была введена предлагаемая вакцина ГамТБвак. В группе 4 морским свинкам для защиты от туберкулезной инфекции была проведена двойная вакцинация: первичная вакцинация с введением предлагаемой вакцины БЦЖ и бустерная вакцинация с введением предлагаемой вакцины «ГамТБвак».
Результаты исследований представлены на фиг. 4.
На фи. 4 представлены графики, отражающие количество выживших морских свинок, аэрозольно инфицированных штаммом H37Rv М. tuberculosis, при введении им различных защитных препаратов: PBS, БЦЖ, первичная вакцинация БЦЖ и бустерная вакцинация ГамТБвак.
Как показано на фиг. 4 в случае контрольной вакцинации PBS морские свинки погибли через 80 дней. Группа БЦЖ (группа 2) показала достаточно высокую протективную эффективность на уровне 60%, которая была выше чем у рекомбинантной вакцины ГамТБвак, показавшей уровень 40% живых морских свинок, через 120 дней после инфицирования. Между тем использование бустерной вакцинации ГамТБвак после первичной БЦЖ вакцинации показало наибольшую протективную эффективность, В группе 4 более 80% морских свинок остались живыми через 120 дней после инфицирования, а первые морские свинки умерли только через 85 дней после инфицирования.
Аналогичные результаты получены при исследовании протективной защиты предлагаемой противотуберкулезной вакцины на экспериментальной группе мышей, хотя и с менее ярко выраженным эффектом.
Таким образом, предлагаемая вакцина показала высокую протективную эффективность, в особенности в качестве бустерной вакцинации после первичной вакцинации БЦЖ.
Эксперимент 5
Клинические исследования предлагаемой вакцины ГамТБвак
В процессе проведения клинических исследований первой фазы на группе здоровых добровольцев в количестве 60 человек (пять групп) были проведены исследования безопасности предлагаемой вакцины для людей и иммуногенности минимальной дозы вакцины.
При проведении исследований безопасности предлагаемой вакцины ГамТБвак добровольцам вводилась минимальная доза вакцины (0,25 от номинальной дозы). Исследования на добровольцах подтвердили выводы, что предлагаемая противотуберкулезная вакцина обладает минимальным токсическим воздействием на организм человека, как это было показано при исследовании воздействия предлагаемой вакцины и ее компонентов на мышей и морских свинок.
Исследования иммуногенности предлагаемой противотуберкулезной вакцины в отношении людей
Добровольцы были разделены на 3 группы. Во всех группах вакцина вводилась двукратно в начале и по истечении 56 дней экспериментов.
В группе 1 добровольцам предлагаемая противотуберкулезная вакцина вводилась в объеме номинальной дозы, в группе 2 добровольцам предлагаемая противотуберкулезная вакцина вводилась в объеме от номинальной дозы и в группе 3 добровольцам вводилась полная доза предлагаемой противотуберкулезной вакцины.
На фиг. 5А и 5Б представлены результаты исследований