Гемостатическое антибактериальное средство, способ его получения, медицинское изделие на основе гемостатического антибактериального средства
Иллюстрации
Показать всеИзобретение относится к медицине, а именно к гемостатическому антибактериальному средству, его применению, способу получения, к медицинскому изделию на основе антибактериального средства и его применению, причем гемостатическое антибактериальное средство представляет собой супрамолекулярный комплекс в виде порошка, содержащий окисленную порошковую целлюлозу и ванкомицин, связанные посредством нековалентных межмолекулярных водородных связей, в котором содержание ванкомицина составляет от 20 до 40 мас. %. Изобретение обеспечивает получение устойчивого супрамолекулярного комплекса. 5 н. и 8 з.п. ф-лы, 2 ил., 2 табл., 3 пр.
Реферат
Изобретение относится к медицине, а именно к гемостатической антибактериальному средству, содержащему полисахарид, связанный с антибиотическим средством, способу его получения, а также относится к изделиям медицинского назначения, использующим полисахариды, связанные с антибиотическими средствами. Предназначено для остановки кровотечений в хирургии, в том числе абдоминальной хирургии, сердечно-сосудистой хирургии, урологии, травматологии, кардиохирургии, торакальная хирургии, нейрохирургии. Может использоваться для остановки диффузных кровотечений из паренхиматозных органов, сосудистых анастомозов и из губчатых, плоских, смешанных костей, а также для оказания местного антисептического действия и регенерации поврежденных тканей.
Диффузное кровотечение во время операции и присоединение внутрибольничной инфекции в послеоперационном периоде - одни из самых актуальных проблем в хирургии. По данным мировой литературы кровотечение увеличивает сроки госпитализации в среднем на 4 дня, а стоимость лечения - на 20%. Быстрая остановка кровотечения приводит к сокращению времени проведения операции, улучшению ее результатов, снижению риска возникновения осложнений и значительному уменьшению расходов. Существующие на сегодняшний день методы борьбы с кровотечением имеют ряд существенных недостатков: диатермоэлектрокоагуляция приводит к ожогу тканей, системное переливание компонентов крови может сопровождаться инфекционными и иммунными осложнениями, а местные кровоостанавливающие средства не в полном объеме удовлетворяют требованиям хирургов. Гемостатические материалы на основе фибрина, ввиду своего животного происхождения, могут привести к возникновению анафилактической реакции на их использование [Beierlein W, Scheule AM, Dietrich W, Ziemer G. Forty years of clinical aprotinin use: a review of 124n hypersensitivity reactions. Ann Thorac Surg 2005; 79: 741-748.]. Также в литературе описаны случаи эмболии альбумин-содержащих гемостатических материалов при их использовании, что в итоге приводило к обширным инфарктам миокарда [Mahmood Z, Cook DS, Luckraz H, O'Keefe P. Fatal right ventricular infarction caused by Bioglue coronary embolism. J Thorac Cardiovascr Surg 2004; 128: 770-771.], острой ишемии нижних конечностей [Bernabeu Е, Castella М, Barriuso С, Mulet J. Acute limb ischemia due to embolization of biological glue after repair of type A aortic dissection. Interact Cardiovasc Thorac Surg 2005; 4: 329-331.] Побочные эффекты от воздействия гемостатических материалов на основе коллагена встречаются редко и чаще всего включают в себя аллергические реакции, образование спаек и ингибирование заживления послеоперационных ран. Костный воск представляет собой материал, который трудно абсорбируется организмом. В экспериментах, различными авторами было выявлено, что костный воск является одним факторов риска возникновения стернальной инфекции, и его использование ингибирует регенерацию костной ткани, тем самым препятствуя заживлению грудины [Wellisz Т, Armstrong J.K, Cambridge J, et al. The effects of a soluble polymer and bone wax on sternal healing in an animal model. Ann Thorac Surg 2008; 85:1776-80.].
He менее остро стоит проблема профилактики внутрибольничных инфекций. Увеличение числа гнойных осложнений в послеоперационном периоде у больных после плановых хирургических вмешательств. Риск присоединения инфекции значительно повышается при использовании имплантируемых устройств медицинского назначения, таких как внутривенные и артериальные катетеры, материалы для остеосинтеза, протезы и другие изделия, которые создают входные ворота для патогенов во время контакта с тканями и жидкостями организма. Не менее актуальной является проблема реинфицирования раневых поверхностей госпитальными штаммами с рук медицинского персонала, постельного белья, шовного и перевязочного материала в группах больных в отделениях интенсивной терапии и др. В условиях строгого контроля за внутрибольничной инфекцией гнойные осложнения в области хирургического разреза регистрируются в 33-38%.
Потенциальное решение проблемы диффузных кровотечений и присоединения внутрибольничной инфекции в послеоперационном периоде состоит в том, чтобы одновременно во время операции применять комбинацию антибиотиков и кровоостанавливающих средств.
В патенте РФ №2034572 предложена гемостатическая губка на основе коллагена и гидроксиапатита и может дополнительно содержать гентамицин или линкомицин. Недостатком данной композиции является использование антибиотиков гентамицина или линкомицина, которые не эффективны в отношении частых возбудителей внутрибольничных инфекций, таких как MRSA (Staphylococcus aureus, устойчивые к метициллину), MRSE (Staphylococcus epidermidis, устойчивые к метициллину), энтерококки, резистентными к ампициллину и аминогликозидам (гентамицину), антибиотикорезистентный пневмококк (S. pneumoniae).
В патенте РФ №2188018 описано лекарственное средство, которое включает азитромицин стеарат магния микрокристаллическ целлюлозу. Недостатком данного средства является использование антибиотика азитромицина, который не эффективен в отношении частого возбудителя внутрибольничной инфекции - MRSA (Staphylococcus aureus, устойчивые к метициллину), микрокристаллическая целлюлоза обладает слабыми гемостатическими свойствами.
Известно применение пасты из антибиотика ванкомицина и физиологического раствора на грудине у кардиохирургических больных: статья Arruda М.V.F. et al. «The use of the vancomycin paste for sternal hemostasis and mediastinitis prophylaxis» [Revista Brasileira de Cirurgia Cardiovascular. - 2008. - T. 23. - №. 1. - C. 35-39] и статья Lazar H.L. et al. «Topical vancomycin in combination with perioperative antibiotics and tight glycemic control helps to eliminate sternal wound infections» [The Journal of thoracic and cardiovascular surgery. - 2014. - T. 148. - №. 3. - C. 1035-1040] Недостатком данного метода является отсутствие в составе пасты гемостатического компонента, что не позволяет в должной мере остановить кровотечение из губчатого вещества грудины после ее продольного рассечения.
Описано (Kanko М., Liman Т., Topcu S. «А Low-Cost and Simple Method to Stop Intraoperative Leakage-Type Bleeding: Use of the Vancomycin-Oxidized Regenerated Cellulose (ORC) Sandwich» [Journal of Investigative Surgery. - 2006. - T. 19. - №. 5. - C. 323-327]) использование гемостатической марли на основе окисленной целлюлозы и антибиотика ванкомицина в виде «Сэндвича» (порошок ванкомицина помещают между двумя слоями окисленной целлюлозы в виде марли). Недостатком данного метода является неравномерность распределения антибиотика ванкомицина по поверхности гемостатической марли, что повышается риск развития инфекции и воспаления, а также длительность остановки кровотечения.
Известно биодеградируемое гемостатическое лекарственное средство для остановки капиллярных и паренхиматозных кровотечений в форме микроволокна, состоящего из диальдегидцеллюлозы с химически иммобилизованными на ней фактором свертывания крови эпсилонаминокапроновой кислотой и бактериолитическим ферментом лизоцимом (патент РФ №2522879). Недостатком данного средства является использование бактериолитического фермента лизоцима, который не эффективен в отношении частого возбудителя внутрибольничной инфекции - MRSA (Staphylococcus aureus, устойчивые к метициллину).
Наиболее близким техническим решением заявляемого изобретения является противомикробная композиция, содержащая комплекс окисленной регенерированной целлюлозы, ковалентно связанной с гентамицином (патент РФ №2465917). Недостатком данной композиции является использование антибиотика гентамицина, который обладает потенциальной нефротоксичностью, ототоксичностью и может вызывать нервно-мышечную блокаду. Данный антибиотик не эффективен против частых возбудителей внутрибольничных инфекций, таких как MRSA (Staphylococcus aureus, устойчивые к метициллину), MRSE (Staphylococcus epidermidis, устойчивые к метициллину), энтерококки, резистентными к ампициллину и аминогликозидам (гентамицину), антибиотикорезистентный пневмококк (S. pneumoniae).
Задачей изобретения является получение эффективного кровоостанавливающего средства, обладающего бактерицидными свойствами, включающего ванкомицин и окисленную целлюлозу, создание гемостатического антибактериального средства, которое может применяться отдельно и в виде медицинского изделия на основе этого средства.
Техническим результатом заявляемого изобретения является получение устойчивого супрамолекулярного комплекса способом иммобилизации ванкомицина на окисленной целлюлозе. Таким образом получено эффективное местное гемостатическое антибактериальное средство и медицинское изделие на его основе, обладающие эффективным гемостатическим и бактерицидным действием, исключающие инфекционные осложнения в послеоперационный период, вызванные грамположительной флорой, обладающие такими свойствами, как нетоксичность и биосовместимость.
Гемостатическое антибактериальное средство может применяться отдельно и в виде медицинского изделия на основе композиции, например, пасты.
Задача решается иммобилизацией ванкомицина на окисленной порошковой целлюлозе. Для улучшения иммобилизации и образования более устойчивых и стабильных супрамолекулярных комплексов добавлена стадия набухания окисленной целлюлозы в воде. Мягкие условия иммобилизации (рН ~3, температура 20-25°С) позволяют сохранить активность ванкомицина. Сначала готовят механическую смесь окисленной порошковой целлюлозы и ванкомицина на ножевом измельчителе роторного типа. Подготовленную механическую смесь добавляют в воду при перемешивании на магнитной мешалке, затем перемешивают в течение 16-20 часов при температуре 20-25°С. За время перемешивания происходит набухание окисленной целлюлозы и повышение доступности ее функциональных групп, что способствует иммобилизации ванкомицина на окисленной целлюлозе. Полученную суспензию центрифугируют в течение 15-20 минут при скорости 5500-6000 об/мин, затем осадок и центрифугат разделяют и высушивают при температуре 50-70°С в течение 6-8 часов, при этом центрифугат высушивают при перемешивании на магнитной мешалке с поддувом воздуха. Высушенные центрифугат и осадок, смешивают в ножевом измельчителе роторного типа и получают порошок, являющийся заявляемым гемостатическим антибактериальным средством - супрамолекулярным комплексом, содержащим окисленную целлюлозу, связанную с ванкомицином за счет нековалентных межмолекулярных водородных связей. Содержание ванкомицина в данном супрамолекулярном комплексе составляет от 20 до 40 мас. %. Показатель рН составляет 2.7-3.2. Средство обладает гемостатическими и антибактериальными свойствами и может применяться для остановки диффузных кровотечений из паренхиматозных органов, сосудистых анастомозов. Медицинское изделие на основе заявленного гемостатического антибактериального средства, содержащего окисленную целлюлозу, связанную с ванкомицином, и включающее стерильный растворитель представляет собой пасту. Стерильным растворителем является физиологический раствор или дистиллированная вода, содержание которых в медицинском изделии составляет от 44,4 до 66,6 мас. %. Паста (медицинское изделие) содержит от 33,3 до 55,5 мас. % гемостатического антибактериального средства. Данное медицинское изделие применяется для остановки диффузных кровотечений из губчатых, плоских, смешанных костей.
Гемостатическое антибактериальное средство, полученное предложенным способом, представляет собой однородные глобулы и представлено на фиг. 1а.: микрофотография окисленной целлюлозы, иммобилизованной ванкомицином (данные сканирующей электронной микроскопии, увеличение в 250 раз);
Для сравнительной характеристики на фиг. 1б. представлена микрофотография механической смеси окисленной целлюлозы и ванкомицина (данные сканирующей электронной микроскопии, увеличение в 250 раз);
Фиг. 2. Микрофотография комплекса окисленной целлюлозы с ванкомицином при смешивании с водой в соотношении 1:1. (данные сканирующей электронной микроскопии, увеличение в 500 раз)
Сущность изобретения иллюстрируется следующими примерами.
Пример 1.
В ножевом измельчителе роторного типа в течение 2 мин готовят механическую смесь из 22,1 г окисленной порошковой целлюлозы и 7,3 г ванкомицина. В реакционный сосуд емкостью 250 мл наливают 130 мл воды и в течение ~ 5 минут при перемешивании на магнитной мешалке при температуре 20-25°С добавляют механическую смесь окисленной целлюлозы и ванкомицина. Полученную смесь перемешивают ~ 16 часов при температуре 20-25°С. За время перемешивания происходит набухание окисленной целлюлозы и происходит повышение доступности ее функциональных групп, что способствует иммобилизации ванкомицина на окисленной целлюлозе. Полученную суспензию центрифугируют 15 мин. при скорости 6000 об/мин. Осадок и центрифугат разделяют. Осадок высушивают до постоянного веса в фарфоровой чашке при температуре ~ 60°С в течение 6-8 часов. Надосадочный раствор (рН 2,9) высушивают в фарфоровой чашке при температуре ~ 60°С в течение 6-8 часов и перемешивании на магнитной мешалке с поддувом воздуха. Высушенные центрифугат и осадок объединяют, перемешивают в ножевом измельчителе роторного типа. Получают порошок бледно-бежевого цвета, являющийся супрамолекулярным комплексом окисленной целлюлозы с иммобилизованным ванкомицином. Содержание ванкомицина в полученном гемостатическим антибактериальном средстве составляет 30% и является предпочтительным.
Методом гель-проникающей хроматографии определен молекулярный вес полученного комплекса, который составляет Mw 25±5 kDa.
В УФ-спектре комплекса присутствует полоса поглощения с λmax 280 нм, что соответствует полосе поглощения фенольных фрагментов ванкомицина.
Данные элементного анализа комплекса, %: найдено С, 39.25; Н, 4.72; N, 2.01; рассчитано С, 41.82; Н, 5.10; N, 2.17. Полученные данные соответствуют комплексу окисленная целлюлоза: ванкомицин в соотношении 3:1.
По данным сканирующей электронной микроскопии (СЭМ) (микроскоп ТМ-1000, Hitachi, Japan) комплекс представляет собой однородные глобулы размером до 150 мкм (Фиг. 1а). В отличие от этого на микрофотографии механической смеси окисленной целлюлозы и ванкомицина (Фиг. 1б) отчетливо наблюдаются ванкомицин в виде пластинчатых кристаллов и окисленная целлюлоза в виде глобул (диаметр от 40 до 150 мкм) и волокон (длина 70-100 мкм, диаметр 16-30 мкм). Таким образом, данные СЭМ однозначно свидетельствуют об образовании супрамолекулярного комплекса.
Поданным ИК-спектроскопии молекулы ванкомицина в комплексе связаны с ОЦ посредством нековалентных межмолекулярных водородных связей, на что указывает отсутствие явных полос поглощения карбоксилат-ионов ОЦ. Образование комплекса происходит, по-видимому, за счет водородных связей между карбоксильными и гидроксильными группами макромолекул окисленной целлюлозы и амидными, аминными, гидроксильными и карбоксильными группами ванкомицина. Образованию комплекса способствует разрыхление структуры ОЦ за счет набухания, что приводит к ослаблению межмолекулярных водородных связей и повышению доступности ее функциональных групп.
Полученный комплекс достаточно устойчив. При длительном перемешивании его с 20-ти кратным избытком воды не происходит высвобождение ванкомицина. При смешивании комплекса с водой в соотношении 1:1 образуется однородная пластичная масса (Фиг. 2).
Для биологических испытаний полученное средство стерилизуют радиационным облучением при следующих условиях: доза 10 kGy, Е 2.45 Mev, f 15 Hz, I 200 mA.
Пример 2.
Для приготовления медицинского изделия 1 грамм гемостатического антибактериального средства, представляющего собой супрамолекулярный комплекс в виде порошка, помещают в стерильную емкость для смешивания. Далее добавляют 1 мл стерильного растворителя: воду или физиологический раствор и перемешивают с помощью стерильного инструмента до гомогенного состояния смеси. Соотношение сухого гемостатического антибактериального средства и растворителя составляет 1:1 (грамм : мл) и является предпочтительным. Состав перемешивают до тех пор, пока средство и растворитель не станут гомогенными. Показатель рН составляет 2.9.
Полученное медицинское изделие имеет густую консистенцию пасты. Присутствие остаточного порошкообразного средства не препятствует эффективности настоящего изобретения. Данное изделие готово к применению сразу после приготовления.
Пример 3.
В альтернативных вариантах осуществления настоящего изобретения объем растворителя может изменяться в пределах ±20% для корректировки консистенции пасты. При содержании в медицинском изделии гемостатического антибактериального средства 33,3 мас. % (1 грамм сухой композиции : 2 мл. растворителя) продолжительность времени набухания пасты длится до 15 минут. Показатель рН составляет 3.2.
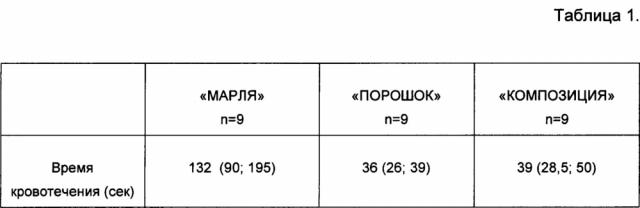
Заявляемое гемостатическое антибактериальное средство применяется для остановки диффузных кровотечений из паренхиматозных органов, сосудистых анастомозов (абдоминальная хирургия, сердечно-сосудистая хирургия, урология и др.). Изучение гемостатических свойств предлагаемого средства (далее «Композиция») проводили путем моделирования кровотечения из паренхиматозного органа и сравнения полученных результатов с показателями гемостатических материалов на основе окисленной целлюлозы в виде марли или порошка без добавления антибиотика. Животные были разделены на три группы: «Марля», «Порошок» и «Композиция» по 9 животных в каждой группе. В качестве хирургической модели использовали печень крысы линии WAG. Выполняли резаную рану длиной 10 мм, глубиной 3 мм. На раневую поверхность наносили гемостатический материал в соответствии с группой животных («Марля», «Порошок», «Композиция») и засекали время кровотечения. Время кровотечения определяли по прекращению истечения крови после очередного снятия гемостатического материала с поверхности раны. По окончании эксперимента операционная рана послойно ушивалась. Полученные результаты представлены в таблице №1.
Время кровотечения с использованием гемостатической марли на основе окисленной целлюлозы, гемостатического порошка на основе окисленной целлюлозы и заявленного гемостатического антибактериального средства («композиция»). Данные представлены как медиана (25; 75 процентиль).
Установлено, что в группе «Композиция» время кровотечения было достоверно ниже в 3,6 раз, чем в группе «Марля». Полученные данные свидетельствуют о выраженной гемостатической активности заявляемой композиции в отношении остановки диффузного кровотечения из паренхиматозного органа. Отсутствие воспаления в группе «Композиция» говорит о наличии антибактериальных свойств.
Заявляемое медицинское изделие на основе гемостатического антибактериального средства - супрамолекулярного комплекса применяется для остановки диффузных кровотечений из губчатых, плоских, смешанных костей (травматология, кардиохирургия, торакальная хирургия, нейрохирургия и др.). Изучение гемостатических свойств медицинского изделия на основе гемостатического антибактериального средства (далее «Медицинское изделие») проводили путем моделирования кровотечения из плоской кости и сравнения полученных результатов с показателями костного воска. В качестве хирургического модели использовали губчатое вещество грудины мини-свиньи. Животные были разделены на две группы: «Медицинское изделие», «Костный воск» по 10 животных в каждой группе. После выполнения срединной стернотомии на губчатое вещество грудины наносили гемостатический материал в количестве 1 грамма в соответствии с группой животных. Сверху накладывали марлевые салфетки и оставляли рану открытой в течение 60 минут. По прошествии указанного времени салфетки взвешивали на электронных настольных весах. Оценивали объем интраоперационной кровопотери (мг). По окончании эксперимента операционная рана послойно ушивалась. Полученные результаты представлены в таблице №2.
Установлено, что в группе «Медицинское изделие» объем кровопотери был достоверно ниже в 1,8 раз, чем в группе «Костный воск». Полученные данные свидетельствуют о выраженной гемостатической активности медицинского изделия в отношении остановки кровотечения из губчатого вещества кости. При гистологическом исследовании срезов грудины через 3 недели после операции в группе «Костный воск» были обнаружены признаки воспаления: эпителиоидные клетки, фибробласты, фиброциты, большое количество плазматических клеток. В группе «Медицинское изделие» гистологических признаков воспаления не обнаружено. Элементы грануляционной ткани (фибробласты, макрофаги, нейтрофильные и эозинофильные лейкоциты, клетки лимфоидного ряда, тучные клетки, капилляры) также чаще обнаруживались в группе «Костный воск».
Отсутствие воспаления и элементов грануляционной ткани в группе «Медицинское изделие» говорит о наличии антибактериальных свойств медицинского изделия.
Антибактериальные свойства гемостатического антибактериального средства и медицинского изделия на основе этого средста подтверждаются проведенными исследованиями. Результаты сравнительной характеристики антибактериальной активности аптечного препарата Ванкомицин (V) и заявляемой композиции (далее «Ванкомицин содержащее средство» - VM) подтверждают антибактериальные свойства изобретения.
В качестве патогенных тест-штаммов использовали грамположительные и грамотрицательные микроорганизмы, относящиеся к IV группе патогенности, из состава «Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор»» Роспотребнадзора. Для культивирования штаммов бактерий, применяемых в работе, использовали рыбный питательный агар (РПА, Оболенск, Россия), сердечно-мозговой агар (СМА, Difco, США), жидкую среду LB (бульон Миллера, Difco, США) и жидкую среду LB с добавлением 10% сердечно-мозгового бульона. Инкубирование клеток в жидкой среде проводили с использованием термостатированной качалки (КТ-4, Россия), при температуре 37°С и скорости вращения 160 об/мин. Титрование культуральных жидкостей и их десятикратных разведений в физиологическом растворе выполняли микрометодом с использованием 96-луночных стерильных планшетов. Резистентность тест-штаммов микроорганизмов к антибиотическим препаратам определяли с помощью аппликации на поверхность питательного агара, засеянного испытуемым микроорганизмом, дисков, пропитанных растворами антибиотиков, диффузионным метом исследования бактериостатического, бактерицидного действия препаратов при высеве тест-штаммов на агаризованные среды методом «колодцев», при культивировании в жидкой питательной среде.
Результаты:
1. Показано, что при использовании диффузионного метода исследования антибиотического действия препаратов «Ванкомицин» (V) и «Ванкомицин содержащее средство» (VM) на типовые патогенные тест-штаммы Staphylococcus, aureus В-1266, Streptococcus pneumonia В-1033 и Streptococcus pyogenes В-1336 препараты V и VM оказывают выраженное литическое действие.
2. Культивирование штаммов полирезистентных стрептококков и стафилококков в жидкой питательной среде с добавлением препаратов V и VM с концентрацией от 5 до 100 мкг/мл показало значительное снижение численности жизнеспособных клеток в опытных вариантах по сравнению с контролем:
- титр клеток штамма S. epidermidis 1827 MRSE в контроле составлял в среднем 3,3×109 КОЕ/мл. При применении в среде культивирования концентрации V и VM 100 мкг/мл численность клеток снижалась еще примерно на порядок и составляла близкие величины для обоих вариантов, в среднем 2,6×103 КОЕ/мл и 4,8×103 КОЕ/мл, соответственно;
- численность жизнеспособных клеток штамма S. aureus 1721 в контроле составляла в среднем 4,6×109 КОЕ/мл, в то время как в опытных вариантах с добавлением антибиотиков V и VM она была значительно меньше, от 2,1×104 до 1,3×105 КОЕ/мл, причем прямой зависимости численности клеток от концентрации антибиотиков в среде не наблюдали;
- титр жизнеспособных клеток в контрольных суспензиях составляет для штамма S. pneumonia В-1033 3,0×108 КОЕ/мл, для штамма Streptococcus pyogenes В-1336
- 2,7×109 КОЕ/мл. Заметной зависимости титра штаммов S. pneumonia В-1033 и Streptococcus pyogenes В-1336 от концентраций антибиотиков, используемых в опыте, не отмечено. Не наблюдается также существенной разницы между действием антибиотиков V и VM на тест-штаммы S. pneumonia В-1033 и Streptococcus pyogenes В-1336. Возможно, сходный титр клеток в опытных суспензиях при добавлении в среду разных концентраций антибиотиков, можно объяснить сохранением в КЖ некоторого количества жизнеспособных неделящихся клеток, на которые ванкомицин не действует, ввиду его способности разрушать именно растущие делящиеся клетки в стадии формирования клеточной стенки, и дальнейшее повышение концентрации антибиотика в среде неэффективно.
Наличие некоторой разницы в титрах жизнеспособных клеток, в ряде вариантов десятикратной, при использовании одинаковых концентраций антибиотиков V и VM, может быть объяснено также возможным несоответствием расчетной концентрации антибиотика VM его полученной концентрации в используемом рабочем растворе, возможно, в результате остаточной сорбции на нерастворимом компоненте препарата VM.
В условиях проведенных опытов антимикробное действие исследуемых препаратов «Ванкомицин» и «Ванкомицин содержащее средство» сходно, по проявленной специфичности соответствует литературным данным по антибиотической активности ванкомицина.
1. Гемостатическое антибактериальное средство, представляющее собой супрамолекулярный комплекс в виде порошка, содержащее окисленную порошковую целлюлозу и ванкомицин, связанные посредством нековалентных межмолекулярных водородных связей, в котором содержание ванкомицина составляет от 20 до 40 мас. %.
2. Применение средства по п. 1 для остановки диффузных кровотечений из паренхиматозных органов, сосудистых анастомозов.
3. Способ получения гемостатического антибактериального средства по п. 1, заключающийся в том, что готовят механическую смесь из окисленной порошковой целлюлозы и ванкомицина, механическую смесь добавляют в воду при перемешивании, затем перемешивают, полученную суспензию центрифугируют, затем осадок и центрифугат разделяют и высушивают при температуре 50-70°С в течение 6-8 ч, после высушенные центрифугат и осадок смешивают в измельчителе.
4. Способ по п. 3, заключающийся в том, что механическую смесь готовят на измельчителе роторного типа.
5. Способ по п. 3, заключающийся в том, что механическую смесь перемешивают в воде в течение 16-20 ч при температуре 20-25°С.
6. Способ по п. 3, заключающийся в том, что полученную суспензию центрифугируют в течение 15-20 мин при скорости 5500-6000 об/мин.
7. Способ по п. 3, заключающийся в том, что центрифугат высушивают при перемешивании на магнитной мешалке с поддувом воздуха.
8. Медицинское изделие, представляющее собой пасту, содержащее гемостатическое антибактериальное средство по п. 1 и стерильный растворитель.
9. Медицинское изделие по п. 8, в котором стерильным растворителем является физиологический раствор.
10. Медицинское изделие по п. 8, в котором стерильным растворителем является дистиллированная вода.
11. Медицинское изделие по п. 8, содержащее от 33,3 до 55,5 мас. % гемостатического антибактериального средства.
12. Медицинское изделие по п. 8, содержащее от 44,4 до 66,6 мас. % стерильного растворителя.
13. Применение медицинского изделия по п. 8 для остановки кровотечений из губчатых, плоских, смешанных костей.