Офтальмологические составы для доставки лекарственных средств к заднему сегменту глаза
Иллюстрации
Показать всеГруппа изобретений относится к химико-фармацевтической промышленности и представляет собой глазной состав в виде суспензии для наружного применения для лечения заболевания заднего сегмента глаза, причем состав содержит активный агент формулы II или его фармацевтически приемлемую соль и одно или более фармацевтически приемлемое вспомогательное вещество, где активный агент или фармацевтически приемлемая соль присутствует в количестве от 0,1% до 5,0% масс./об. и по меньшей мере 95% активного агента представлено в нерастворимой форме, а также применение состава в получении лекарственного препарата, пригодного для обеспечения доступа к заднему сегменту глаза и/или для лечения и/или облегчения заболевания заднего сегмента глаза. Группа изобретений позволяет усовершенствовать способ доставки активного агента в задний сегмент глаза без явного его накопления в переднем сегменте, что достигается благодаря наличию более 95% активного агента в нерастворимой форме. 2 н. и 35 з.п. ф-лы, 20 табл., 10 пр.
Реферат
РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет предварительной заявки США № 61/784681, поданной 14 марта 2013, полное содержание которой включено в настоящее изобретение с помощью ссылки во всей своей полноте.
ОБЛАСТЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В общем, варианты осуществления, описанные в настоящем изобретении, относятся к местному введению фармацевтического соединения или его соли для лечения глазных заболеваний или состояний. Описанные варианты осуществления включают офтальмологические составы фармацевтического соединения или его соли, где состав представляет собой раствор или суспензию. Раствор содержит агент, улучшающий растворимость, и является пригодным для доставки к заднему сегменту глаза субъекта.
УРОВЕНЬ ТЕХНИКИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Лечение заболеваний или расстройств заднего сегмента глаза путем нанесения местно активного агента является неэффективным из-за неэффективной доставки активного агента в целевое место. Значительное большинство местных лекарственных средств проникает через роговицу. Однако роговица не является одинаково проницаемой для всех применяемых местно активных агентов, поскольку основная структура роговицы определяет относительное проникновение активного агента. В действительности, наибольший барьер для проникновения активного агента создает эпителий роговицы, который содержит много клеточных мембран и, следовательно, более поддается проникновению активных агентов, которые являются липофильными. Напротив, поскольку строма роговицы состоит в основном из воды, активные агенты проходят более быстро через данный самый толстый компонент роговицы, если они являются гидрофильными. Эндотелий представляет собой монослой, который также является липофильным. Активные агенты, которые являются липофильными или амфифильными, то есть они могут вести себя или как заряженные или как незаряженные молекулы, проникают через роговицу наилучшим способом. Аналогично роговице, через эпителий конъюнктивы и кровеносные сосуды в или под эпителием конъюнктивы может проникать тот же тип липофильных или двухфазных агентов. Однако, из-за свойств липофильных мембран в конъюнктиве и ее собственной сосудистой системы, большинство активных агентов обычно не проникают через конъюнктиву и в глаз. Агенты с ограниченным проникновением в сосудистые ткани в конъюнктивальной и субконъюнктивальной областях попадают в общее кровообращение.
Если активный агент проникает через роговицу в переднюю камеру глаза, все еще существуют барьеры для успешной доставки лекарственного средства в ткани заднего сегмента глаза, такие как сетчатка и сосудистая оболочка. Данные барьеры состоят, по меньшей мере, отчасти, из пассивных барьеров, таких как гидродинамика водянистой влаги, хрусталик и ресничный поясок и большой объем стекловидного тела, а также активные барьеры, такие как клеточный транспорт или насосы, расположенные в цилиарном эпителии или ионные градиенты, существующие в глазу.
Помимо проблем с местной доставкой лекарственных средств в задний сегмент глаза, существует несколько преимуществ данного способа доставки по сравнению с системной доставкой и интравитреальной или субконъюнктивальной доставкой. Интравитреальное и субконъюнктивальное введение обычно основано на применении иглы, соединенной со шприцом, для проникновения или через стенку глаза или через конъюнктивальную ткань, доставляя водные фармакологические агенты или водные суспензии агентов (например, стероидов) для неотложного лечения. Однако следует также отметить, что увеличивающееся количество способов может продолжительно доставлять груз посредством транспортных средств, таких как полимеры, органические ячейки или наночастицы, доставляя активный терапевтический агент в течение длительного или продленного периода времени. Местная доставка обеспечивает прямое нанесение на целевой орган - глаз, с относительной простотой нанесения для большинства пациентов, и благодаря направленному нанесению, необходимость меньших доз активного агента, связанных с началом действия, часто приводя к пониженному или несущественному системному воздействию. Недостатки местной доставки включают: загрязнение капель для местного применения, потенциальное требование наличия консервантов, потенциальная токсичность лекарственного средства или консерванта для глазной поверхности, ограничение проникновения большинства местных активных агентов через конъюнктиву, роговицу и переднюю камеру глаза, и риск, хотя и значительно меньший по сравнению с системной доставкой, системного поглощения лекарственных средств, что может воздействовать на другие органы, такие как сердце и легкие. Широко известные осложнения интравитреального введения включают инфекцию, отслоение сетчатки, кровоизлияние и рубцевание. Осложнения субконъюнктивального введения также включают инфекцию, рубцевание, кровоизлияние и случайное проникновение через глазное яблоко.
Из-за ограниченной проходимости многих капель для местного применения через роговичные и конъюнктивальные барьеры, одного из основных недостатков капель для местного применения, может быть необходима большая концентрация активных агентов в местной состава для того, чтобы достигать значимых терапевтических концентраций лекарственного средства в глазу. В зависимости от активного агента, концентрация состава для наружного применения может быть высокотоксичной для переднего сегмента глаза, включая роговицу и хрусталик. Следовательно, лечение заболеваний или расстройств заднего сегмента глаза будет составами, которые обеспечивают низкую биодоступность активного агента в переднем сегменте глаза, будет оказывать благоприятное действие, при этом обеспечивая доступность эффективной концентрации активного агента к заднему сегменту глаза.
Настоящие варианты осуществления изобретения обеспечивают новые состава, которые преодолевают данные проблемы, обнаруживаемые при глазной доставке существующих местных терапевтических агентов. Настоящее изобретение обеспечивает комбинированные эффекты пониженного воздействия лекарственного средства на роговицу и передний сегмент глаза, при этом увеличивая биодоступность к заднем сегменту глаза. Снижая воздействие на роговицу и увеличивая биодоступность к заднему сегменту, состав настоящего изобретения улучшает офтальмологическую переносимость и улучшает терапевтический индекс активного агента.
СУЩНОСТЬ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к фармацевтическим составам в виде раствора и/или суспензии, которые снижают воздействие активного агента в переднем сегменте глаза, например, роговице, при этом увеличивая биодоступность агента в заднем сегменте глаза, например, в центральной сосудистой оболочке глаза и/или центральной зоне сетчатки.
Варианты осуществления обеспечивают две различные формы состава, содержащего активный агент, раствор и суспензию, с улучшенными характеристиками по сравнению с другой композицией в виде геля. Варианты осуществления обеспечивают то, что активный агент в виде раствора и/или суспензии, является лучшим по сравнению с тем же самым активным ингредиентом, сформулированным в виде геля, при доставке активного ингредиента в задний сегмент глаза, при этом снижая воздействие в переднем сегменте глаза. Повышенные концентрации активного агента в переднем сегменте глаза ограничивают глазную переносимость капель для местного применения, содержащих активный агент. Следовательно, пониженная биодоступность активного агента на роговичной или конъюнктивальной поверхности, при этом поддерживая подходящие концентрации, необходимые для связывания соответствующих рецепторов в тканях-мишенях и обеспечения терапевтического эффекта в заднем сегменте глаза, таком как сосудистая оболочка глаза и сетчатка, является очень желательной и представляет собой конечный результат, достигаемый конкретными вариантами осуществления, описанными в настоящем изобретении.
Настоящее изобретение относится к композициям и способам, пригодным для лечения патологических состояний, которые возникают или обостряются глазным ангиогенезом и пропотеванием жидкости через сосуды, например, при диабетической ретинопатии (включая фоновую диабетическую ретинопатию, пролиферативную диабетическую ретинопатию и диабетический отек макулы); возрастной дегенерации макулы (ВМД) (включая неоваскулярную (влажную/экссудативную) ВМД, сухую ВМД и географическую атрофию); патологической неоваскуляризации сосудистой оболочки глаза (ХНВ) любого механизма (т.е. миопии высокой степени, травме, серповидноклеточной анемии; гистоплазмозе глаз, ангиоидных полосах сетчатки, разрыве сосудистого тракта глаза при травме, друзах оптического нерва и некоторых ретинальных дистрофиях); патологической ретинальной неоваскуляризации любого механизма (т.е. серповидно-клеточной ретинопатии, болезни Илза, глазном ишемическом синдроме, каротидно-кавернозном соустье, семейной экссудативной форме витреоретинопатии, синдроме повышенной вязкости крови, идиопатическом окклюзионном артериолите, дробьевидной ретинохороидопатии, ретинальном васкулите, саркоидозе или токсоплазмозе); увеите; окклюзию вены сетчатки (центральной или ветки); глазной травме; эдеме, вызванной хирургической операцией; неоваскуляризации, вызванной хирургической операцией; кистозном макулярном отеке; ишемии глаз; ретинопатии недоношенных; синдроме Коутса; серповидно-клеточной ретинопатии и/или неоваскулярной глаукоме. Состав настоящего изобретения содержит, по меньшей мере, один антиангиогенный агент, противовоспалительный агент или агент, ослабляющий проницаемость сосудов, для применения в лечении ангиогенных глазных расстройств.
Согласно вариантам осуществления настоящего изобретения, активный агент представляет собой ингибитор киназы. Примеры некоторых ингибиторов киназ, которые можно применять, получая полезные терапевтические результаты, включают ингибиторы рецепторных тирозинкиназ, например, без ограничения, VEGFR, FGFR, Tie-2 и эфриновые рецепторы киназ.
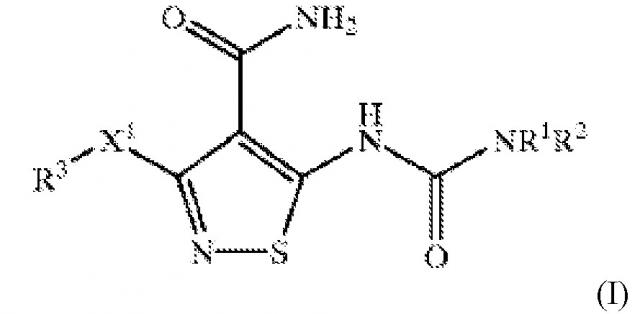
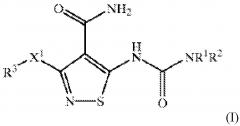
Варианты осуществления настоящего изобретения обеспечивают офтальмический состав для лечения глазной неоваскуляризации активным агентом формулы I:
или его фармацевтически приемлемой солью; и фармацевтически приемлемые вспомогательные вещества; активный агент или фармацевтически приемлемая соль присутствует в количестве от приблизительно 0,02% до приблизительно 0,6% масс./об. так, чтобы композиция образовывала раствор или суспензию, и где активный агент определяют как: X1 представляет собой O или S; R1 представляет собой H, C1-C10 алкил, C2-C10 алкенил, C2-C10 алкинил, -C(O)(C1-C10 алкил), -(CH2)t(C6-C10 арил), -(CH2)t(4-10-членный гетероцикл), -C(O)(CH2)t(C6-C10 арил) или -C(O)(CH2)t (5-10-членный гетероцикл), где t представляет собой целое от 0 до 5; алкильная группа необязательно содержит 1 или 2 гетерофрагмента, выбранные из O, S и -N(R6)- при условии, что два O атома, два S атома или O и S атом не соединены непосредственно друг с другом; арильная и гетероциклическая R1 группа необязательно конденсирована с C6-C10 арильной группой, C5-C8 насыщенной циклической группой или 5-10-членной гетероциклической группой; 1 или 2 атома углерода в указанных выше гетероциклических фрагментах необязательно замещены оксо (═O) группой или анионом кислорода; -(CH2)t- фрагменты указанных выше R1 групп необязательно содержат углерод-углерод двойную или тройную связь, где t представляет собой целое от 2 до 5; и указанные выше R1 группы, за исключением H, необязательно замещены 1-3 R4 группами; R2 представляет собой H; R3 представляет собой -(CH2)t(C6 -C10 арил), где t представляет собой целое от 0 до 5; необязательно конденсированный с C6 -C10 арильной группой, C5 -C8 насыщенной циклической группой или 5-10-членной гетероциклической группой; -(CH2)t- фрагменты необязательно содержат углерод-углерод двойную или тройную связь, где t представляет собой целое от 2 до 5, и необязательно замещены 1-5 R4 группами; каждая R4 независимо выбрана из C1-C10 алкила, C2-C10 алкенила, C2-C10 алкинила, галогена, циано, нитро, трифторметила, трифторметокси, азидо, -OR5, -C(O)R5, -C(O)OR5, -NR6C(O)OR5, -OC(O)R5, -NR6 SO2R5, -SO2NR5 R6, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, -S(O)jR7, где j представляет собой целое в диапазоне от 0 до 2, -SO3H, -NR5(CR6R7)tOR6, -(CH2)t(C6-C10 арила), -SO2(CH2)t(C6-C10 арила), -S(CH2)t(C6-C10арила), -O(CH2)t(C6-C10 арила), -(CH2)t(5-10-членного гетероцикла) и -(CR6 R7)mOR6 , где m представляет собой целое от 1 до 5, и t представляет собой целое от 0 до 5; алкильная группа необязательно содержит 1 или 2 гетеро фрагмента, выбранные из O, S и -N(R6)-, при условии, что два O атома, два S атома, или O и S атом не соединены непосредственно друг с другом; арильная и гетероциклическая R4 группы необязательно конденсированы с C6-C10 арильной группой, C5-C8 насыщенной циклической группой или 5-10-членной гетероциклической группой; 1 или 2 атома углерода в указанных выше гетероциклических фрагментах необязательно замещены оксо (═O) группой или анионом кислорода; и алкильный, арильный и гетероциклический фрагменты указанных выше R4 групп необязательно замещены 1-3 заместителями, независимо выбранными из галогена, циано, нитро, трифторметила, трифторметокси, азидо, -NR6SO2R5 , -SO2NR5R6 , -C(O)R5, -C(O)OR5 , -OC(O)R5, -NR6C(O)R5, -C(O)NR5R6, -NR5R6, -(CR6R7)mOR6, где m представляет собой целое от 1 до 5, -OR5 и заместителями, перечисленными в определении R5; и каждый R5, R6, и R7 независимо представляет собой H или C1-C6 алкил.
В другом варианте осуществления настоящего изобретения, R3 в формуле I представляет собой -(CH2)t(C6 -C10 арил), где t представляет собой целое от 1 до 3, и R3 группа необязательно замещена 1-4 R4 группами.
В другом варианте осуществления, R3 в формуле I настоящего изобретения представляет собой бензил, необязательно замещенный 1-4 заместителями, независимо выбранными из галогена и C1-C4 алкила. R3 в формуле I настоящего изобретения представляет собой бензил, замещенный 1-4 заместителями, независимо выбранные из метила, фтора, хлора и брома.
В некоторых вариантах осуществления, R1 в формуле I настоящего изобретения представляет собой -(CH2)t (5-10-членный гетероцикл), где t представляет собой целое от 0 до 5, необязательно замещенный 1 или 2 заместителями, независимо выбранные из C1-C4 алкила, гидрокси и гидроксиметила.
Настоящее изобретение относится к гетероциклическому фрагменту R1 группы в формуле I, выбранному из морфолино, пирролидинила, имидазолила, пиперазинила, пиперидинила и 2,5-диазабицикло[2,2,1]гепт-2-ила, t переменная R1 группы находится в диапазоне от 2 до 5, и R1 группа необязательно замещена одной или более гидрокси группами.
Например, гетероциклический фрагмент R1 группы в формуле I настоящего изобретения представляет собой пирролидин.
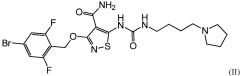
В следующих вариантах осуществления настоящего изобретения, активный агент представляет собой:
.
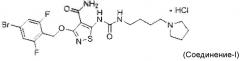
В некоторых вариантах осуществления настоящего изобретения, активный агент представляет собой гидрохлоридную соль соединения формулы II, а именно соединение-I:
.
Варианты осуществления настоящего изобретения относятся к составам, содержащим от приблизительно 0,005% до приблизительно 5,0% масс./об. активного агента формул (I), (II) или его фармацевтически приемлемой соли, например, соединения-I. В некоторых вариантах осуществления концентрация соединения-I или его свободного основания (формула II) в композициях составляет приблизительно 0,005% - приблизительно 0,01%, приблизительно 0,01% - приблизительно 0,05%, приблизительно 0,05% - приблизительно 0,1%, приблизительно 0,1% - приблизительно 0,2%, приблизительно 0,2% - приблизительно 0,3%, приблизительно 0,3% - приблизительно 0,4%, приблизительно 0,4% - приблизительно 0,5%, приблизительно 0,5% - приблизительно 0,6%, приблизительно 0,6% - приблизительно 0,7%, приблизительно 0,7% - приблизительно 0,8%, приблизительно 0,8% - приблизительно 0,9%, приблизительно 0,9% - приблизительно 1,0%, приблизительно 1,1 - приблизительно 2,0%, приблизительно 2,1 - приблизительно 3,0%, приблизительно 3,1 - приблизительно 4,0%, или приблизительно 4,1- приблизительно 5,0% масс./об. для местного введения. В некоторых вариантах осуществления состава содержат приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0%, или приблизительно 5,0% масс./об. соединения-I или его свободного основания (формула II).
Настоящее изобретение относится к раствору активного агента (например, соединения-I), который содержит один или более агентов, улучшающих растворимость.
Состав, содержащий приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0% или приблизительно 5,0% масс./об. соединения формулы (I), (II) или его фармацевтически приемлемой соли, например, соединения-I, содержит агент, улучшающий растворимость. Агент, улучшающий растворимость, в составе состава может представлять собой циклодекстрин, например, 2-гидроксипропил-β-циклодекстрин, метил-β-циклодекстрин, произвольно метилированный-β-циклодекстрин, этилированный-β-циклодекстрин, триацетильный-β-циклодекстрин, перацетилированный-β-циклодекстрин, карбоксиметил-β-циклодекстрин, гидроксиэтил-β-циклодекстрин, 2-гидрокси-3-(триметиламмонио)пропил-β-циклодекстрин, глюкозил-β-циклодекстрин, мальтозил-β-циклодекстрин, сульфобутиловый эфир-β-циклодекстрин, разветвленный-β-циклодекстрин, гидроксипропил-β-циклодекстрин, произвольно метилированный-β-циклодекстрин, триметил-β-циклодекстрин или их комбинации.
В одном варианте осуществления, агент, улучшающий растворимость, в составе представляет собой 2-гидроксипропил-β-циклодекстрин или β-циклодекстринсульфобутиловый эфир. Состав содержит один или более из хлорида бензалкония (BAK), хлорида натрия и регулирующего pH агента.
В дополнительных вариантах осуществления, состав, содержащий приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0%, или приблизительно 5,0% масс./об. активного агента или его фармацевтически приемлемой соли, содержит буфер, например, трометамин. В одном варианте осуществления состав, содержащий приблизительно 0,005%, приблизительно 0,05%, приблизительно 0,1%, приблизительно 0,2%, приблизительно 0,3%, приблизительно 0,4%, приблизительно 0,5%, приблизительно 0,6%, приблизительно 0,7%, приблизительно 0,8%, приблизительно 0,9%, приблизительно 1,0%, приблизительно 2,0%, приблизительно 3,0%, приблизительно 4,0%, или приблизительно 5,0% масс./об. активного агента или его фармацевтически приемлемой соли, содержит приблизительно 0,3% - приблизительно 1,0% масс./об. трометамин и необязательно дополнительно содержит приблизительно 0,005% масс./об. хлорида бензалкония (BAK).
Настоящее изобретение относится к составу, имеющему величину pH от приблизительно 4,5 до приблизительно 7,5 при температуре ниже или равной приблизительно 40°C. В некоторых вариантах осуществления, величина pH состава составляет от приблизительно pH 5,0 до приблизительно 7,0. В одном варианте осуществления величина pH состава равна приблизительно 6,0 при температуре ниже или равной приблизительно 40°C.
Настоящие варианты осуществления относятся к применению состава соединения-I или его свободного основания (формула II) в получении лекарственного препарата для получения доступа к заднему сегменту глаза и/или для лечения и/или облегчения заболевания заднего сегмента глаза, васкулопатического или воспалительного заболевания глаза. Они включают, например, диабетическую ретинопатию (включая фоновую диабетическую ретинопатию, пролиферативную диабетическую ретинопатию и диабетический отек макулы); возрастную дегенерацию макулы (ВМД) (включая неоваскулярную (влажную/экссудативную) ВМД, сухую ВМД и географическую атрофию); патологическую хороидальную неоваскуляризацию (ХНВ) любого механизма (т.е. миопию высокой степени, травму, серповидноклеточную анемию; гистоплазмоз глаз, ангиоидные полосы сетчатки, разрыв сосудистого тракта глаза при травме, друзы оптического нерва и некоторые ретинальные дистрофии); патологическую ретинальную неоваскуляризацию любого механизма (т.е. серповидно-клеточную ретинопатию, болезнь Илза, глазной ишемический синдром, каротидно-кавернозное соустье, семейную экссудативную форму витреоретинопатию, синдром повышенной вязкости крови, идиопатический окклюзионный артериолит; дробьевидную ретинохороидопатию, ретинальный васкулит, саркоидоз и токсоплазмоз); увеит; окклюзию вены сетчатки (центральную или ветки); травму глаз; эдему, вызванную хирургической операцией; неоваскуляризацию, вызванную хирургической операцией; кистозный макулярный отек; ишемию глаз; ретинопатию недоношенных; синдром Коутса; серповидно-клеточную ретинопатию и/или неоваскулярную глаукома.
В некоторых вариантах осуществления, продолжительность воздействия соединения-I составляет от 1 до 90 дней. В некоторых вариантах осуществления, режим дозирования включает несколько курсов местного глазного введения состава, содержащего соединение-I, субъекту в течение от 1 до 90 дней. Например, режим дозирования включает введение состава один раз в день, дважды в день, три раза в день или четыре раза в день в течение от 1 до 90 дней. Например, режим дозирования включает введение состава один, два, три или четыре раза через день (т.е. в 1, 3, 5, 7 день и т.д.) в течение вплоть до 90 дней. Например, режим дозирования включает введение один раз в 1 день, один или два раза в 2-90 день. Например, режим дозирования включает введение один, два, три или четыре раза в 1 день, с последующим введением один раз в день в течение 2-90 дней. Например, режим дозирования включает введение один, два, три, четыре раза в 1 день, с последующим введением один, два, три или четыре раза через день (т.е. в 1, 3, 5, 7 день и т.д.) в течение вплоть до 90 дней. Например, один режим дозирования включает введение один раз в день или дважды в день в течение 1, 2, 3, 4 или 5 последовательных дней. Для режима дозирования два или три раза в день, субъекты получают местную глазную дозу состава, содержащего соединение-I, в 1-й и 4-й дни с интервалом приблизительно 4, 6 или 8 часов. В другом варианте осуществления, субъекты получают местные глазные дозы состава, содержащего соединение-I, приблизительно с интервалом 4, 6 или 8 часов в течение четырех последовательных дней. В некоторых вариантах осуществления субъекты получают одну или две местные глазные дозы состава, содержащего соединения-I, в день в течение 5 последовательных дней. В еще других вариантах осуществления, субъекты получают одну или две местные глазные дозы состава, содержащего соединения-I, в течение 5-90 последовательных дней. В некоторых вариантах осуществления, субъекты получают одну или две местные глазные дозы состава, содержащего соединения-I, в течение, по меньшей мере, 25 последовательных дней. В одном варианте осуществления, субъекты получают одну или две местные глазные дозы в течение, по меньшей мере, 90 последовательных дней или более.
Например, состав, содержащий приблизительно 2 мг/мл соединения-I, вводят дважды в день в глаз или оба глаза субъекта в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 3 мг/мл соединения-I, вводят дважды в день в глаз или оба глаза субъекта в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 3 мг/мл соединения-I, вводят ежедневно в глаз или оба глаза субъекта в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 4 мг/мл соединения-I, вводят дважды в день в глаз или оба глаза субъекта в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 4 мг/мл соединения-I, вводят в глаз или оба глаза субъекта ежедневно в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 5 мг/мл соединения-I, вводят в глаз или оба глаза субъекта дважды в день в течение от 1 до 90 дней.
В некоторых вариантах осуществления состав, содержащий приблизительно 5 мг/мл соединения-I, вводят в глаз или оба глаза субъекта ежедневно в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 6 мг/мл соединения-I, вводят в глаз или оба глаза субъекта дважды в день в течение от 1 до 90 дней. В некоторых вариантах осуществления состав, содержащий приблизительно 6 мг/мл соединения-I, вводят в глаз или оба глаза субъекта ежедневно в течение от 1 до 90 дней. Режим дозирования в течение от 1 до 90 дней может представлять собой любой из режимов, включающих последовательные или чередующиеся дни введения, описанные в параграфе выше.
В некоторых вариантах осуществления, состав, содержащий соединение формулы (II) или соединения-I, вводят в глаз или оба глаза субъекта. Например, приблизительно 0,2% - приблизительно 0,6% (масс./об.) соединения формулы (II) или приблизительно 0,1%-0,7% (масс./об.) состава, содержащего соединение I, настоящего изобретения вводят один раз в день (QD) или два раза в день (BID) в глаз или оба глаза субъекта в течение от 1 до 90 дней. В некоторых вариантах осуществления соединение формулы (II) или соединение-I образует комплекс с комплексообразующим агентом, например, циклодекстрином (например, гидроксипропил-β-циклодекстрином (HP-β-CD, KLEPTOSE® HPB) (%)) в соотношении приблизительно 1:8, где приблизительно 2%-13% (масс./об.) циклодекстрина (например, Kleptose® HPB (%)) добавляют к составу. Состав дополнительно содержит приблизительно 0,1% - приблизительно 0,2% буфера, например, 10 мМ фосфатного буфера. Требуемая осмолярность состава составляет приблизительно 200 - приблизительно 300 мОсм, достигаемую добавлением количества, достаточного для достижения осмолярности соли, например, хлорида натрия. pH состава составляет приблизительно 6,0.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Материалы, соединения, состав, изделия и способы, описанные в настоящем изобретении, будут более ясны со ссылкой на следующее подробное описание конкретных аспектов описанного объекта изобретения и примеры, включенные в настоящее изобретение. Перед тем как настоящие материалы, соединения, состав, изделия, устройства и способы будут описаны, ясно, что аспекты, описанные ниже, не ограничивают конкретные способы получения или конкретные реагенты, которые могут изменяться. Также ясно, что терминология, применяемая в настоящем изобретении, служит только для целей описания конкретные аспектов и не предполагается ограничивающей.
Кроме того, во всем описании, ссылаются на различные публикации. Описание данных публикаций включено во всей полноте в настоящее изобретение с помощью ссылки в настоящую заявку для того, чтобы более полно описать состояние настоящего уровня техники, к которому относится описанный объект. Описанные ссылки также отдельно и конкретно включены с помощью ссылки для материала, содержащегося в них, который обсуждается в предложении, на котором основана ссылка.
Настоящее изобретение относится к композициям или составам, которые содержат активный агент для применения в лечении глазных расстройств, вызванные пролиферацией эндотелиальных клеток, повышенной проницаемостью, воспалением или ангиогенезом сосудов. Состав настоящего изобретения являются пригодными в предотвращении или ингибировании неоваскуляризации и пропотевания жидкости через сосуды, связанного с глазным расстройством. В некоторых случаях, состав настоящего изобретения вызывают регресс неоваскуляризацию. Вкратце, в контексте настоящего изобретения, активные агенты следует понимать как любую молекулу, или природную или полученную, которая действует, ингибируя рост сосудов, снижает проницаемость сосудов и/или снижает воспаление. В частности, настоящее изобретение относится к составам, содержащим активный агент, в терапевтически эффективном количестве.
Общие определения
В данном описании и в формуле изобретения, которая следует далее, ссылаются на ряд терминов, которые определяют так, что они имеют следующие значения: все проценты, соотношения и пропорции в настоящем изобретении приведены по весу, если не указано иначе. Все температуры приведены в градусах Цельсия (°C), если не указано иначе.
Под “фармацевтически приемлемым” подразумевают материал, который не является биологически или иначе нежелательным, т.е. материал можно вводить индивиду вместе с соответствующим активным соединением, не вызывая клинически нежелательных биологических эффектов или не взаимодействуя пагубным способом с любым из других компонентов фармацевтической состава или состава, в котором он содержится.
Весовой процент компонента, если специально не указано противоположное, основан на суммарном весе состава, в котором содержится компонент.
“Эффективное количество”, как применяют в настоящем изобретении, обозначает “количество одного или более описанных соединений, эффективное при дозах и в течение периодов времени, необходимых для достижения требуемого или терапевтического результата. ”Эффективное количество” может изменяться в зависимости от факторов, известных в данной области техники, таких как болезненное состояние, возраст, пол и вес человека или животного, которого лечат. Хотя конкретные режимы дозирования можно описать в примерах настоящего изобретения, специалисту в данной области техники ясно, что режим дозирования можно изменять, обеспечивая оптимальный терапевтический ответ. Например, несколько раздельных доз можно вводить ежедневно, или дозу можно пропорционально снижать, как показано требованиями терапевтической ситуации. Кроме того, состав настоящего изобретения можно вводить с такой частотой, которая требуется для получения терапевтического количества.
“Вспомогательное вещество” применяют в настоящем изобретении для включения любого другого соединения, которое может содержаться в или которое можно смешивать с одним или более из описанных ингибиторов, которое не является терапевтически или биологически активным соединением. Как есть, вспомогательное вещество должно быть фармацевтически или биологически приемлемым или подходящим (например, вспомогательное вещество должно быть, в общем, нетоксичным для субъекта). “Вспомогательное вещество” включает отдельное данное соединение, и также предполагается, что оно включает несколько вспомогательных веществ. Для целей настоящего изобретения термин “вспомогательное вещество” и “носитель” применяют взаимозаменяемо во всем описании настоящего изобретения, и указанные термины определяют в настоящем изобретении как “ингредиенты, которые применяют на практике формулирования безопасной и эффективной фармацевтического состава”.
Как применяют в настоящем изобретении, под “субъектом” подразумевают индивида. Таким образом, “субъект” может включать домашних животных (например, кошек, собак и т.д.), сельскохозяйственных животных (например, крупный рогатый скот, лошадей, свиней, овец, коз и т.д.), лабораторных животных (например, мышь, кролика, крысу, морскую свинку и т.д.) и птиц. “Субъект” может также включать примата или человека.
Под “снижать” или другими формами слова, такими как “снижение”, подразумевают ослабление осложнения или снижение характеристики (например, пропотевания жидкости через сосуды или опухания ткани). Ясно, что это обычно относится к некоторой стандартной или ожидаемой величине, другими словами, оно является относительным, но не всегда необходимо ссылаться на стандартную или относительную величину.
Термин “лечить” или другие формы слова, такие как “подвергаемый лечению” или “лечение”, применяют в настоящем изобретении для обозначения того, что введение соединения настоящего изобретения облегчает заболевание или расстройство у хозяина и/или снижает, ингибирует или устраняет конкретную характеристику или осложнение, связанные с расстройством (например, пропотевание жидкости через сосуды).
Поскольку способы настоящего изобретения относятся к предотвращению расстройств, ясно, что термин “предотвращать” не требует, чтобы болезненное состояние полностью устранялось. Скорее, как применяют в настоящем изобретении, термин предотвращение относится к способности специалиста в данной области техники определить популяцию, которая является восприимчивой к расстройству так, чтобы введение соединений настоящего изобретения можно было осуществлять перед возникновением заболевания. Термин доза не подразумевает, что болезненное состояние полностью избегается.
Термин “облегчение” или другие формы слова, такие как “облегчать”, применяют в настоящем изобретении для обозначения того, что введение терапевтического агента настоящего изобретения ослабляет один или более симптомов заболевания или расстройства у хозяина и/или ослабляет, ингибирует или устраняет конкретный синдром, связанный с заболеванием или состоянием перед и/или после введения терапевтического агента.
Описанные соединения влияют на пропотевание жидкости через сосуды или патологическую неоваскуляризацию ингибированием рецепторной тирозинкиназы.
Во всем описании и формуле изобретения настоящего изобретения слово “включает” и другие формы слова, такие как “включая”, обозначают включение, без ограничения, и не предполагается, что они исключают, например, другие добавки или компоненты.
“Необязательный” или “необязательно” обозначает то, что описанное впоследствии событие или обстоятельство может происходить или не происходить, и что описание включает случаи, где событие или обстоятельства возникает и случае, где оно не возникает.
Термин “приблизительно” относится к любому минимальному изменению концентрации или количества терапевтического агента, которое не изменяет эффективность агента при получении состава и лечении заболевания или расстройства. Например, без ограничения, концентрация терапевтического агента будет эффективной, если концентрация изменяется между 0,005%-5,0% (±0,0005%). Термин “приблизительно” относительно диапазона концентраций терапевтических/активных агентов настоящего изобретения также включает любое изменение стандартного количества или диапазона, который будет представлять собой эффективное количество или диапазон.
Диапазоны можно выразить в настоящем изобретении в виде от “приблизительно” одной конкретной величины и/или до “приблизительно” другой конкретной величины. Когда выражают данный диапазон, другой аспект включает от одной конкретной величины и/или до другой конкретной величины. Аналогично, когда величины выражают как приблизительные величины, применяя антецедент “приблизительно”, ясно, что конкретная величина образует другой аспект. Кроме того, ясно, что конечные величины каждого из диапазонов являются важными и относительно другой конечно