Биорезорбируемый биологический матрикс для замещения дефектов костной ткани и способ его получения
Иллюстрации
Показать всеГруппа изобретений относится к медицине, а именно к биотехнологии, и может быть использована для получения биорезорбируемого биологического матрикса для замещения дефектов костной ткани из ксеногенной или аллогенной костной ткани. Способ включает следующие последовательные стадии: a) стадию предварительной обработки указанной ксеногенной или аллогенной костной ткани, включающую один или более цикл его замораживания при температурах от -20 до -80°C и оттаивания при температурах от +5 до +37°C; b) стадию глубокой очистки и экстракции материала, полученного на предыдущей стадии, включающую обработку этого материала в растворе ионного или ионного и амфотерного детергента в буферном растворе, затем, факультативно, отмывку в буферном растворе, затем дальнейшую обработку в растворе неионного детергента, за которой следует экстракция материала с использованием ультразвукового дезинтегратора; c) стадию делипидирования материала, полученного на предыдущей стадии, включающую обработку материала в растворе этанола, и/или этанола-хлороформа, и/или этанола-этилацетата и толуола, а затем обработку гидроксидом натрия; d) стадию ферментации материала, полученного на предыдущей стадии, включающую в себя обработку материала в растворах ДНКазы и/или трипсина; e) стадию деминерализации материала, полученного на предыдущей стадии, включающую в себя обработку материала раствором сильной кислоты с последующей нейтрализацией гидроксидом натрия; f) стадию пропитывания, включающую в себя импрегнацию материала, полученного на предыдущей стадии, везикулярным фосфатидилхолином и/или холестерином, в который включены желатин (гидролизованный коллаген), и/или костный ателоколлаген, и/или поли-(е-капролактон). Группа изобретений относится также к применению биорезорбируемого биологического матрикса для заполнения дефектов костной ткани или в качестве импланта в хирургии. Использование данной группы изобретений позволяет получить биологический матрикс, обладающий повышенной остео- и биоинтеграцией, высокой биосовместимостью и отсутствием иммунореактивности со стороны реципиента. 3 н. и 19 з.п. ф-лы, 1 табл., 7 ил.
Реферат
Область техники
Настоящее изобретение относится к медицинской биотехнологии, медицине, травматологии, ортопедии, стоматологии и ортодонтии, а именно к способу получения биологического матрикса, предназначенного для замещения дефектов костной ткани.
Уровень техники
Сокращение сроков реабилитации и повышение эффективности восстановительных операций на опорно-двигательном аппарате остается актуальной социально-экономической и медицинской проблемой. В последнее время все большее внимание уделяется использованию процессов регенерации как альтернативе механического замещения дефектов кости посредством металлических и керамических имплантов.
Использование костных трансплантатов является общепринятым мировым стандартом при лечении переломов, обширных дефектов костной ткани после оперативных вмешательств и травм, а также при замене утраченных костей. Данный тезис подтверждается огромным количеством экспериментального и клинического материала по всему миру. Наиболее распространенным подходом является использование аутотрансплантатов. Однако использование собственного биологического материала имеет ряд серьезных ограничений, в первую очередь связанных с травматичностью, ограниченным ресурсом и такими осложнениями, как ранняя послеоперационная боль, хроническая боль в месте забора трансплантата, хронической вялотекущей инфекцией, рубцами, потерей крови и другими.
В качестве альтернативы предложено использовать аллотрансплантаты, но им не хватает остеоактивного потенциала аутотрансплантатов, и, кроме того, они несут риск контаминации инфекционными агентами и иммунного отторжения вследствие реакции отторжения трансплантата («хозяин против трансплантата»).
Наиболее современные подходы направлены на улучшение эффективности костных трансплантатов или других искусственных эндопротезов путем включения костных клеток-предшественников или незрелых клеток мезенхимального ряда и факторов роста в целях стимуляции роста, дифференцировки клеток и активации процессов регенерации кости.
В то же время идеальный костный трансплантат должен быть изготовлен из биоматериалов, в данном случае костной ткани, которые в полной мере имитируют структуру и свойства естественного костного матрикса (экстрацеллюлярного матрикса кости). Кроме того, данный матрикс должен как включать остеопрогениторные клетки, так и обеспечивать полный спектр метаболических и экологических сигналов, обнаруживаемых в нативной здоровой кости.
Однако создание биоактивной конструкции, которая структурно, функционально и механически сравнима с натуральной костью, полностью моделирующей микросреду, в том числе биохимические и биофизические сигналы, до сих пор является вызовом для исследователей и производителей во всем мире. Наиболее предпочтительным заменителем костной ткани представляется ксеногенный биологический матрикс, полученный с использованием физико-химических методов децеллюляризации и глубокой очистки, вследствие сохранения трехмерной организации коллагена и аморфной формы гидроксиапатита и возможности импрегнации в него различных биологически активных компонентов.
Известен способ (Fages J, et al. (1998) Viral inactivation of human bone tissue using supercritical fluid extraction. ASAIO J 44:289-293), где после распиливания кости проводили обезжиривание биологического матрикса методом сверхкритической флюидной экстракции при следующих условиях: скорость потока CO2 – 2 кг/ч, давление 250 бар, температура 50°C, продолжительность обработки 10 минут на 1 г костной ткани. Настоящий способ включает дополнительные этапы, где проводили удаление белков 35% раствором перекиси водорода (Н2О2) в течение 24 часов при 40°C; удаление остаточных липидов и стерилизацию гидроксидом натрия 1М, 1 час при 20°C с дальнейшей нейтрализацией водным раствором NaH2PO4 в концентрации 12 г/л в течение 30 минут и последующей обработкой 95% этанолом в течение 3 часов при 20°C с дальнейшей обработкой 100% этанолом в течение 2 часов при 20°C; после этого образцы сушили на воздухе 12 часов при 40°C. После упаковки проводили стерилизацию гамма-облучением при 25 кГрей. Данный метод позволяет получить стерильный биологический костный матрикс.
Недостатками данного способа являются недостаточная очистка матрикса от антигенной составляющей вследствие отсутствия ферментативной обработки материала, использование высокой температуры, при которой происходит неизбежная денатурация коллагена, и использование 100% этанола, для которого требуются специальные условия.
Из предшествующего уровня техники известен способ (Bone graft material incorporating demineralized bone matrix and lipids, US7357947 B2, Biomet Inc. (US), 15.04.2008), где свежую костную массу получали из мелких животных - крыс. После нескольких промывок фосфатно-солевым буферным раствором и этанолом кости лиофильно высушивали и размалывали в частицы диаметром 100-500 мкм, которые были далее декальцифицированы 0,6N HCl/1% Тритон X-100. Для полного удаления липидов частицы погружали в смесь хлороформа и метанола 1:1 на 12 часов при комнатной температуре. Данный способ позволяет получить деминерализованный костный матрикс.
Недостатками данного способа являются отсутствие стадии первичной очистки костного материала и малое количество стадий промывки, что не позволяет получить деминерализованный костный матрикс высокой степени чистоты. Кроме того, данный способ позволяет получить костный матрикс только в виде крошки.
Из предшествующего уровня техники известен способ (Demineralized bone matrix compositions and methods, US 8202539 B2, Warsaw Orthopedic, Inc. (US), опубл. 19.06.2012.), где кость, на примере среза бедренной кости человека, размалывали на мельнице радиально для отделения радиальных слоев от диафиза. После удаления губчатых участков кости, кортикальную кость размалывали на трех глубинах: 1,5 мм – периостальный слой, далее еще 1,5 мм – средний слой и далее еще 1,5 мм – эндостальный слой, таким образом получали три глубины – это 1,5, 3 и 4,5 мм. Во избежание случайного попадания костного мозга в материал дальнейшее размалывание не проводили. Далее осуществляли деминерализацию. В качестве переносчика размолотых и деминерализованных частиц выступал глицерол. Было показано, что возможны произвольные комбинации долей частиц из различных слоев. Было продемонстрировано, что деминерализованный костный матрикс из периостального слоя обладает наиболее высокой остеоиндуктивностью, чем из среднего и тем более из эндостального слоя. Данный способ позволяет получить остеоиндуктивный деминерализованный костный матрикс.
Недостатками данного способа являются отсутствие стадии первичной очистки костного материала и малое количество стадий промывки, что не позволяет получить деминерализованный костный матрикс высокой степени чистоты. В данном способе отсутствуют стадии делипидирования и децеллюляризации, вследствие чего значительно повышается риск иммунного ответа на имплантацию полученного биологического матрикса.
Из предшествующего уровня техники известен способ (Process for demineralization of bone matrix with preservation of natural growth factors, US 8992964 B2, Bacterin International, Inc. (US), опубл. 31.03.2015), где для получения деминерализованного губчатого костного матрикса 1-300 г губчатой кости помещали в 10-4500 мл 0,3-2M HCl, далее смесь перемешивали в течение 4-10 часов, в процессе перемешивания раствор HCl заменяли каждые 1-4 часа. Каждые 5-90 минут проводили тест губчатого костного матрикса на полную сжимаемость. Полностью сжимаемые сегменты губчатого костного матрикса помещали в нейтрализующий раствор с pH > 4. Свойства полученного матрикса улучшали обработкой озоном, где матрикс помещали в обогащенный озоном раствор с микропузырьками, причем раствор периодически заменялся, а концентрация озона была от 0,1 до 400 частей на миллион, причем время экспозиции составляло от 0,1 до 7 часов, а температура обогащенного озоном раствора от −20 до 50°C. Такая обработка возможна и перед деминерализацией. Деминерализованный костный матрикс имел концентрацию костного морфогенетического белка (BMP)-2 ≥ 5000 пг/г и сжимаемость до 20 раз. Данная методика позволяет получить деминерализованный костный матрикс с удовлетворительными биофизическими характеристиками.
Недостатками данного способа являются отсутствие стадий первичной очистки костного материала, удаления липидов, промывки и обработки детергентами, что не позволяет получить матрикс высокого качества и степени чистоты и значительно повышает риск иммунных реакций.
Из предшествующего уровня техники известен способ (Bone graft comprising a demineralized bone matrix and a stabilizing agent, US 7959941 B2, Warsaw Orthopedic, Inc., опубл. 14.06.2011), где после ручной очистки от мягких тканей губчатые кости распиливали на большие сегменты, а трубчатые – на малые. Сегменты промывали холодной деионизированной водой. Для удаления липидов и дегидратации костные сегменты помещали в 100% этанол на как минимум 1 час, причем этанол периодически заменяли. На 100 г кости использовали 4 л 100% этанола. Далее для окончательной дегидратации костные сегменты помещались в раствор безводного диэтилового эфира в вытяжном шкафу на 1 час. На 100 г кости использовали 2 л эфира. Обезвоженные костные сегменты замораживали и размалывали в порошок. Далее порошок деминерализовали 0,5M HCl (50 мл на 1 г кости) в течение 3 часов при комнатной температуре или 4°С с постоянным перемешиванием. Далее костные сегменты нейтрализовывали холодной деионизированной водой до достижения раствором pH воды. На промывку уходило 500 мл воды на 1 г костной массы. Деминерализованный костный порошок помещали в 100% этанол в течение 1 часа (200 мл 100% этанола на 1 г кости) и далее в раствор безводного диэтилового эфира в вытяжном шкафу на 1 час (100 мл эфира на 1 г кости). После этого для испарения эфира костные сегменты оставляли на ночь в вытяжном шкафу. Получающиеся частицы не имели запаха, снежно-белые и легко отделялись друг от друга. Для стерилизации использовался холодный этиленоксид или гамма-облучение. Данный способ позволяет получить стерильный деминерализованный костный матрикс.
Недостатками данного способа являются использование больших объемов токсичного диэтилового эфира, что несовместимо с требованиями безопасности. За исключением начального этапа, отсутствуют стадии промывки и обработки детергентами, что не позволяет получить матрикс высокого качества и степени чистоты.
Из предшествующего уровня техники известен способ (Bone matrix compositions and methods, CA2690457 A1, Osteotech, Inc. et al. (US), опубл. 24.12.2008), где после ручной очистки от мягких тканей кость перемалывали в порошок диаметром 2,8-4 мм, который далее помещали в раствор хлороформа и метанола 1:1 на 6 часов для удаления липидов. После высушивания в вытяжном шкафу в течение ночи частицы подвергали дополнительному высушиванию под вакуумом в течение 12 часов. Далее частицы подвергали деминерализации в 0,6N растворе HCl в течение 75 минут и промывали дистиллированной водой до pH ≥ 3. Далее частицы инкубировали в 100 мМ фосфатно-солевом буферном растворе с pH 7,4, содержащем 2 мМ азида натрия (ингибитор ферментов) и 6,0 мМ N-этилмалеимида (ингибитор протеаз) в течение 72 часов при 37°C. Затем частицы дважды промывали водой в течение 15 минут при комнатной температуре и лиофилизировали. Данная методика позволяет получить лиофилизированный деминерализованный костный матрикс в виде порошка или частиц.
Недостатками данного способа являются практически полное отсутствие этапов промывки, а также обработки детергентами, что не позволяет получить матрикс высокого качества и степени чистоты. Данный способ позволяет получить костный матрикс только в виде порошка или крошки, что ограничивает его применимость.
Из предшествующего уровня техники известен способ (Manufacturing method for fibrous demineralized bone matrix, US 9029077 B2, Cg Bio Co., Ltd. (KR) опубл. 12.05.2015), где после ручного удаления мягких тканей с кости, в примере весом 172 г, оставшиеся мягкие ткани, липиды и костный мозг удаляли при помощи детергента, содержащего сурфактант. Кость распиливали пополам и погружали в 20 мл 0,6N раствора HCl на 1 г кости в течение 3 часов для частичной деминерализации. Далее кость помещали в 20 мл дистиллированной воды на 1 г кости для промывки. Кости распиливали слайсером на слои, причем толщина слоя составляла около 0,5 мм. Далее костные слои погружали в 30 мл 0,6N раствора HCl на 1 г кости на 3 часа для полной деминерализации. Преципитирующий деминерализованный костный матрикс пульверизировали в течение 10 минут, нейтрализовывали фосфатно-солевым буферным раствором, промывали дистиллированной водой и лиофилизировали получением около 31 г матрикса в виде волокон. Данная методика позволяет получить лиофилизированный деминерализованный костный матрикс в виде слоев.
Недостатками данного способа является отсутствие детального описания обработки детергентом, при помощи которого предполагается удаление липидов и децеллюляризация, что значительно повышает риск иммунных реакций.
Из предшествующего уровня техники известен способ (Bone matrix compositions and methods, US 8328876 B2, Warsaw Orthopedic Inc. (US), опубл. 11.12.2012), где деминерализованный порошок помещали в раствор, содержащий 50 мМ Tris-HCl (pH 7,4), 5 мМ CaCl2 и 80 ЕД/мл очищенной бактериальной коллагеназы (соотношение 1 г порошка на 3 мл раствора) на 1 час при 37°C с перемешиванием. Далее деминерализованный костный матрикс перемешивали в течение 1 часа в 45 мл 0,1N уксусной кислоты при 4°C. После этого матрикс дважды промывали холодной водой в течение 30 минут и нейтрализовывали в течение 30 минут холодным фосфатно-солевым буферным раствором. Данная методика позволяет увеличить остеоиндуктивные свойства деминерализованного костного матрикса.
Недостатками данного способа являются частичная деградация коллагена в костном матриксе и вымывание костных морфогенетических белков вследствие использования уксусной кислоты, что снижает остеоиндуктивные свойства матрикса.
Из предшествующего уровня техники известен способ (Bone graft material incorporating demineralized bone matrix and lipids, US 6565884 B2, Biomet Manufacturing LLC (US), опубл. 20.05.2003), где заранее деминерализованный костный матрикс смешивали с лецитином с итоговой массовой долей матрикса от 20 до 80% и инкапсулировали в желатин для имплантации. Данная методика позволяет увеличить остеоиндуктивные свойства деминерализованного костного матрикса.
Недостатком данного способа является использование физического смешения компонентов, что не позволяет в полной мере импрегнировать лецитин и желатин в структуру матрикса, что, в свою очередь, снижает его эффективность.
Из предшествующего уровня техники известен способ (Xenograft bone matrix for orthopedic applications, EP 1418866 A2, Aperion Biologics, Inc (US), опубл. 19.05.2004), где замороженные свиные кости промывали дезинфектантом и размораживали с последующей очисткой от мягких тканей. Проксимальный и дистальный метафизы спиливали, а диафиз распиливали на удобные для обработки сегменты, которые помещали в ванну с изопропанолом. Далее сегменты переносили в сосуд с гексаном или метанолом на 12-18 часов при постоянном перемешивании при 4°C. После двукратно промывали водой в течение 10-12 часов при постоянном перемешивании при 4°C. Далее материал подвергали обработке 1,5М NaCl в течение 10-12 часов при постоянном перемешивании при 4°С, а далее промывали в воде и перемалывали в порошок с диаметром < 500 мкм. Затем порошок ресуспендировали в растворе 70% изопропанола и 0,1% Tween-20 и фильтровали через сито с последующим трехкратным повторением процедуры, что в сумме составляло 4 раза. Частицы ресуспендировали в H2O2 и перемешивали в течение 4-6 часов при 4°С. Затем надосадок сливали и к порошку добавляли 0,5N HCl с перемешиванием в течение 20-24 часов при 4°С. После трехкратной промывки водой добавляли раствор α-галактозидазы для снижения иммуногенности на 4-12 часов при 4-26°С с последующим сливанием этого раствора и трехкратной промывкой водой. Финальную стадию подготовки осуществляли лиофилизацией в течение 36-38 часов. Данный способ позволяет получить гипоиммуногенный деминерализованный костный матрикс.
Недостатками данного способа являются высокая длительность процедуры и возможность получения биологического матрикса только в форме порошка.
В качестве прототипа выбран способ (Decellularization and recellularization of organs and tissues, Патент US 8470520 B2, Regents Of The University Of Minnesota (US), опубл. 25.06.2013), описывающий:
(1) Децеллюляризацию биологической ткани полиэтиленгликолем (ПЭГ), где ткани промываются в 200 мл фосфатно-солевого буферного раствора, содержащего 100 ЕД/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина B в течение 20 минут. Далее ткани децеллюляризируются в 35 мл ПЭГ (1 г/мл) в течение 30 минут. После этого они как минимум дважды промываются в 500 мл фосфатно-солевого буферного раствора в течение 24 часов. Далее ткани экспонируются 35 мл ДНКазы I (70 ЕД/мл) в течение 1 часа и затем промываются в 500 мл фосфатно-солевого буферного раствора в течение 24 часов.
(2) Децеллюляризацию 5% Тритоном X-100, 0,1% NH4OH и 0,05% трипсином, где ткани промываются в 200 мл фосфатно-солевого буферного раствора, содержащего 100 ЕД/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина B в течение 20 минут. Далее ткани децеллюляризируются в 0,05% трипсине в течение 30 минут, а затем 5% раствором Тритона X-100 и 0,1% NH4OH в 500 мл фосфатно-солевого буферного раствора в течение 6 часов. Затем ткани промываются деионизированной водой в течение 1 часа и фосфатно-солевым буферным раствором в течение 12 часов и после этого промываются трижды 500 мл фосфатно-солевым буферным раствором в течение 24 часов. Далее ткани экспонируются 35 мл ДНКазы I (70 ЕД/мл) в течение 1 часа и еще дважды промываются в 500 мл фосфатно-солевого буферного раствора в течение 24 часов.
(3) Децеллюляризацию 1% додецилсульфатом натрия, где ткани промываются в 200 мл фосфатно-солевого буферного раствора, содержащего 100 ЕД/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина B в течение 20 минут. Далее ткани децеллюляризируются 500 мл 1% водного раствора додецилсульфата натрия в течение 6 часов. Затем ткани промываются деионизированной водой в течение 1 часа и фосфатно-солевым буферным раствором в течение 12 часов и после этого промываются трижды в 500 мл фосфатно-солевого буферного раствора в течение 24 часов. Далее ткани экспонируются 35 мл ДНКазы I (70 ЕД/мл) в течение 1 часа и еще трижды промываются в 500 мл фосфатно-солевого буферного раствора в течение 24 часов.
(4) Децеллюляризацию 5% Тритоном X-100 и 0,1% NH4OH, где ткани промываются в 200 мл фосфатно-солевого буферного раствора, содержащего 100 ЕД/мл пенициллина, 0,1 мг/мл стрептомицина и 0,25 мкг/мл амфотерицина B в течение 20 минут. Далее ткани децеллюляризируются в 500 мл 5% водного раствора Тритона X-100 и 0,1% NH4OH в течение 6 часов. Затем ткани промываются деионизированной водой в течение 1 часа и фосфатно-солевым буферным раствором в течение 12 часов и после этого промываются трижды в 500 мл фосфатно-солевого буферного раствора в течение 24 часов. Далее ткани экспонируются 35 мл ДНКазы I (70 ЕД/мл) в течение 1 часа и еще трижды промываются в 500 мл фосфатно-солевого буферного раствора в течение 24 часов.
Настоящий способ позволяет получить децеллюляризированный костный матрикс.
Недостатками данного способа являются недостаточная очистка и децеллюляризация больших объемов биологических тканей вследствие ограничения пропитывания толщи биоматериала используемыми реагентами, неполная отмывка и отсутствие дополнительного физического воздействия. Кроме того, весь процесс очистки и децеллюляризации биоматериала проводится при комнатной температуре в течение длительного времени без использования специальных консервантов, что повышает риск деградации биоматериала и его контаминации. Помимо этого, данная методика не позволяет провести деминерализацию биоматериала для получения матрикса с низким содержанием минеральной компоненты.
Таким образом, известные из уровня техники решения имеют важный недостаток – отсутствие одной или более стадий обработки биологического материала: первичной очистки, удаления липидов, промывки или обработки детергентами. Как правило, они не содержат необходимого количества стадий промывки либо стадии обработки детергентами. В то же время полноценная децеллюляризация и очистка инородного имплантируемого биоматериала как аллогенного, так и ксеногенного происхождения должна содержать как минимум: (1) первичную очистку костного материала; (2) удаление пахучих веществ и липидов; (3) обработку детергентами с целью децеллюляризации; (4) деминерализацию с последующей нейтрализацией pH; (5) промывку на всех этапах обработки материала; (6) финальную подготовку образца для непосредственного придания необходимой формы, включая стерилизацию. Кроме того, большинство решений подразумевает получение биологического матрикса только в качестве мелкодисперсного порошка вследствие невозможности пассивной диффузии химических реагентов вглубь объемного матрикса по причине отказа от использования любых физических воздействий. Помимо этого, решения используют неприемлемые для биологической составляющей матрикса внешние условия, при которых происходит либо денатурация белка, либо его вымывание.
Раскрытие изобретения
Задачей настоящего изобретения является разработка эффективного и безопасного биологического матрикса для замещения дефектов костной ткани.
Поставленная задача решается за счет использования многостадийной обработки биологического материала, а именно ксеногенной или аллогенной костной ткани, при сохранении нативной трехмерной организации коллагенового каркаса, сохранения нативной аморфной формы гидроксиапатита и фосфата кальция, наличия в биологическом матриксе активных компонентов, а именно белков экстрацеллюлярного матрикса и модифицирующих биомолекул (включая биоактивные пептиды и факторы роста).
Общим техническим результатом предлагаемой группы изобретений является получение биологического матрикса, обладающего повышенной остео- и биоинтеграцией, оптимальной скоростью биодеградации, высокой биосовместимостью, отсутствием иммунореактивности со стороны реципиента, высокой способностью к остеокондукции, выраженным остеогенным потенциалом при остеосинтезе и костной пластике. Биологический матрикс состоит из костного коллагена, гидроксиапатита и/или фосфата кальция, причем костный коллаген в настоящем матриксе представлен в нативной невосстановленной форме с полностью сохраненной трехмерной структурой, гидроксиапатит и фосфат кальция представлены в нативной аморфной форме, а сам матрикс, очищенный от клеточного дебриса, чужеродных липидов, нуклеиновых кислот и иммуногенов, содержит остаточные количества костных морфогенетических белков и может быть дополнительно модифицирован везикулярным фосфатидилхолином и/или холестерином с включенными гидролизованным коллагеном и/или ателоколлагеном и/или поли(е-капролактоном), а также различными биологически активными веществами (такими как биоактивные пептиды и факторы роста), посредством импрегнации.
Поставленная техническая задача достигается за счет использования многостадийной обработки биологического материала, а именно ксеногенной или аллогенной костной ткани, сохранения нативной трехмерной организации коллагенового каркаса, сохранения нативной аморфной формы гидроксиапатита и фосфата кальция и наличия в биологическом матриксе активных компонентов, а именно белков экстрацеллюлярного матрикса и модифицирующих биомолекул (включая биоактивные пептиды и факторы роста).
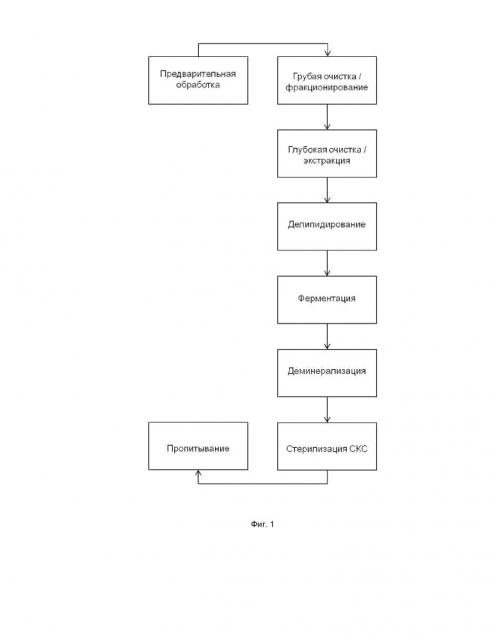
Способ получения биологического матрикса для замещения дефектов костной ткани по настоящему изобретению включает ряд последовательных стадий, в том числе: (1) предварительную обработку биологического материала; (2) грубую очистку и фракционирование; (3) глубокую очистку и экстракцию; (4) делипидирование; (5) ферментацию; (6) деминерализацию; (7) стерилизацию в сверхкритических средах.
Стадия предварительной обработки биологического материала включает замораживание биоматериала при -20 – -40°С, обработку дезинфектантами, включая раствор антибиотиков и антимикотиков, в течение 1-72 часов при температуре 1-8°С; обработку раствором перекиси водорода в концентрации 0,1-5% в течение 1-72 часов при температуре 1-8°С, причем соотношение биологической ткани к раствору составляет от 1:10 до 1:40.
В одном из вариантов осуществления способа в качестве дезинфектантов используют растворы гентамицин/амфотерицин и пенициллин/стрептомицин и/или нистатин и/или фунгизон.
В одном из вариантов осуществления способа обработку дезинфектантами проводят в условиях ультразвуковой ванны при общих условиях, описанных выше.
В одном из вариантов осуществления способа обработку раствором перекиси водорода проводят в условиях ультразвуковой ванны при условиях, описанных выше.
В одном из вариантов осуществления способа раствор для предварительной обработки меняют 1 раз в час.
Стадия грубой очистки и фракционирования включает очистку биологического образца от мягких тканей и фиброзного слоя периоста; фракционирование биологического материала; отмывку в растворе перекиси водорода в концентрации 0,1-5% в течение 1-72 часов при температуре 1-8°С, причем соотношение биологической ткани к раствору составляет от 1:10 до 1:40.
В одном из вариантов осуществления способа очистку биологического образца от мягких тканей проводят непосредственно после стадии предварительной обработки биологического материала.
В одном из вариантов осуществления способа очистку биологического образца от мягких тканей проводят после замораживания предварительного образца при температуре -20°С.
В одном из вариантов осуществления способа фракционирование биологического материала осуществляют отделением губчатого слоя кости от кортикального слоя.
В одном из вариантов осуществления способа фракционирование биологического материала осуществляют отделением диафиза трубчатой кости от метафиза и эпифиза.
В одном из вариантов осуществления способа фракционирование биологического материала осуществляют отделением периостального и среднего слоя от эндостального, причем периостальный и средний слой отделяют на глубину 8-10 мм.
В одном из вариантов осуществления способа обработку раствором перекиси водорода проводят в условиях ультразвуковой ванны.
В одном из вариантов осуществления способа каждый из растворов для грубой очистки меняют 1 раз в час в течение всей стадии отмывки.
В одном из вариантов осуществления способа биологический образец отделяют в форме блока губчатой кости.
В одном из вариантов осуществления способа биологический образец отделяют в форме блока губчатой и кортикальной кости.
В одном из вариантов осуществления способа биологический образец отделяют в форме кортикальной пластины.
В одном из вариантов осуществления способа биологический образец измельчают до состояния крошки или мелкодисперсного порошка кортикальной и/или губчатой кости.
Стадия глубокой очистки и экстракции включает обработку в растворе ионных и амфотерных поверхностно-активных веществ; отмывку матрикса в буферных растворах и/или деионизированной воде; нейтрализацию ионных поверхностно-активных веществ и ренатурацию белков; вторичную отмывку в буферных растворах и/или деионизированной воде; ультразвуковую экстракцию примесей.
В одном из вариантов осуществления способа в качестве ионных поверхностно-активных веществ используют додецилсульфат натрия в концентрации 0,1-10%.
В одном из вариантов осуществления способа в качестве ионных/анионных поверхностно-активных веществ используют лаурил сульфат, Тритон X-200, Тритон XQS-20, Тритон QS-15, Тритон QS-44 по отдельности в концентрации 0,1-10% или в смеси.
В одном из вариантов осуществления способа в качестве амфотерных поверхностно-активных веществ используют (3-[(3-холамидопропил)диметиламмонио]-1-пропансульфонат) в концентрации 0,1-10%.
В одном из вариантов осуществления способа ионные поверхностно-активные вещества и амфотерные поверхностно-активные вещества смешиваются в соотношении от 1:40 до 40:1.
В одном из вариантов осуществления способа обработку в растворе комплекса ионных и амфотерных поверхностно-активных веществ проводят с использованием ультразвукового дезинтегратора.
В одном из вариантов осуществления способа обработку в растворе комплекса ионных и амфотерных поверхностно-активных веществ проводят в течение 1-72 часов при температуре 35-41°С.
В одном из вариантов осуществления способа непосредственно перед стадией обработки в растворе комплекса ионных и амфотерных поверхностно-активных веществ раствор вместе с биологическим материалом сонифицируют с использованием ультразвукового дезинтегратора в течение 5-30 минут при температуре 35-41°С.
В одном из вариантов осуществления способа обработку в растворе комплекса ионных и амфотерных поверхностно-активных веществ проводят при постоянном перемешивании при орбитальной скорости 50-250 оборотов в минуту.
В одном из вариантов осуществления способа отмывку матрикса в буферных растворах и/или бидистиллированной деионизированной воде проводят в течение 1-72 часов при температуре 1-8°С, причем предпочтительным является фосфатно-солевой буферный раствор.
В одном из вариантов осуществления способа нейтрализации ионных поверхностно-активных веществ и ренатурацию белков проводят в растворе неионных поверхностно-активных веществ, включающего Тритон Х-100 в концентрации 0,1-5% и Tween-20 в концентрации 0,005-1%.
В одном из вариантов осуществления способа для нейтрализации ионных поверхностно-активных веществ используют Твин 80, Бридж 35/56/72/76/92V/97/58P, дигитонин, дигитоксигенин по отдельности в концентрации 0,1-10% или в смеси.
В одном из вариантов осуществления способа нейтрализацию и ренатурацию проводят при температуре 35-41°С.
В одном из вариантов осуществления способа нейтрализацию и ренатурацию проводят при постоянном перемешивании при орбитальной скорости 100-250 оборотов в минуту.
В одном из вариантов осуществления способа вторичную отмывку в буферных растворах и/или деионизированной воде проводят в течение 1-72 часов при температуре 1-8°С, причем предпочтительным является фосфатно-солевой буферный раствор.
В одном из вариантов осуществления способа каждый из растворов ионных и амфотерных поверхностно-активных веществ, неионных поверхностно-активных веществ и растворов для промывки меняют 1 раз в час.
В одном из вариантов осуществления способа в промывочный раствор добавляют антибиотики и/или антимикотики.
В одном из вариантов осуществления способа ультразвуковую экстракцию примесей проводят в условиях ультразвуковой ванны.
Предпочтительным способом является сочетание перфузии ионным детергентом, в частности додецилсульфатом натрия в концентрации 1%, растворенным в деионизированной воде, с последующей промывкой фосфатно-солевым буферным раствором и перфузией неионным детергентом, в частности Тритон X-100 в концентрации 1%, для удаления додецилсульфата натрия и ренатурации белков внеклеточного матрикса с последующей промывкой в фосфатно-солевом буферном растворе с антибиотиками в течение 72 часов.
В одном из вариантов осуществления способа непосредственно после отмывки в буферных растворах проводят центрифугирование костного матрикса в фосфатно-солевом буферном растворе при 300-3000 об/мин на горизонтальной центрифуге в течение 10-30 минут.
В одном из вариантов осуществления способа проводят отмывку в буферных растворах с переменной ионной силой.
В одном из вариантов осуществления способа проводят отмывку в растворе NaCl в концентрации 250-800 мМ.
В одном из вариантов осуществления способа отмывку проводят при температуре 0,5-2°С.
Стадия делипидирования включает обработку этанолом и/или смесью этанола и хлороформа; отмывку в буферных растворах или деионизированной воде или делипидирование в спиртах в условиях сверхкритических сред.
В одном из вариантов осуществления способа делипидирование проводят в смеси этанола и этилацетата, причем соотношение компонентов смеси от 1:1 до 1:4 соответственно.
В одном из вариантов осуществления способа после делипидирования в спиртах проводят дополнительную обработку в растворе толуола при 35-41°С в течение 1-72 часов.
В одном из вариантов осуществления способа после обработки в спиртах проводят последующую обработку гидроксидом натрия в концентрации 0,5-20 г/л при температуре 1-8°С в течение 1-72 часов.
Причем все стадии, за исключением того, где указано противоположное, осуществляются при постоянном перемешивании на роторной качалке-шейкере в условиях холодильной камеры при температуре 1-8°С, причем температура не должна превышать 8°С.
Стадия ферментации включает обработку в растворах ферментов – ДНКаза и/или трипсин и последующую отмывку в буферных растворах или деионизированной воде, причем обработку трипсином осуществляют с добавлением ионов магния (Mg2+) в фосфатно-солевом буферном растворе в концентрации 0,1-2%.
В одном из вариантов осуществления способа стадию ферментации осуществляют обработкой в растворе ДНКазы в концентрации 10-500 мкг/мл.
В одном из вариантов осуществления способа стадию ферментации осуществляют обработкой в растворе трипсина в концентрации 0,05-1%.
В одном из вариантов осуществления способа обработку трипсином осуществляют добавлением раствора магния хлорида в концентрации 0,05-5 мМ.
В одном из вариантов осуществления способа стадию ферментации осуществляют при температуре 37°С на орбитальном шейкере при 100-250 оборотов в минуту.
В одном из вариантов осуществления способа каждый из растворов для ферментации меняют 1 раз в час.
В одном из вариантов осуществления способа непосредственно после отмывки в буферных растворах проводят центрифугирование костного матрикса в фосфатно-солевом буферном растворе при 300-3000 об/мин на горизонтальной центрифуге в течение 10-30 минут.
Стадия деминерализации включает обработку в растворе смеси сильной кислоты и неионного детергента с последующей нейтрализацией, коррекцией pH и отмывкой.
В одном из вариантов осуществления способа стадию деминерализации осуществляют при температуре 18-25°С 0,6M раствором HCl в сочетании с 1% Тритон X-100 в течение 1-24 часов с дальнейшей нейтрализацией 0,5М NaOH при температуре 18-25°С и отмывкой в буферных растворах и/или деионизированной воде в течение 1-72 часов при температуре 1-8°С, причем предпочтительным является фосфатно-солевой буферный раствор.
В одном из вариантов осуществления способа перед стадией деминерализации костный материал предварительно высушивают при помощи сушильного шкафа или лиофильной сушки.
В одном из вариантов осуществления способа после отмывки проводят последующую обработку гидроксидом натрия в концентрации 0,5-20 г/л при температуре 1-8°С в течение 1-72 часов и проводят вторичную отмывку в буферных растворах и/или деионизированной воде проводят в течение 1-72 часов при температуре 1-8°С, причем предпочтительным является фосфатно-солевой буферный раствор.
Стадию стерилизации в сверхкритических средах проводят в условиях сверхкритического CO2 при давлении 250 бар и температуре 35-41°С в течение 1-3 часов, причем предпочтительной является температура 37-40°С.
В одном из вариантов осуществления способа изначально проводят статическое насыщение биологического материала сверхкритическим растворителем при температуре 35-41°С в течение 1-3 часов.
В одном из вариантов осуществления способа стерилизацию в сверхкритических средах проводят посредством постоянной подачи CO2 при скорости 1,5-5 кг/ч.
В одном из вариантов осуществления способа соотношение объема камеры и объема стерилизуемой биологической ткани должно составлять 1:20-1:200.
Полученный биологический матрикс может быть импрегнирован фосфатидилхолином и/или холестерином, с включенными желатином (гидролизованным коллагеном), и/или костным ателоколлагеном, и/или поли(е-капролактоном), и/или биологически активными веществами (включая биоактивные пептиды и факторы роста), причем раствор фосфатидилхолина и/или холестерина в этаноле ресуспендируют в круглодонной колбе, водные растворы желатина и/или биологически активных веществ вносят в колбу и выпаривают в роторном испарителе для получения пленки. Далее в колбу вносят предварительно очищенный биологический матрикс и выпаривают на роторном испарит