Соединения и способы усиления деградации белков-мишеней и других полипептидов с помощью е3 убиквитин лигазы
Иллюстрации
Показать всеИзобретение относится к бифункциональным соединениям, которые могут найти применение в качестве модуляторов мишеневого убиквитинирования, особенно ингибиторов различных полипептидов и других белков, которые деградируются и/или иным образом ингибируются бифункциональными соединениями в соответствии с настоящим изобретением. В частности, изобретение относится к соединениям, которые содержат на одном конце лиганд VHL, присоединенный к убиквитин лигазе, и на другом конце группу, которая связывает белок-мишень, так что белок-мишень размещен в непосредственной близости к убиквитин лигазе для осуществления деградации (и ингибирования) этого белка, демонстрирует широкий спектр фармакологической активности, связанной с соединениями в соответствии с настоящим изобретением, связанной с деградацией/ингибированием мишеневых полипептидов. 7 н. и 25 з.п. ф-лы, 19 ил., 2 таб., 1 пр.
Реферат
Область изобретения
Настоящее изобретение относится к бифункциональным соединениям, которые могут найти применение в качестве модуляторов мишеневого убиквитинирования, особенно, ингибиторов различных полипептидов и других белков, которые деградируются и/или иным образом ингибируются бифункциональными соединениями в соответствии с настоящим изобретением. В частности, настоящее изобретение относится к соединениям, которые содержат на одном конце лиганд VHL, который связывается с убиквитин лигазой VHL E3 (указываемый в данном документе как связывающая убиквитин лигазу лигандная группа ) и на другом конце группу, которая связывает белок-мишень (указываемая как мишеневая группа белка/полипептида или группа ), таким образом, что мишеневый белок/полипептид находится в непосредственной близости от убиквитин лигазы, чтобы осуществить деградацию (и ингибирование) этого белка. Настоящее изобретение демонстрирует широкий спектр фармакологической активности, связанной с соединением в соответствии с настоящим изобретением, в соответствии с деградацией/ингибированием мишеневых полипептидов.
Связанные заявки и поддержка грантом
По данной заявке испрашивается приоритет в соответствии с предварительной заявкой US61/585769 с идентичным заголовком, поданной 12 января 2011 г., полное содержание которой включено в данное описание путем ссылки.
Данное изобретение было разработано при поддержке правительственного гранта № AI084140 Национального института здоровья. Правительство имеет определенные права на данное изобретение.
Предпосылки изобретения
E3 убиквитин лигазы (среди которых более 600 являются известными у человека)1 придают субстрату специфичность к убиквитинированию и являются более привлекательными терапевтическими мишенями, чем обычные протеасомные ингибиторы3,4, из-за их специфичности к некоторым белковым субстратам. Хотя разработка лигандов E3 лигазы оказалась сложной, частично из-за того, что они должны прерывать белок-белковое взаимодействие,5 в последних разработках представлены специфические лиганды, которые связываются с этими лигазами. Белок-белковые взаимодействия, как известно, являются затрудненной целью для использования небольших молекул из-за участия больших контактных поверхностей и неглубоких бороздок или плоских поверхностей. С другой стороны, большинство препаратов из небольших молекул связывают ферменты или рецепторы в жестких и четко определенных карманах.6 С момента открытия нутлинов, первой небольшой молекулы ингибиторов E3 лигазы,7 были сообщения о дополнительных соединениях, мишенью которых являются ингибиторы апоптозных белков (IAP),8,9 SCFMet30,10 и SCFCdc4,11, однако, данная область остается недостаточно развитой.
Одной E3 лигазой с вызывающими интерес терапевтическими возможностями является супрессор опухолей фон Гиппель-Линдау (VHL), субъединица распознавания субстрата Е3 лигазным комплексом VCB, который также состоит из элонгинов B и C, Cul2 и Rbx1.12 Основной субстрат VHL представляет собой фактор 1α, индуцируемый гипоксией, (HIF-1α), фактор транскрипции, который активирует гены, такие как проангиогенный фактор роста VEGF и индуцирующий красные кровяные тельца цитокин эритропоэтин, в ответ на низкий уровень кислорода. В то время как HIF-1α конститутивно экспрессируется, его внутриклеточные уровни сохраняются очень низкими в нормоксических условиях посредством гидроксилирования его белками, имеющими домен пролил гидроксилазы, (PHD), и последующего опосредованного VHL убиквитинилирования (фиг. 1).
Используя рациональный дизайн, авторы разработали первые лиганды фон Гиппеля Линдау (VHL) из небольших молекул, субъединицу распознавания субстрата Е3 лигазой VCB, важной мишени при злокачественном новообразовании, хронической анемии и ишемии.2 Авторы также получили кристаллические структуры VHL с разработанным ими самым мощным лигандом, 15, подтверждая, что соединение имитирует режим связывания фактора транскрипции HIF-1α, основного субстрата VHL.
Из предыдущих биохимических и структурных исследований связывания гидроксилированного пептида HIF с VHL стало ясно, что гидроксипролин играет важную роль в обеспечении этого взаимодействия белок:белок. Как следствие этой работы, авторы настоящего изобретения разработали поляризационный флуоресцентный (FP) анализ связывания гидроксилированный пептид HIF:VHL, с помощью которого авторы проанализировали >120 соединений, имеющих центральный гидроксипролиновый остаток, окруженный непептидными фрагментами. В продолжение этого исследования, в настоящий момент авторы изобретения разработали сокристаллические структуры комплекса VHL с семью из предпочтительных соединений. Анализ этих связанных лигандом структур дает возможность осуществить дизайн/синтез следующего поколения лигандов VHL, которые связываются со связывающимися фрагментами белка, давая бифункциональные соединения в соответствии с настоящим изобретением.
Основным мотивом настоящего изобретения является потребность в небольшой молекуле E3 лигазного лиганда для разработанной авторами технологии PROTAC (Proteolysis Targeting Chimera). Эта технология подводит белки-мишени/полипептиды к E3 лигазам для убиквитинилирования и последующей протеасомной деградации. В нескольких доказывающих правильность концепции экспериментах авторы настоящего изобретения продемонстрировали полезность этого подхода с использованием короткой пептидной последовательности от HIF, которая связывается с VHL. Для того чтобы получить более "лекарственно-подобный" PROTAC, авторы изобретения заменили пептид HIF на "небольшую молекулу" лиганда VHL, обеспечивая тем самым средства для рекруитирования белков к Е3 лигазам для убиквитинилирования и деградации, и, в конце концов, предложили возможность лечения на основе этой деградации белка.
Объекты изобретения
Объект изобретения касается соединений, которые рекруитируют эндогенные белки к E3 убиквитин лигазе для деградации.
Дополнительным объектом изобретения является получение соединений, которые модулируют деградацию белка в организме пациента или субъекта и могут быть использованы для лечения заболевания или состояния, которые модулированы посредством деградированного белка.
Другим объектом изобретения является получение фармацевтических композиций, основанных на вышеописанных модуляторах, особенно, включая ингибиторы, для терапевтического лечения пациента или субъекта, предпочтительно включая пациента или субъекта человека.
Также объектом изобретения являются способы определения связывающих белок фрагментов, которые присоединяются к представляющим интерес белкам.
Еще одним объектом изобретения являются способы идентификации эндогенных белков в биологической системе, особенно, включая систему человека, которые связываются со связывающими белок фрагментами в соединениях в соответствии с настоящим изобретением.
И еще одним объектом изобретения являются способы идентификации эффектов деградации представляющих интерес белков в биологической системе с использованием соединений в соответствии с настоящим изобретением.
Еще одним объектом изобретения являются способы лечения пациентов, где деградация белков-мишеней обеспечивает предполагаемый терапевтический эффект.
Еще одним объектом изобретения являются соединения и композиции, которые могут быть использованы в первом медицинском применении.
Еще одним объектом изобретения являются соединения и/или композиции, которые могут быть использованы при лечении пациентов, когда деградация белков-мишеней обеспечивает предполагаемый терапевтический эффект.
Любой один или несколько из этих и/или других объектов изобретения могут быть легко поняты при обычном ознакомлении с представленным далее описанием изобретения.
Краткое описание фигур
На фигуре 1 показано: (A) Аккумуляция HIF-1α приводит к регуляции транскрипции генов, участвующих в гипоксическом ответе, таких как эритропоэтин и VEGF. (B) В нормоксических условиях HIF-1α гидроксилируется, распознается VHL, убиквитинилируется и деградируется протеасомой, предотвращая регуляцию транскрипции генов.
Фигура 2. С помощью WaterLOGS ЯМР-спектроскопии показано связывание 3, но не L-Hyp или NAc-Hyp-NMe, с VHL.
На фигуре 3 представлено графическое изображение, показывающее ключевое взаимодействие между 15 и VHL.
На фигуре 4 показана сокристаллическая 2,9 Å структура 15 (самые светлые серые углероды), связанная с VHL, указывается, что ее связывание имитирует связывание пептида HIF-1α (светлые серые углероды, pdb 1LM817).
На фигуре 5 показаны кристаллические структуры V54BC apo (A) и в комплексе с 15 (B). Плотность электронов (2F0-FC), размещенных вокруг остатков сайта связывания Hyp (палки, желтые углероды) и сохраненные молекулы воды (красные точки), и 15 (палочки, циановые углероды) показаны синим и оконтурены при 1,2σ. Поверхность белка показана зеленым при 50% прозрачности.
На фигурах 6-12A и B показана активность отдельных соединений в соответствии с настоящим изобретением в описанном анализе поляризации/смещения VHL. Соединения в соответствии с настоящим изобретением указаны под своим номером вверху каждого графика. Контрольное соединение представлено на фигуре 15B и служит в качестве минимальной поляризации (максимальное смещение) для целей сравнения. Процент ингибирования, как представлено, был определен путем нормализации до максимальной и минимальной поляризации, и изображен графически относительно log [VL]. Значения IC50 были определены с использованием Prism 5 для каждой репликации (n=9), которые затем были усреднены для определения среднего IC50 и стандартой ошибки среднего (SEM).
На фигуре 13 (наряду с таблицей 2 - таблицей сродства) представлено множество соединений по примерам в соответствии с настоящим изобретением.
На фигуре 14 представлено множество предпочтительных соединений из представленных в таблице 2 в соответствии с настоящим изобретением.
На фигуре 15 представлен еще ряд соединений в соответствии с настоящим изобретением и их активность. Большинство соединений являются активными в концентрациях ниже 100 мкМ.
На фигуре 16 представлено множество предпочтительных соединений из представленных на фигуре 15 в соответствии с настоящим изобретением.
На фигуре 17 представлены восемь особенно предпочтительных соединений из представленных на фигуре 15 в соответствии с настоящим изобретением.
На фигуре 18 представлены шесть предпочтительных соединений в соответствии с настоящим изобретением, которые содержат связывающие фрагменты белка-мишени эстрогена, присоединенные к предпочтительным связывающим фрагментам лиганд убиквитина.
На фигуре 19 показан класс предпочтительных соединений в соответствии с настоящим изобретением.
Краткое описание изобретения
Настоящее изобретение основано на открытии того, что белок убиквитинового пути убиквитинилирует белок-мишень, как только белок убиквитинового пути и белок-мишень располагаются в непосредственной близости от химерной конструкции, которая связывает белок убиквитинового пути и белок-мишень. Соответственно, настоящее изобретение относится к композиции, которая приводит к убиквитинилированию выбранного белка-мишени. Настоящее изобретение относится также к библиотеке композиций и ее применению.
В одном варианте осуществления настоящее изобретение относится к композиции, которая может быть использована для регуляции активности белка. Композиция содержит связывающий фрагмент белка убиквитинового пути (предпочтительно, для E3 убиквитин лигазы, отдельно или в комплексе с E2 убиквитин конъюгирующим ферментом, который ответственен за перенос убиквитина к белкам-мишеням) согласно определенной химической структуре, и фрагмент белка-мишени, которые соединены вместе, предпочтительно посредством линкера, где связывающий фрагмент белка убиквитинового пути распознает белок убиквитинового пути, и мишеневый фрагмент распознает белок-мишень, и где связывающий фрагмент белка убиквитинового пути связывается с мишеневым фрагментом.
В другом варианте осуществления настоящее изобретение относится к библиотеке соединений. Библиотека содержит более одного соединения, где каждая композиция имеет формулу A-B, где A представляет собой связывающий фрагмент белка убиквитинового пути (предпочтительно фрагмент E3 убиквитин лигазы, как описано иным образом в данном документе), и B представляет собой связывающий белок элемент библиотеки молекул, где A связан (предпочтительно посредством линкерной группы) с B, и где связывающий фрагмент белка убиквитинового пути распознает белок убиквитинового пути, в частности, E3 убиквитин лигазу. В конкретном варианте осуществления изобретения библиотека содержит конкретный распознающий убиквитинилирование пептид VHL для E3 убиквитин лигазы (связывающий фрагмент белка убиквитинового пути, как описано иным образом в данном документе) со случайными связывающими элементами белков-мишеней (например, библиотека химических соединений). Как таковой, белок-мишень не определен заранее, и этот метод может быть использован для определения активности предполагаемого связывающего элемента белка и его фармакологического значения в качестве мишени при деградации убиквитин лигазой.
В еще другом варианте осуществления настоящее изобретение относится к способу скрининга библиотеки по настоящему изобретению для идентификации соединения, содержащего мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией клетки. Способ включает инкубирование клетки с пулом элементов из библиотеки; контроль за заранее установленной функцией клеток; определение пула элементов, которые изменяют заданную функцию клетки; инкубирование клетки с композицией из идентифицированного пула элементов; контроль за заранее установленной функцией клетки; и идентификацию композиции, которая изменяет заданную функцию клетки, где идентифицированная композиция содержит мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией.
В другом варианте осуществления настоящее изобретение относится к способу скрининга библиотеки по настоящему изобретению для идентификации композиции, содержащей мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией клетки. Способ включает инкубирование клетки с каждой композицией из библиотеки; контроль за заранее установленной функцией клетки; идентификацию композиции, которая изменяет заданную функцию клетки; где идентифицированная композиции содержит мишеневый фрагмент, который распознает белок-мишень, связанный с заранее определенной функцией.
В еще другом варианте осуществления настоящее изобретение относится к способу идентификации белка-мишени, связанного с заранее определенной функцией клетки. Способ включает инкубирование клетки с композицией из библиотеки по настоящему изобретению; контроль за заранее установленной функцией клетки; идентификацию композиции, которая изменяет заданную функцию клетки; идентификацию белка-мишени, который присоединяется к идентифицированной композиции, где белок-мишень связан с заранее определенной функцией клетки.
В еще другом варианте осуществления настоящее изобретение относится к способу идентификации белка-мишени, связанного с заранее определенной функцией клетки. Способ включает инкубирование клетки с пулом объектов из библиотеки по настоящему изобретению; контроль за заранее установленной функцией клеток; идентификацию пула элементов, которые изменяют заданную функцию клетки; инкубирование клетки с композицией из идентифицированного пула элементов; контроль за заранее установленной функцией клеток; идентификацию композиции, которая изменяет заданную функцию клетки; и идентификацию белка-мишени, который присоединяется к идентифицированной композиции, где белок-мишень связан с заранее определенной функцией клетки.
В еще другом варианте осуществления настоящее изобретение относится к способу убиквитинилирования/деградации белка-мишени в клетке. Способ включает введение бифункциональной композиции, содержащей связывающий фрагмент белка убиквитинового пути и мишеневый фрагмент, предпочтительно соединенные посредством линкерной группы, как иным образом описано в данном документе, где связывающий фрагмент белка убиквитинового пути присоединен к мишеневему фрагменту, и где связывающий фрагмент белка убиквитинового пути распознает белок убиквитинового пути (например, убиквитин лигазу, предпочтительно E3 убиквитин лигазу) и мишеневый фрагмент распознает белок-мишень, так что деградация белка-мишени будет проходить, когда белок-мишень располагается в непосредственной близости от убиквитин лигазы, что приводит к деградации/ингибированию действия белка-мишени и контролю уровней белка. Контроль уровней белка, достигаемый настоящим изобретением, обеспечивает лечение заболевания или состояния, которые модулированы посредством белка-мишени, путем понижения уровня этого белка в клетках организма пациента.
В другом варианте осуществления настоящее изобретение относится к способу лечения пациента, при необходимости этого, страдающего заболеванием или состоянием, модулированным посредством белка, где деградация указанного белка будет приводить к терапевтическому действию на данного пациента, способ включает введение пациенту, при необходимости этого, эффективного количества соединения в соответствии с настоящим изобретением, необязательно в комбинации с другим биологически активным агентом. Заболевание или состояние может представлять собой заболевание, вызванное микробиологическим агентом или другим экзогенным агентом, таким как вирус, бактерии, грибки, простейшие или другие микробы, или может быть заболеванием, которое вызвано избыточной экспрессией белка, что приводит к заболеванию и/или состоянию.
В одном варианте осуществления настоящее изобретение относится к соединению, представленному химической структурой:
,
где L представляет собой линкерную группу, и
представляет собой связывающий фрагмент убиквитин лигазы, где указанная линкерная группа, кроме того, необязательно связана с группой .
В другом варианте осуществления настоящее изобретение относится к соединению, которое содержит группу , соответствующую общей структуре:
,
где представляет собой связывающий фрагмент убиквитин лигазы; предпочтительно лиганд, который связывает убиквитин лигазу, предпочтительно E3 убиквитин лигазу;
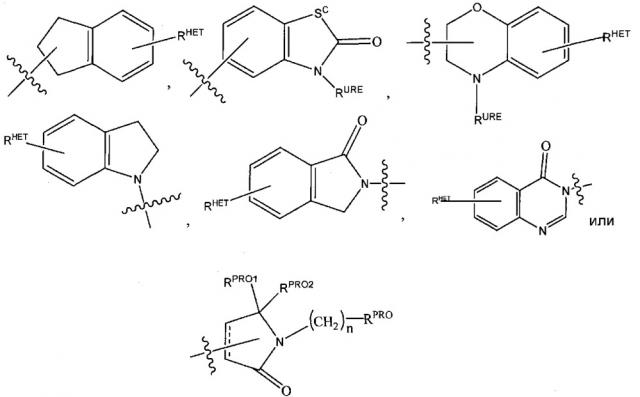
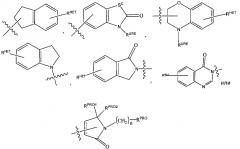
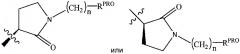
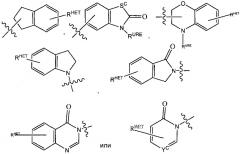
представляет собой химический фрагмент (фрагмент белка-мишени), который присоединяется к белку-мишени или полипептиду, который разрушается убиквитин лигазой, и химически связан с группой непосредственно или посредством линкера L, или альтернативно представляет собой группу , которая также является связывающим фрагментом убиквитин лигазы, которая может быть такой же или отличающейся от группы и присоединена к группе непосредственно или посредством линкерной группы; и
L представляет собой линкерный фрагмент, который может либо присутствовать, либо отсутствовать, и химически (ковалентно) связывает и ,
или его фармацевтически приемлемой соли, энантиомеру, стереоизомеру, сольвату или полиморфу.
В соответствии с некоторыми аспектами настоящего изобретения, когда группа представляет собой группу , соединение напоминает димерное соединение, где оба конца соединения содержат связывающий фрагмент убиквитин лигазы, как иным образом описано в данном документе.
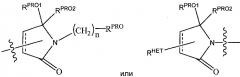
Согласно предпочтительным аспектам изобретения и, когда присутствует, , каждый, независимо представляют собой группу, соответствующую химической структуре:
,
где R1′ представляет собой необязательно замещенную C1-C6 алкильную группу, необязательно замещенный -(CH2)nOH, необязательно замещенный -(CH2)nSH, необязательно замещенную (CH2)n-O-(C1-C6)алкильную группу, необязательно замещенную (CH2)n-WCOCW-(C0-C6)алкильную группу, содержащую эпоксидную группу WCOCW, где каждый W независимо обозначает H или C1-C3 алкильную группу, необязательно замещенный -(CH2)nCOOH, необязательно замещенный -(CH2)nC(O)-(C1-C6 алкил), необязательно замещенный -(CH2)nNHC(O)-Rl, необязательно замещенный -(CH2)nC(O)-NR1R2, необязательно замещенный -(CH2)nOC(O)-NR1R2, -(CH2O)nH, необязательно замещенный -(CH2)nOC(O)-(C1-C6 алкил), необязательно замещенный -(CH2)nC(O)-O-(C1-C6 алкил), необязательно замещенный -(CH2O)nCOOH, необязательно замещенный -(OCH2)nO-(C1-C6 алкил), необязательно замещенный -(CH2O)nС(O)-(C1-C6 алкил), необязательно замещенный -(OCH2)nNHC(O)-R1, необязательно замещенный -(CH2O)nC(O)-NR1R2, -(CH2CH2O)nH, необязательно замещенный -(CH2CH2O)nCOOH, необязательно замещенный -(OCH2CH2)nO-(C1-C6 алкил), необязательно замещенный -(CH2CH2O)nC(O)-(C1-C6 алкил), необязательно замещенный -(OCH2CH2)nNHC(O)-Rl, необязательно замещенный -(CH2CH2O)nC(O)-NR1R2, необязательно замещенный -SO2RS, необязательно замещенный S(O)RS, NO2, CN или галоген (F, Cl, Br, I, предпочтительно F или Cl);
R1 и R2, каждый, независимо представляют собой H или C1-C6 алкильную группу, которая необязательно может быть замещена одной или двумя гидроксильными группами или до трех группами галогена (предпочтительно фтора);
RS представляет собой C1-C6 алкильную группу, необязательно замещенную арильную, гетероарильную или гетероциклическую группу или группу -(CH2)mNR1R2,
X и X′, каждый, независимо представляют собой C=O, C=S, -S(O), S(O)2, (предпочтительно X и X′ оба представляют собой C=O);
R2′ представляет собой необязательно замещенную -(CH2)n-(C=O)u(NR1)v(SO2)wалкильную группу, необязательно замещенную группу -(CH2)n-(C=O)u(NR1)v(SO2)wNR1NR2N, необязательно замещенный -(CH2)n-(C=O)u(NR1)v(SO2)w-арил, необязательно замещенный -(CH2)n-(C=O)u(NR1)v(SO2)w-гетероарил, необязательно замещенный -(CH2)n-(C=O)vNR1(SO2)w-гетероцикл, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-алкил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -NR1-(CH2)n-(C=O)u(NR1)v(SO2)w-арил, необязательно замещенный -NR1-(CH2)n-(C=O)u(NR1)v(SO2)w-гетероарил или необязательно замещенный -NR1-(CH2)n-(C=O)vNR1(SO2)w-гетероцикл, необязательно замещенную -XR2′-алкильную группу; необязательно замещенную -XR2′-арильную группу; необязательно замещенную -XR2′-гетероарильную группу; необязательно замещенную -XR2′-гетероциклильную группу; необязательно замещенную;
R3′ представляет собой необязательно замещенный алкил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-алкил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-C(O)NR1R2, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-арил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-гетероарил, необязательно замещенный -(CH2)n-C(O)u(NR1)v(SO2)w-гетероцикл, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-алкил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-арил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-гетероарил, необязательно замещенный -NR1-(CH2)n-C(O)u(NR1)v(SO2)w-гетероцикл, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-алкил, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-NR1NR2N, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-NR1C(O)R1N, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-арил, необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-гетероарил или необязательно замещенный -O-(CH2)n-(C=O)u(NR1)v(SO2)w-гетероцикл; -(CH2)n-(V)n′-(CH2)n-(V)n′-алкильную группу, необязательно замещенную -(CH2)n-(V)n′-(CH2)n-(V)n′-арильную группу, необязательно замещенную -(CH2)n-(V)n′-(CH2)n-(V)n′-гетероарильную группу, необязательно замещенную -(CH2)n-(V)n′-(CH2)n-(V)n′-гетероциклильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-алкильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-арильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-гетероарильную группу, необязательно замещенную -(CH2)n-N(R1′)(C=O)m′-(V)n′-гетероциклильную группу, необязательно замещенную -XR3′-алкильную группу; необязательно замещенную -XR3′-арильную группу; необязательно замещенную -XR3′-гетероарильную группу; необязательно замещенную -XR3′-гетероциклильную группу; необязательно замещенную;
где R1N и R2N, каждый, независимо представляют собой H, C1-C6 алкил, который необязательно замещен одной или двумя гидроксильными группами и до трех группами галогена, или необязательно замещенную -(CH2)n-арильную, -(CH2)n-гетероарильную или -(CH2)n-гетероциклильную группу;
V представляет собой O, S или NR1;
R1 имеет значения, указанные выше;
R1 и R1′, каждый, независимо представляют собой H или C1-C6 алкильную группу;
XR2′ и XR3′, каждый, независимо представляют собой необязательно замещенный -(CH2)n-, -(CH2)n-CH(XV)=CH(XV)- (цис или транс), -(CH2)n-CH≡CH-, -(CH2CH2O)n- или C3-C6 циклоалкильную группу, где Xv представляет собой H, галоген или C1-C3 алкильную группу, которая является необязательно замещенной;
каждый m обозначает независимо 0, 1, 2, 3, 4, 5, 6;
каждый m′ обозначает независимо 0 или 1;
каждый n независимо обозначает 0, 1, 2, 3, 4, 5, 6;
каждый n′ обозначает независимо 0 или 1;
каждый u обозначает независимо 0 или 1;
каждый v обозначает независимо 0 или 1;
каждый w обозначает независимо 0 или 1; и
где любой один или несколько из R1′, R2′, R3′, X и X′ в модифицированы с целью ковалентного присоединения к группе посредством линкерной группы, когда не представляет собой , или когда представляет собой , один или несколько из R1′, R2′, R3′, X и X′ из каждого и модифицированы для ковалентного присоединения друг к другу напрямую или посредством линкерной группы,
или его фармацевтически приемлемая соль, стереоизомер, сольват или полиморф.
В альтернативных вариантах осуществления настоящего изобретения и, когда присутствует, , каждый, независимо представляют собой группу, соответствующую химической структуре:
,
где каждый из R1′, R2′, R3′ являются таким, как описано выше, и X представляет собой группу C=O, C=S, -S(O) или группу S(O)2, более предпочтительно группу C=O, и
где любой один или несколько из R1′, R2′, R3′ модифицированы для присоединения к линкерной группе, которая, кроме того, ковалентно связана с группой , когда группа не представляет собой группу , или, когда представляет собой группу , любой один или несколько из R1′, R2′, R3′ в каждом из и модифицированы для ковалентного присоединения друг к другу либо непосредственно, либо посредством линкерной группы, или его фармацевтически приемлемая соль, энантиомер, диастереомер, сольват или полиморф.
В соответствии с еще дополнительными предпочтительными аспектами настоящего изобретения и, когда присутствует, , каждый, независимо соответствуют химической структуре:
,
где любой один или несколько из R1′, R2′, R3′ модифицированы с целью присоединения к линкерной группе, которая, кроме того, ковалентно связана с группой , когда группа не представляет собой группу , или, когда представляет собой группу , любой один или несколько из R1′, R2′, R3′ в каждом из и модифицированы для ковалентного присоединения друг к другу либо непосредственно, либо посредством линкерной группы, или его фармацевтически приемлемая соль, энантиомер, диастереомер, сольват или полиморф.
Согласно другим предпочтительным аспектам настоящего изобретения R1′ представляет собой предпочтительно гидроксильную группу или группу, которая может быть метаболизирована до гидроксильной или карбоксильной группы, так что соединение представляет собой пролекарственную форму активного соединения. Примеры предпочтительных групп R1′ включают, например, -(CH2)nOH, (CH2)n-O-(C1-C6)алкильную группу, -(CH2)nCOOH, -(CH2O)nH, необязательно замещенный -(CH2)nOC(O)-(C1-C6 алкил) или необязательно замещенный -(CH2)nC(O)-O(C1-C6 алкил), где n обозначает 0 или 1. Когда R1′ представляет собой или содержит группу карбоновой кислоты, гидроксильную группу или аминогруппу, тогда гидроксильная группа, группа карбоновой кислоты или аминогруппа (каждая из которых может быть необязательно замещена) могут быть далее химически модифицированы с обеспечением ковалентного связывания с линкерной группой, к которой присоединена группа (включая группу ).
X и X′, когда присутствуют, предпочтительно представляют собой группу C=O, C=S, -S(O) или группу S(O)2, более предпочтительно группу C=O.
R2′ предпочтительно представляет собой необязательно замещенный -NR1-T-арил, необязательно замещенную -NR1-T-гетероарильную группу или необязательно замещенный -NR1-T-гетероцикл, где R1 представляет собой H или CH3, предпочтительно H, и T представляет собой необязательно замещенную -(CH2)n-группу, где каждая одна из метиленовых групп может быть необязательно замещена одним или двумя заместителями, предпочтительно выбранными из галогена, боковой цепи аминокислоты, как иным образом описано в данном документе, или C1-C3 алкильной группы, предпочтительно одной или двумя метильными группами, которые могут быть необязательно замещены; и n обозначает от 0 до 6, часто 0, 1, 2 или 3, предпочтительно 0 или 1. Альтернативно, T также может представлять собой -(CH2O)n-группу, -(OCH2)n-группу, -(CH2CH2O)n-группу, -(OCH2CH2)n-группу, все из указанных групп необязательно замещены.
Предпочтительные арильные группы для R2′ включают необязательно замещенные фенильные или нафтильные группы, предпочтительно фенильные группы, где фенильная группа необязательно замещена линкерной группой, к которой присоединена группа (включая группу ), галоген (предпочтительно F или Cl), амин, моноалкил- или диалкиламин (предпочтительно диметиламин), F, Cl, OH, COOH, C1-C6 алкил, предпочтительно CH3, CF3, OMe, OCF3, NO2 или CN группа (каждая из которых может быть замещена в орто-, мета- и/или пара-положении фенильного кольца, предпочтительно пара-), или необязательно замещенная фенильная группа (фенильная группа, в свою очередь, предпочтительно замещена линкерной группой, присоединенной к группе , включая группу ) и/или, по меньшей мере, одной из групп F, Cl, OH, COOH, CH3, CF3, OMe, OCF3, NO2 или CN (в орто-, мета- и/или пара-положениях фенильного кольца, предпочтительно пара-), нафтильной группой, которая необязательно может быть замещена, необязательно замещенным гетероарилом, предпочтительно необязательно замещенным изоксазолом, включая метилимидазол, необязательно замещенным оксазолом, включая метилзамещенный оксазол, необязательно замещенным тиазолом, включая метилзамещенный тиазол, необязательно замещенным изотиазол