Биосовместимая ранозаживляющая композиция
Иллюстрации
Показать всеИзобретение относится к медицине. Описана композиция, которая содержит хитозан и/или солевую форму хитозана или его производных - блок- и привитые сополимеры, такие как хитозан - поливинилпирролидон, и органо-неорганический сополимер полилактида с полититаноксидом при следующем соотношении компонентов, масс. %: хитозан и/или солевая форма хитозана или его производных - блок- и привитые сополимеры - 50-90, органо-неорганический сополимер полилактида с полититаноксидом - 10-50. Композиция может дополнительно содержать наночастицы золота, аминокислоты. Композиция ускоряет заживление ран различной этиологии без воспалительных осложнений в отсутствие специально вводимых бактерицидных препаратов. 3 з.п. ф-лы, 1 табл., 9 пр.
Реферат
Область техники
Предлагаемое изобретение относится к области биотехнологии, медицины и ветеринарии, а именно к ранозаживляющим средствам, способным продуцировать активные формы кислорода (АФК), стимулирующие процессы пролиферации и дифференциации клеток, обладающим бактерицидностью, биосовместимостью, гипоаллергенностью и регулируемым временем биодеградации. Предлагаемое изобретение может быть использовано для заживления ран и ожогов различной этиологии. Применение композиции также эффективно при лечении пролежней и гнойных ран и позволяет сократить сроки лечения в несколько раз.
Уровень техники
В последние годы был разработан достаточно широкий спектр материалов и изделий медицинского назначения на основе природных и синтетических полимеров в области ранозаживляющих средств.
Известна композиция, защищенная патентом (US 8642088 В2, опубл. 04.02.2014), содержащая матрицу из хитозана и танинов, где танины содержат один или несколько олигомерных проантоцианидинов. Хитозан электростатически связан с одним или несколькими олигомерными проантоцианидинами. Матрица из хитозана и танинов представлена в виде хитозан-танинового композиционного материала, в котором композиция представляет собой гидрогелевую пленку. Композиционный материал хитозан-танин не включает сшивающий агент. Прочность на растяжение композитного материала выше, чем у той же самой пленки гидрогеля, содержащей хитозан, но без олигомерного проантоцианидина. Такая композиция может быть выполнена в виде наночастиц, гидрогелевой пленки, биопены или биогеля. Композиция может использоваться для доставки лекарств, для антибактериальных и/или противогрибковых применений, для применения в тканевой инженерии, для заживления ран.
Недостатком композиции является то, что танины являются дубильными веществами и будут приводить к гибели фибробластов и др. клеток кожи. Танины сужают поры кожи и замедляют процесс регенерации тканей. Являясь сильным антиоксидантом, танины будут существенно снижать концентрацию АФК, продуцируемых фагоцитами в области раневой поверхности. Известно, что АФК, синтезируемые фагоцитами, стимулируют процессы пролиферации, сокращают сроки ранозаживления.
Известна раневая повязка с противомикробными свойствами для нанесения на рану и способ ее изготовления, защищенная патентом (US 9610378 В2, опубл. 04.04.2017). Противомикробную раневую повязку получают путем нанесения на пористую раневую повязку хитозана с наночастицами серебра. Она обладает превосходным свойством пролонгированного высвобождения наночастиц серебра. Данная раневая повязка обладает антибактериальной активностью против различных патогенных бактерий при минимальной токсичности по отношению к нормальным клеткам, не прилипает к поверхности раны при поглощении экссудата, и может пролонгировано выделять хитозан-наночастицы серебра, поддерживая антибактериальную активность в течение длительного периода времени. Способ приготовления включает стадии: получение раствора антибактериального покрытия с использованием водорастворимого хитозана и наночастиц серебра; адсорбирование и нанесение раствора на пористый материал; сушку пористого материала, с адсорбированным на ней раствором, в результате чего получают раневую повязку с диспергированными в ней частицами хитозан-наночастицами серебра.
Недостатком данного изобретения является частичное ингибирование скорости ранозаживления за счет присутствия наночастиц серебра. Повязка является небиодеградируемой, непрозрачной, что не позволяет контролировать состояние раны без удаления повязки.
Наиболее близким техническим решением к заявляемому является изобретение «Способ получения композиционных рассасывающихся материалов на основе хитозана и полилактида» (патент RU 2540468, опубл. 20.05.2014), в котором предлагается способ получения композиции на основе хитозана и полилактида, включающий приготовление разбавленного раствора хитозана в минеральной или органической кислоте и приготовление раствора полилактида в одном или нескольких органических растворителях. В раствор хитозана добавляют от 10 до 50% раствора полилактида от массы хитозана при непрерывном перемешивании, полученную смесь подвергают ультразвуковой обработке до получения блок-сополимера хитозана с полилактидом.
Недостатком данной композиции является то, что композиция не обладает достаточными ранозаживляющими и бактерицидными свойствами, возникает риск инфицирования раны.
Раскрытие изобретения
Техническая проблема, решаемая предлагаемым изобретением, - создание эффективной биосовместимой ранозаживляющей композиции для лечения ран различной этиологии, продуцирующей АФК, стимулирующие процессы пролиферации и дифференциации клеток, с бактерицидными свойствами.
Технический результат от использования изобретения заключается в ускорении заживления ран различной этиологии более чем в два раза, по сравнению с естественной скоростью эпителизации тканей (3-5 дней против 7-10 дней) без воспалительных осложнений в отсутствии специально вводимых бактерицидных препаратов.
Указанный технический результат достигается тем, что биосовместимая ранозаживляющая композиция на основе хитозана и полилактида, содержит хитозан и/или солевую форму хитозана или его производных - блок- и привитые сополимеры, такие как хитозан - поливинилпирролидон, и органо-неорганический сополимер полилактида с полититаноксидом в высокодисперсном состоянии при следующем соотношении компонентов, масс. %:
| хитозан и/или солевая форма хитозана | |
| или его производных - блок- и привитые | |
| сополимеры | 50-90 |
| органо-неорганический сополимер полилактида | |
| с полититаноксидом | 10-50. |
Композиция может дополнительно содержать наночастицы золота с содержанием от 0,01-3 масс. %.
Композиция может дополнительно содержать аминокислоты, такие как лизин, пролин, глицин или их смесь, с содержанием аминокислот от 0,1 до 1 масс. %.
Солевые формы хитозана представляют собой хлорид, сукцинат, ацетат, аскорбат, никотинат хитозана.
Подробное раскрытие изобретения
Вышеуказанные и иные аспекты и преимущества настоящего изобретения раскрыты в нижеследующем подробном его описании.
АФК выполняют роль сигнальных молекул клеток для большинства биологических систем, тканей человека и животных. Фагоцитирующие клетки используют АФК для реализации своего антимикробного действия. Фагоцитирующие клетки (нейтрофилы, макрофаги, поглощающие погибшие клетки и вирулентные бактерии), используя АФК, будут увеличивать свою антимикробную эффективность, не допуская инфицирование раневой поверхности. Образующиеся в фагоцитах перекись водорода и O2-, а также дополнительные свободные радикалы, продуцированные фагоцитами, являются одним из активаторов запуска клеточной пролиферации и дифференцировки в процессе ранозаживления. Активные формы кислорода, являясь инициаторами и регуляторами апоптоза и запуская запрограммированную гибель поврежденных и маложизнеспособных клеток раневой поверхности (без их некроза), буду снижать, уменьшать до минимума воспалительные процессы.
Продукты биодеградации хитозана в ране - ди- и моносахариды - будут использованы клетками в качестве энергетического субстрата для синтеза АТФ - энергетической «валюты» клетки. Они обладают иммуностимулирующим и общеукрепляющим эффектами и выступают в качестве энергетического и пластического материала при эпителизации.
Полилактид является одним из наиболее распространенных синтетических биосовместимых и биоразлагаемых полимеров, которые используются в медицинской практике. В частности, из него изготавливают длительно функционирующие хирургические нити и биомедицинские материалы для сердечно-сосудистой хирургии.
Полилактид обеспечивает регулирование скорости биодеградации и повышенную механическую прочность композиции (пленки).
При создании биосовместимых материалов особое внимание необходимо уделять аспектам их взаимодействия с биологической средой организма, физиологическому связыванию с окружающими тканями. Повысить устойчивость композитов действию различных вредных бактерий и микроорганизмов можно с помощью специальных добавок, оказывающих антибактериальный эффект, но не препятствующих естественной интеграции материала в ткани организма. Одним из эффективных таких наполнителей является диоксид титана в наноразмерной форме, который в настоящее время применяется как фотокатализатор. Диоксид титана на своей поверхности генерирует АФК (, •ОН, время жизни составляет 10-9 с) за счет протекания обратимого одноэлектронного перехода при световом воздействии.
Эти АФК могут не только разлагать вредные загрязняющие вещества и связываться с бактериями и микробами, вызывая их гибель (обладают бактерицидным и вирулицидным действием), а также полное разложение оставшихся тканей бактерий. Следует отметить, что все эти процессы протекают вблизи поверхности композита и не приводят к образованию вредных для организма биоцидов. Известно, что использование порошкообразного диоксида титана в качестве антисептического средства в три раза эффективнее действия хлора и в полтора раза эффективнее действия азота. Кроме того, известно, что TiO2 используется в медицине как покрытие ортопедических имплантов, что способствует их адгезии внутри организма и ускоренному росту вокруг них клеток костной ткани (остеобластов) благодаря естественному концентрации на их поверхности Са-содержащих соединений.
Активность TiO2 зависит от размеров его частиц (удельной поверхности) и аллотропной модификации. Продуцирование АФК увеличивается при снижении размера частиц и достигает максимального значения при нахождении диоксида титана в коллоидном состоянии (размер частиц менее 50 нм).
В данном изобретении предлагается композиция, в которой используется не порошкообразный диоксид титана, а его полимерная форма - высокодисперсный полититаноксид анатазной структуры, химически связанный с полилактидом и равномерно распределенный в нем (органо-неорганический сополимер). Размер частиц полититаноксида менее 30 нм.
Сочетание в органо-неорганическом сополимере полилактида с полититаноксидом в высокодисперсном состоянии выполняет несколько функций: обеспечивает оптическую прозрачность композиции и высокую эффективность генерирования АФК, позволяет регулировать скорость биодеградации композиции в ране, что в совокупности ускоряет процесс ранозаживления.
Предлагаемая композиция в виде пленки - эластичная, оптически прозрачная, что позволяет контролировать состояние раны. Пленка наносится непосредственно на рану и не вызывает болевых ощущений.
Композиция может дополнительно содержать наночастицы золота с содержанием от 0,01 масс. % до 3 масс. % для легирования ими полититаноксида с целью увеличения скорости образования активных форм кислорода и генерирования активных форм кислорода не только УФ-, но и видимым светом.
Композиция может дополнительно содержать аминокислоты - лизин, пролин, глицин - для обеспечения ускоренного ранозаживления и безрубцовой эпителизации ткани.
Показано бактерицидное действие композиции по отношению к культурам ряда бактерий: Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli.
Композицию готовят следующим образом. Вначале готовят органо-неорганический сополимер полилактида с политинаноксидом путем смешения лактида (промышленный образец) с алкоксидом титана (промышленный образец), в массовом соотношении компонентов ω(лактид):ω(Ti(OPri)4) от 25:75 до 50:50, затем прогревают систему при температуре 130°С в течение 24 часов в атмосфере аргона. После окончания синтеза продукт выделяют с помощью этилового спирта и высушивают под вакуумом до постоянной массы. В результате получается сополимер полилактида с полититаноксидом в высокодисперсном состоянии. Далее смешивают сополимер с раствором 2-4% раствора хитозана (промышленный образец). Далее из полученной смеси заливают пленку методом полива на подложку, высушивают при температуре 20-45°С, а затем вакуумируют до постоянной массы, получая пленку предлагаемого состава.
Осуществление изобретения (с примерами)
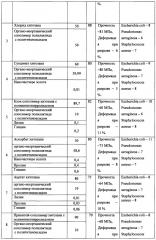
Пример 1.
Получали оптически прозрачную ранозаживляющую пленку на основе композиции состава: хитозана 90 масс. %, сополимера полилактида с полититаноксидом 10 масс. % (массовое соотношение компонентов в сополимере ω(полилактида):ω(полититаноксида)=85%: 15%).
Механические свойства пленок (разрывную прочность σ и относительное удлинение ε) определяли на разрывной машине ZWIC Z005 (Германия) при скорости растяжения 50 мм/мин. Прочность при разрыве ранозаживляющей пленки указанного состава составляет 70 МПа, а деформация при разрыве ~ 8%. Таким образом, пленки обладают высокой прочностью при разрыве и хорошей деформацией.
Исследовали светопропускание пленки на спектрофотометре УФ- и видимого диапазонов UV-1650 (Shimadzu). Светопропускание пленки в видимой области спектра превышает 70%. При УФ-воздействии на пленку в течение 1 часа наблюдается снижение ее светопропускания в видимой области спектра на ~ 10%, что связанно с процессами образования на ее поверхности АФК в результате одноэлектронного перехода .
Для исследования способности пленок к ранозаживлению проводили опыты на экспериментальных животных - кроликах. Для этого у предварительно наркотизированных опытных животных снимали лоскут ткани размером 40×60 мм с левого бедра и закрывали поврежденную область пленкой, края которой фиксировали хирургическим клеем. Далее оценивали время эпителизации тканей. Результаты показали, что при использовании пленки указанного состава ранозаживление происходит в 2 раза быстрее, чем без нее (в контрольных опытах без пленки) - раневая поверхность зажила за четыре дня против 8 дней в контрольном опыте без использования композиции. Количество эозинофилов, характеризующих гипериммунный ответ в форме аллергии, значений находился в пределах величин контрольной группы, а через 10 дней - не превышал значений нормы (интактных животных).
Биодеградацию пленки исследовали на белых нелинейных крысах, которых разделяли на 4 группы по 5 особей в каждой: 1 группа - интактные животные (норма), 2 группа - контрольные животные, 3 и 4 группы - опытные животные. Предварительно наркотизированным животным 2-4 групп делали разрез кожи в межлопаточной области. Опытным животным (3 и 4 группы) подкожно вводили образцы ранозаживляющей пленки, после чего разрез зашивали. Контрольным животным зашивали рану, не вводя под кожу пленку. Через 1 неделю у животных всех групп забирали кровь для анализа с целью определения функционального состояния организма. Количество лейкоцитов, лимфоцитов и эозинофилов у опытных животных статистически значимо не отличалось от значений у контрольных животных. Это служило свидетельством отсутствия у животных аллергической реакции и стресса на введение пленки. Одновременно забивали животных и извлекали пленку с целью определения ее размеров. Размеры пленки уменьшались на 40-50%, что указывало на начало ее биодеградации. Спустя две недели после введения пленки показатели крови животных опытных групп достоверно не отличались от показателей крови интактных и контрольных животных. Вскрытие участков, куда вводили пленку, показало ее отсутствие, что указывало на ее биодеградируемость. Отсутствие отрицательных показателей крови и признаков воспаления свидетельствует о нетоксичности композиции.
Параллельно были проведены испытания бактерицидного действия биосовместимой ранозаживляющей пленки. В качестве тест культур использовались следующие виды бактерий: Escherichia coli (кишечная палочка), Pseudomonas aeruginosa (синегнойная палочка), Staphylococcus aureus (стафилококк золотистый). Для оценки бактерицидной активности исследуемую композицию помещали на поверхность агаризованной питательной среды. В питательную среду вводились тест-культуры бактерий. О наличии бактерицидной активности судили по зоне ингибирования роста тест-культур бактерий, которая образуется вокруг исследуемых образцов. В результате испытаний зона ингибирования роста бактерий составила:
Escherichia coli - 11 мм,
Pseudomonas aeruginosa - 7 мм,
Staphylococcus aureus - 8 мм.
Таким образом, подтверждается эффективное бактерицидное действие образцов на примере патогенных бактерий.
Все биосовместимые ранозаживляющие композиции, описанные в примерах 1-9 обладают высоким ранозаживляющим эффектом, бактерицидностью и нетоксичностью. При проведении экспериментов во всех случаях наблюдалось увеличение скорости ранозаживления и эпителизации в 2 раза - за 3-5 дня против 7-10 дней по сравнению с контрольной группой животных (т.е. без использования композиции). Все композиции способны к биодеградации в сроки от 2 до 4 недель.
Все солевые формы хитозана взаимозаменяемые, обеспечивающие растворимость хитозана без изменения сроков ранозаживления.
Увеличение концентрации хитозана или его производных в составе композиции, а также органо-неорганического сополимера полилактида с полититаноксидом, наночастиц золота и аминокислот, выше пределов указанных в формуле изобретения не целесообразно, поскольку не изменяет сроков ранозаживления по сравнению с предлагаемым составом композиции. Кроме того, снижается эластичность пленок (деформация) и увеличивается их хрупкость. Уменьшение этих концентраций ниже указанных пределов - снижает эффективность всех полезных свойств биосовместимой ранозаживляющей композиции.
Таким образом, предлагаемая биосовместимая ранозаживляющая композиция позволяет ускорить заживление ран различной этиологии в два раза, по сравнению с естественной скоростью эпителизации тканей (3-5 дней против 7-10 дней) без воспалительных осложнений в отсутствии специально вводимых бактерицидных препаратов.
1. Биосовместимая ранозаживляющая композиция на основе хитозана и полилактида, отличающаяся тем, что она содержит хитозан и/или солевую форму хитозана или его производных - блок- и привитые сополимеры, такие как хитозан - поливинилпирролидон, и органо-неорганический сополимер полилактида с полититаноксидом в высокодисперсном состоянии, при следующем соотношении компонентов, масс.%:
| хитозан и/или солевая форма хитозана | |
| или его производных - блок- и привитые | |
| сополимеры | 50-90 |
| органо-неорганический сополимер полилактида | |
| с полититаноксидом | 10-50 |
2. Композиция по п. 1, отличающаяся тем, что она дополнительно содержит наночастицы золота с содержанием от 0,01-3 масс. %.
3. Композиция по п. 1, отличающаяся тем, что она дополнительно содержит аминокислоты, такие как лизин, пролин, глицин или их смесь, с содержанием аминокислот от 0,1 до 1 масс. %.
4. Композиция по п. 1, отличающаяся тем, что солевые формы хитозана представляют собой хлорид, сукцинат, ацетат, аскорбат, никотинат хитозана.