Внутриглазные имплантаты, содержащие простамиды
Иллюстрации
Показать всеГруппа изобретений относится к медицине и предназначена для снижения внутриглазного давления у пациента с глаукомой. Описаны биодеградируемый внутриглазной имплантат, содержащий простамиды и соединения простамидов, а также способ его получения. Группа изобретений позволяет расширить арсенал терапевтических средств. 2 н. и 1 з.п. ф-лы, 10 ил., 3 табл., 2 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА
В данной заявке заявляется приоритет согласно кодексу США, раздел 35, § 119 (е) по предварительной заявке на патент США №61/798291, поданной 15 марта 2013 года, предварительной заявке на патент США №61/877573, поданной 13 сентября 2013 года и предварительной заявке на патент США №61/898210, поданной 31 октября 2013 года, которые включены в данный документ в полном объеме посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0001] Изобретение в целом относится к устройствам и способам лечения заболеваний глаза у пациента, а более конкретно - к внутриглазным имплантатам, которые обеспечивают пролонгированное высвобождение терапевтического агента в глаз, в который установлен имплантат, для лечения глазной гипертензии, например, путем снижения или по меньшей мере поддержания внутриглазного давления (ВГД), и к способам получения и использования таких имплантатов.
[0002] Агенты, понижающие давление в глазу, эффективны при лечении ряда различных гипертензивных состояний глаза, таких как приступы повышенного внутриглазного давления после хирургической или лазерной трабекулэктомии, глаукома, и как предоперационные дополнительные вспомогательные вещества.
[0003] Глаукома представляет собой заболевание глаза, которое часто характеризуется повышенным внутриглазным давлением. На основании ее этиологии, различают первичную или вторичную глаукому. Например, первичная глаукома у взрослых (врожденная глаукома) может быть либо открытоугольной, либо острой или хронической закрытоугольной. Вторичная глаукома возникает вследствие ранее перенесенных глазных заболеваний, таких как увеит, внутриглазные опухоли или расширенная катаракта.
[0004] Увеличение внутриглазного давления при глаукоме происходит вследствие затруднения оттока внутриглазной жидкости. При хронической открытоугольной глаукоме передняя камера и ее анатомические структуры выглядят практически нормально, но дренаж внутриглазной жидкости затруднен. При острой или хронической закрытоугольной глаукоме передняя камера неглубокая, радужно-роговичный угол сужен, а радужная оболочка может заслонять трабекулярную сеть на входе в канал Шлемма. Расширение зрачка может приводить к выталкиванию корня радужки по направлению к углу и может вызывать блокировку зрачка и, таким образом, спровоцировать острый приступ. Глаза с узкими углами передней камеры предрасположены к приступам острой закрытоугольной глаукомы различных степеней тяжести.
[0005] Вторичную глаукому может вызвать любое препятствие оттоку внутриглазной жидкости из задней камеры в переднюю камеру и впоследствии в канал Шлемма. Воспалительные заболевания передней камеры могут препятствовать оттоку влаги за счет полной задней синехии бомбированной радужки и могут закупоривать дренажный канал экссудатом. Другими распространенными причинами являются внутриглазные опухоли, расширенная катаракта, окклюзия центральной вены сетчатки, травма глаза, хирургические процедуры и внутриглазное кровоизлияние.
[0006] Снижение внутриглазного давления может способствовать предотвращению глаукомы или потери зрения вследствие глаукомы. В настоящий момент глазные капли, содержащие терапевтически активные агенты для снижения внутриглазного давления, назначаются многим пациентам, которые могут принимать капли один или более раз в день для снижения повышенного внутриглазного давления, связанного с глаукомой.
[0007] Было бы полезно предложить системы доставки лекарственных средств, которые можно имплантировать в глаз, такие как внутриглазные имплантаты, и способы использования таких систем, которые способны высвобождать терапевтический агент, такой как гипотензивный (или снижающий ВГД) агент, с постоянной или контролируемой скоростью в течение длительных периодов времени и в количествах с минимальными или без негативных побочных эффектов, благодаря чему снижается внутриглазное давление в глазу пациента, включая, но не ограничиваясь ими, пациентов, страдающих от или склонных к глаукоме.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0008] Длительное, долговременное снижение внутриглазного давления в глазу может обеспечиваться введением в глаз одного или более биодеградируемых внутриглазных имплантатов, представленных в данном документе. Биодеградируемый внутриглазной имплантат в соответствии с данным изобретением содержит или состоит из биодеградируемого полимерного материала и терапевтического агента, связанного с биодеградируемым полимерным материалом. Имплантат(-ы) можно вводить в глаз в качестве монотерапии, и он может доставлять терапевтический агент непосредственно в глазничную область глаза в количестве, эффективном для снижения повышенного внутриглазного давления (глазная гипертензия) в глазу в течение длительного периода, такого как, например, 1-6 месяцев или более. Имплантаты могут также использоваться для лечения или предотвращения глаукомы или других медицинских патологических состояний глаза, связанных с повышенным внутриглазным давлением.
[0009] Терапевтический агент, входящий в состав внутриглазного имплантата в соответствии с данным изобретением, содержит, преимущественно состоит или состоит из соединения, которое является эффективным для уменьшения внутриглазного давления в глазу с гипертензией. В некоторых вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы I или его фармацевтически приемлемой соли, или его сложноэфирного пролекарства
где волнистые сегменты представляют собой α- или β-связь, пунктирные линии представляют собой двойную связь или одинарную связь, R представляет собой замещенный гетероарильный радикал, где каждый R1 независимо выбран из группы, состоящей из водорода и низшего алкильного радикала, содержащего до шести атомов углерода, X представляет собой -OR1, -N(R1)2 или -N(R5)SO2R6, где R5 представляет собой водород или CH2OR6, R6 представляет собой водород, низший алкильный радикал, содержащий до шести атомов углерода, галоген-замещенное производное вышеуказанного низшего алкильного радикала или фтор-замещенное производное вышеуказанного низшего алкильного радикала, и R15 представляет собой водород или низший алкильный радикал, содержащий до шести атомов углерода; и Y представляет собой =O или 2 водородных радикала.
[0010] Заместитель(-и) замещенного гетероарильного радикала в Формуле I может быть выбран из группы, состоящей из С1-C6 алкилов; галогенов (таких как фтор, хлор и бром); трифторметила (CF3); COR1 (такого как СОСН3); COCF3; SO2N(R1)2 (такого как SO2NH2); NO2; и CN.
[0011] В более конкретных вариантах реализации изобретения терапевтический агент может содержать или состоять из соединения Формулы II, или его фармацевтически приемлемой соли, или его сложноэфирного пролекарства
где R1, X, Y, R5, R6 и R15 являются такими, как определено выше для Формулы I, и где Z выбран из группы, состоящей из О и S, А выбран из группы, состоящий из N, -СН и С, R2 выбран из группы, состоящей из водорода, галогена и низшего алкила, содержащего от 1 до 6 атомов углерода, R3 и R4 независимо выбраны из группы, состоящей из водорода, галогена, низшего алкила, содержащего от 1 до 6 атомов углерода, или вместе с , R3 и R4 образуют конденсированное арильное кольцо.
[0012] В некоторых вариантах реализации изобретения терапевтический агент, входящий в состав имплантата в соответствии с данным изобретением, содержит или состоит из соединения Формулы II, где по меньшей мере один из R2, R3 или R4 независимо выбран из группы, состоящей из хлора, брома и C1-C6 алкила. В более конкретных вариантах реализации изобретения по меньшей мере один из R2, R3 или R4 представляет собой хлор или бром. В более конкретных вариантах реализации изобретения по меньшей мере один из R2, R3 или R4 представляет собой бром. В более конкретном варианте реализации изобретения по меньшей мере два из R2, R3 или R4 представляют собой хлор. В некоторых вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы II, где по меньшей мере один из R2, R3 или R4 представляет собой этил, пропил или бутил. В некоторых вариантах реализации изобретения R6 представляет собой метил, этил или трифторметил. В одном варианте реализации изобретения терапевтический агент содержит или состоит из соединения Формулы II, где R15 представляет собой водород или метил.
[0013] В одном варианте реализации изобретения терапевтический агент содержит или состоит из соединения Формулы II, где X представляет собой -N(R1)2, и Y представляет собой =О.
[0014] В одном варианте реализации изобретения терапевтический агент, входящий в состав имплантата в соответствии с данным изобретением, содержит или состоит из соединения Формулы III
или его фармацевтически приемлемой соли, или его сложноэфирного пролекарства, где X представляет собой -ОН или -N(R1)2, и где R1 независимо выбран из группы, состоящей из водорода и C1-C6 алкила.
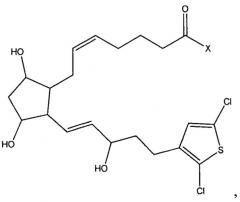
[0015] В дополнительных вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы IV
или его фармацевтически приемлемой соли или его сложноэфирного пролекарства, где X представляет собой -ОН или -N(R1), и где R1 независимо выбран из группы, состоящей из водорода и C1-C6 алкила.
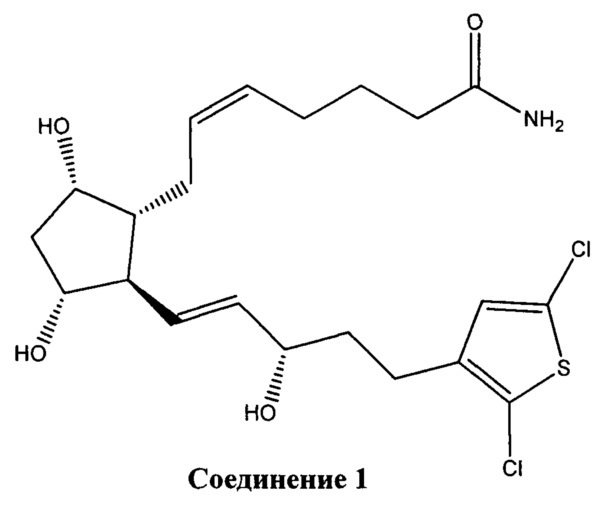
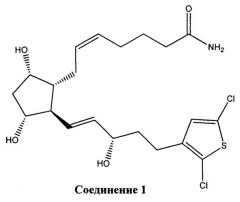
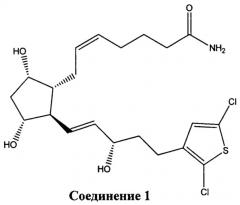
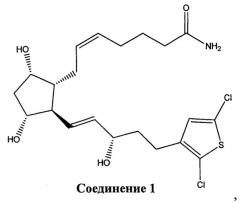
[0016] В конкретном варианте реализации изобретения терапевтический агент содержит или состоит из соединения Формулы IV, где X представляет собой -NH2. Это соединение обозначено в данном документе как Соединение 1 и имеет следующую структуру:
[0017] В других вариантах реализации изобретения терапевтический агент содержит или состоит из соединения Формулы IV или его фармацевтически приемлемой соли, где X представляет собой -ОН. Это соединение обозначено в данном документе как Соединение 2 и имеет следующую структуру:
[0018] Специалистам в данной области очевидно, что Формулы I-IV содержат один или более стереоцентров. Если специально не указано иное, в объем данного изобретения входят все энантиомеры и диастереомеры Формул I-IV и их рацемические смеси. Некоторые Соединения, имеющие одну из Формул I-IV, могут образовывать соли с фармацевтически приемлемыми кислотами или основаниями, и такие фармацевтически приемлемые соли соединений также входят в объем данного изобретения.
[0019] Таким образом, настоящее изобретение предлагает биодеградируемый внутриглазной имплантат, эффективный для снижения внутриглазного давления в глазу пациента, который содержит или состоит из биодеградируемого полимерного материала и Соединения, имеющего Формулу I, II, III или IV, как определено выше, или его фармацевтически приемлемой соли. Конкретные варианты реализации изобретения предлагают биодеградируемый внутриглазной имплантат, содержащий или состоящий из биодеградируемого полимерного материала и Соединения 1 или Соединения 2, или их смеси, связанных с биодеградируемым полимерным материалом.
[0020] Другой вариант реализации изобретения представляет собой биодеградируемый внутриглазной имплантат, содержащий биодеградируемый полимерный материал и Соединение 1 в качестве фармацевтически активного агента, причем внутриглазной имплантат не содержит никаких других фармацевтически активных агентов или агентов, понижающих ВГД, кроме Соединения 1.
[0021] Соединения, имеющие любую из Формул I-IV, могут быть получены с помощью способов, известных в данной области. Например, см. патенты США №№6602900, 6124344, 5741810 и 5834498.
[0022] Соединение, имеющее Формулу I, II, III или IV, может быть связано с биодеградируемым полимерным материалом. Таким образом, Соединение может быть смешано с, растворено и/или диспергировано в, заключено в или присоединено к биодеградируемому полимерному материалу. Соединение, имеющее Формулу I, II, III или IV, может быть однородно или неоднородно диспергировано или распределено в биодеградируемом полимерном материале. Высвобождение Соединения из имплантата после установки в глаз может происходить путем диффузии Соединения, эрозии или разрушения полимерного материала, растворения, осмоса или любой их комбинации.
[0023] Биодеградируемый внутриглазной имплантат, представленный в данном документе, может иметь подходящий размер и состав для установки в глазничную область глаза, такую как, например, стекловидное тело или передняя камера глаза, для лечения глаукомы и снижения внутриглазного давления, включая, например, повышенное внутриглазное давление (или глазную гипертензию) в глазу.
[0024] Конкретные варианты реализации изобретения предлагают внутриглазной биодеградируемый имплантат, который должен высвобождать Соединение, имеющее любую из Формул I-IV (например, Соединение 1), непрерывно in vitro и/или in vivo в глазу в течение 1-3 месяцев, 3 месяцев или более, 3-6 месяцев или 6 месяцев или более после установки в глаз пациента.
[0025] Внутриглазной имплантат в соответствии с данным изобретением может высвобождать от 5 до 200 нанограмм (нг) Соединения в день, от 10 до 200 нанограмм Соединения в день, от 5 до 100 нанограмм Соединения в день, от 10 до 100 нанограмм Соединения в день, от 10 до 50 нанограмм Соединения в день, по меньшей мере 10 нг, но не более 50 нг Соединения в день, от 10 до около 35 нг Соединения в день или от 20 до 35 нанограмм Соединения в день в течение 1 месяца или более, 2 месяцев или более, 1-3 месяцев, 3-6 месяцев или 6 месяцев или более.
[0026] Имплантаты в соответствии с данным изобретением разработаны так, чтобы контролированным образом высвобождать Соединение Формулы IV, такое как, например, Соединение 1. В некоторых формах имплантат будет обеспечивать линейную или практически постоянную скорость высвобождения Соединения 1 в течение 1 месяца или более, например в течение 1, 3 или 6 месяцев.
[0027] Суточные дозировки Соединения 1 в интервале от 5 до 200, от 10 до 100 нанограмм, или даже 5-50 нанограмм, при доставке или высвобождении непосредственно в переднюю камеру, могут являться терапевтически эффективным количеством для снижения внутриглазного давления в глазу. Термин «терапевтически эффективное количество» или «эффективное количество» относится к уровню или количеству активного агента (например, Соединения 1 или Соединения 2), необходимого для снижения внутриглазного давления без значительных негативных или побочных эффектов в глазу или в области глаза, в которой агент применяется.
[0028] Имплантаты в соответствии с данным изобретением могут уменьшать внутриглазное давление в глазу пациента в течение 1 месяца (30 дней) или более, 1-3 месяцев, 3 месяцев, 3-6 месяцев или даже 6 месяцев или более после установки имплантата в глаз. Пациентом, как правило, является человек или другое млекопитающее, которое ощущает или у которого диагностировано повышенное внутриглазное давление или глазная гипертензия в одном или обоих глазах. Пациента можно дополнительно определить как субъекта, страдающего глаукомой, так как глаукома часто сопровождается повышенным внутриглазным давлением. Следовательно, имплантаты, описанные в данном документе, могут быть использовны, как правило, для снижения повышенного внутриглазного давления в глазу и для лечения глаукомы у пациента. В связи с этим один вариант реализации изобретения представляет собой способ уменьшения глазной гипертензии или снижения повышенного внутриглазного давления у пациента, нуждающегося в этом, включающий установку в глаз пациента биодеградируемого внутриглазного имплантата в соответствии с данным изобретением.
[0029] В конкретных формах способа лечения один или более внутриглазных имплантатов, содержащих Соединение, имеющее любую из Формул I-IV, можно устанавливать, или, более конкретно, вводить при помощи инъекций в переднюю камеру глаза, чтобы таким образом снижать внутриглазное давление и уменьшать глазную гипертензию в глазу. Следовательно, внутриглазной имплантат, например, может иметь подходящий размер и состав для установки в переднюю камеру глаза. Такие имплантаты могут называться «внутриглазными» имплантатами.
[0030] Имплантаты в соответствии с данным изобретением разработаны так, чтобы обеспечивать долговременное снижение повышенного внутриглазного давления (или глазной гипертензии) путем обеспечения пролонгированного непрерывного высвобождения терапевтически эффективного количества Соединения 1 (или в целом Соединения, имеющего Формулу I, II, III или IV) или его фармацевтически приемлемой соли непосредственно в пораженную область глаза, такую как передняя камера глаза. В этом контексте терапевтически эффективное количество Соединения 1 может представлять собой дозировку между 5 и 200 нг/день, 10 и 200 нг/день, 5 и 50 нг/день или, конкретнее, 10-40 нг/день, или, еще конкретнее, около 15 нг/день, 20 нг/день или 30 нг/день. Пациентом может являться человек или другое млекопитающее, нуждающееся в лечении глазной гипертензии (повышенного внутриглазного давления) или глаукомы. Имплантат может быть в форме экструдированного волокна или прессованной таблетки. Другие формы могут включать капсулы, пленки или пластины. Экструдированное волокно может представлять собой цилиндрический или нецилиндрический стержень, имеющий диаметр и длину, подходящие для установки в глаз, например в переднюю камеру или стекловидное тело глаза.
[0031] Один вариант реализации изобретения представляет собой экструдированный внутрикамерный биодеградируемый имплантат, содержащий около 8 масс. %. Соединения 1 и от 0,001% до 10 масс. % гексадекан-1-ола (гексадеканола), причем общая масса имплантата составляет от 30 до 100 мкг, и он высвобождает от 10 до 50 нг Соединения 1 в день в течение 3-5 месяцев in vitro в фосфатно-солевом буферном растворе при 37°C. В некоторых формах такого имплантата биодеградируемый полимерный материал содержит поли(D,L-лактид), имеющий кислотную концевую группу и характеристическую вязкость 0,16-0,24 дл/г, и поли(D,L-лактид), имеющий сложноэфирную концевую группу и характеристическую вязкость 0,25-0,35 дл/г, и сополимер поли(D,L-лактид-со-гликолид), имеющий сложноэфирную концевую группу, молярное соотношение D,L-лактида к гликолиду, равное около 75:25 (например, от 73:27 до 77:23) и характеристическую вязкость 0,16-0,24 дл/г, причем характеристическая вязкость каждого полимера и сополимера измерена в 0,1% растворе полимера или сополимера в хлороформе при 25°C.
[0032] Пациенты, которых можно эффективно лечить, используя биодеградируемые внутрикамерные имплантаты, содержащие Соединение, имеющее Формулу I, II, III или IV (например, Соединение 1), могут включать тех, кто приобрел или страдает от или у кого диагностированы глаукома, открытоугольная глаукома, закрытоугольная глаукома, хроническая закрытоугольная глаукома, общеизвестная иридотомия, глазная гипертензия, повышенное внутриглазное давление, псевдоэксфолиативная глаукома или пигментная глаукома. Имплантат в соответствии с данным изобретением может быть эффективным для уменьшения внутриглазного давления в глазу с низким, нормальным или повышенным внутриглазным давлением. Поэтому, имплантат в соответствии с данным изобретением может являться эффективным для лечения глаукомы во всех ее формах, включая глаукому с повышенным внутриглазным давлением, а также глаукому с низким или нормальным давлением, так как такие пациенты также потенциально могут получать пользу от дальнейшего снижения внутриглазного давления. Вследствие способности высвобождать терапевтически эффективные количества потенциальных агентов для снижения внутриглазного давления, таких как Соединение 1, в течение длительных периодов, ожидается, что имплантаты в соответствии с данным изобретением будут способны снижать внутриглазное давление у таких пациентов в течение продолжительных периодов без необходимости в частых внутриглазных инъекциях или регулярном введении глазных капель на поверхность глаза, что может быть обязательно для местного применения. Более того, большая эффективность Соединения 1 для снижения ВГД по сравнению с некоторыми другими простамидами и противоглаукомными агентами делает возможным изготавливать меньшие имплантаты с более длительными периодами введения, которые будут безопаснее и лучше для глаза, а следовательно для пациента.
[0033] Таким образом, один вариант реализации настоящего изобретения представляет собой способ снижения внутриглазного давления (ВГД) в глазу, который включает установку биодеградируемого внутриглазного имплантата в глаз, содержащего или состоящего из биодеградируемого полимерного материала и Соединения, имеющего любую из Формул I-IV, или его фармацевтически приемлемой соли, связанной с полимерным материалом, причем имплантат снижает внутриглазное давление в глазу в течение 1, 3 или 6 месяцев или более после установки в глаз. В некоторых случаях имплантат может снижать ВГД в глазу по меньшей мере на 30% по сравнению с ВГД в глазу без имплантата или до получения имплантата (исходное ВГД) в течение 1, 3 или 6 месяцев или более. Имплантат можно устанавливать в глазничную область глаза, и поэтому он может иметь размер, подходящий для установки в глазничную область глаза. Пациент может иметь низкое или нормальное внутриглазное давление или может страдать от повышенного внутриглазного давления, иногда называемого внутриглазной гипертензией, или у пациента может быть глаукома. В более конкретной форме пациент страдает от или у него диагностированы глаукома или повышенное внутриглазное давление, и имплантат устанавливают в переднюю камеру или стекловидное тело пораженного глаза (пораженных глаз). В конкретном варианте реализации изобретения имплантат устанавливают в угол передней камеры (или радужно-роговичный угол), а еще более конкретно - в нижний угол передней камеры пораженного глаза (пораженных глаз). В любом из этих способов Соединение в имплантате (т.е. терапевтический агент) может содержать или представлять собой Соединение 1 или Соединение 2, фармацевтически приемлемую соль Соединения 1 или 2 или любую их смесь, и имплантат может быть установлен в переднюю камеру или стекловидное тело глаза путем внутрикамерного или интравитреального введения. В конкретных вариантах реализации изобретения имплантат устанавливают в угол передней камеры (или радужно-роговичный угол) глаза. Имплантат также может быть установлен в субконъюнктивальную область глаза.
[0034] Соответственно, данное изобретение предлагает способ лечения глаукомы у пациента, включающий стадию установки биодеградируемого внутриглазного имплантата, как описано в данном документе, в глаз пациента. Имплантат также может быть установлен в переднюю камеру глаза или в другую глазничную область глаза для лечения глаукомы.
[0035] Некоторые варианты реализации изобретения включают способ введения Соединения, имеющего Формулу III или IV, такого как Соединение 1 или Соединение 2, без глазных капель, включающий установку имплантата, описанного в данном документе, в глаз пациента, нуждающегося в этом. Имплантат предпочтительно устанавливают в переднюю камеру глаза.
[0036] В одном варианте реализации изобретения предлагается способ снижения внутриглазного давления у пациента, нуждающегося в этом, включающий введение в глаз(-а) пациента фармацевтической композиции, состоящей из терапевтически эффективного количества соединения, имеющего Формулу I, II, III или IV. В некоторых вариантах реализации изобретения предлагается способ уменьшения внутриглазного давления у пациента, нуждающегося в этом, включающий введение в глаз(-а) пациента фармацевтической композиции, содержащей терапевтически эффективное количество Соединений 1 или 2. Фармацевтическая композиция для снижения внутриглазного давления должна, как правило, быть биологически совместимой с глазом и содержать терапевтически эффективное количество Соединения и фармацевтически приемлемого эксципиента. Биологически совместимые имплантаты и полимеры вызывают лишь небольшое количество или не вызывают токсических эффектов, не являются опасными или физиологически активными и не вызывают иммунологическую реакцию. В конкретных вариантах реализации изобретения фармацевтическая композиция находится в форме жидкости, такой как водный раствор, масло или эмульсия. В одном варианте реализации изобретения фармацевтическую композицию вводят в глаз(-а) пациента местно. Например, фармацевтическую композицию можно вводить в виде глазных капель. В другом варианте реализации изобретения фармацевтическую композицию вводят в переднюю камеру глаза без использования глазных капель.
[0037] Фармацевтические композиции могут быть получены комбинированием терапевтически эффективного количества по меньшей мере одного соединения согласно настоящему изобретению, или его фармацевтически приемлемой соли, в качестве активного агента, с традиционными фармацевтически приемлемыми эксципиентами, и путем приготовления дозированных лекарственных форм, подходящих для местного применения в глазу. Терапевтически эффективное количество может варьироваться от 0,0001 до 5% или 10% (масса к объему) в жидких препаратах. Для офтальмологического применения одной из возможных сред может быть физиологический солевой раствор. pH таких композиций желательно поддерживать между 6,5 и 7,2 с помощью подходящего буферного агента или системы, причем предпочтительным является практически нейтральный pH. Препараты могут также содержать один или более традиционных, фармацевтически приемлемых консервантов, стабилизаторов, антиоксидантов, комплексообразующих веществ, веществ, регулирующих тоничность (например, соли щелочных или щелочно-земельных металлов) и поверхностно-активных веществ. Некоторые композиции могут содержать как буферный компонент, так и компонент, регулирующий тоничность.
[0038] В других вариантах реализации изобретения предлагается способ получения биодеградируемых внутриглазных имплантатов, эффективных для снижения внутриглазного давления у пациента, которые содержат или состоят из терапевтического агента, биодеградируемого полимерного материала и, необязательно, одного или более эксципиентов. Способ включает следующие стадии по порядку: а) смешивание терапевтического агента с биодеградируемым полимером или двумя или более биодеградируемыми полимерами и одним или более эксципиентами, если присутствуют, с получением смеси, б) экструдирование смеси с получением волокна, и в) разрезание волокна на куски с длиной, подходящей для установки в глаз пациента, страдающего от повышенного глазного давления, с получением с получением внутриглазных имплантатов. В конкретных вариантах реализации изобретения волокно разрезают на куски, длиной, подходящей для установки в переднюю камеру глаза. Терапевтический агент может содержать соединение, имеющее любую из Формул I-IV, или может содержать Соединения 1 или 2, как определено в данном документе. В некоторых случаях терапевтический агент, используемый для смешивания с полимером(-ами) (стадия а), может представлять собой твердое вещество. Смесь можно экструдировать при температуре от 60°C до 150°C.
[0039] В других вариантах реализации изобретения предлагается устройство для имплантирования или введения биодеградируемого внутриглазного имплантата согласно любому из вариантов реализации изобретения, представленных в данном документе, в глазничную область глаза у пациента, страдающего от глаукомы или глазной гипертензии (т.е. повышенного внутриглазного давления), которое содержит удлиненный корпус с продольной осью и катетер, проходящий в продольном направлении от корпуса, имеющий полость внутри него, сконструированную таким образом, чтобы вмещать внутриглазной имплантат. Устройство дополнительно содержит внутриглазной имплантат согласно любому из вариантов реализации изобретения, представленных в данном документе. Имплантат может быть расположен внутри полости катетера или ближе к центру полости катетера. Для конкретных форм реализации устройства размеры катетера равны или не более чем размеры иглы 21, 22, 25, 27, 28 или 30 калибра, и катетер должен иметь скошенный или острый конец для более легкого проникновения в ткань глаза. В некоторых формах внутренний и внешний диаметры катетера не более чем у иглы 25 или 27 калибра.
[0040] Также в объем данного изобретения входят способы доставки внутриглазного имплантата в глаз пациента, страдающего от глаукомы или повышенного внутриглазного давления, с использованием устройства, описанного вышесодержащего катетер, который имеет внутренний конец, острый дистальный конец и полость, проходящую внутри него, внутриглазной имплантат, выбранный из любого имплантата, представленного в данном документе, привод, движение которого приводит к выталкиванию имплантата из устройства. Полость катетера имеет такой размер, чтобы вместить внутриглазной имплантат и позволить ему перемещаться по ней. Способ включает стадии введения катетера в глазничную область глаза пациента и нажатия на или активации привода, что приводит к выталкиванию имплантата из катетера в глаз пациента. В некоторых вариантах реализации изобретения глазничная область глаза, в которую вводят имплантат, может представлять собой переднюю камеру или стекловидное тело глаза.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0041] Фиг. 1 иллюстрирует поперечное сечение глаза млекопитающих.
[0042] Фиг. 2 иллюстрирует кумулятивное общее высвобождение в процентах in vitro Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для четырех (4) отдельных имплантатов (Имплантаты 1-4), полученных с помощью двухшнекового экструдера. Композиция каждого имплантата представлена в Таблице 2.
[0043] Фиг. 3 иллюстрирует кумулятивное общее высвобождение в процентах in vitro Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантатов 5 и 6, полученных с помощью поршневого экструдера. Композиция каждого имплантата представлена в Таблице 2.
[0044] Фиг. 4 иллюстрирует кумулятивное общее высвобождение в процентах in vitro Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантатов 7 и 8, полученных с помощью поршневого экструдера. Композиция каждого имплантата представлена в Таблице 2.
[0045] Фиг. 5 иллюстрирует пролонгированный эффект понижения внутриглазного давления (ВГД) у собак при введении Соединения 1 в глаз в форме экструдированного биодеградируемого внутрикамерного имплантата (Имплантат 1, представленный в Таблице 2). Один имплантат устанавливали в переднюю камеру одного глаза каждой собаки из исследуемой группы. Противоположный глаз оставляли без обработки. Исследуемая группа состояла из 8 собак (n=8). Среднее изменение (в процентах) ВГД относительно исходного ВГД в пролеченных и непролеченных глазах для каждой группы измеряли в различные моменты времени и затем наносили на линейный график, демонстрирующий изменение ВГД со временем.
[0046] Фиг. 6 иллюстрирует эффект уменьшения ВГД при помощи Имплантата 2 у собак (n=8) после установки одного имплантата в переднюю камеру глаза. In vivo исследование проводили так, как описано для Фиг. 5 и в Примере 2.
[0047] Фиг. 7 иллюстрирует эффект уменьшения ВГД при помощи Имплантата 3 у собак (n=8) после установки одного имплантата в переднюю камеру глаза. In vivo исследование проводили так, как описано для Фиг. 5 и в Примере 2.
[0048] Фиг. 8 иллюстрирует эффект уменьшения ВГД при помощи Имплантата 4 у собак (n=8) после установки одного имплантата в переднюю камеру глаза. In vivo исследование проводили так, как описано для Фиг. 5 и в Примере 2.
[0049] Фиг. 9 иллюстрирует in vitro кумулятивное общее высвобождение в процентах Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантата 9, полученного с помощью поршневого экструдера. Композиция Имплантата 9 представлена в Таблице 2.
[0050] Фиг. 10 иллюстрирует кумулятивное общее высвобождение в процентах in vitro (в процентах) Соединения 1 в фосфатно-солевой буферный раствор (0,01 М; pH 7,4) при 37°C в зависимости от времени для Имплантатов №3, 10 и 11, полученных с помощью двухшнекового экструдера. Композиции Имплантатов 3, 10 и 11 представлены в Таблице 2.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
[0051] «C1-C6 алкил» означает алкил, содержащий от 1 до 6 атомов углерода.
[0052] Символ «Н», при использовании в Формулах в данном документе, обозначает атом водорода.
[0053] Символ «О», при использовании в Формулах в данном документе, обозначает атом кислорода.
[0054] Символ «N», при использовании в Формулах в данном документе, обозначает атом азота.
[0055] Символ «S», при использовании в Формулах в данном документе, обозначает атом серы.
[0056] Символ «С», при использовании в Формулах в данном документе, обозначает атом углерода.
[0057] Символ «Cl», при использовании в Формулах в данном документе, обозначает атом хлора.
[0058] Символ «Br», при использовании в Формулах в данном документе, обозначает атом брома.
[0059] «Профиль кумулятивного высвобождения» относится к кумулятивному суммарному процентному содержанию активного агента (такого как, например, Соединение 1), высвобожденного из имплантата в глазничную область in vivo со временем или в специальную среду для высвобождения (например, ФСБ) in vitro со временем.
[0060] «Пролекарство» означает соединение (например, предшественник лекарственного средства), которое превращается in vivo с образованием активной формы соединения. Превращение может происходить по различным механизмам (например, путем метаболических или химических процессов), таким как, например, гидролиз.
[0061] Термин «фармацевтически приемлемые соли» относится к солям или комплексам, которые сохраняют требуемую биологическую активность Соединения или терапевтического агента и практически или совсем не проявляют нежелательных токсических эффектов у млекопитающих или в клеточной системе, в которую они были введены.
[0062] «Внутриглазной имплантат» относится к устройству или элементу, которые имеет форму, пригодную для установки в глаз. Примеры включают экструдированные волокна, состоящие из биодеградируемого полимерного материала и фармацевтически активного агента, такого как Соединение, имеющее Формулу I, II, III, или IV, связанное с полимерным материалом, и разрезанные на куски, пригодные для установки в глаз. Внутриглазные имплантаты, как правило, биологически совместимы с физиологическими условиями глаза и не оказывают побочных реакций на глаз. В некоторых формах настоящего изобретения внутриглазной имплантат может иметь подходящий размер и состав для установки в переднюю камеру или стекловидное тело глаза. Внутриглазные имплантаты могут быть введены в глаз без значительного нарушения зрения. Внутриглазные имплантаты, состоящие из одного или более биодеградируемых полимеров и Соединения, имеющего Формулу I, II, III или IV, или его фармацевтически приемлемой соли, представляют собой примеры внутриглазных имплантатов (системы доставки лекарственных средств) в рамках настоящего изобретения.
[0063] «Внутрикамерный» имплантат представляет собой внутриглазной имплантат, который имеет подходящий размер и состав для установки в переднюю камеру глаза. Неограничивающие примеры включают Имплантаты 1-4 и 9-11, представленные в Таблице 2.
[0064] «Интравитреальный» имплантат представляет собой внутриглазной имплантат, который имеет подходящий размер и состав для установки в стекловидное тело глаза.
[0065] «Пригодный для или имеющий подходящую форму, размер или структуру для введения, имплантации или установки в глазничную область или участок» по отношению к имплантату, означает имплантат, который имеет такой размер (т.е. геометрические параметры и массу), что его м