Сконструированная способами инженерии платформа для встраивания трансгена (etip) для нацеливания генов и стэкинга признаков
Иллюстрации
Показать всеИзобретение относится к области биохимии, в частности к способу получения трансгенной клетки растения. При этом способ включает трансформацию клетки растения донорной молекулой нуклеиновой кислоты, которая встраивается в геномный локус, выбранный из группы, состоящей из FAD2, FAD3 и IPK1, с использованием сайт-специфической нуклеазы. Изобретение позволяет эффективно получать трансгенные клетки растений. 20 з.п. ф-лы, 28 табл., 83 ил., 8 пр.
Реферат
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет по временной патентной заявке США № 61/697882, поданной 7 сентября 2012 года.
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к области прицельной трансформации растений, нацеливания генов, направленного встраивания в геном и экспрессии белков в растениях. В предпочтительном варианте осуществления настоящее изобретение относится к сконструированной способами инженерии платформе для встраивания трансгена (ETIP), которую можно встраивать случайным образом или в заданные положения в геномах растений.
УРОВЕНЬ ТЕХНИКИ
Чтобы удовлетворить возрастающую глобальную потребность в продуцировании продуктов питания, типичные подходы для улучшения сельскохозяйственной производительности (например, увеличенный выход или сообщенная способами инженерии устойчивость к вредителям) основаны либо на мутационной селекции, либо на внесении новых генов в геномы сельскохозяйственных культур путем трансформации. Эти процессы по своему существу являются неспецифическими и относительно неэффективными. Например, общепринятые способы трансформации растений доставляют экзогенную ДНК, которая встраивается в геном в случайных положениях. Таким образом, для идентификации и отделения трансгенных линий растений с желаемыми признаками, необходимо осуществить сотни уникальных случайных событий встраивания на конструкцию, а затем провести скрининг в отношении желаемых особей. В результате, общепринятые способы инженерии признаков растений являются трудоемкой, времязатратной и непредсказуемой задачей. Более того, случайная природа этих встраиваний затрудняет прогнозирование того, возникнут ли плейотропные эффекты вследствие непреднамеренного разрушения генома.
Случайная природа современных способов трансформации требует осуществления сотен событий встраивания для идентификации и селекции кандидатов с трансгенным событием (трансформация и скрининг события являются скорость-лимитирующими в отношении генов-кандидатов, идентифицированных в функциональных геномных исследованиях). Кроме того, в зависимости от положения встраивания в геноме экспрессирующая кассета для гена может экспрессироваться на различных уровнях в результате эффекта положения в геноме. Этот эффект положения в геноме делает результаты сравнения влияния различных регуляторных элементов и конструкций трансгенов при случайном встраивании в геном с использованием общепринятого способа трансформации в высокой степени вариабельными. В результате, получение, выделение и охарактеризация линий растений с встроенными способами инженерии генами или признаки является чрезвычайно трудоемким и дорогостоящим процессом с низкой вероятностью успеха.
Прицельная модификация генов решает логистические проблемы общепринятых практик в растительных системах, и она является давно существующей целью ведущих исследователей растений и сельскохозяйственных биотехнологов. Однако, за исключением "нацеливания генов" посредством положительной-отрицательной селекции с лекарственным средством в рисе или использования предварительно встроенных способами инженерии участков рестрикции, направленная модификация во всех видах растений, как модельных, так и возделываемых, до недавнего времени оставалась труднодостижимой. Terada et al. (2002) Nat Biotechnol 20(10): 1030; Terada et al. (2007) Plant Physiol 144(2):846; D'Halluin et al. (2008) Plant Biotechnology J. 6(1):93.
Недавно были описаны способы и композиции для направленного расщепления геномной ДНК. Такие события направленного расщепления можно использовать, например, для индукции направленного мутагенеза или направленных делеций клеточных последовательностей ДНК, или для способствования направленной рекомбинации в заданном хромосомном локусе. См., например, публикации патентов США 2003/0232410, 2005/0208489, 2005/0026157, 2005/0064474 и 2006/0188987, и международную публикацию WO 2007/014275.
В публикации патента США №2008/0182332 описано применение неканонических нуклеаз с цинковыми пальцами (ZFN) для направленной модификации геномов растений. В патентной заявке США №12/284888 описано опосредуемое ZFN направленное встраивание в локус EPSPS растений. Однако все еще остается потребность в обнаружении композиций и способов для идентификации, селекции и быстрого осуществления стабильного направленного встраивания в конкретные положения в геноме растений.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Вариант осуществления настоящего изобретения относится к способу получения трансгенной клетки растения. В следующем варианте осуществления предусматривается клетка растения, имеющая геномную ДНК, содержащую поддающуюся нацеливанию молекулу нуклеиновой кислоты. Следующие варианты осуществления включают поддающуюся нацеливанию молекулу нуклеиновой кислоты, содержащую: по меньшей мере один участок распознавания сайт-специфической нуклеазой; первый фрагмент первого маркерного гена и второй фрагмент второго маркерного гена. В другом варианте осуществления клетка растения трансформирована донорной молекулой нуклеиновой кислоты и молекулой нуклеиновой кислоты сайт-специфической нуклеазы. В следующем варианте осуществления геномная ДНК клетки растения расщепляется по меньшей мере в одном участке расщепления сайт-специфической нуклеазой. Дополнительный вариант осуществления включает встраивание донорной молекулы нуклеиновой кислоты в поддающуюся нацеливанию молекулу нуклеиновой кислоты, где встраивание в поддающуюся нацеливанию молекулу нуклеиновой кислоты включает встраивание по меньшей мере одного функционального маркерного гена, с получением трансгенной клетки растения, причем трансгенная клетка растения содержит поддающуюся нацеливанию молекулу нуклеиновой кислоты и встроенную донорную молекулу нуклеиновой кислоты, содержащую по меньшей мере один функциональный маркерный ген.
В другом варианте осуществления настоящее изобретение относится к хромосомному участку-мишени в Brassica napus, выбранному из группы, состоящей из от нуклеотидов 1-579 SEQ ID NO: 431 до нуклеотидов 166-732 SEQ ID NO: 432, от нуклеотидов 1-550 SEQ ID NO: 433 до нуклеотидов 190-653 SEQ ID NO: 434, от нуклеотидов 1-298 SEQ ID NO: 435 до 51-644 SEQ ID NO: 436, от нуклеотидов 1-536 SEQ ID NO: 437 до нуклеотидов 146-545 SEQ ID NO: 438, от нуклеотидов 1-431 SEQ ID NO: 439 до нуклеотидов 167-685 SEQ ID NO: 440, от нуклеотидов 1-599 SEQ ID NO: 441 до нуклеотидов 116-521 SEQ ID NO: 442, от нуклеотидов 1-298 SEQ ID NO: 443 дод нуклеотидов 193-775 SEQ ID NO: 444, и от нуклеотидов 1-651 SEQ ID NO: 445 до нуклеотидов 120-578 SEQ ID NO: 446.
В следующем варианте осуществления настоящее изобретение относится к способу получения трансгенной клетки растения. Следующие варианты осуществления включают поддающуюся нацеливанию молекулу нуклеиновой кислоты, содержащую: по меньшей мере один участок распознавания сайт-специфической нуклеазой; первый фрагмент первого маркерного гена; и второй фрагмент второй некодирующей полинуклеотидной последовательности. В другом варианте осуществления клетка растения трансформирована донорной молекулой нуклеиновой кислоты и молекулой нуклеиновой кислоты сайт-специфической нуклеазы. В следующем варианте осуществления геномная ДНК клетки растения расщепляется по меньшей мере в одном участке распознавания сайт-специфической нуклеазой. Дополнительный вариант осуществления включает встраивание донорной молекулы нуклеиновой кислоты в поддающуюся нацеливанию молекулу нуклеиновой кислоты, где встраивание в поддающуюся нацеливанию молекулу нуклеиновой кислоты включает встраивание по меньшей мере одного функционального маркерного гена, с получением трансгенной клетки растения, причем трансгенная клетка растения содержит поддающуюся нацеливанию молекулу нуклеиновой кислоты и встроенную донорную молекулу нуклеиновой кислоты, содержащую по меньшей мере один функциональный маркерный ген.
Указанные выше и другие признаки станут более понятными из представленного ниже подробного описания нескольких вариантов осуществления, которое предоставлено с отсылкой на прилагаемые чертежи.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
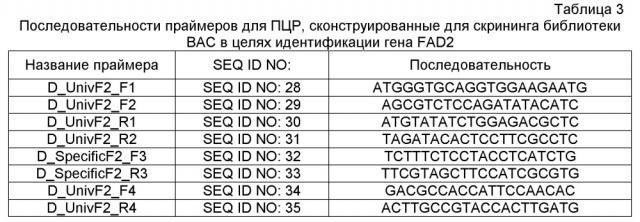
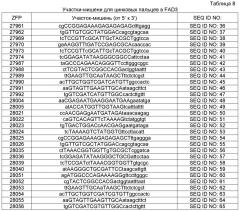
Фиг. 1A-1E: представлено выравнивание последовательностей гена FAD2, проведенное с использованием AlignX®.
Фиг. 2: представлено филогенетическое дерево для последовательностей гена FAD2, полученное с использованием Jalview™ v2.3 на основе расстояний, полученных методом ближайшего связывания.
Фиг. 3A-3M': представлено выравнивание последовательностей гена FAD3, проведенное с использованием AlignX®.
Фиг. 4: представлено филогенетическое дерево последовательностей гена FAD3, полученное с использованием Jalview™ v2.3 на основе расстояний, полученных методом ближайшего связывания. Обозначенные последовательности соответствуют следующему: FAD3A'/A'' описана в настоящем описании как FAD3A'; гаплотип 2 описан в настоящем описании как FAD3C'; гаплотип 1 описан в настоящем описании как FAD3C'' и гаплотип 3 описан в настоящем описании как FAD3A''.
Фиг. 5: представлена карта плазмиды pDAB104010 и представлена репрезентативная экспрессирущая кассета для нуклеаз с цинковыми пальцами (ZFN). План этой конструкции сходен с другими экспрессирующими кассетами для ZFN, где домены цинковых пальцев 24828 и 24829 заменены альтернативными доменами цинковых пальцев, которые описаны ниже.
Фиг. 6: представлен иллюстративный график с множеством кривых, демонстрирующий количество считанных последовательностей с делециями в заданном участке ZFN на 10000 считанных последовательностей. На оси X на графике представлено количество удаленных оснований, на оси Y представлено количество считанных последовательностей, и на оси Z представлено кодируемое цветом обозначение образца, как описано справа на графике. Конкретный представленный пример представляет собой пример локуса 1 семейства генов FAD2, которое содержит 3 участка-мишени для ZFN: A, B и C, с четырьмя представителями семейства генов и двумя контрольными трансфекциями, оцениваемыми в качестве контрольных образцов A и B. Линии, приведенные сверху вниз (от A-контроль_FADA' сверху легенды до C_образец_FAD2C снизу легенды) представлены на графике от наиболее близкой к обозначенной оси X (A_контроль_FADA') до наиболее удаленной от обозначенной оси X (C_образец_FAD2C).
Фиг. 5: представлены данные нацеливания ZFN на локус 4 семейства генов FAD2. Локус содержит два участка ZFN и две необходимые контрольные трансфекции. Фиг. 7B: конкретный контекст последовательности (SEQ ID NO: 471-480), окружающий участок-мишень для ZFN, где обозначены FAD2A и C, содержащие тринуклеотидные повторы C, T и G, что приводит к наблюдаемому увеличению однонуклеотидных делеций при секвенировании локусов FAD2A и C.
Фиг. 8: представлена карта плазмиды pDAS000130.
Фиг. 9: представлена карта плазмиды pDAS000271.
Фиг. 10: представлена карта плазмиды pDAS000272.
Фиг. 11: представлена карта плазмиды pDAS000273.
Фиг. 12: представлена карта плазмиды pDAS000274.
Фиг. 13: представлена карта плазмиды pDAS000275.
Фиг. 14: представлена карта плазмиды pDAS000031.
Фиг. 15: представлена карта плазмиды pDAS000036.
Фиг. 16: представлена карта плазмиды pDAS000037.
Фиг. 17: представлены конфигурации ETIP и нуклеиновой кислоты-груза, а также продукт направленного встраивания груза в участок ETIP в геноме клетки растения.
Фиг. 18: проиллюстрирована трансформация клеток протопластов с последующей селекцией с помощью FACS нацеленной ДНК груза в ETIP в линии-хозяине с использованием реконструирования укороченных поддающихся оценке и селективных маркеров как на 3'-, так и на 5'-конце.
Фиг. 19A-B: проиллюстрирована направляемая гомологией репарация события ETIP в каноле, которое является результатом двухцепочечного разрыва ДНК геномного локуса нуклеазой с цинковыми пальцами (pDAS000074 или pDAS000075) и последующего встраивания донора Ds-red (pDAS000068, pDAS000070 или pDAS000072) в локус ETIP хромосомы канолы. Встраивания донора в геномный локус приводит к полностью функциональному трансгену Ds-red с высокой экспрессией.
Фиг. 20: представлена сортировка способом FACS протопластов канолы и вычисленная эффективность трансфекции протопластов канолы, которые были трансфицированы pDAS000031 ("pDAS31"). Кроме того, предоставлены результаты сортировки способом FACS нетрансформированных протопластов канолы в качестве отрицательного контроля.
Фиг. 21: представлена сортировка способом FACS протопластов канолы и вычисленная эффективность трансфекции для событий ETIP протопластов канолы, которые были трансфицированы pDAS000064/pDAS000074 (верхний график) и pDAS000064/pDAS000075 (нижний график).
Фиг. 22: представлена сортировка способом FACS протопластов канолы и вычисленная эффективность трансфекции для событий ETIP в протопластах канолы, трансформированных pDAS000068/pDAS000074 (верхний график) и pDAS000068/pDAS000075 (нижний график).
Фиг. 23: представлена сортировка способом FACS протопластов канолы и вычисленная эффективность трансфекции для событий ETIP в протопластах канолы, трансформированных pDAS000070/pDAS000074 (верхний график) и pDAS000070/pDAS000075 (нижний график).
Фиг. 23: представлена сортировка способом FACS протопластов канолы и вычисленная эффективность трансфекции для событий ETIP в протопластах канолы, трансформированных pDAS000072/pDAS000074 (верхний график) и pDAS000072/ pDAS000075 (нижний график).
Фиг. 25: представлена карта плазмиды pDAS000074.
Фиг. 26: представлена карта плазмиды pDAS000075.
Фиг. 27: представлена карта плазмиды pDAS000064.
Фиг. 28: представлена карта плазмиды pDAS000068.
Фиг. 29: представлена карта плазмиды pDAS000070.
Фиг. 30: представлена карта плазмиды pDAS000072.
Фиг. 31: представлена схема, демонстрирующая участки связывания праймеров и зонда на трансгене-мишени для анализа в целях оценки числа копий трансгена.
Фиг. 32: представлен файл Sequencher, демонстрирующий домен ZFN, распознающий ДНК FAD2A (bc12075_Fad2a-r272a2 и bc12075_Fad2a-278a2) и участки связывания специфических праймеров для ZFN (FAD2A.UnE.F1 и FAD2A.UnE.R1) и эндогенных праймеров (FAD2A/2C.RB.UnE.F1 и FAD2A/2C.RB.UnE.R1).
Фиг. 33: представлена схема, демонстрирующая участки связывания праймеров на эндогенной и трансгенной мишени, используемых для обнаружения встраивания трансгенов FAD2A с помощью полной HDR.
Фиг. 34: представлена схема, где участки рестрикции эндонуклеазой pn1 встречаются в полностью отредактированном локусе FAD2A и где связываются зонды для саузерн-блоттинга FAD2a 5', hph и FAD2A 3'.
Фиг. 35: представлены репрезентативные данные оценки числа копий с помощью q-ПЦР. В левом столбце представлены данные, полученные для известного растения T0 с одной случайной вставкой, которое использовали в качестве калибровочного образца, относительно которого все другие образцы "нормализовывали". В правом столбце представлено известное трансгенное растение T0 с 5 вставками трансгенов. Число встраиваемых копий для обоих растений определяли с использованием саузерн-анализа. В остальных столбцах предоставлены оценки числа копий для предполагаемых трансгенных растений. Столбцы обозначены слева направо фигуры как; контроль с 1 копией, 310420, 311819, 311821, 311822, 311823, 311824, 311827, 312524, 312525, 312526, 312527, 312529, 312530, 312532, 313810, 313811, 313905, 313941, 313942, 313944 и контроль с 5 копиями. Столбцы можно использовать для определения оцененного числа копий каждого трансгенного растения. При использовании программного обеспечения для оценки числа копий, растения дикого типа, нетрансформированные растения и контроли только с плазмидой не дают результата для числа копий, поскольку они не обладают Cq как для мишени hph, так и для мишени HMG 7/7.
Фиг. 36: представлена карта плазмиды pDAB105855, содержащей последовательность ДНК-мишень, содержащую; последовательность RB7 MAR/участок связывания v1 eZFN4, промотор OsUbi3/Phi YFP/ZmPer5 3'UTR v2/участок связывания eZFN1/ELP1 HR2 v2, промотор v8 ZmUbi1/Cry34Ab1 v2/StPinII 3' UTR v2, промотор v3 TaPer/Cry35Ab1 v5/StPinII 3' UTR v2, SCBVv2/AAD-1v3/ZmLip 3' UTR v1 между границами T-ДНК.
Фиг. 37: представлена карта плазмиды pDAB105941, содержащей кодирующую последовательность ZFN1 под контролем экспрессии промотора убиквитина 1 с интроном 1 кукурузы (промотор v2 ZmUbi1) и ZmPer5 3'UTR v2.
Фиг. 38: представлена карта плазмиды pDAB112366, содержащей интрон без промотора (интрон rubi3) промотора убиквитина 3 риса (OsUbi3), за которым следует ген устойчивости к гербициду (фосфинотрицинацетилтрансфераза (PAT)) и ZmLip 3'UTR.
Фиг. 39: представлена схема использования участка ETIP, встроенного в геном, для нацеливания донорного полинуклеотида, содержащего экспрессирующую ген кассету. Как представлено на схеме, донор способен экспрессировать трансген, если встраивание происходит в локусе ETIP. Случайное встраивание донора не приводит к экспрессии трансгена, поскольку, как правило, отсутствуют промоторные элементы, которые могут контролировать экспрессию.
ПОДРОБНОЕ ОПИСАНИЕ
В настоящем описании описаны способы и композиции для получения сконструированной способами инженерии платформы для встраивания трансгена (ETIP), содержащего поддающуюся нацеливанию молекулу нуклеиновой кислоты, которая стабильно встроена в геном клетки растения и служит в качестве зародышевой плазмы-хозяина для трансформации и встраивания донорной молекулы нуклеиновой кислоты. Изобретение относится к области прицельной трансформации растений, нацеливания генов, направленного встраивания в геном и экспрессии белков в растениях. В предпочтительном варианте осуществления ETIP можно встраивать случайным образом или в заданные положения в геномах растений для облегчения быстрой селекции и обнаружения одного или нескольких представляющих интерес генов (GOI), которые были нацелены (как 3'-, так и 5'-концы) в положение ETIP в геноме. В некоторых вариантах осуществления в ETIP можно вносить специфические двухцепочечные разрывы. В других вариантах осуществления описан способ селекции и увеличения содержания выделенных клеток или протопластов после нацеливания, за которым следует регенерация фертильных растений с использованием проточной цитометрии и FACS.
Конкретные способы включают получение трансгенной клетки растения, имеющей стабильную наследуемую генетическую модификацию в растении и его потомстве, а также состав трансгенного растения. В определенных вариантах осуществления ETIP описана для применения в системе для прицельной трансформации растений, где ETIP, содержащая встраиваемую нуклеиновую кислоту, стабильно встраивается в зародышевую плазму хозяина. Другие варианты осуществления относятся к способам получения трансгенной клетки растения так, чтобы геномная ДНК клетки растения включала по меньшей мере один стабильно встроенный функциональный маркерный ген. В некоторых вариантах осуществления способ включает использование поддающейся нацеливанию молекулы нуклеиновой кислоты, содержащей один или несколько участков распознавания нацеливающей сайт-специфической нуклеазой, первый фрагмент первого маркерного гена и второй фрагмент второго маркерного гена. В другом варианте осуществления донорная молекула нуклеиновой кислоты содержит представляющую интерес нуклеотидную последовательность и две последовательности нуклеиновой кислоты, фланкирующие представляющую интерес последовательность нуклеиновой кислоты. В другом варианте осуществления две последовательности нуклеиновой кислоты, фланкирующие представляющую интерес последовательность нуклеиновой кислоты, представляют собой последовательность нуклеиновой кислоты первого и второго участков гомологии. В других вариантах осуществления для трансформации клетки растения используют донорную молекулу нуклеиновой кислоты. Последовательности нуклеиновой кислоты участка гомологии могут быть гомологичны областям ETIP или поддающейся нацеливанию последовательности молекулы нуклеиновой кислоты, и они могут быть гомологичны первому и второму фрагменту первого и второго маркерных генов в поддающейся нацеливанию молекуле нуклеиновой кислоты.
Также описаны композиции и способы для получения трансгенных растений, где донорная молекула нуклеиновой кислоты экспрессирует один или несколько продуктов экзогенной последовательности нуклеиновой кислоты (например, белок или молекула РНК), которая стабильно встроилась в ETIP или в поддающуюся нацеливанию молекулу нуклеиновой кислоты в клетке растения. В некоторых вариантах осуществления в ETIP или поддающейся нацеливанию молекуле нуклеиновой кислоты используются участки связывания нуклеазами с цинковыми пальцами или сайт-специфической нуклеазы, содержащей белок, проявляющий активность нуклеазы с цинковыми пальцами. В альтернативных вариантах осуществления для сайт-специфической нуклеазы используются дополнительные технологии нацеливания, такие как мегануклеазы, TAL, РНК-направляемые CRISPR-Cas9 или лейциновые молнии. В конкретных вариантах осуществления ETIP представляет собой поддающуюся нацеливанию молекулу нуклеиновой кислоты, которая облегчает исследование генов-кандидатов и конструкций экспрессирующих векторов растений ранних фаз процесса разработки трансгенного растения. В некоторых вариантах осуществления трансгенная клетка растения включает встраиваемую молекулу нуклеиновой кислоты, имеющую полинуклеотидную последовательность с одним или несколькими участками распознавания нацеливающей сайт-специфической нуклеазой и первый и второй фрагменты первого и второго маркерных генов. Понятно, что фрагменты маркерных генов могут не кодировать функциональный продукт экспрессии маркерного гена. Более того, в качестве одного варианта осуществления маркерные гены могут содержать последовательность нуклеиновой кислоты интрона. В других вариантах осуществления маркерные гены могут содержать последовательность нуклеиновой кислоты участка гомологии.
В некоторых вариантах осуществления одна или две, или более областей донорной молекулы нуклеиновой кислоты лишены гомологии последовательностей с геномной ДНК (экзогенной) растения. В дополнительных вариантах осуществления донорная молекула нуклеиновой кислоты может содержать последовательность нуклеиновой кислоты участка гомологии. Последовательности нуклеиновой кислоты участков гомологии в донорной молекуле нуклеиновой кислоты могут быть встроены в области, фланкирующие участок расщепления сайт-специфической нуклеазой в поддающейся нацеливанию молекуле нуклеиновой кислоты. В определенных вариантах осуществления последовательности участка гомологии могут иметь длину от 50 п.н. до 3 т.п.н.
В конкретных вариантах осуществления донорная молекула нуклеиновой кислоты может содержать экзогенные последовательности нуклеиновой кислоты, которые обеспечивают нацеливание на поддающуюся нацеливанию молекулу нуклеиновой кислоты ETIP и селекцию на 5'- и 3'-концах точно нацеленных событий. Продукты экзогенных последовательностей нуклеиновой кислоты могут содержать, например, один или несколько генов или молекул кДНК, или любой тип кодирующей или некодирующей нуклеотидной последовательности, а также один или несколько регуляторных элементов генов (например, промоторов). Конструкция донорной молекулы нуклеиновой кислоты обеспечивает вырезание кодирующей и некодирущей ДНК, включая, но не ограничиваясь ими, селективные маркеры, после селективного встраивания донорной ДНК в ETIP.
В конкретных вариантах осуществления поддающаяся нацеливанию молекула нуклеиновой кислоты ETIP может включать первый фрагмент первого маркерного гена, и второй фрагмент второго маркерного гена, и донорную молекулу нуклеиновой кислоты, содержащую соответствующий второй фрагмент первого маркерного гена и первый фрагмент второго маркерного гена. Первый фрагмент первого маркерного гена может быть расположен на 5'-конце поддающейся нацеливанию молекулы нуклеиновой кислоты, а второй фрагмент второго маркерного гена может быть расположен на 3'-конце поддающейся нацеливанию молекулы нуклеиновой кислоты, так чтобы стабильное встраивание донорной молекулы нуклеиновой кислоты, содержащей второй фрагмент первого маркерного гена и первый фрагмент второго маркерного гена, в геном клетки растения формировало функциональный первый маркерный ген и второй маркерный ген. В некоторых вариантах осуществления эти маркерные гены можно использовать для селекции стабильного встраивания ETIP. В некоторых вариантах осуществления подходящие маркерные гены могут включать PMI, Xyl(A), YFP, DSR, GFP, GUS, NPTII, AAD-1, AAD-12, DGT-28, AHAS, PAT, DSM-2, HYG, BAR и гены флуоресцентных белков. В других вариантах осуществления маркерный ген представляет собой маркерный ген, поддающийся визуальному скринингу, присутствие которого можно определять путем мониторинга изменения цвета клетки. В других вариантах осуществления маркерный ген представляет собой ген селективного маркера (например, ген, кодирующий устойчивость к гербициду или антибиотику), селекцию присутствия которого проводят с использованием гербицида или антибиотика, который уменьшает рост клеток. В следующих вариантах осуществления маркерный ген представляет собой маркерный ген для положительной селекции.
В выбранный экспрессирующий вектор можно включать различные селективные маркеры, также описанные в качестве репортерных генов, для обеспечения идентификации и селекции трансформированных растений ("трансформантов"). Для подтверждения экспрессии селективных маркеров в трансформированных растений доступно множество способов, включая, например секвенирование ДНК и ПЦР (полимеразная цепная реакция), саузерн-блоттинг, РНК-блоттинг, иммнологические способы для обнаружения белка, экспрессируемого с вектора, например, преципитированного белка, который опосредует устойчивость к фосфотрицину, или визуального наблюдения других белков, таких как репортерные гены, кодирующие β-глюкуронидазу (GUS), люциферазу, зеленый флуоресцентный белок (GFP), желтый флуоресцентный белок (YFP), DsRed, β-галактозидаза, хлорамфениколацетилтрансфераза (CAT), щелочная фосфатаза и т.п. (см. Sambrook, et al., Molecular Cloning: A Laboratory Manual, Third Edition, Cold Spring Harbor Press, N.Y., 2001).
Гены селективных маркеров используют для селекции трансформирвоанных клеток или тканей. Гены селективных маркеров включают гены, кодирующие устойчивость к антибиотикам, такие как гены, кодирующие неомицинфосфотрансферазу II (NEO) и гигромицинфосфотрансферазу (HPT), а также гены, сообщающие устойчивость к гербицидным соединениям. Гены устойчивости к гербицидам кодируют модифицированный белок-мишень, нечувствительный к гербициду, или фермент, который деградирует или детоксифицирует гербицид в растении до того, как он сможет подействовать. Например, устойчивости к глифосату можно достигать с использованием генов, кодирующих мутантный фермент-мишень - 5-енолпирувилшикимат-3-фосфатсинтазу (EPSPS). Гены и мутанты EPSPS хорошо известны и дополнительно описаны ниже. Устойчивость к глюфосинату аммония, бромксинилу и 2,4-дихлорфеноксиацетату (2,4-D) достигают с использованием бактериальных генов, кодирующих pat или DSM-2, гена нитрилазы, генов aad-1 или aad-12, которые детоксифицируют соответствующие гербициды.
В одном варианте осуществления гербициды могут ингибировать конус нарастания или меристему, включая имидазолинон или сульфонилмочевину, и хорошо известны гены синтазы ацетогидроксикислот (AHAS) и ацетолактатсинтазы (ALS) для устойчивости/толерантности к этим гербицидам. Гены устойчивости к глифосату включают мутантные гены 5-енолпирувилшикимат-3-фосфатсинтазы (EPSP) и dgt-28 (посредством встраивания рекомбинантных нуклеиновых кислот и/или различных форм мутагенеза нативных генов EPSP in vivo), гены aroA и гены глифосатацетилтрансферазы (GAT), соответственно). Гены устойчивости к другим фосфоносоедениниям включают гены bar из видов Streptomyces, включая Streptomyces hygroscopicus и Streptomyces viridichromogenes, и гены устойчивости к пиридокси или феноксипропионовым кислотам и циклогексонам (гены, кодирующие ингибитор ACC-азы). Иллюстративные гены, сообщающие устойчивость к циклогександионам и/или арилоксифеноксипропионовой кислоте (включая галоксифоп, диклофоп, феноксипроп, флуазифоп, квизалофоп) включают гены ацетилкофермент-A-карбоксилазы (ACC-аза): Acc1-S1, Acc1-S2 и Acc1-S3. В одном варианте осуществления гербициды могут ингибировать фотосинтез и включают триазин (гены psbA и 1s+) или бензонитрил (ген нетрилазы).
В одном варианте осуществления гены селективных маркеров включают, но не ограничиваются ими, гены, кодирующие: неомицинфосфотрансферазу II; цианамидгидратазу; аспартаткиназу; дигидродипиколинатсинтазу; триптофандекарбоксилазу; дигидродипиколинатсинтазу и десенсибилизированную аспартаткиназу; продукт гена bar; триптофандекарбоксилазу; неомицинфосфотрансферазу (NEO); гигромицинфосфотрансферазу (HPT или HYG); дигидрофолатредуктазу (DHFR); фосфинотрицинацетилтрансферазу; дегалогеназу 2,2-дихлорпропионовой кислоты; синтазу ацетогидроксикислоты; 5-енолпирувилшикиматфосфатсинтазу (aroA); галоарилнитрилазу; ацетилкофермент-A-карбоксилазу; дигидроптероатсинтазу (sulI) и полипептид фотосистемы II массой 32 кДа (psbA).
Один вариант осуществления также включает гены, кодирующие устойчивость к: хлорамфениколу; метотрексату; гигромицину; спектиномицину; бромксинилу; глифосату и фосфинотрицину.
Подразумевается, что описанный выше перечень генов селективных маркеров не является ограничивающим. Настоящее изобретение охватывает любой репортерный ген или ген селективного маркера.
В одном варианте осуществления поддающаяся нацеливанию полинуклеотидная молекула ETIP встроена в геномных локус. В одном примере геномные локусы FAD2, FAD3 и IPK1 могут быть выбраны в качестве мишеней для встраивания ETIP и последующего встраивания донорной полинуклеотидной молекулы. Было показано, что разрушение эндогенных генов FAD2 и FAD3 не оказывает неблагоприятного влияния на агрономические или качественные свойства клетки растения. Таким образом, когда участки FAD2 и FAD3 разрушены, не происходит ухудшения агрономических или качественных свойств, ассоциированных с функциональностью растения или растительного продукта (канола, соя, кукуруза и т.д.), и группирование признаков, ассоциированных с конкретными характеристиками качества масла, ускоряет интрогрессию, и наблюдают развитие новой зародышевой плазмы. В конкретных вариантах осуществления донорная молекула нуклеиновой кислоты может быть связана с регуляторным элементом, таким как промотор, интрон, 5'-UTR или 3'-UTR.
Встраивание донорной молекулы нуклеиновой кислоты в ETIP можно облегчать с помощью направленного двухцепочечного расщепления сайт-специфической нуклеазой. Сайт-специфическая нуклеаза может быть расположена в поддающейся нацеливанию молекуле нуклеиновой кислоты ETIP. Более того, сайт-специфическая нуклеаза может быть расположена в подающейся нацеливанию молекуле нуклеиновой кислоты ETIP, содержащей сконструированную способами инженерии подушку для встраивания (ELP), см. патент США №20110191899. Более того, сайт-специфическая нуклеаза может быть расположена в или вблизи ELP в выбранной ETIP. Расщепление можно нацеливать на ETIP с использованием слитых белков, содержащих ДНК-связывающий домен, такой как ДНК-связывающий домен мегануклеазы, ДНК-связывающий домен РНК-направляемых CRISPR-Cas9, ДНК-связывающий домен в виде лейциновой молнии, ДНК-связывающий домен TAL, белок с цинковыми пальцами (ZFP), нуклеаза с цинковыми пальцами или химерные комбинации вышеуказанных, которые сконструированы так, чтобы они связывали встроенную способами инженерии последовательность в выбранной ETIP. Такое расщепление стимулирует встраивание экзогенных полинуклеотидных последовательностей груза или донорной нуклеиновой кислоты в или вблизи участка расщепления в ETIP. Встраивание донорных молекул нуклеиновой кислоты с использованием описанных способов может происходить как по зависимым от гомологии, так и по независимым от гомологии механизмам, причем селекцию направленных событий встраивания осуществляют путем скрининга новых поддающихся селекции и/или оценке маркеров, которые являются функциональными при направленных событиях встраивания как в 3'-, так и в 5'-областях ETIP. Настоящее изобретение демонстрирует применение новых сконструированных способами инженерии участков связывания цинковых пальцев и ZFN для обеспечения селективных двухцепочечных разрывов в ETIP.
В альтернативных вариантах осуществления новые модифицированные способами инженерии ДНК-связывающие домены (например, ZFP, мегануклеазы, лейциновые молнии, TAL, РНК-направляемые CRISPR-Cas9) связываются с одним или несколькими участками-мишенями в ETIP, которые не существуют в нативном геноме клетки растения. ДНК-связывающий домен(ы) может включать, например, любой из модифицированных способами инженерии ДНК-связывающих доменов с цинковыми пальцами, содержащих распознающие спирали, такие как описаны в заявке США № 12/931096. В некоторых вариантах осуществления любой из ДНК-связывающих доменов, описанных в настоящем описании, может дополнительно содержать функциональный домен, например, домен расщепления или половинный домен расщепления. В других вариантах осуществления половинный домен расщепления может происходить из эндонуклеазы рестрикции типа IIS, такой как Fokl или Stsl. Следующие варианты осуществления домена расщепления могут включать хоминг-эндонуклеазу, например, такую как хоминг-эндонуклеаза с модифицированным ДНК-связывающим доменом.
Варианты осуществления настоящего изобретения включают применение ДНК-связывающего белка с цинковыми пальцами. ДНК-связывающий белок с цинковыми пальцами, "ZFP" (или связывающий домен) представляет собой белок или домен в более крупном белке, который связывает ДНК специфическим для последовательности образом через один или несколько цинковых пальцев, которые представляют собой области аминокислотной последовательности в связывающем домене, структура которых стабилизирована координационной связью с ионом цинка. Термин "ДНК-связывающий белок с цинковыми пальцами" часто сокращенно обозначают как белок с цинковыми пальцами или ZFP. Связывающие домены цинковых пальцев могут быть "модифицированы способами инженерии" так, чтобы они связывались с заданной нуклеотидной последовательностью. Неограничивающие примеры модификации способами инженерии белков с цинковыми пальцами являются конструирование и селекция. Сконструированный белок с цинковыми пальцами представляет собой белок, не встречающийся в природе, конструкция/композиция которого в основном является результатом рациональных критериев. Рациональные критерии для конструирования включают использование правил замены и компьютерных алгоритмов для обработки информации в базе данных, хранящей информацию о существующих конструкциях ZFP и данные о связывании. См., например, патенты США 6140081, 6453242, 6534261 и 6785613; также см. WO 98153058, WO 98153059, WO 98153060, WO 021016536 и WO 031016496 и патенты США 6746838, 6866997 и 7030215.
В конкретных вариантах осуществления настоящего изобретения можно использовать нуклеазу с цинковыми пальцами (ZFN). ZFN может представлять собой любую нуклеазу с цинковыми пальцами, которая может быть доставлена в клетку растения в соответствии с настоящим изобретением. Например, ZFN могут включать слитые белки, содержащие домен расщепления (или половинный домен расщепления) и связывающий домен цинковых пальцев, полинуклеотиды, кодирующие эти белки, и комбинации полипептидов и кодирующих полипептиды полинуклеотидов. Связывающий домен цинковых пальцев может включать один или несколько цинковых пальцев (например, 2, 3, 4, 5, 6, 7, 8, 9 или более цинковых пальцев), и он может быть модифицирован способами инженерии так, чтобы он связывался с любой представляющей интерес областью. Таким образом, путем идентификации представляющей интерес области-мишени, в которой является желательным расщепление или рекомбинация, способами, описанными в настоящем описании, можно сконструировать один или несколько слитых белков, содержащих домен расщепления (или половинный домен расщепления) и домен цинкового пальца, модифицированный способами инженерии так, чтобы он распознавал последовательность-мишень в указанной представляющей интерес области. Присутствие такого слитого белка (или белков) в клетке приводит к связыванию слитого белка(ов) с его (их) участком(ами) связывания и расщепление в или вблизи указанной представляющей интерес области. Более того, если в такой клетке также присутствует экзогенный полинуклеотид, гомологичный представляющей интерес области, между нуклеотидной последовательностью с двухцепочечным разрывом и экзогенным полинуклеотидом гомологичная рекомбинация происходит с высокой частотой. Для целей настоящего изобретения "гомологичная рекомбинация" относится к специализированной форме такого обмена, которая происходит, например, в ходе репарации д