Способы, композиции и устройства для амплификации нуклеиновых кислот
Иллюстрации
Показать всеИзобретение относится к биотехнологии. Описана композиция для амплификации нуклеиновой кислоты, представляющей интерес, включающая смесь деоксинуклеотидов (dNTP), двухвалентных катионов, фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, отличающаяся тем, что смесь содержит соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, где указанная соль представляет собой аммоний пентаборат, и дикарбоновую кислоту. Также описаны наборы для амплификации нуклеиновой кислоты, представляющей интерес, включающие указанную композицию. Кроме того, описаны способы амплификации нуклеиновой кислоты, представляющей интерес, в том числе ДНК, представляющей интерес, включающие использование указанной композиции. 5 н. и 8 з.п. ф-лы, 1 табл., 5 ил., 6 пр.
Реферат
Настоящее изобретение относится к области амплификации нуклеиновых кислот, например, амплификации нуклеиновых кислот для детектирования присутствия конкретных последовательностей нуклеиновых кислот в биологических образцах, таких как образцы из растений или из растительного материала или материала, полученного из растений. Способы могут использоваться качественным или количественным образом и могут также использоваться для определения того, находится ли концентрация конкретных последовательностей нуклеиновых кислот в биологических образцах ниже заданного порогового уровня.
Предлагаются способы и композиции для амплификации нуклеиновых кислот, с помощью которых нуклеиновые кислоты, включая ДНК, экстрагируются из биологического материала или из материала, содержащего такой биологический материал, с использованием экстракции с помощью щелочного раствора, предпочтительно, с минимальным механическим мацерированием образца, или даже совсем без него, и при этом щелочной экстракт непосредственно добавляют в реакционную смесь или лиофилизированный мастермикс, делая возможной амплификацию нуклеиновой кислоты, представляющей интерес, без введения дополнительной стадии нейтрализации или разбавления.
Способы и композиции может быть удобным использовать вместе с единым устройством, делающим возможным отбор образцов, предпочтительно, из части растения, и амплификацию и/или детектирование нуклеиновой кислоты (кислот), представляющей интерес, без необходимости в открывании устройства после отбора образца материала, потенциально содержащего нуклеиновую кислоту (кислоты), представляющую интерес, и/или после реакции амплификации, тем самым сводя к минимуму риск загрязнения образца любой посторонней нуклеиновой кислотой.
Уровень техники
В современной агрономии способность детектирования конкретной последовательности нуклеотидов так называемой нуклеиновой кислоты, представляющей интерес, или целевой последовательности, становится все более и более важной. Это возможность позволяет, например, быстро детектировать конкретные последовательности нуклеиновых кислот, связанные с присутствием конкретной характеристики или признака у растения, тем самым давая возможность выводить конкретные растения с конкретными сочетаниями характеристик более прямым и более эффективным образом. Такая возможность также позволяет детектировать конкретные вариантные аллели у растений.
При выведении трансгенных растений возникает необходимость в способности детектироваться присутствие биологического материала, содержащего конкретные трансгенные объекты, например, в поле, при выведении сортов растений или в коммерческой цепи (производство зерна, транспортировка зерна, хранение зерна, и тому подобное), предпочтительно, при более высокой скорости, с более низкими затратами и при большем разнообразии. Кроме того, различные трансгенные объекты могут содержать сходные или даже идентичные нуклеиновые кислоты, и часто является желательной возможность различать такие различные трансгенные объекты, содержащие сходные или идентичные нуклеиновые кислоты, требующая применения конкретных способов и инструментов детектирования этих объектов.
В дополнение к этому, все больше и больше болезней растений можно быстро и однозначно диагностировать посредством детектирования конкретных последовательностей нуклеотидов, связанных с патогенами (грибковыми, вирусными, бактериальными, нематодами или другими вредителями растений), вызывающими болезнь.
Применение детектирования конкретной последовательности нуклеотидов в биологическом материале, разумеется, не ограничивается агрономическими применениями, но также простирается на другие области, включая область медицины, криминалистику, генетическое консультирование, и тому подобное.
Разнообразные способы детектирования основываются на амплификации целевой нуклеиновой кислоты и/или ДНК, имеющей конкретную последовательность нуклеотидов, при этом самый старый способ представляет собой цепную реакцию полимеразы.
Особенный интерес представляют собой изотермические способы амплификации ДНК, включая так называемую LAMP или петлевую изотермическую амплификацию, как описано, например, в патенте США № 641027 (Eiken). Способ отличается использованием 4 различных праймеров, конкретно сконструированных для распознавания 6 различных областей на целевом гене, и процесс реакции осуществляется при постоянной температуре с использованием реакции замещения цепи. Амплификация и детектирование целевой нуклеиновой кислоты, представляющей интерес, могут быть завершены на одной единственной стадии посредством инкубирования смеси биологического образца или экстракта его нуклеиновой кислоты, праймеров, полимеразы ДНК с активностью замещения цепи и субстратов при постоянной температуре (примерно 65°C). Это обеспечивает высокую эффективность амплификации, при этом ДНК амплифицируется 109-1010 раз за 15-60 минут. Благодаря его высокой специфичности, присутствие амплифицированного продукта может указывать на присутствие целевого гена (http://loopamp.eiken.co.jp/e/lamp/index.html).
Другие изотермические способы амплификации ДНК включают так называемую реакцию амплификации с помощью никующего фермента (NEAR) (Envirologix). NEAR использует никующий фермент и цепь-замещающую полимеразу для генерирования малых фрагментов ДНК, которые вводят в реакцию удлинения ДНК; поочерёдные циклы никования и удлинения приводят к экспоненциальной амплификации. Способ описан, например, в US 2009/0017453.
Другой изотермический способ амплификации нуклеиновой кислоты и/или ДНК представляет собой так называемую рекомбиназную полимеразную амплификацию (TwistDx). Способ RPA использует рекомбиназы, которые способны к спариванию олигонуклеотидных праймеров с гомологичной последовательностью дуплексной ДНК. С помощью этого способа, синтез ДНК с помощью ДНК-полимеразы направлен на определенные точки образца ДНК. Если целевая последовательность присутствует, инициируется реакция амплификации ДНК. Рекомбиназная полимеразная амплификация с помощью описана, например, в патенте США № 7270981.
Другие изотермические способы амплификации описаны в Gill и Ghaemi, 2008, Nucleosides Nucleotides Nucleic Acids, 27(3) 224-243.
Важная стадия во всех способах амплификации нуклеиновых кислот и/или ДНК представляет собой приготовление матричных нуклеиновых кислот из биологического материала. Для автоматического осуществления реакции амплификации, предпочтительной является удобная и эффективная экстракция нуклеиновых кислот из биологических образцов, дающая достаточное количество матричных нуклеиновых кислот, и предпочтительно, в растворе без мутности. Предпочтительно, стадия экстракции должна включать только минимальную мацерацию или даже исключать механическую мацерацию биологического материала, поскольку это может вносить мутность в раствор. Щелочная экстракция матричной нуклеиновой кислоты и/или ДНК из биологических образцов может предложить такой способ с использованием только минимальной мацерации биологического образца.
Klimyuk (1993) (Plant Journal 3(3) 493-494) описывает щелочную обработку с целью быстрого приготовления растительного материала для надежного анализа PCR.
Chomczynski and Rymaszewski (2006) описывают способ экстракции на основе щелочного полиэтиленгликоля из бактерий образцов эукариотических тканей и цельной крови для непосредственной PCR (BioTechniques, 40, 454-457).
Недостаток способов щелочной экстракции заключается в том, что полученный в результате экстракт должен нейтрализоваться или разбавляться в достаточной степени перед добавлением экстракта или его аликвоты в реакционную смесь для амплификации. Такая стадия разбавления или нейтрализации дает в результате дополнительные манипуляции с образцом, увеличивает риск загрязнения образца нежелательными нуклеиновыми кислотами и/или ДНК. Кроме того, дополнительная стадия усложняет автоматическое осуществление реакции амплификации (см. также Lee et al., 2009, J. Agric. Food Chem. 2009, 57, 9400-9402).
Кроме того, имеется необходимость в автоматическом осуществлении отбора образцов, амплификации и детектировании с минимальным количеством стадий способа. Такие наборы и/или устройства для автоматического осуществления могли бы использоваться в окружающей среде вне лаборатории, в частности, если химический механизм и само его осуществление являются устойчивыми.
Современные способы детектирования для использования вне лабораторной окружающей среды представляют собой инструменты для детектирования на основе белков, такие как иммунохроматографические полоски. Инструменты для детектирования на основе белков не могут детектировать, например, трансгенные растения с молчащими генами, вызывающими появление признака, временную или специальную экспрессию белков, или не могут различать различные растения или трансгенные объекты, экспрессирующие одинаковые или сходные белки.
Настоящее изобретение предлагает решение этих проблем, как описано ниже в разделах Сущность изобретения, Подробные описания вариантов осуществления, в примерах, чертежах и в формуле изобретения.
Сущность изобретения
В одном из вариантов осуществления настоящего изобретения, предлагается композиция, пригодная для амплификации нуклеиновых кислот, содержащая смесь деоксинуклеотидов (dNTP), двухвалентных катионов, таких как дает Mg2SO4 или другие соли магния, фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации целевой нуклеиновой кислоты, такой как ДНК, представляющая интерес, отличающаяся тем, что смесь дополнительно содержит соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, такой как аммоний пентаборат (NH4B5O8), предпочтительно, при конечной концентрации в пределах между 10 мМ и 100 мМ, предпочтительно, между 30 мМ и 40 мМ, и дополнительную органическую кислоту, предпочтительно, дикарбоновую кислоту, которая может быть выбрана из щавелевой кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, адипиновой кислоты, пимелиновой кислоты, субериновой кислоты, азелаиновой кислоты, себациновой кислоты, глюкуроновой кислоты, молочной кислоты, винной кислоты, фумаровой кислоты, малеиновой кислоты или их смеси, предпочтительно, из яблочной кислоты, предпочтительно, при конечной концентрации в пределах между 10 мМ и 40 мМ, предпочтительно, при 40 мМ. Двухвалентные катионы могут обеспечиваться Mg2SO4 и могут иметь конечную концентрацию в пределах между 1 и 10 мМ, предпочтительно, между 4 и 8 мМ. И dNTP могут иметь конечную концентрацию в пределах между 0,2 мМ и 1,4 мМ, предпочтительно, между 0,4 мМ и 0,9 мМ. Фермент, способный к амплификации ДНК, может быть выбран из ДНК I полимеразы, полимеразы Кленова, полимеразы TaqI, полимеразы ДНК со свойствами замещения цепи, phi 29 полимеразы, Bst полимеразы, Csa полимеразы, 96-7 полимеразы, Bsm полимеразы или GspSSD полимеразы.
В другом варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, может дополнительно содержать молекулы, делающие возможным флуоресцентное детектирование амплифицированных нуклеиновых кислот или ДНК, такие как димерные красители, содержащие мономерные красители, связанные с нейтральной молекулой, которые становятся флуоресцентными только когда связываются с нуклеиновой кислотой, или интеркалирующие красители, включая N',N'-диметил-N-[4-[(E)-(3-метил-1,3-бензотиазол-2-илиден)метил]-1-фенилхинолин-1-ий-2-ил]-N-пропилпропан-1,3-диамин) или флуоресцентный краситель SYTO-81 (Invitrogen).
В другом варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, может дополнительно содержать молекулы, делающие возможным детектирование амплифицированной нуклеиновой кислоты посредством специфичного связывания антитела или связывания посредством сродства, или посредством анализов гибридизации на основе нуклеиновых кислот или их сочетаний (известных также как иммунохроматографические анализы).
Еще в одном варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, может дополнительно содержать детергент, предпочтительно, Triton X-100 или Tween 20, или Pluronic F-68, предпочтительно, при концентрации в пределах между 0,01% и 0,5%, предпочтительно, примерно 0,1%.
Также предлагаются композиции, пригодные для амплификации нуклеиновых кислот, дополнительно содержащие защитный агент при лиофилизации, такой как трегалоза, который может присутствовать при конечной концентрации в пределах между 0,001 и примерно 5%, и/или бетаин при концентрации в пределах между 0,05 мМ - 1 М.
Во всех вариантах осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновой кислоты, является пригодной для амплификации нуклеиновой кислоты и/или последовательности ДНК, представляющей интерес, в биологическом образце, таком как биологический образец, полученный из растения, представляющего интерес. Нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, может быть специфичной для коммерчески доступного объекта трансформации или для экспериментально доступного объекта трансформации. Нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, может также быть специфичной к присутствию конкретной аллели, такой как вариантная аллель, или нуклеиновая кислота и/или последовательность ДНК, представляющая интерес, может представлять собой маркер, такой как маркер QTL. Концентрации олигонуклеотидов праймеров являются такими, как известно в данной области для различных способов амплификации нуклеиновых кислот.
В другом варианте осуществления настоящего изобретения, композиция, пригодная для амплификации нуклеиновых кислот, как описано в настоящем документе, может подвергаться воздействию лиофилизации.
Еще в одном варианте осуществления настоящего изобретения, предлагается набор, содержащий композицию, пригодную для амплификации нуклеиновых кислот, как описано в настоящем документе.
Набор может содержаться внутри устройства, указанное устройство содержит
a. средства для отбора образцов биологического материала;
b. резервуар для жидкости, содержащий щелочной экстракционный раствор;
c. соответствующие каналы для направления щелочного экстракционного раствора, при активировании, на биологический образец в реакционной смеси; и
d. необязательно, средства для детектирования амплификации нуклеиновых кислот.
Набор может также содержаться внутри картриджа, указанный картридж содержит
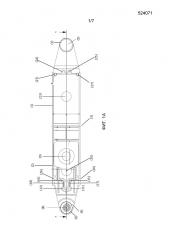
a) первый компонент, предпочтительно, компонент, являющийся основой, предпочтительно, покрытый на обеих сторонах прозрачными покрытиями, с формированием тем самым каналов и камер (1), и второй компонент, предпочтительно, компонент, являющийся крышкой (2), складываемые вместе для закрывания, предпочтительно, посредством совмещения двух структур вместе, предпочтительно, вокруг шарнирной секции (3); причем
b) указанные первый и второй компоненты или указанные компоненты, являющиеся основой и крышкой, содержат вставляемую и соответствующую принимающую часть (4) и (5), которые, когда первый и второй компоненты или компоненты, являющиеся основой и крышкой, совмещаются, формируют камеру A, подходящую для приема биологического образца; где камера A предпочтительно является герметичной;
c) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит соединенный с ним резервуар (9) для жидкости, содержащий щелочной раствор; где указанный резервуар для жидкости соединен с камерой A посредством канала (10);
d) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры B (11) (12), соединенные с указанной камерой A или с указанной частью (4) камеры A, расположенной на основе, посредством, по меньшей мере, одного канала (13);
e) указанный первый компонент или указанный компонент, являющийся основой, дополнительно содержит, по меньшей мере, одну, предпочтительно, две камеры C (15) (16), каждая из них соединена с указанной, по меньшей мере, одной камерой B посредством канала (17) (18);
f) указанный первый компонент или указанный компонент, являющийся основой, дополнительно, необязательно содержит, по меньшей мере, одну, предпочтительно, две камеры D (19) (20), каждая из них соединена с указанной, по меньшей мере, одной камерой C посредством канала (21) (22);
g) указанный второй компонент или указанный компонент, являющийся крышкой, предпочтительно имеет физический доступ (23), предпочтительно, отверстие, чтобы сделать возможным взаимодействие с резервуаром (9) для жидкости;
h) указанный второй компонент или компонент, являющийся крышкой, дополнительно, необязательно содержит, по меньшей мере, одну, предпочтительно, две оптически прозрачных области над областью указанной камеры B или над областями указанных двух камер C, делая возможным мониторинг камеры B или C (24) (25);
где указанная композиция содержится в указанных камерах B.
Настоящее изобретение также предлагает способ амплификации нуклеиновой кислоты или ДНК, представляющей интерес, включающий использование композиции, пригодной для амплификации нуклеиновых кислот, как описано в настоящем документе, или набора, как описано в настоящем документе. Способ предпочтительно представляет собой изотермический способ амплификации ДНК. Матричная нуклеиновая кислота или ДНК может быть приготовлена в щелочном растворе и может дополнительно содержать ДНК-носитель.
Настоящее изобретение также предлагает способ амплификации нуклеиновой кислоты или ДНК, включающий стадии a) выделения матричной нуклеиновой кислоты или ДНК из биологического образца, такого как часть растения, орган или ткань, часть листа растения, из семян или гранулированных семян с использованием щелочного экстракционного раствора, такого как щелочной экстракционный раствор, содержащий KOH, NaOH или LiOH, предпочтительно, KOH, предпочтительно, при концентрации 25 мМ - 100 мМ, в частности, при концентрации примерно 50 мМ, и предпочтительно, с обработкой биологического образца с минимальной механической мацерацией или вообще без нее, и b) приготовления ингредиентов и условий для амплификации нуклеиновой кислоты или ДНК, где указанная выделенная матричная нуклеиновая кислота или ДНК в указанном щелочном экстракционном растворе не разбавляется или не нейтрализуется перед указанной стадией b), но вместо этого, непосредственно добавляется в реакционную смесь или в лиофилизированнный мастермикс.
Краткое описание чертежей
Фигура 1: Схематический чертеж разложенного картриджа, как описано в настоящей заявке. Панель A: вид внутренней стороны разложенного картриджа. Панель B: вид наружной стороны разложенного картриджа. Панель C: поперечное сечение A-A разложенного картриджа. (1) Верхняя опора или крышка; (2) нижняя опора или крышка; (3) шарнирная секция; (4) нижняя часть камеры A; (5) верхняя часть камеры A; (6) (7) выступающие части или защелки частей камеры A; (8) канал для транспортировки текучей среды, для распределения текучей среды на биологическом образце; (9) резервуар для жидкости, для щелочного экстракционного раствора; (10) канал для текучей среды; (11) (12) камеры B, которые могут содержать лиофилизированную реакционную смесь; (13) канал для текучей среды; (14) соединение T-образной формы; (15) (16) камеры C; (17) (18) каналы для текучей среды; (19)(20) камеры D; (21) (22) каналы для текучей среды; (23) отверстие в верхней крышке, дающее возможность для приложения давления к резервуару для жидкости; (24) (25) оптически прозрачные области; (26) отверстия и (27) выступы в крышке для смыкания верхней и нижней опор вместе.
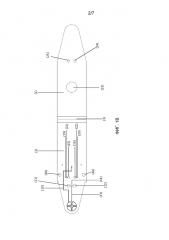
Фигура 2: Панель A: Трехмерная репрезентация картриджа в соответствии с настоящим изобретением. Относительно ссылочных номеров, см. Фигуру 1. Панель B: отбор образца листа растения с использованием картриджа в соответствии с настоящим изобретением. Панель C: детектирование флуоресценции в реальном времени после активирования реакции посредством приведения в действие блистера с текучей средой, тем самым нагнетается буфер для экстракции нуклеиновой кислоты или ДНК на образец из листа, разбавляя лиофилизированную реакционную смесь. Картридж нагревают до постоянной температуры 65°C.
Фигура 3: Сравнение различных условий реакции для реакции LAMP. Панель 1. амплификация каталазы; Панель 2. амплификация дважды мутировавших EPSPS. А: условия для буфера А; В: условия для буфера; С: условия для буфера (см. Пример 1).
Фигура 4: Детектирование продуктов LAMP с помощью иммунохроматографических полосок.
LAMP осуществляют с помощью петлевых праймеров, меченых биотином и FAM, и детектируют на полосках HybriDetect от Milenia Biotec. Полоска 1: хлопок GHB614 (содержащий дважды мутировавший ген EPSPS); Полоска 2: хлопок дикого типа.
Фигура 5: Панель А: влияние типа органической кислоты и концентрации на реакцию LAMP. Панель В: влияние различных концентраций аммония пентабората на реакцию LAMP. Панель С: влияние детергентов на реакцию LAMP. Панель D: сравнение присутствия и отсутствия малеиновой кислоты или лимонной кислоты на реакцию LAMP (а) с 40 мМ малеиновой кислоты; (b) без органической кислоты; (с) с 40 мМ лимонной кислоты.
Подробное описание различных вариантов осуществления настоящего изобретения
Настоящее изобретение основывается на оптимизации условий реакции амплификации нуклеиновой кислоты, делающей возможной прямую ферментативную амплификацию нуклеиновой кислоты с использованием в качестве матрицы нуклеиновой кислоты и/или ДНК, экстрагированной из биологического материала с помощью щелочного раствора, без какой-либо промежуточной стадии нейтрализации или разбавления, как для предыдущего уровня техники. Прямое добавление нуклеиновой кислоты и/или ДНК также устраняет необходимость в термической денатурации нуклеиновой кислоты, чтобы сделать возможным связывание праймера, и может, таким образом, вносить вклад в эффективность детектирования нуклеиновой кислоты, представляющей интерес.
Таким образом, в одном из вариантов осуществления настоящего изобретения, описан способ амплификации нуклеиновых кислот, таких как ДНК, включающий стадии а. выделения матричной нуклеиновой кислоты или ДНК из биологического образца с использованием щелочного экстракционного раствора
b. приготовления ингредиентов и условий для амплификации ДНК,
где указанная выделенная матричная ДНК в указанном щелочном экстракционном растворе не разбавляется или не нейтрализуется перед указанной стадией b), но вместо этого непосредственно добавляется к этим ингредиентам.
Щелочной экстракционный раствор может содержать KOH, NaOH или LiOH, предпочтительно, KOH, предпочтительно, в диапазоне концентраций примерно от 25 до 100 мМ, в частности, в диапазоне концентраций около 50 мМ. Одно из преимуществ щелочной экстракции нуклеиновой кислоты и/или ДНК из биологических образцов заключается в том, что нет необходимости в переработке биологического образца с помощью механической мацерации, тем самым устраняется введение мутности в экстракты или в последующие реакционные смеси. Разумеется, определенный уровень мацерации может быть приемлемым или даже предпочтительным. Например, высечка образца листа уже вводит минимальный уровень мацерации для образца, хотя никакой дополнительной мацерации может не потребоваться. Кроме того, минимальная мацерация может включать прокол образца или сжатие образца.
Предпочтительно, экстракционный раствор также содержит ДНК-носитель, то есть, ДНК, которая не содержит нуклеиновой кислоты, представляющей интерес, и предпочтительно получается из организма, не родственного с биологическим материалом, отбираемым как образец. Для растительного материала, удобный источник ДНК-носителя представляет собой ДНК молок рыбы, хотя можно также использовать ДНК из любого другого источника. Присутствие ДНК-носителя уменьшает частоту ложных положительных событий при последующей амплификации и детектировании амплифицированной ДНК.
Чтобы сделать возможным прямое добавление щелочного экстракта, содержащего матричную нуклеиновую кислоту или матричную ДНК, к реакционной смеси, реакционная смесь имеет композицию, имеющую достаточную буферную емкость, даже без слишком сильного увеличения ионной силы реакционной смеси, так что фермент для амплификации не ингибируется.
Чтобы сделать возможной прямую амплификацию без дополнительной стадии нейтрализации или разбавления, настоящее изобретение предлагает в одном из вариантов осуществления композицию, пригодную для амплификации молекул нуклеиновой кислоты и/или ДНК, содержащую смесь двухвалентных катионов, деоксинуклеотидов (dNTP), фермента, способного к амплификации ДНК, и праймеров, пригодных для амплификации нуклеиновой кислоты и/или ДНК, представляющей интерес, отличающуюся тем, что смесь имеет достаточную буферную емкость при достаточно низкой ионной силе для достаточной нейтрализации щелочного раствора, содержащего матричную нуклеиновую кислоту или ДНК, чтобы сделать возможным функционирование фермента для амплификации. Такая композиция может, например, содержать соль, содержащую аммоний в качестве катиона, и анион слабой кислоты, и/или дополнительную органическую кислоту, предпочтительно, дикарбоновую кислоту.
Как используется в настоящем документе, слабая кислота представляет собой кислоту, которая имеет pKa примерно от 2 до 6. В одном из вариантов осуществления соль представляет собой аммоний пентаборат (NH4B5O8). В другом варианте осуществления, соль может представлять собой соль слабой кислоты и аммония в качестве катиона, при этом, при растворении в воде, достигаемое значение pH находится вблизи оптимального pH для фермента, который должен использоваться в реакции амплификации. В предпочтительном варианте осуществления, pH после растворения соли аммония составляет приблизительно 8,5.
Аммоний пентаборат в реакционной смеси может иметь конечную концентрацию в пределах между 10 мМ и 100 мМ, предпочтительно, между 30 и 40 мМ, в частности, примерно 30 мМ. Катион аммония и боратный анион можно также получить из других источников. Например, катион аммония может быть получен из сульфата аммония, а боратный анион из Трис-бората. Однако необходимо быть осторожным, чтобы поддерживать общую ионную силу буфера достаточно низкой, для того чтобы предотвратить ингибирование фермента полимеразы.
Дополнительная органическая кислота может быть выбрана из щавелевой кислоты, малоновой кислоты, янтарной кислоты, глутаровой кислоты, адипиновой кислоты, пимелиновой кислоты, субериновой кислоты, азелаиновой кислоты, себациновой кислоты, глюкуроновой кислоты, молочной кислоты, винной кислоты, фумаровой кислоты, малеиновой кислоты или их смесей, предпочтительно, при конечной концентрации в пределах между 10 и 40 мМ, предпочтительно, примерно при 40 мМ. Важно, что органическая кислота не является ингибиторной по отношению к реакции амплификации или к амплификации. Обнаружено, например, что лимонная кислота или аскорбиновая кислота могут быть ингибиторными для реакции LAMP.
Другое важное составляющее реакционной смеси для амплификации нуклеиновых кислот и/или ДНК представляет собой олигонуклеотидные праймеры. Термин "праймер", как используется в настоящем документе, охватывает любую нуклеиновую кислоту, предпочтительно, ДНК, которая способна осуществлять прайминг синтеза выделяемой нуклеиновой кислоты в способе, зависимом от матрицы, таком как PCR, NEAR, RPA, LAMP. Как правило, праймеры представляют собой олигонуклеотиды из 10-30 нуклеотидов, но могут использоваться и более длинные последовательности. Праймеры, пригодные для LAMP, могут составлять до 60 нуклеотидов. Праймеры могут быть приготовлены в двухнитевой форме, хотя однонитевая форма является предпочтительной. Праймеры распознают специфично целевую последовательность нуклеотидов нуклеиновой кислоты, представляющей интерес, и специфично гибридизуются с этой нуклеиновой кислотой, тем самым определяется специфичность анализа относительно нуклеиновой кислоты, представляющей интерес, которая должна амплифицироваться/детектироваться. Праймеры могут содержать дополнительные химические модификации, делающие возможным детектирование амплифицированной нуклеиновой кислоты или ДНК, как описано далее в настоящем документе. Точное расположение и структура праймеров также организуются с помощью способа амплификации, который должен использоваться. Например, для LAMP сконструированы 4 типа праймеров, на основе 6 различных областей целевого гена: области F3c, F2c и F1c находятся на 3' стороне, а области B1, B2 и B3 на 5' стороне:
FIP: внутренний прямой праймер (FIP) состоит из F2 области (на 3'окончании), которая является комплементарной по отношению к области F2c, и из такой же последовательности как у Flc области на 5' окончании.
Праймер F3: внешний прямой праймер состоит из F3 области, которая является комплементарной по отношению к области F3c.
BIP: внутренний обратный праймер (BIP) состоит из B2 области (на 3' окончании), которая является комплементарной по отношению к области B2c, и из такой же последовательности как у области B1c на 5' окончании.
Праймер B3: внешний обратный праймер состоит из B3 области, которая является комплементарной по отношению к области B3c.
Реакция может дополнительно оптимизироваться посредством введения так называемых петлевых праймеров (либо петлевого праймера B, либо петлевого праймера F), содержащих последовательности комплементарные к однонитевой петлевой области (либо между B1 и B2 областями, либо между F1 и F2 областями) на 5' окончании гантелеобразной структуры, они обеспечивают повышенное количество исходных точек для синтеза ДНК для способа LAMP (см. также loopamp.eiken.co.jp/e/lamp).
Еще одно важное составляющее реакционной смеси для амплификации нуклеиновых кислот и/или ДНК представляет собой ферменты для амплификации. В зависимости от используемого способа, эти ферменты включают полимеразу ДНК I, полимеразу Кленова, полимеразу TaqI, полимеразу ДНК со свойствами замещения цепи, phi 29 полимеразу, Bst полимеразу (NEB), Csa полимеразу, 96-7 полимеразу (http://www.nippongene.com), Bsm полимеразу (Fermentas), GspSSD полимеразу (Optigene) и другие.
В одном из вариантов осуществления способов по настоящему изобретению, композиция является пригодной для использования в связи с так называемым способом LAMP, как описано в настоящем документе. Однако эти композиции и способы можно также использовать в других типах амплификации, включая RPA, PCR, NEAR, и тому подобное.
Другие составляющие в реакционной смеси считаются менее критичными и включают dNTP при конечной концентрации в пределах между 0,2 мМ и 1,4 мМ и двухвалентные катионы (Mg2+, Mn2+, …) при конечной концентрации в пределах между 1-10 мМ. Mg2SO4 представляет собой пригодную для использования соль, но она может быть заменена другими солями.
Детектирование амплифицированной нуклеиновой кислоты, представляющей интерес, предпочтительно ДНК, представляющей интерес, может осуществляться любым способом, известным в данной области. Детектирование может быть специфичным или неспецифичным или представлять собой сочетание их обоих. Детектирование может основываться на колориметрическом, турбидиметрическом, люминесцентном или флуоресцентном анализе. Флуоресцентное детектирование считается очень удобным. Как правило, флуоресцентное детектирование нуклеиновой кислоты достигается с использованием флуоресцентных красителей для нуклеиновых кислот, которые могут классифицироваться на два больших класса: интеркаляторы и красители, связывающиеся с малой бороздкой, хотя имеются и другие красители, которые могут связываться с нуклеиновыми кислотами множеством способов, включая электростатическое взаимодействие между положительно заряженным красителем и отрицательно заряженной нуклеиновой кислотой. Флуоресцентные интеркаляторы представляют собой красители, которые связываются с двухнитевой ДНК или двухнитевой РНК, встраиваясь сами по себе между парой соседних оснований. Красители, связывающиеся с малой бороздкой, представляют собой красители, которые связываются с малой бороздкой двухнитевой ДНК.
Интеркаляторные красители включают этидий бромид (хорошо известный в данной области, но менее предпочтительный из-за его мутагенных или канцерогенных свойств) или асимметричных цианиновых красителей, таких как SYBR Green I, SYBR Gold или SYBR Safe. SYBR Green представляет собой N’,N’-диметил-N-[4-[(E)-(3-метил-1,3-бензотиазол-2-илиден)метил]-1-фенилхинолин-1-ий-2-ил]-N-пропилпропан-1,3-диамин). SYBR Safe описан в публикации заявки на патент США № 2005/0239096 (включенной в настоящий документ в качестве ссылки).
Публикация заявки на патент США №2006/0211029 (включенной в настоящий документ в качестве ссылки) описывает несколько димерных флуоресцентных красителей, включая EVA Green. Димерные флуоресцентные красители содержат два мономерных красителя и соответствующий линкер для формирования димерного красителя, при этом в отсутствии нуклеиновых кислот, димерный краситель принимает шпилькообразную конформацию, которая имеет низкий фоновый уровень флуоресценции или вообще ее не имеет. В присутствии нуклеиновых кислот, краситель принимает открытую неупорядоченную конформацию, которая дает возможность красителю для взаимодействия с нуклеиновой кислотой и повышения флуоресценции.
Другой флуоресцентный краситель, который может быть пригодным для использования, представляет собой SYTO-81 (Invitrogen).
Tanner et al. (2012, Biotechniques 53, 2) описывают флуоресцентные зонды для реакции LAMP, которые, когда используются вместе со сходными праймерами на чистой ДНК, дают в результате детектирование амплификации, которая, видимо, является чуть более поздней, но имеет значительно лучшее отношение сигнал/шум, чем при использовании, например, SYBR Green.
Детектирование амплифицированной нуклеиновой кислоты, представляющей интерес, может также осуществляться посредством специфичного распознавания антитела. Для этой цели, амплифицированная нуклеиновая кислота, представляющая интерес, может содержать модификации, содержащие специфичные антигены, распознаваемые специфичным антителом, которые могут вводиться, например, посредством модификации олигонуклеотидных праймеров, используемых для амплификации нуклеиновых кислот. Детектирование также может достигаться посредством анализов, основанных на сродстве (с использованием, например, стрептавидина-биотина) или анализов на основе гибридизации. Использование этого типа анализов хорошо известно в данной области (например, иммунохроматографических полосок).
Как используется в настоящем документе, биологический образец используют для указания любого биологического материала, в частности, биологического материала, содержащего нуклеиновые кислоты, или материала, содержащего такой биологический материал или полученного из него, при условии, что нуклеиновые кислоты по-прежнему могут детектироваться. Неограничивающий список биологических материалов включает сегменты листьев, сегменты стеблей, сегменты корней, семенной материал, гранулированные семена, муку, волокна, отдельные семена, хлопья из семян, насыпные семена, и тому подобное. Биологический материал может содержать грибки, бактерии, включая ризобактерии, вирусы, растения, животных, Protista, и тому подобное, или может быть получен из них.
Композиции для амплификации нуклеиновых кислот, представляющих интерес, как описано в настоящем документе, могут дополнительно содержать детергенты, такие как Triton X-100, Tween 20, Pluronic-F-68 (Invitrogen), или их сочетания, предпочтительно, при концентрации примерно 0,1%.
Удобно, когда композиции для амплификации нуклеиновых кислот, представляющих интерес, как описано в настоящем документе, приготавливаются в лиофилизированной форме. Для этой цели, композиции дополняются защитными агентами для лиофилизации, такими как трегалоза, предпочтительно, при конечной концентрации от 0,001% примерно до 5%. Предпочтительно, компоненты лиофилизируются на твердой или полутвердой основе или подложке ("матрас"), делая возможными простые манипуляции.
Композиции и способы амплификации нуклеиновой кислоты, представляюще