Способ селективного разделения рацемической смеси сальбутамола
Иллюстрации
Показать всеИзобретение относится к химико-фармацевтической промышленности и представляет собой способ селективного разделения рацемической смеси сальбутамола методом сверхкритической флюидной хроматографии, заключающийся в том, что проводят разделение рацемической смеси сальбутамола элюированием с помощью подвижной фазы из сверхкритического CO2, спирта и динамического модификатора из раствора рацемической смеси сальбутамола в спирте с применением колонки, состоящей из силикагеля с привитым к нему хиральным селектором, отличающийся тем, что в качестве рацемической смеси сальбутамола используют соль сальбутамола, в качестве хирального селектора применяют макроциклический гликопептид эремомицин, а также тем, что в составе подвижной фазы используют динамический модификатор в концентрации 10÷200 мМ по отношению к спирту, состоящий либо из смеси изопропиламина с трифторуксусной кислотой в мольном соотношении 1:1÷3:1, либо из смеси изопропиламина с ацетатом аммония в мольном соотношении 1:1÷5:1, при этом в качестве спирта используют метанол, разделение проводят при температуре 18÷25°C. Изобретение позволяет в одну стадию разделить рацемическую смесь соли сальбутамола для получения соли R-сальбутамола. 1 з.п. ф-лы, 3 ил., 3 пр.
Реферат
Изобретение относится к области фармакологии, а именно к способам получения терапевтически активных соединений, а именно R-энантиомера сальбутамола, который может быть использован при лечении заболеваний дыхательных путей и входить в состав противоастматических препаратов.
1. Сальбутамол (другое название - альбутерол) - синтетическое лекарственное средство, которое используется в ингаляционной форме при хронической астме и некоторых других заболеваниях дыхательных путей [https://beta.nhs.uk/medicines/salbutamol-inhaler]. Сальбутамол хирален, и нужной терапевтической активностью обладает только его R-энантиомер [Penn R.B., Frielle Т., McCullough J.R. et al. Clin. Rev. Allergy Immunol. 1996. Vol. 14. No. 1. P. 37.]. Обычно считается, что S-изомер - нейтральный балласт, и большинство производителей препаратов на основе сальбутамола используют рацемат. Но есть сведения, что S-изомер гораздо медленнее всасывается в кровь из бронхов [Matera M.G., Calzetta L., Roglianni P. et al. Pulm. Pharmacol. Ther. 2011. Vol. 24. No. 2. P. 221.]. Считают, что из-за этого при долгом постоянном употреблении S-изомер может накапливаться в бронхах, формировать там микроотложения, которые будут ухудшать астму и приводить к появлению нежелательных побочных эффектов [Matera M.G., Calzetta L., Roglianni P. et al. Pulm. Pharmacol. Ther. 2011. Vol. 24. No. 2. P. 221., M. Patel, N.C. Thomson. Expert Opin. Pharmacother. 2011. Vol. 12. No. 7. P. 1133.]. В связи с этим в настоящее время производители противоастматических препаратов прикладывают усилия для получения лекарств на основе чистого R-изомера сальбутамола.
Известны патенты, посвященные выделению чистого R-энантиомера сальбутамола. В патентах US 7247750 и US 7049469 раскрывается способ получения левосальбутамола или его фармакологически приемлемых солей, включающий в себя асимметричное гидрирование прохирального левосальбутамола в присутствии родия и хирального бидентантного фосфинового лиганда в качестве катализирующей системы и последующее получение соли левосальбутамола с помощью кислоты. В качестве лиганда, в частности, используют (2R,4R)-4-(дициклогексилфосфино)-2-(дифенилфосфинометил)-N-метиламинокарбонилпирролидин.
Предложенные способы являются достаточно дорогостоящими и сложными в исполнении.
Другой подход - это селективная кристаллизация для разделения энантиомеров сальбутамола. Так, в патентах US RE43984, US RE43844 и US 6995286 предложен способ получения оптически чистого (R) сальбутамола или его фармацевтически приемлемых солей, имеющий значение энантиомерного избытка 95% или более. Способ позволяет получать либо R-изомер сальбутамола, либо его предшественника (4-бензил-албутерол или метил-5-[2-[(1,1-диметилэтил)амино]-1-гидроксиэтил]-2-(фенилметокси)-бензоат) в оптически чистой форме. Процесс получения включает в себя растворение смеси энантиомеров сальбутамола, 4-бензил-албутерола или метил-5-[2-[(1,1-диметилэтил)амино]-1-гидроксиэтил]-2-(фенилметокси)-бензоата с L-винной кислотой (в мольном избытке) в растворителе; охлаждение раствора до кристаллизации соли одного из энантиомеров; отделение соли от раствора; выделение энантиомера из соли. В случае когда в качестве исходных веществ используют 4-бензил-албутерол или метил-5-[2-[(1,1-диметилэтил)амино]-1-гидроксиэтил]-2-(фенилметокси)-бензоат, проводят дебензилирование энантиомера и получают R-энантиомер сальбутамола. Впоследствии полученное соединение может быть переведено в фармакологически приемлемую соль. В патенте US 8063251 показан другой способ. Он включает в себя растворение рацемической смеси 4-бензилсалбутамола и (+) 4-нитротартраниловой кислоты в бинарной системе растворителей, содержащей алкилацетат и спирт, при температуре кипения с обратным холодильником с образованием раствора; охлаждение раствора для кристаллизации соли 4-нитротартраниловой кислоты R-изомера 4-бензилсальбутамола; фильтрацию раствора для отделения соли 4-нитротартраниловой кислоты S-изомера 4-бензилсальбутамола; очистку соли 4-нитротартраниловой кислоты R-изомера 4-бензилсальбутамола путем обработки бинарной системой растворителей, содержащей алкилацетат и спирт; обработку соли 4-нитротартраниловой кислоты R-изомера 4-бензилсальбутамола 5-15% раствором муравьиной кислоты с получением соли муравьиной кислоты R-изомера 4-бензилсальбутамола; отделение (+) 4-нитротартраниловой кислоты путем фильтрации; охлаждение фильтрата, содержащего соль муравьиной кислоты R-изомера 4-бензилсальбутамола до 5-10°С с последующим подщелачиванием фильтрата до pH 9-9,5 добавлением основания для получения энантиомерного чистого R-изомера 4-бензилсальбутамола; выделение R-изомера путем экстрагирования его метиленхлоридом с последующим удалением растворителя с получением остатка; обработку остатка толуолом при температуре от 80 до 85°С, охлаждение раствора до 0-5°С для осаждения оптически чистого R-изомера и фильтрацию оптически чистого R-изомера; а также дебензилирование R-изомера 4-бензилсальбутамола с получением оптически чистого R-изомера сальбутамола. В патенте RU 1697383 также рассматривается способ перекристаллизации. Изобретение касается аминоспиртов, в частности выделения сальбутамола из водных или водно-спиртовых растворов, образующихся в указанном производстве. Целью изобретения является повышение качества и выхода целевого продукта. Для этого ведут концентрирование указанных растворов [полученных восстановлением 1-(4-окси-3-оксиметилфенил)-2-(N-трет-бутилбензиламино)-этанона гидрохлорида дигидрата] до содержания воды 10-30% с последующим подщелачиванием, экстракцией сальбутамола и перекристаллизацией технического продукта из низших алифатических спиртов или их смесей с этил ацетатом. При этом для экстракции однократно используют маточные растворы от перекристаллизации технического продукта. Эти условия повышают выход целевого продукта фармакопейной чистоты с 39,5 до 77,2%.
Недостатками селективной перекристаллизации является многостадийность процесса и возможность получения чистого продукта только через несколько циклов.
Еще один из подходов получения чистого R-изомера сальбутамола - хроматографическое разделение энантиомеров. В патенте US 9809706 раскрывается изобретение, относящееся к способу разделения энантиомеров (в том числе сальбутамола) с использованием полимерных гранул с высокой площадью поверхности. Кроме того, изобретение относится к получению функционализированного полимера, содержащего сердцевину с сополимером из мономеров, выбранных из неароматического акрилата, этилендиметакрилата и дивинилбензола, а также оболочку, которая включает мономеры, выбранные из глицидиловых эфиров метакрилата, и хиральный селектор, выбранный из производных винной кислоты и аминокислот.
Метод жидкостной хроматографии является достаточно эффективным, но также и затратным по времени, поэтому в настоящее время используют модифицированный способ жидкостного хроматографического разделения - сверхкритическую флюидную хроматографию. Наиболее близкое техническое решение, выбранное авторами в качестве прототипа, изложено в статье [М. Garzotti, М. Hamdan. J. Chromatogr. В. 2002. Vol. 770. P. 53]. Энантиомеры чистой формы сальбутамола в растворе этанола разделяли на колонках с полисахаридными хиральными селекторами: трис[3,5-диметилфенилкарбамат]целлюлозы, трис[4-метилбензоат]целлюлозы, трис[3,5-диметилфенилкарбамат]амилозы. В качестве подвижной фазы использовали диоксид углерода с этанолом в смеси с изопропиламином, взятым в качестве модификатора. Температура колонки составляла 35°С.
Недостатком прототипа является разделение энантиомеров чистой формы сальбутамола, а не его соли, в то время как для применения в медицине нужны именно фармацевтически приемлемые соли R-сальбутамола.
Еще одним недостатком прототипа является использование температуры 35°С для разделения энантиомеров сальбутамола, хотя при повышенной температуре селективность снижается.
Изобретение направлено на изыскание одностадийного и простого в реализации способа разделения рацемической смеси соли сальбутамола для получения соли R-сальбутамола, востребованного в фармакологии в качестве основного компонента ряда препаратов, направленных на лечение заболеваний дыхательных путей.
Технический результат достигается тем, что предложен способ селективного разделения рацемической смеси сальбутамола методом сверхкритической флюидной хроматографии, заключающийся в том, что проводят разделение элюированием с помощью подвижной фазы из сверхкритического CO2, спирта и динамического модификатора из раствора рацемической смеси сальбутамола в спирте с применением колонки, состоящей из силикагеля с привитым к нему хиральным селектором, отличающийся тем, что в качестве рацемической смеси сальбутамола используют соль сальбутамола, в качестве хирального селектора применяют макроциклический гликопептид эремомицин, а также тем, что в составе подвижной фазы используют динамический модификатор в концентрации 10÷200 мМ по отношению к спирту, состоящий либо из смеси изопропиламина с трифторуксусной кислотой в мольном соотношении 1:1÷3:1, либо из смеси изопропиламина с ацетатом аммония в мольном соотношении 1:1÷5:1, при этом в качестве спирта используют метанол, разделение проводят при температуре 18÷25°С.
Целесообразно, что в качестве соли сальбутамола используют сульфат, тартрат.
Под рацемической смесью сальбутамола понимают смесь энантиомеров сальбутамола в равных концентрациях.
Диапазон концентраций динамический модификатор÷метанол выбран из тех соображений, что при концентрации меньше 10 мМ не реализуется селективное разделение рацемической смеси соли сальбутамола, а использование концентрации больше 200 мМ не приводит к дальнейшему увеличению селективности разделения энантиомеров сальбутамола.
Диапазон соотношений изопропиламин трифторуксусная кислота (ацетат аммония) обусловлен тем, что при соотношении меньше чем 1:1 происходит коэлюирование энантиомеров сальбутамола, а использование соотношений больших чем 3:1 (5:1), приводит к понижению коэффициента энантиоселективности.
Заявленный температурный интервал 18÷25°С определен тем, что для обеспечения температуры меньше 18°С требуется дополнительное охлаждающее оборудование, а при температуре больше 25°С наблюдается снижение селективности разделения рацемической смеси соли сальбутамола.
Экспериментально установлено, что использование гликопептида эремомицина в качестве хирального селектора обеспечивает максимальную селективность разделения рацемической смеси соли сальбутамола по сравнению с другими гликопептидами, использующимися в жидкостной хроматографии.
Использование метанола обусловлено наилучшей растворимостью солей сальбутамола по сравнению с другими алифатическими спиртами.
Сущность изобретения заключается в том, что использование в качестве динамического модификатора смеси изопропиламина с трифторуксусной кислотой или изопропиламина с ацетатом аммония с мольной концентрацией кислоты, не превышающей мольной концентрации изопропиламина, позволяет реализовать механизм энантиораспознавания с участием ионных взаимодействий сорбент-сорбат на гликопептидном хиральном селекторе эремомицине.
Изобретение проиллюстрировано следующими фигурами.
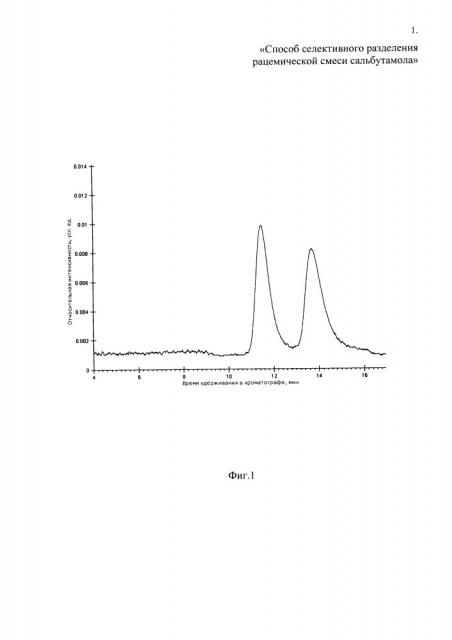
Фиг. 1. Участок хроматограммы, иллюстрирующий разделение энантиомеров сальбутамола по Примеру 1.
Фиг. 2. Участок хроматограммы, иллюстрирующий разделение энантиомеров сальбутамола по Примеру 2.
Фиг. 3. Участок хроматограммы, иллюстрирующий разделение энантиомеров сальбутамола по Примеру 3
Иллюстрации получены на хроматографе Investigator SFC System производства компании Waters Corp.
Ниже приведены примеры, иллюстрирующие, но не ограничивающие предложенный способ.
Пример. 1.
Рацемическую смесь сульфата сальбутамола разделяли при температуре 25°С с помощью подвижной фазы из сверхкритического СO2, спирта и динамического модификатора из метанольного раствора смеси сальбутамола с применением колонки, состоящей из силикагеля с привитым к нему макроциклическим гликопептидом эремомицином, в составе подвижной фазы использовали динамический модификатор с концентрацией 10 мМ по отношению к спирту, модификатор состоял из смеси изопропиламина с трифторуксусной кислотой в мольном соотношении 1:1.
Получили разделение энантиомеров сальбутамола (Фиг. 1) с коэффициентом селективности, равным 1.17.
Пример. 2.
Рацемическую смесь сульфата сальбутамола разделяли при температуре 20°С с помощью подвижной фазы из сверхкритического СО2, спирта и динамического модификатора из метанольного раствора смеси сальбутамола с применением колонки, состоящей из силикагеля с привитым к нему макроциклическим гликопептидом эремомицином, в составе подвижной фазы использовали динамический модификатор с концентрацией 100 мМ по отношению к спирту, модификатор состоял из смеси изопропиламина с трифторуксусной кислотой в мольном соотношении 2:1.
Получили разделение энантиомеров сальбутамола (Фиг. 2) с коэффициентом селективности, равным 1.20.
Пример. 3.
Рацемическую смесь тартрата сальбутамола разделяли при температуре 18°С с помощью подвижной фазы из сверхкритического СО2, спирта и динамического модификатора из метанольного раствора смеси сальбутамола с применением колонки, состоящей из силикагеля с привитым к нему макроциклическим гликопептидом эремомицином, в составе подвижной фазы использовали динамический модификатор с концентрацией 200 мМ по отношению к спирту, модификатор состоял из смеси изопропиламина с ацетатом аммония в мольном соотношении 5:1.
Получили разделение энантиомеров сальбутамола (Фиг. 3) с коэффициентом селективности, равным 1.14.
Предложенный способ позволяет проводить селективное разделение рацемической смеси соли сальбутамола, что позволяет выделить соль R-сальбутамола для дальнейшего применения в составе фармацевтических препаратов, и отделить небезопасную для здоровья пациентов соль S-сальбутамола.
1. Способ селективного разделения рацемической смеси сальбутамола методом сверхкритической флюидной хроматографии, заключающийся в том, что проводят разделение рацемической смеси сальбутамола элюированием с помощью подвижной фазы из сверхкритического CO2, спирта и динамического модификатора из раствора рацемической смеси сальбутамола в спирте с применением колонки, состоящей из силикагеля с привитым к нему хиральным селектором, отличающийся тем, что в качестве рацемической смеси сальбутамола используют соль сальбутамола, в качестве хирального селектора применяют макроциклический гликопептид эремомицин, а также тем, что в составе подвижной фазы используют динамический модификатор в концентрации 10÷200 мМ по отношению к спирту, состоящий либо из смеси изопропиламина с трифторуксусной кислотой в мольном соотношении 1:1÷3:1, либо из смеси изопропиламина с ацетатом аммония в мольном соотношении 1:1÷5:1, при этом в качестве спирта используют метанол, разделение проводят при температуре 18÷25°C.
2. Способ по п. 1, отличающийся тем, что в качестве соли сальбутамола используют сульфат, тартрат.