Ингибиторы фермента фосфодиэстеразы 10
Иллюстрации
Показать всеИзобретение относится к новым производным формулы (I), также к фармацевтическим композициям, содержащим такие соединения, к способам получения таких соединений и композиций, к применению таких соединений или фармацевтических композиций для предупреждения или лечения неврологических, психических и метаболических расстройств и заболеваний. Технический результат: получены новые соединения, которые являются ингибиторами фермента фосфодиэстеразы 10 (PDE10) и которые могут быть применимы для лечения или предупреждения неврологических, психических и метаболических расстройств, в которые вовлечен фермент PDE10. 5 н. и 8 з.п. ф-лы, 8 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым производным имидазо[1,2-b]пиридазина и имидазо[1,2-a]-пиразина, которые являются ингибиторами фермента фосфодиэстеразы 10 (PDE10) и которые могут быть применимы для лечения или предупреждения неврологических, психических и метаболических расстройств, в которые вовлечен фермент PDE10. Настоящее изобретение также направлено на фармацевтические композиции, содержащие такие соединения, на способы получения таких соединений и композиций, на применение таких соединений или фармацевтических композиций для предупреждения или лечения неврологических, психических и метаболических расстройств и заболеваний.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
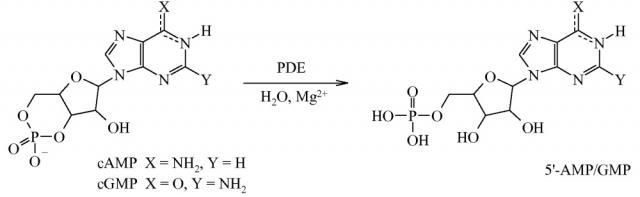
Фосфодиэстеразы (PDE) представляют собой семейство ферментов, кодируемых 21 геном и подразделенных на 11 отдельных семейств согласно структурным и функциональным свойствам. Эти ферменты осуществляют метаболическую инактивацию широко распространенных внутриклеточных вторичных мессенджеров, циклического 3′,5′-аденозинмонофосфата (cAMP) и циклического 3′,5′-гуанозинмонофосфата (cGMP). Эти два мессенджера регулируют большое разнообразие биологических процессов, в том числе выработку и действие провоспалительных медиаторов, функционирование ионных каналов, сокращение мышц, коммитирование, дифференцировку, апоптоз, липогенез, гликогенолиз и глюконеогенез. Они осуществляют это посредством активации протеинкиназы A (PKA) и протеинкиназы G (PKG), которые, в свою очередь, фосфорилируют большое разнообразие субстратов, в том числе факторы транскрипции и ионные каналы, которые регулируют многочисленные физиологические реакции. В случае нейронов предусматриваются активация cAMP- и cGMP-зависимых киназ и последующее фосфорилирование белков, вовлеченных в быструю регуляцию синаптической передачи, а также в дифференцировку и выживаемость нейронов. Внутриклеточные концентрации cAMP и cGMP точно регулируются скоростью биосинтеза с помощью циклаз и скоростью расщепления с помощью PDE. PDE представляют собой гидролазы, которые инактивируют cAMP и cGMP посредством каталитического гидролиза 3′-сложноэфирной связи с образованием неактивного 5′-монофосфата (схема A).
Схема A
На основании субстратной специфичности семейства PDE можно разделить на три группы: i) cAMP-специфические PDE, которые включают PDE4, 7 и 8; ii) cGMP-селективные ферменты PDE5, 6 и 9 и iii) PDE, действующие на два субстрата, PDE1, 2 и 3, а также PDE10 и 11.
Кроме того, для PDE характерна дифференциальная экспрессия во всем организме, в том числе в центральной нервной системе. Вследствие этого разные изоферменты PDE могут иметь разные физиологические функции. Соединения, которые селективно ингибируют семейства или изоферменты PDE, могут проявлять особую терапевтическую активность, меньшее количество побочных эффектов или и то, и другое.
Об обнаружении фосфодиэстеразы 10A (PDE10A) сообщалось в 1999 г. Из всех 11 известных семейств PDE PDE10 характеризуется наиболее ограниченным распределением с высоким уровнем экспрессии только в головном мозге и яичках.
В головном мозге мРНК и белок PDE10A экспрессируются на высоком уровне в большинстве стриарных средних шипиковых нейронов (MSN). Такое своеобразное распределение PDE10A в головном мозге вместе с увеличением числа ее фармакологических исследований указывает на потенциальное применение ингибиторов PDE10A в лечении неврологических и психических расстройств, таких как шизофрения.
В базальных ганглиях MSN представляют собой основное место получения и интеграции глутаматергического входа от коры больших полушарий и дофаминергического входа от среднего мозга и формируют ключевые исходящие пути, которые способствуют проведению различий между уместными и неуместными когнитивными и двигательными паттернами и воздействию на них.
MSN представляют собой GABA-ергические проекционные нейроны, равномерно распределенные между двумя различными путями. Стрионигральные MSN (в прямом пути) экспрессируют дофаминовый рецептор D1 и нейропептиды динорфин и вещество P; стриопаллидарные MSN (в непрямом пути) экспрессируют дофаминовые рецепторы D2 и нейропептид энкефалин. Дофаминовые рецепторы D1 положительно связаны с выработкой cAMP, тогда как дофаминовые рецепторы D2 отрицательно связаны с выработкой cAMP. Эти пути воздействуют на концентрацию внеклеточного дофамина и модулируют двигательные и поведенческие реакции.
Ингибиторы PDE10 и шизофрения
В связи с преимущественной локализацией PDE10 в MSN в большинстве исследований ингибиторов PDE10 внимание было сосредоточено на моделях для доклинического исследования психоза.
На основании исследований, проводимых на мышах с нокаутом, эффекты ингибирования PDE10 в отношении экспрессии генов в стриарных нейронах сравнивали с эффектами, индуцированными агонистом D1 и антагонистом D2.
Шизофрения является тяжелой и хронической психической болезнью, которая поражает приблизительно 1% населения. Клинические симптомы становятся очевидными в относительно раннем возрасте, обычно появляясь в юности или в раннем взрослом возрасте. Симптомы шизофрении обычно подразделяются на описываемые как позитивные, в том числе галлюцинации, эпизоды бреда и нарушения мышления, и называемые негативными, включающие социальное отчуждение, ослабление эмоциональных реакций, бедность речи и неспособность испытывать удовольствие. Кроме того, пациенты с шизофренией страдают от когнитивных расстройств, таких как ухудшение внимания и памяти. Этиология заболевания все еще является неизвестной, однако была выдвинута гипотеза, что в основе симптомов шизофрении лежат нарушения действия нейромедиаторов. Одной из наиболее часто обсуждаемых является дофаминергическая гипотеза, которая предполагает, что гиперактивность дофаминовой передачи обуславливает позитивные симптомы, наблюдаемые у пациентов с шизофренией.
Эффективность антипсихотических средств, реализуемых в настоящее время на рынке, коррелирует с их способностью к блокированию дофаминовых рецепторов D2. Однократное и постоянное введение антипсихотических средств, таких как галоперидол, имеет характерные эффекты в отношении экспрессии генов в стриарных нейронах. Также наблюдали, что ингибирование PDE10A вызывало изменения экспрессии генов в стриарных нейронах, подобные таковым, вызываемым галоперидолом.
Атипичные антипсихотические средства, такие как клозапин, оланзапин, рисперидон и палиперидон, проявляют более благоприятный профиль экстрапирамидных побочных эффектов (EPS) и поздней дискинезии, ассоциированных с кратковременной и долговременной блокадой рецепторов D2. Однако все еще существует необходимость в разработке новых антипсихотических средств с профилем пролонгированного терапевтического действия и меньшим количеством побочных эффектов, например, путем применения подходов за рамками блокады дофаминового рецептора D2.
Таким образом, ингибиторы PDE10 могут обладать фармакологическим профилем, аналогичным таковому современных антипсихотических средств, которые в основном лечат позитивные симптомы шизофрении, но также обладают потенциалом для устранения негативных и когнитивных симптомов шизофрении, при этом не имеют нецелевых связанных побочных эффектов, таких как EPS или высвобождение пролактина, которые часто наблюдаются при применении существующих антипсихотических средств.
Поскольку ингибиторы PDE10 можно применять для повышения уровней cAMP и/или cGMP в клетках, которые экспрессируют фермент PDE10, например, в нейронах, которые входят в состав базальных ганглиев, ингибиторы PDE10 могут быть применимыми в лечении шизофрении и, кроме того, ряда состояний, описываемых в данном документе, таких как болезнь Паркинсона, болезнь Хантингтона, аддикция и депрессия. Ингибиторы PDE10 также могут быть применимыми при других состояниях, таких как ожирение, инсулинонезависимый сахарный диабет, биполярное расстройство, обсессивно-компульсивное расстройство и боль.
Эффективность ингибирования PDE10A в моделях когнитивной деятельности и в отношении негативных симптомов шизофрении также предполагалась в недавно опубликованных in vivo исследованиях, в которых этот механизм связывали с повышением общительности в анализе социального приближения/социального избегания, обратным эффектом длительного лечения с помощью MK-801 в тесте принудительного плавания, улучшением распознавания социально значимых запахов у мышей и улучшением распознавания новых объектов у крыс.
Документы из уровня техники
В WO 2011/051342, опубликованной 5 мая 2011 г., раскрываются соединения имидазо[1,2-b]пиридазина и их активность в качестве ингибиторов фермента фосфодиэстеразы 10.
В WO 2011/110545, опубликованной 15 сентября 2011 г., раскрываются производные имидазо[1,2-a]пиразина и их активность в качестве ингибиторов фермента фосфодиэстеразы 10.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является обеспечение новых гидроксилзамещенных соединений, которые являются ингибиторами PDE10.
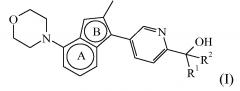
Таким образом, в одном аспекте настоящее изобретение относится к соединению формулы (I):
или к его стереоизомерной форме, где
R1 представляет собой H, а R2 представляет собой ;
или где R1 и R2, взятые вместе с атомом углерода, к которому они присоединены, образуют радикал формулы
; и
бицикл
представляет собой бицикл формулы a) или формулы b) ;
или к его фармацевтически приемлемой соли или сольвату.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата и фармацевтически приемлемый носитель или наполнитель.
Дополнительно, настоящее изобретение относится к соединению формулы (I), или к его стереоизомерной форме, или к его фармацевтически приемлемой соли или сольвату для применения в качестве лекарственного препарата и к соединению формулы (I), или его стереоизомерной форме, или его фармацевтически приемлемой соли или сольвату для применения в лечении или в предупреждении неврологических, психических или метаболических расстройств и заболеваний.
Дополнительно, настоящее изобретение относится к применению соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата в комбинации с дополнительным фармацевтическим средством для применения в лечении или предупреждении неврологических, психических или метаболических расстройств и заболеваний.
Дополнительно, настоящее изобретение относится к способу получения фармацевтической композиции согласно настоящему изобретению, предусматривающему, что фармацевтически приемлемый носитель тщательно перемешивают с терапевтически эффективным количеством соединения формулы (I), или его стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата.
Настоящее изобретение также относится к продукту, содержащему соединение формулы (I), или его стереоизомерную форму, или его фармацевтически приемлемую соль или сольват, и дополнительное фармацевтическое средство, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении неврологических, психических или метаболических расстройств и заболеваний.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Химические названия соединений согласно настоящему изобретению были образованы согласно правилам номенклатуры, принятым Химической реферативной службой (CAS), с использованием программного обеспечения Advanced Chemical Development, Inc. (продукт ACD/Name, версия 10.01; текущая сборка 15494, 1 декабря 2006 г.).
Определения
Выражение “C1-4алкил”, применяемое в данном документе отдельно или в качестве части другой группы, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, имеющий, если не указано иное, от 1 до 4 атомов углерода, такой как метил, этил, 1-пропил, 1-метилэтил, бутил, 1-метилпропил, 2-метил-1-пропил, 1,1-диметилэтил и т.п.
Выражение “галоген” или “галогенид”, применяемое в данном документе отдельно или в качестве части другой группы, относится к фтору, хлору, брому или йоду, при этом фтор или хлор являются предпочтительными.
Выражение “субъект”, применяемое в данном документе, относится к животному, предпочтительно млекопитающему (например, кошке, собаке, примату или человеку), более предпочтительно человеку, которое является или являлось объектом лечения, наблюдения или эксперимента.
Выражение “терапевтически эффективное количество”, применяемое в данном документе, означает такое количество активного соединения или фармацевтического средства, которое вызывает биологический или медицинский эффект в системе тканей у животного или человека, желаемый исследователем, ветеринаром, врачом или другим клиницистом, что включает облегчение или нивелирование симптомов заболевания или расстройства, лечение которого осуществляют.
Подразумевается, что выражение “композиция”, применяемое в данном документе, охватывает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который получают прямо или непрямо в результате комбинаций определенных ингредиентов в определенных количествах.
Подразумевается, что выражение “лечение”, применяемое в данном документе, обозначает все способы, которые могут предусматривать замедление, нарушение, подавление или прекращение прогрессирования заболевания, но необязательно означает полное устранение всех симптомов.
Выражение “соединения по настоящему изобретению” обозначает соединения формулы (I), их стереоизомерные формы, а также соли и сольваты.
Что касается применения в медицине, соли соединений по настоящему изобретению относятся к нетоксичным "фармацевтически приемлемым солям". Однако при получении соединений согласно настоящему изобретению или их фармацевтически приемлемых солей могут быть применимыми другие соли. Подходящие фармацевтически приемлемые соли соединений включают соли присоединения кислоты, которые можно образовывать, например, путем смешивания раствора соединения с раствором фармацевтически приемлемой кислоты, такой как хлористоводородная кислота, серная кислота, фумаровая кислота, малеиновая кислота, янтарная кислота, уксусная кислота, бензойная кислота, лимонная кислота, винная кислота, угольная кислота или фосфорная кислота.
И наоборот, упомянутые формы солей можно превратить в форму свободного основания путем обработки соответствующим основанием.
Кроме того, если соединения по настоящему изобретению имеют кислотный фрагмент, их подходящие фармацевтически приемлемые соли могут включать соли щелочных металлов, например, соли натрия или калия; соли щелочноземельных металлов, например, соли кальция или магния; и соли, образованные с подходящими органическими лигандами, например, соли четвертичного аммония.
Иллюстративные кислоты, которые можно применять при получении фармацевтически приемлемых солей, включают без ограничения следующие: уксусную кислоту, 2,2-дихлоруксусную кислоту, ацилированные аминокислоты, адипиновую кислоту, альгиновую кислоту, аскорбиновую кислоту, L-аспарагиновую кислоту, бензолсульфоновую кислоту, бензойную кислоту, 4-ацетамидобензойную кислоту, (+)-камфорную кислоту, камфорсульфоновую кислоту, каприновую кислоту, капроновую кислоту, каприловую кислоту, коричную кислоту, лимонную кислоту, цикламовую кислоту, этан-1,2-дисульфоновую кислоту, этансульфоновую кислоту, 2-гидроксиэтансульфоновую кислоту, муравьиную кислоту, фумаровую кислоту, галактаровую кислоту, гентизиновую кислоту, глюкогептоновую кислоту, D-глюконовую кислоту, D-глюкуроновую кислоту, L-глутаминовую кислоту, бета-оксоглутаровую кислоту, гликолевую кислоту, гиппуровую кислоту, бромистоводородную кислоту, хлористоводородную кислоту, (+)-L-молочную кислоту, (±)-DL-молочную кислоту, лактобионовую кислоту, малеиновую кислоту, (-)-L-яблочную кислоту, малоновую кислоту, (±)-DL-миндальную кислоту, метансульфоновую кислоту, нафталин-2-сульфоновую кислоту, нафталин-1,5-дисульфоновую кислоту, 1-гидрокси-2-нафтойную кислоту, никотиновую кислоту, азотную кислоту, олеиновую кислоту, оротовую кислоту, щавелевую кислоту, пальмитиновую кислоту, памовую кислоту, фосфорную кислоту, L-пироглутаминовую кислоту, салициловую кислоту, 4-аминосалициловую кислоту, себациновую кислоту, стеариновую кислоту, янтарную кислоту, серную кислоту, дубильную кислоту, (+)-L-винную кислоту, тиоциановую кислоту, п-толуолсульфоновую кислоту, трифторметилсульфоновую кислоту и ундециленовую кислоту.
Иллюстративные основания, которые можно применять в получении фармацевтически приемлемых солей, включают без ограничения следующие: аммиак, L-аргинин, бенетамин, бензатин, гидроксид кальция, холин, диметилэтаноламин, диэтаноламин, диэтиламин, 2-(диэтиламино)этанол, этаноламин, этилендиамин, N-метилглюкамин, гидрабамин,
1H-имидазол, L-лизин, гидроксид магния, 4-(2-гидроксиэтил)морфолин, пиперазин, гидроксид калия, 1-(2-гидроксиэтил)пирролидин, вторичный амин, гидроксид натрия, триэтаноламин, трометамин и гидроксид цинка.
И наоборот, упомянутые формы солей можно превратить в формы свободных кислот путем обработки соответствующей кислотой.
Выражение “сольват” включает формы присоединения растворителя, а также их соли, которые могут образовывать соединения формулы (I). Примерами таких форм присоединения растворителя являются, например, гидраты, алкоголяты и т.п.
В рамках данной заявки элемент, в частности, при упоминании в отношении соединения формулы (I), включает все изотопы и смеси изотопов этого элемента, либо встречающиеся в природе, либо полученные синтетическим путем, либо с природным изотопным составом, либо в изотопно-обогащенной форме. Меченные радиоактивным изотопом соединения формулы (I) могут содержать радиоактивный изотоп, выбранный из группы 3H, 11C, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно, радиоактивный изотоп выбран из группы 3H, 11C и 18F.
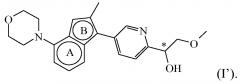
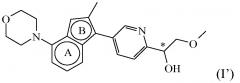
Соединение формулы (I), определенное в данном документе, где R1 представляет собой H, а R2 представляет собой , называемое в данном документе соединением формулы (I’), имеет один асимметрический атом углерода, как проиллюстрировано ниже, где асимметрический атом углерода обозначен *:
Таким образом, соединение формулы (I), определенное в данном документе, где R1 представляет собой H, а R2 представляет собой , называемое в данном документе соединением формулы (I’), может образовывать два различных энантиомера, т.е. стереоизомеры, которые представляют собой несовпадающие при наложении зеркальные отображения друг друга, и может существовать либо в качестве чистого энантиомера, либо в качестве его смесей.
Соответственно, определение “соединение формулы (I)” включает энантиомеры соединения формулы (I) либо в качестве чистого энантиомера, либо в качестве смеси двух энантиомеров. Конкретная смесь согласно настоящему изобретению представляет собой смесь 1:1 пары энантиомеров, также называемая рацематом или рацемической смесью.
Абсолютная конфигурация определяется согласно системе Кана-Ингольда-Прелога. Конфигурация при асимметрическом атоме определяется или как R, или как S. Выделенные соединения, абсолютная конфигурация которых неизвестна, могут быть обозначены как (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света. Если указан конкретный энантиомер, это означает, что указанный энантиомер практически свободен от другого энантиомера, т.е. связан с менее 50%, предпочтительно менее 20%, более предпочтительно менее 10%, еще более предпочтительно менее 5%, в частности, менее 2% и наиболее предпочтительно менее 1% этого энантиомера.
Таким образом, если соединение формулы (I) указано, например, как (R), это означает, что соединение практически не содержит энантиомер (S); если соединение формулы (I) указано, например, как (+), это означает, что соединение практически не содержит энантиомер (-).
Специалисты в данной области могут определить абсолютную стереохимическую конфигурацию соединений формулы (I) и промежуточных соединений, применяемых в их получении, при использовании хорошо известных способов, таких как, например, рентгеновская дифракция.
Применяемое в данном документе обозначение “RS” означает рацемическую смесь, если не указано иное; обозначения “*R” или “*S” применяют, если абсолютная стереохимическая конфигурация не определена, хотя само соединение было выделено в качестве отдельного стереоизомера и является энантиомерно чистым.
Таким образом, в конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I’):
,
или к его стереоизомерной форме, где
бицикл
представляет собой бицикл формулы a) или формулы b) ; или к его фармацевтически приемлемой соли или сольвату.
Таким образом, в дополнительном конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I’), выбранному из соединений формул (I’-a) и (I’-b), определенных ниже:
,
или к его стереоизомерной форме, или к его фармацевтически приемлемой соли или сольвату.
В дополнительном варианте осуществления настоящее изобретение относится к соединению формулы (I’-a) в виде практически чистого энантиомера (+)-(I’-a) ([α]20D=+40,8° (c=0,5, DMF)) или в виде практически чистого энантиомера (-)-(I’-a) ([α]20D=-44,7° (c=0,5, DMF)) или к его фармацевтически приемлемой соли или сольвату. Альтернативным обозначением каждого из энантиомеров является
*R-(I’-a) или *S-(I’-a):
,
имеющий угол оптического вращения [α]=-44,7° (589 нм, c=0,5 г/100 мл, DMF, 20°C); или
,
имеющий угол оптического вращения [α]=+40,8° (589 нм, c=0,5 г/100 мл, DMF, 20°C).
Согласно дополнительному варианту осуществления настоящее изобретение относится к соединению формулы (I), определенному в данном документе, где R1 и R2 взяты вместе с атомом углерода, к которому они присоединены, с образованием радикала формулы , называемому в данном документе соединением формулы (I”), представленному ниже:
,
где бицикл
представляет собой бицикл формулы a) или формулы b) , или к его фармацевтически приемлемой соли или сольвату.
Таким образом, в дополнительном конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I”), выбранному из соединений формул (I”-a) и (I”-b), определенных ниже:
| (I”-a) | (I”-b), |
или к его фармацевтически приемлемой соли или сольвату.
Получение
Соединения по настоящему изобретению в большинстве случаев можно получать при помощи последовательности стадий, каждая из которых известна специалисту в данной области. В частности, соединения можно получать согласно следующим способам синтеза.
Соединение формулы (I) во всех соответствующих случаях можно синтезировать в виде рацемической смеси энантиомеров, которые можно отделить друг от друга согласно известным из уровня техники процедурам разделения. Рацемические соединения формулы (I) можно превращать в соответствующие формы диастереомерных солей посредством реакции с подходящей хиральной кислотой. Указанные формы диастереомерных солей можно затем разделять, например, с помощью селективной или фракционной кристаллизации, а энантиомеры выделяют оттуда с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы также можно получить из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов при условии, что реакция протекает стереоспецифично.
Экспериментальная процедура 1
Конечное соединение формулы (I) можно получить посредством сочетания Сузуки путем введения промежуточного соединения формулы (II), где галоген представляет бром или йод, в реакцию с бороновой кислотой или сложным эфиром бороновой кислоты формулы (III), где каждый из R3 и R4 можно независимо выбрать из водорода или C1-4алкила или можно взять вместе с образованием, например, двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2-, в присутствии подходящего катализатора, такого как тетракис(трифенилфосфин)палладий(0), в присутствии подходящего основания, такого как карбонат натрия, в подходящем инертном растворителе, таком как смесь 1,4-диоксана и воды, в подходящих условиях реакции, таких как нагревание при приемлемой температуре, путем традиционного нагревания или под действием микроволнового излучения в течение периода времени, обеспечивающего завершение реакции.
Схема реакций 1
Экспериментальная процедура 1a
Конечное соединение формулы (I), где заместитель -CR1R2(OH) представляет собой
, настоящим называемое соединением формулы (I’), можно получить согласно общей процедуре, описанной в разделе Экспериментальная процедура 1, где соединение формулы (III) имеет формулу (IIIa), где R3 и R4 определены для соединения формулы (III) выше.
Схема реакций 1a
Экспериментальная процедура 1b
Конечное соединение формулы (I), где заместитель -CR1R2(OH) представляет собой
, настоящим называемое соединением формулы (I”), можно получить согласно общей процедуре, описанной в разделе Экспериментальная процедура 1, где соединение формулы (III) имеет формулу (IIIb), где R3 и R4 определены для соединения формулы (III) выше.
Схема реакций 1b
Экспериментальная процедура 2a
Промежуточное соединение формулы (II), где
представляет собой бицикл формулы a) , называемое в данном документе (IIa), можно получить согласно стадиям реакции, описанным в WO 2011/051342, показанным на схеме реакций (2a) ниже.
Схема реакций 2a
A: бромирование
B: реакция с 2-хлорпропаноном
C: реакция с морфолином
D: дегалогенирование
E: галогенирование
Соединения формулы (II) можно получить согласно вышеописанной схеме реакций (2a) из коммерчески доступных материалов посредством процедуры из пяти стадий (стадии A-E).
На стадии E соединение формулы (IIa) можно получить путем введения промежуточного соединения формулы A4 в реакцию с N-бром- или N-йодсукцинимидом в подходящем инертном растворителе, таком как дихлорметан, в присутствии подходящего кислотного катализатора, такого как уксусная кислота, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -10°C до 40°C. Конкретный пример стадии E описан в данном документе ниже в отношении синтеза промежуточного соединения A5.
Экспериментальная процедура 2b
Промежуточное соединение формулы (II), где
представляет собой бицикл формулы b) , называемое в данном документе (IIb), можно получить согласно стадиям реакции, описанным в WO 2011/110545, показанным на схеме реакций (2b) ниже.
Схема реакций 2b
F: реакция с 2-хлорпропаноном
G: галогенирование
H: реакция с морфолином
Соединения формулы (IIb) можно получить согласно вышеописанной схеме реакций (2b) из коммерчески доступных материалов посредством процедуры из трех стадий (стадии F-H).
Стадии F-H можно осуществлять в условиях реакции, подробно описываемых в WO 2011/051342. На стадии G 8-хлор-2-метилимидазо[1,2-a]пиразин вводят в реакцию с N-бром- или N-йодсукцинимидом в подходящем инертном растворителе, таком как DCM, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -10°C до 60°C, в течение периода времени, обеспечивающего завершение реакции. Стадию H можно осуществлять путем введения соединения формулы (IV) в реакцию с морфолином в подходящем инертном растворителе, таком как CH3CN, в подходящих условиях реакции, таких как нагревание при приемлемой температуре, путем традиционного нагревания или под действием микроволнового излучения в течение периода времени, обеспечивающего завершение реакции. Конкретный пример стадии H описан в данном документе ниже в отношении синтеза промежуточного соединения A8.
Экспериментальная процедура 3
Промежуточное соединение формулы (IIIa) можно получить согласно стадиям реакции, показанным на схеме реакций (3) ниже.
Схема реакций 3
J: образование кетона
K: восстановление кетона
L: образование бороновой кислоты или сложного эфира бороновой кислоты
Соединения формулы (IIIa) можно получить согласно вышеописанной схеме реакций (3), где R3 и R4 могут представлять собой водород или C1-4алкил или могут быть взяты вместе с образованием, например, двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2-, из коммерчески доступных материалов посредством процедуры из трех стадий (стадии J, K, L), описанной в данном документе ниже.
На стадии J соединение формулы A10 можно получить путем введения соединения формулы (V) в реакцию с подходящим реагентом, таким как реактив Гриньяра, полученный из 5-бром-2-йодпиридина, и, например, реагент C1-4алкилмагнийгалогенид, такой как, например, изопропилмагнийхлорид, в условиях реакции, известных специалисту в данной области, как, например, в THF при 0°C в инертной атмосфере. Соединения формулы (V), где R5 может быть выбран, например, из необязательно замещенных -O-C1-4алкила, -N(C1-4алкил)(O-C1-4алкила), -O-арила и образует вместе с группой (C=O) активированное карбонильное соединение, такое как, например, сложный эфир или амид, такой как, например, амид Вайнреба, можно получить коммерчески или получить в соответствии с условиями реакции, известными специалисту в данной области, такими как описанные ниже в отношении синтеза промежуточного соединения A9.
На стадии K соединение формулы A11 можно получить путем введения промежуточного соединения формулы A10 в реакцию с восстановителем, таким как борогидрид натрия, в подходящем инертном растворителе, таком как метанол, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -10°C до 25°C. Конкретный пример стадии K описан в данном документе ниже в отношении синтеза промежуточного соединения A11.
На стадии L соединение формулы (IIIa) можно получить путем введения промежуточного соединения формулы A11 в реакцию с подходящим три-C1-4алкилборатом, таким как триизопропилборат, в присутствии подходящего основания, такого как н-бутиллитий, в подходящем инертном растворителе, таком как Et2O, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -78°C до 25°C, альтернативно, соединение формулы (IIIa) можно получить путем введения промежуточного соединения формулы A8 в реакцию с подходящим производным диоксаборолана, таким как, например, 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-бис-1,3,2-диоксаборолан, в присутствии подходящего основания, такого как ацетат калия, в подходящем растворителе, таком как 1,4-диоксан, в присутствии палладиевого катализатора, такого как [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), в подходящих условиях реакции, таких как приемлемая температура, варьирующая от 60 до 100°C. Конкретный пример стадии L описан в данном документе ниже в отношении синтеза промежуточного соединения A12.
Экспериментальная процедура 4
Промежуточное соединение формулы (IIIb) можно получить согласно стадиям реакции, показанным на схеме реакций (4) ниже.
Схема реакций 4
M: образование бороновой кислоты или сложного эфира бороновой кислоты
Соединения формулы (IIIb) можно получить согласно вышеописанной схеме реакций (4), где R3 и R4 могут представлять собой водород или C1-4алкил или могут быть взяты вместе с образованием, например, двухвалентного радикала формулы -CH2-CH2-, -CH2-CH2-CH2- или -C(CH3)2C(CH3)2-, из коммерчески доступных материалов посредством процедуры из одной стадии, описанной в данном документе ниже.
На стадии M соединение формулы (IIIb) можно получить путем введения промежуточного соединения формулы A13 в реакцию с подходящим три-C1-4алкилборатом, таким как триизопропилборат, в присутствии подходящего основания, такого как н-бутиллитий, в подходящем инертном растворителе, таком как Et2O, в подходящих условиях реакции, таких как приемлемая температура, обычно варьирующая в диапазоне от -78°C до 25°C, альтернативно, соединение формулы (IIIb) можно получить путем введения промежуточного соединения формулы A13 в реакцию с подходящим производным диоксаборолана, таким как, например, 4,4,4′,4′,5,5,5′,5′-октаметил-2,2′-бис-1,3,2-диоксаборолан, в присутствии подходящего основания, такого как ацетат калия, в подходящем растворителе, таком как 1,4-диоксан, в присутствии палладиевого катализатора, такого как [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), в подходящих условиях реакции, таких как приемлемая температура, варьирующая от 60 до 100°C. Конкретный пример стадии L описан в данном документе ниже в отношении синтеза промежуточного соединения A14.
Соединение формулы A13 [CAS 1206912-74-4] и бороновая кислота на его основе [CAS 1207759-01-0] известны из уровня техники. Типичная процедура синтеза A13 посредством реакции 2,5-дибромпиридина с тетрагидро-4H-пиран-4-оном описана в данном документе ниже.
Экспериментальная процедура 5a
Из вышеописанного следует, что конкретные соединения формулы (I), где
заместитель -CR1R2(OH) представляет собой
, и является бициклом формулы a) , называемые в данном документе (I’-a), можно получить посредством реакции соединения формул