Онколитические штаммы clostridium ghonii, способы получения и применения
Иллюстрации
Показать всеГруппа изобретений относится к бактериальным штаммам Clostridium ghonii, способным подавлять рост солидной злокачественной опухоли, вызывать регрессию и разрушение солидной злокачественной опухоли, а также их применению. Предложены штаммы Clostridium ghonii MW-DCG_HNCv18, Clostridium ghonii MW-DCG_CCv17 и Clostridium ghonii MW-DCG_LCv26, депонированные в Национальном Институте Измерений (National Measurement Institute, 1/153 Bertie Street, Port Melbourne, Victoria, Australia 3207) под соответствующими регистрационными номерами V12/001485, V12/001487 и V12/001486. Предложенные штаммы используют для подавления роста солидной злокачественной опухоли, ее регрессии и разрушения у субъекта, для лечения такой опухоли у субъекта, для получения лекарственного средства для лечения солидной злокачественной опухоли. Предложенные штаммы также могут быть использованы для подавления или лечения солидной злокачественной опухоли в составе фармацевтической композиции или в составе набора. 10 н. и 37 з.п. ф-лы, 11 ил., 3 табл., 3 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к созданию производного бактериального штамма авирулентной, непатогенной Clostridium ghonii, который способен подавлять рост одной или более солидных опухолей, вызывать регрессию одной или более солидных опухолей или же практически полное или полное разрушение одной или более солидных опухолей. Настоящее изобретение также относится к композиции, включающей производный бактериальный штамм для направленного лизиса солидных опухолей.
Уровень техники
Образование рака - многоступенчатый процесс, который вовлекает ряд молекулярных и структурных изменений. Солидные опухоли, такие как меланома, рак легкого, толстой кишки, головы/шеи, яичника, молочной железы, поджелудочной железы и предстательной железы, составляют 90% всех раковых опухолей. Признаками солидных опухолей последней стадии являются обширный ангиогенез, некроз и гипоксия, наряду с явным присутствием центральной (внутренней) области и периферической области. Центральная область солидной опухоли характеризуется высоким интерстициальным давлением, низким внеклеточным pH, гетерогенностью опухолевых клеток и анаэробным метаболизмом, включая гликолиз с высокой концентрацией глюкозы и уровнем лактата. Периферическая область, как правило, содержит быстро делящиеся раковые клетки, хотя эти клетки составляют лишь 25-50% от общего количества клеток, присутствующих в периферической области. Остальные клетки в периферической области обычно являются не раковыми клетками соединительной ткани.
Внутренние центральные области опухоли не поддаются современным методам химио- и лучевой терапии, поскольку недоступны для пассивно дифундирующих химиотерапевтических средств, вследствие плохой васкуляризации и высокого интерстициального давления. Кроме того, дефицит кислородных радикалов также способствует резистентности к химиотерапии и лучевой терапии, а также уменьшению повреждения ДНК в процессе лечения.
Если диагноз поставлен на ранней стадии, оперативное вмешательство является основным методом терапии для устранения рака, с последующей лучевой терапией и/или химиотерапией для предотвращения рецидива. Впрочем, из-за отсутствия определенных симптомов в клинических условиях, до 85% пациентов с солидными опухолями выявляются на поздней стадии, когда операция уже не эффективна. Химио/лучевая терапия или их комбинации часто использовались в качестве паллиативной терапии, которая не способна улучшить общий уровень выживаемости таких пациентов. Химические/лекарственные соединения в форме антител и ингибиторов передачи сигнала испытывали в доклинических исследованиях на животных с раковыми опухолями последней стадии для оценки противоопухолевой терапии, но такие соединения оказались не способны проникать в солидные опухоли, не могли накапливаться в высокой концентрации, эффективно достигать достаточного количества раковых клеток и покидать нераковые стромальные клетки, стволовые клетки, и при этом не затрагивалась структура опухолевой ткани. Кроме того, частое возникновение резистентности делает указанные методы молекулярной терапии в целом неэффективными.
Генную терапию для лечения рака считается более эффективным методом, чем указанные выше медикаментозные терапии. Виротерапия с применением живых вирусов, как предполагают, является лучшим подходом, в настоящее время уже используемым для лечения солидных опухолей поздних стадий, но имеет недостатки, такие как слабое распространение в опухоли (Shayakhmetov et al., 2002) и быстрый печеночный клиренс из кровотока после внутривенного введения. В совокупности, все доступные в настоящее время методы противоопухолевой терапии, направленные на устранение солидных опухолей, до сих пор не решили проблему эффективного лечения рака на поздних стадиях.
В случаях, когда внутреннее окружение опухоли, также известное как микроокружение, не позволяет эффективно применять химио, лучевую и виротерапию, такое окружение может обеспечивать уникальную возможность для применения терапии на основе бактерий, в которой используются анаэробные бактерии и присущие им онколитические свойства. Были изучены различные анаэробные бактерии, включая штаммы, относящиеся к роду Clostridium. В естественной среде, Clostridium имеют два состояния роста - вегетативная палочка и круглая спора. Последний тип представляет собой устойчивую защитную форму клостридий, которая помогает им выживать в сложных условиях. Спора имеет твердую оболочку, окружающую внешнюю поверхность ключевых жизненно важных частей внутри бактерий. Кроме того, на внутренней поверхности оболочек также присутствуют мембранные слои. В сочетании, твердая оболочка и мембранный слой позволяют клостридиям выживать в неблагоприятной среде, которая не подходит для вегетативной палочки. Когда становятся доступны такие условия роста, как анаэробная среда и большее количество питательных веществ, спора усиливает экспрессию генов и ускоряет рост вегетативных палочек.
Было показано, что облигатные анаэробные протеолитические спорообразующие клостридии, C. novyi (включают novyi-NT без удаленного основного токсина, но все еще несущий несколько других токсинов и токсичных факторов) и C. sordellii, обладают специфичной направленностью в уникальную гипоксическую/некротическую внутреннюю область опухоли (см. Фигуру 8), вызывая умеренный онколизис в некоторых раковых опухолях в сочетании с антиангиогенными средствами. Впрочем, указанные штаммы являются патогенными микроорганизмами и обычно вызывают различные болезни у человека, при этом основные проблемы вызывает их характерная токсичность для людей. Этими сложностями является то, что (1) уровни токсичности слишком высоки, чтобы они могли быть приемлемыми в качестве пригодных терапевтических моделей для лечения человека, и (2) условие биологической безопасности в случае применения патогенной бактерии для человека невозможно нарушить. Кроме того, штаммы дикого типа Clostridium novyi и C. sordellii показывали быстрое развитие токсических явлений, приводя к существенной гибели у экспериментальных мышей.
Настоящее изобретение основано на открытии и создании производных, облигатно анаэробных штаммов Clostridium ghonii, которые были адаптированы с целью того, чтобы вызывать более медленный, но уверенный онколизис, и, что важно и неожиданно, являются относительно не токсичными по сравнению с другими штаммами клостридий. Недавно обнаруженные штаммы являются производными авирулентного, непатогенного штамма Clostridium ghonii. Указанные производные штаммы Clostridium ghonii не только являются полезной альтернативой известным штаммам клостридий (например, C. sporogenes, C. novyi и C. sordeili), но проявляют меньше токсических побочных эффектов, нежели другие штаммы клостридий. Не будучи связанным никаким биологическим механизмом или процессом, новый способ адаптации, разработанный авторами изобретения и описанный в настоящей заявке, позволяет новым производным бактериальным штаммам приобретать дополнительную способность проникать через поврежденные сосуды в ангиогенные/гипоксические/некротические области солидной опухоли после внутривенной инъекции клостридиальных спор настоящего изобретения, чтобы прорастать в палочки, эффективно и неизбирательно лизировать/разжижать различные клетки, а также структурную основу (фибронектины и коллагены) в опухоли, вызывая, таким образом, существенное разрушение и изменение микроокружения опухоли. Такое разрушение микроокружения опухоли эффективно подавляет рост опухоли, возможно, сопровождается регрессом опухоли и, в некоторых случаях, в конечном счете, приводит к практически полному или совершенно полному разрушению всей опухоли. Настоящее изобретение дает возможность объединить подход применения инъекций спор с существующими методами, гарантируя полное устранение опухоли. В качестве неограничивающего примера, одной из таких возможностей является применение моноклонального антитела направленного действия, которое в иных случаях не будет эффективным в терапии солидной опухоли. Применение направленного моноклонального антитела в опухоли, микроокружение которой частично или полностью разрушено новыми бактериальными штаммами настоящего изобретения, становится намного более эффективным, вследствие недавнего изменения микроокружения опухоли. Применение спор настоящего изобретения, как описано и определено в настоящей заявке, несомненно, является вкладом в уровень техники как в форме противоопухолевой монотерапии, так и в комбинации с другой противоопухолевой терапией.
Сущность изобретения
Согласно первому аспекту, в настоящем изобретении предложен бактериальный штамм, который получен из авирулентного, непатогенного штамма Clostridium ghonii, где производный бактериальный штамм способен подавлять рост солидной опухоли. В настоящем изобретении также предложен бактериальный штамм, который получен из авирулентного, непатогенного штамма Clostridium ghonii, где производный бактериальный штамм способен вызывать регрессию или разрушение солидной опухоли. Штамм вызывает онколизис клеток, содержащихся в микроокружении опухоли. В настоящем изобретении также предложен онколизис тканевых структур, содержащихся в микроокружении, под действием одного или более ферментов, присутствующих в бактериальных клетках новых штаммов, таких как протеиназы, липазы и коллагеназы.
В одном варианте осуществления лизису подвергается от приблизительно 20% до приблизительно 90% или от приблизительно 20% до приблизительно 70%, или от приблизительно 20% до приблизительно 40%, или от приблизительно 20% до приблизительно 35%, или от приблизительно 25% до приблизительно 35% клеток в микроокружении опухоли. В другом варианте осуществления полученный бактериальный штамм вызывает меньшую токсичность по сравнению с референсным клостридиальным штаммом.
В другом варианте осуществления авирулентный, непатогенный штамм Clostridium ghonii может быть выбран из группы, состоящей из штаммов под регистрационными номерами ATCC 25757, BCRC 14548, CCUG 9282, DSM 15049, NCIMB 10636, PEV, Prevot PEV, VPI 4897 и VTT E-042451.
Бактериальный штамм настоящего изобретения может быть выбран из группы, состоящей из MW-DCG_LCv1, MW-DCG_LCv2, MW-DCG_LCv3, MW-DCG_LCv4, MW-DCG_LCv5, MW-DCG_LCv6, MW-DCG_LCv7, MW-DCG_LCv8, MW-DCG_LCv9, MW-DCG_LCv10, MW-DCG_LCv11, MW-DCG_LCv12, MW-DCG_LCv13, MW-DCG_LCv14, MW-DCG_LCv15, MW-DCG_LCv16, MW-DCG_LCv17, MW-DCG_LCv18, MW-DCG_LCv19, MW-DCG_LCv20, MW-DCG_LCv21, MW-DCG_LCv22, MW-DCG_LCv23, MW-DCG_LCv24, MW-DCG_LCv25, MW-DCG_LCv26, MW-DCG_CCv13, MW-DCG_CCv14, MW-DCG_CCv15, MW-DCG_CCv16, MW-DCG_CCv17, MW-DCG_HNCv13, MW-DCG_HNCv14, MW-DCG_HNCv15, MW-DCG_HNCv16, MW-DCG_HNCv17 и MW-DCG_HNCv18.
Штаммы бактерий MW-DCG_LCv1, MW-DCG_LCv2, MW-DCG_LCv3, MW-DCG_LCv4, MW-DCG_LCv5, MW-DCG_LCv6, MW-DCG_LCv7, MW-DCG_LCv8, MW-DCG_LCv9, MW-DCG_LCv10, MW-DCG_LCv11, MW-DCG_LCv12, DCG_HNCv13, MW-DCG_HNCv14, MW-DCG_HNCv15, MW-DCG_HNCv16, MW-DCG_HNCv17 и MW-DCG_HNCv18 обладают специфичностью в отношении и терапевтически эффективны против злокачественных солидных опухолей головы и шеи. Штамм MW-DCG_HNCv18 является предпочтительным штаммом и представлен регистрационным номером V12/001485.
Штаммы бактерий MW-DCG_LCv1, MW-DCG_LCv2, MW-DCG_LCv3, MW-DCG_LCv4, MW-DCG_LCv5, MW-DCG_LCv6, MW-DCG_LCv7, MW-DCG_LCv8, MW-DCG_LCv9, MW-DCG_LCv10, MW-DCG_LCv11, MW-DCG_LCv12, MW-DCG_CCv13, MW-DCG_CCv14, MW-DCG_CCv15, MW-DCG_CCv16 и MW-DCG_CCv17 обладают специфичностью в отношении и терапевтически эффективны против злокачественных солидных опухолей толстой кишки. Штамм MW-DCG_CCv17 является предпочтительным штаммом и представлен регистрационным номером V12/001487.
Штаммы бактерий MW-DCG_LCv1, MW-DCG_LCv2, MW-DCG_LCv3, MW-DCG_LCv4, MW-DCG_LCv5, MW-DCG_LCv6, MW-DCG_LCv7, MW-DCG_LCv8, MW-DCG_LCv9, MW-DCG_LCv10, MW-DCG_LCv11, MW-DCG_LCv12, MW-DCG_LCv13, MW-DCG_LCv14, MW-DCG_LCv15, MW-DCG_LCv16, MW-DCG_LCv17, MW-DCG_LCv18, MW-DCG_LCv19, MW-DCG_LCv20, MW-DCG_LCv21, MW-DCG_LCv22, MW-DCG_LCv23, MW-DCG_LCv24, MW-DCG_LCv25 и MW-DCG_LCv26 обладают специфичностью в отношении и терапевтически эффективны против злокачественных солидных опухолей легкого. Штамм MW-DCG_LCv26 является предпочтительным штаммом и представлен регистрационным номером V12/001486.
Согласно второму аспекту, в настоящем изобретении предложены клостридиальные споры одного или более бактериальных штаммов первого аспекта. В одном варианте осуществления клостридиальные споры второго аспекта могут быть объединены с физиологически приемлемым носителем и/или вспомогательным веществом.
Согласно третьему аспекту, в настоящем изобретении предложен способ подавления роста, регрессии или разрушения одной или более солидных злокачественных опухолей у субъекта, где способ включает введение терапевтически эффективного количества клостридиальных спор второго аспекта субъекту, нуждающемуся в этом.
Согласно четвертому аспекту, в настоящем изобретении предложено применение клостридиальных спор второго аспекта с целью вызвать подавление роста, регрессию или разрушение одной или более солидных опухолей у субъекта, где терапевтически эффективное количество клостридиальных спор второго аспекта вводят субъекту, нуждающемуся в этом.
Согласно пятому аспекту, в настоящем изобретении предложен способ лечения одной или более солидных злокачественных опухолей у субъекта, где подавление роста одной или более опухолей, регрессия опухоли или разрушение опухоли служит показателем лечения, где способ включает введение:
(1) терапевтически эффективного количества клостридиальных спор согласно второму аспекту и
(2) терапевтически эффективного количества противоопухолевого средства субъекту.
Согласно шестому аспекту, в настоящем изобретении предложено применение клостридиальных спор второго аспекта и противоопухолевого средства в комбинированной терапии для лечения одной или более солидных злокачественных опухолей у субъекта, где подавление роста одной или более опухолей, регрессия опухолей или разрушение опухолей является показателем лечения, где (1) терапевтически эффективное количество клостридиальных спор второго аспекта и (2) терапевтически эффективное количество противоопухолевого средства вводят субъекту, нуждающемуся в этом.
В варианте осуществления пятого и шестого аспектов, введение (1) и (2) субъекту происходит последовательно или одновременно. (1) и (2) можно вводить субъекту в виде одной фармацевтической композиции. Введение (1) и (2), в виде одной композиции или по отдельности, может быть повторено один или более раз, чтобы гарантировать регрессию опухоли. Например, (1) и (2) можно вводить субъекту в качестве первой дозы, с последующим введением одного (2) в качестве второй дозы. Можно вводить больше одного противоопухолевого средства в любом количестве доз.
В другом варианте осуществления (1) представляет собой клостридиальные споры MW-DCG_HNCv18, а (2) - химерное моноклональное антитело против EGFR. В другом варианте осуществления (2) представляет собой Цетуксимаб. В еще одном варианте осуществления клостридиальные споры MW-DCG_HNCv18 и Цетуксимаб одновременно вводят субъекту, с последующим вторым введением одного Цетуксимаба.
В одном варианте осуществления третьего, четвертого, пятого и шестого аспектов терапевтически эффективное количество клостридиальных спор второго аспекта составляет от приблизительно 106 колониеобразующих единиц (КОЕ) до приблизительно 1014 КОЕ/кг на дозу. В другом варианте осуществления терапевтически эффективное количество клостридиальных спор второго аспекта составляет приблизительно 108-1012 или приблизительно 109-1011 КОЕ/кг на дозу. В другом варианте осуществления терапевтически эффективное количество клостридиальных спор второго аспекта составляет приблизительно 1010-1011 КОЕ/кг на дозу. В еще одном варианте осуществления терапевтически эффективное количество клостридиальных спор второго аспекта составляет приблизительно 1010,5 КОЕ/кг на дозу. Введение терапевтически эффективного количества клостридиальных спор второго аспекта субъекту может быть выполнено внутривенно, люмбально, подкожно или внутримышечно. Например, введение может быть внутривенным.
Согласно седьмому аспекту, в настоящем изобретении предложена фармацевтическая композиция, включающая клостридиальные споры второго аспекта и физиологически приемлемый носитель и/или вспомогательное вещество. Композиция может дополнительно включать противоопухолевое средство. Противоопухолевое средство может быть средством, определенным согласно пятому и шестому аспектам.
Противоопухолевое средство является любым средством, которое может использоваться в химиотерапии, лучевой терапии или терапии на основе антител или их комбинациях. Средство может быть одним или более химическими соединениями, одной или более молекулами РНК, одним или более антителами или их любой комбинацией.
Например, одно или более химических соединений могут быть дихлорацетатом натрия, паклитакселом, доксилом, топотеканом, ДНК-модифицирующими лекарственными средствами, карбоплатином, антиметаболитами, гемцитабином, лекарственными средствами, которые блокируют деление клеток, винкристином, антиангиогенными средствами и пазопанибом.
Примером одной или большего количества молекул РНК является малая интерферирующая РНК (миРНК). миРНК может быть специфична к лактатдегидрогеназе (LDHA) или специфична к CD147.
Примером одного или большего количества антител является противоопухолевое моноклональное антитело. Противоопухолевое антитело может быть антителом против иммуностимуляции или моноклональным антителом против регуляторных T-клеток. Примером антитела против иммуностимуляции является моноклональное антитело против CD40. Моноклональным антителом против CD40 может быть FGK45. Примером моноклонального антитела против регуляторных T-клеток является моноклональное антитело против CD25. Моноклональным антителом против CD25 может быть PC61. В другом варианте осуществления средство направлено против рецептора эпидермального фактора роста (EGFR).
Противоопухолевое моноклональное антитело может быть конъюгированным или "голым". Голые антитела, например, действуют через комплемент-опосредованный цитолиз и антителозависимую клеточноопосредованную цитотоксичность. Конъюгированные антитела включают антитела, которые конъюгированы с радиоизотопом или ферментом, активирующим лекарственное соединение. Радиоизотопно конъюгированное антитело может использоваться в радиоиммунотерапии. Примерами радиоизотопно конъюгированного антитела или радиоизотопа является рений-188 или рений-186, фтордезоксиглюкоза (18F), также известная, как FDG, иттрий-90 (90Y)-конъюгированное антитело против CD20, Y90-ибритутомаб тиуксетан, и иод-131 (131I)-конъюгированное антитело против CD20, I131-тозитумомаб. Антитела, конъюгированные с активирующим лекарственное соединение ферментом, могут использоваться в антителонаправленной терапии с применением фермента и пролекарства (ADEPT). Противоопухолевое моноклональное антитело может быть конъюгировано с липосомой или наночастицей, которые могут заключать в себе различные лекарственные средства и терапевтические нуклеотиды, такие как молекулы миРНК.
Способ согласно пятому аспекту и применение согласно шестому аспекту может дополнительно включать гормональную терапию, гипертермию, хирургию, радиацию или их любую комбинацию, в качестве альтернативы или в дополнение к введению одного или более противоопухолевых средств. Радиация может быть ионизирующим излучением.
Согласно восьмому аспекту, в настоящем изобретении предложен способ получения бактериального штамма из авирулентного, непатогенного штамма Clostridium ghonii, где производный бактериальный штамм, полученный указанным способом, способен подавлять рост, вызывать регрессию или разрушение одной или более солидных опухолей в результате онколизиса клеток в микроокружении одной или большего количества опухолей, где производный бактериальный штамм, полученный указанным способом, вызывает меньшую токсичность, чем референсный клостридиальный штамм.
В одном варианте осуществления способ получения бактериального штамма из авирулентного, непатогенного штамма Clostridium ghonii включает:
(1) Получение инъекционной формы клостридиальных спор из авирулентного, непатогенного штамма Clostridium ghonii, включающее:
(a) инокуляцию вегетативных палочек бактериального штамма (1) в среду спорулирования,
(b) выдерживание в течение достаточного времени и в определенных условиях для спорулирования палочек, и
(c) очистку спор;
(2) Введение очищенных клостридиальных спор (1) животному, которое поддерживает рост солидной опухоли;
(3) Оценку параметров для определения скорости и степени онколизиса и токсичности;
(4) Сбор вегетативных палочек из опухоли (2) при извлечении опухоли;
(5) Посев палочек (4) на агаровую чашку;
(6) Отбор двух или более одиночных колоний с чашки (5) и инокуляцию питательной культуры с целью выращивания вегетативных палочек; и
(7) Повтор этапов (1)(a)-(6) от приблизительно 10 до приблизительно 35 раз.
В другом варианте осуществления две или более одиночных колоний (6) являются тремя одиночными колониями.
В другом варианте осуществления этапы (1)(a)-(6) повторяют от приблизительно 15 до приблизительно 30 раз или от приблизительно 17 до приблизительно 26 раз.
В другом варианте осуществления параметры (3) могут включать время колонизации спор, онколизис, образование и выход гноя, объем опухоли, системную токсичность, выживание животных, количество спор/палочек, выделенных из опухолей после внутривенного введения спор или любую комбинацию перечисленного.
В другом варианте осуществления бактериальный штамм вызывает лизис от приблизительно 20% до приблизительно 90% или от приблизительно 20% до приблизительно 70%, или от приблизительно 20% до приблизительно 40%, или от приблизительно 20% до приблизительно 35%, или от приблизительно 25% до приблизительно 35% клеток в микроокружении опухоли. В другом варианте осуществления авирулентный, непатогенный штамм Clostridium ghonii может быть выбран из группы, состоящей из штаммов с регистрационными номерами ATCC 25757, BCRC 14548, CCUG 9282, DSM 15049, NCIMB 10636, PEV, Prevot PEV, VPI 4897 и VTT E-042451.
Согласно девятому аспекту, в настоящем изобретении предложен набор для лечения одной или более солидных злокачественных опухолей, включающий бактериальный штамм согласно первому аспекту, клостридиальные споры согласно второму аспекту или фармацевтическую композицию согласно седьмому аспекту, дополнительно включающий противоопухолевое средство и инструкции по применению.
В варианте осуществления согласно одному или нескольким предыдущим аспектам, субъект может быть млекопитающим. Млекопитающее может быть человеком.
В варианте осуществления согласно одному или нескольким предыдущим аспектам, солидная злокачественная опухоль выбрана из группы, состоящей из карцином дыхательной системы, карцином желудочно-кишечной системы, карцином мочеполовой системы, карцином яичков, карцином молочной железы, карцином предстательной железы, карцином эндокринной системы, меланом, хориокарциномы и карцином шейки матки, легкого, головы и шеи, толстой кишки, яичника, головного мозга, мочевого пузыря, молочной железы, предстательной железы, опухолей костной, жировой и хрящевой ткани, болезни Ходжкина, нехождкинской лимфомы, B-клеточной лимфомы, эпителиотропной лимфомы, композитной лимфомы, анапластической крупноклеточной лимфомы, лимфомы лимфоидной ткани, ассоциированной с желудочной и нежелудочной слизистой, лимпфопролиферативной болезни, T-клеточной лимфомы, лимфомы Беркитта, мантийноклеточной лимфомы, диффузной крупноклеточной лимфомы, лимфоплазмацитоидной лимфомы и множественной миеломы.
Определения
В рамках настоящего описания, термин "включающий" означает "включает в основном, но не обязательно исключительно". Кроме того, вариации слова "включающий", такие как "включает", имеют соответственно измененные значения.
Термин "штамм" означает подмножество бактериальных видов, отличающееся от других бактерий тех же видов одним или несколькими незначительными, но определяемыми, различиями. Штамм представляет собой "популяцию организмов, которая происходит от одного организма или изолята чистой культуры. Штаммы в пределах вида могут несколько отличаться друг от друга различными способами" (стр. 392, Prescott et al., 1996). Штаммы часто создаются в лаборатории путем мутагенеза существующих штаммов или диких вариантов бактериальные видов.
При использовании в настоящем описании, термин "производный" является любым бактериальным штаммом, полученным из авирулентного, непатогенного Clostidium ghonii, такого как, без ограничения, штаммы под регистрационным номером ATCC 25757, BCRC 14548, CCUG 9282, DSM 15049, NCIMB 10636, PEV, Prevot PEV, VPI 4897 и VTT E-042451, с использованием которых было осуществлено получение производных штаммов путем последовательных этапов селекции, выделения и инокуляции с ксенографтной солидной опухолью у животного, в результате чего наблюдается онколизис опухоли, а токсичность для животного является незначительной.
При использовании в настоящем описании, термины "некротическая область", "гипоксическая область", "центральное окружение" и "микроокружение" являются взаимозаменяемыми и относятся к внутренней части солидной опухоли, которая имеет одно или несколько следующих особенностей: наличие высокого интерстициального давления, низкого внеклеточного pH, гетерогенности опухолевых клеток и анаэробного метаболизма, включая гликолиз с высокой концентрацией глюкозы и уровнем лактата.
При использовании в настоящем описании, термин "выделенный" или "выделение" означает, что бактериальные клетки были удалены или собраны с культуральных чашек или из их естественной окружающей среды или хозяина (например, опухоли).
При использовании в настоящем описании, фраза "меньшая токсичность, чем референсный клостридиальный штамм" и "вызывает меньшую токсичность, чем референсный клостридиальный штамм" означает, что рост производного клостридиального штамма в солидной опухоли субъекта и последующий онколизис дает меньшую токсичность для субъекта по сравнению с субъектом, которому ввели референсный клостридиальный штамм, где референсный штамм может быть, без ограничения, сахаролитической разновидностью, протеолитическим C. sporogenes, протеолитическим C. novyi-NT и C. sordellii, или даже C. ghonii, которые не были получены способом настоящего изобретения или только прошли процесс адаптации. Уровень токсичности определяют и оценивают с использованием полного оценочного листа, включающего следующие четыре уровня: Внешний вид; Клинические симптомы; Неспровоцированное поведение; и Поведенческие реакции на внешние стимулы.
Термин "рак" включает злокачественные новообразования, характеризующиеся нерегулируемым или неконтролируемым ростом клеток, такие как солидные злокачественные новообразования, которые могут формироваться в виде карциномы, саркомы или лимфомы. Термин "рак" включает первичные злокачественные опухоли, например, опухоли, клетки которых еще не мигрировали в другие участки в теле субъекта помимо участка локализации исходной опухоли, и вторичные злокачественные опухоли, например, опухоли, которые являются результатом метастазирования, миграции клеток опухоли во вторичные участки, отличные от участка локализации исходной опухоли.
При использовании в настоящем описании, термин "солидная опухоль" является аномальной массой ткани, которая обычно не содержит кисты или области с жидкостью. Солидные опухоли могут быть доброкачественными или злокачественными. Солидные опухоли, рассматриваемые в настоящей заявке, являются злокачественными опухолями. Саркомы, карциномы и лимфомы могут иметь отношение к солидным опухолям. Лейкозы обычно не формируют солидные опухоли.
При использовании в настоящем описании, термин "карцинома" означает любое злокачественное новообразование из эпителиальных или эндокринных тканей, включая карциномы дыхательной системы, карциномы желудочно-кишечной системы, карциномы мочеполовой системы, карциномы яичка, карциномы молочной железы, карциномы предстательной железы, карциномы эндокринной системы, меланомы, хориокарциному, а также карциномы шейки матки, легкого, головы и шеи, толстой кишки и яичника.
При использовании в настоящем описании, термин "саркома" означает любые злокачественные опухоли мезодермальной соединительной ткани, например, опухоли костной, жировой и хрящевой ткани.
При использовании в настоящем описании, термин "лимфома" означает любое злокачественное новообразование из гематопоэтических клеток костного мозга. Эти злокачественные новообразования обычно проявляются как солидные опухоли. Примеры лимфом включают болезнь Ходжкина, неходжкинскую лимфому, B-клеточную лимфому, эпителиотропную лимфому, комплексную лимфому, анапластическую крупноклеточную лимфому, лимфому лимфоидной ткани, ассоциированной с желудочной и нежелудочной слизистой, лимфопролиферативную болезнь, T-клеточную лимфому, лимфому Беркитта, мантийноклеточную лимфому, диффузную крупноклеточную лимфому, лимфоплазмацитоидную лимфому и множественную миелому.
При использовании в настоящем описании, термин "подавление" означает, что опухоль прекратила расти.
При использовании в настоящем описании, термин "регрессия опухоли" означает уменьшение солидных опухолей после введении клостридиальных спор настоящего изобретения, отдельно или в комбинации с противоопухолевым средством и/или дополнительной противоопухолевой терапией. Для определения регрессии опухоли, размер обработанной и необработанной (контрольной) опухоли измеряют в определенной точке времени и сравнивают друг с другом. Как "подавление", так и "регрессия" могут, в конечном счете, приводить или не приводить к разрушению опухоли.
При использовании в настоящем описании, термин "субъект" означает организмы, которые могут страдать от рака, особенно в форме солидных опухолей. Организмы могут быть млекопитающими и включают человека и различных, не относящихся к человеку, животных, таких как приматы, собаки и кошки. Предпочтительные животные, относящиеся к человеку, включают относящихся к человеку субъектов. Как рассматривается в настоящем описании, субъект может подвергаться большему риску возникновения солидных злокачественных опухолей, развивающихся в их теле, по сравнению со средним представителем популяции.
При использовании в настоящем описании, термин "лечение" и его вариации относится к любым возможным применениям, которые устраняют состояние болезни или симптомы, предотвращают развитие болезни, или иным образом предотвращают, препятствуют, задерживают или меняют вспять прогрессию болезни или других нежелательных симптомов каким бы то ни было образом. Как рассматривается в настоящем описании, лечение солидной опухоли означает подавление роста, регрессию или полное или практически полное разрушение опухоли.
При использовании в настоящем описании, термин "эффективное количество" включает, в рамках своего значения, нетоксичное, но достаточное количество компонента как такового, которое обеспечивает требуемый терапевтический или профилактический эффект. Точное требуемое количество будет изменяться от субъекта к субъекту в зависимости от таких факторов, как биологический вид, подвергаемый лечению, возраст и общее состояние субъекта, тяжесть состояния, подвергаемого лечению, конкретное вводимое вещество, способ введения и т.д. Таким образом, не возможно определить точное "эффективное количество". Однако, для любого данного случая, соответствующее "эффективное количество" может быть определено средним специалистом в данной области при использовании стандартных экспериментов. В частности, термины "эффективное количество" и "терапевтически эффективное количество" синонимично относятся к такому количеству композиции или единичной дозированной формы, которая в группе пациентов производит эффект (1) уменьшения размера опухоли; (2) ингибирования (то есть, замедления в некоторой степени, предпочтительно остановки) метастазирования опухоли; (3) ингибирования в некоторой степени (то есть, замедления в некоторой степени, предпочтительно подавления) роста опухоли; и/или; (4) ослабление в некоторой степени (или предпочтительно устранение) одного или нескольких симптомов, связанных с раком; (5) практически полное или полное разрушение опухоли; (6) увеличение времени прогрессии болезни; и/или (7) повышение общей выживаемости.
При использовании в настоящем описании, "фармацевтическая композиция" относится к клостридиальным спорам, в отдельности или в одной или более комбинациях, описанных в настоящей заявке. В одном варианте осуществления комбинация представляет собой клостридиальные споры производных бактериальных штаммов настоящего изобретения и одно или более противоопухолевых средств, которые могут быть известны в уровне техники. Другие химические компоненты, такие как физиологически приемлемые носители и вспомогательные вещества, также рассматриваются в настоящем описании.
При использовании в настоящем описании, термин "фармацевтически приемлемый" означает, что агент или вспомогательное вещество в целом считаются приемлемыми для применения в фармацевтической композиции.
При использовании в настоящем описании, "физиологически приемлемый носитель" относится к носителю или разбавителю, который не вызывает существенного раздражения организма и не нарушает биологической активности и свойств вводимой композиции. Примерные фармацевтически приемлемые носители включают твердые и жидкие разбавители. Примерами фармацевтически приемлемых жидких разбавителей являются вода, этанол, пропиленгликоль и глицерин; из них, в некоторых вариантах осуществления, предпочтительной является вода.
При использовании в настоящем описании, "вспомогательное вещество" относится к фармацевтически инертному веществу, добавляемому к фармацевтической композиции для дополнительного облегчения введения фармацевтической композиции настоящего изобретения. Неограничивающие примеры вспомогательных веществ включают карбонат кальция, фосфат кальция, различные сахара и типы крахмала, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли. Группы вспомогательных веществ и активных фармацевтических компонентов в области фармацевтики считаются взаимоисключающими.
Краткое описание фигур
Фигура 1. Схематическое изображение образования спор. На схематическом изображении показано, что новую аликвоту суспензии клостридиальных спор сеют на чашку с усиленным клостридиальным агаром в анаэробных условиях на 24 часа. Затем отбирают до пяти колоний, инокулируют в 10 мл среды HI и анаэробно культивируют. Через двадцать четыре часа культуру переносят в 50 мл или 100 мл модифицированной среды для спорулирования и культивируют в анаэробных условиях. Если используется емкость с плотно закрытой крышкой, культуру можно инкубировать в обычном инкубаторе без анаэробных условий. Споры готовы для сбора через 7 дней, но могут быть собраны даже через 14 дней. Во время сбора колбу быстро встряхивают, затем оставляют на пару минут, верхний слой культуры отбирают пипеткой во флакон для центрифужных стаканов и центрифугируют при 5000g для промывки спор. Очищенные споры титруют, чтобы определить титр в колониеобразующих единицах (КОЕ). Эта работа занимает 2-4 дня. Процесс может быть масштабирован.
Фигура 2. Онколитическая активность полученных бактериальных штаммов. Мышей рандомизировано распределяли в 3 группы. В день 15, группу 1 оставляли без инъекции в качестве контроля (обозначили как 'нет' в подписи на фигуре), Группе 2 вводили фосфатно-солевой буфер (обозначили как 'PBS' в подписи на фигуре) и группе 3 вводили споры производного бактериального штамма (обозначили как 'DCG' в подписи на фигуре). Объем опухоли регистрировали все последующие дни. Группа DCG показала замедленный рост объема опухоли.
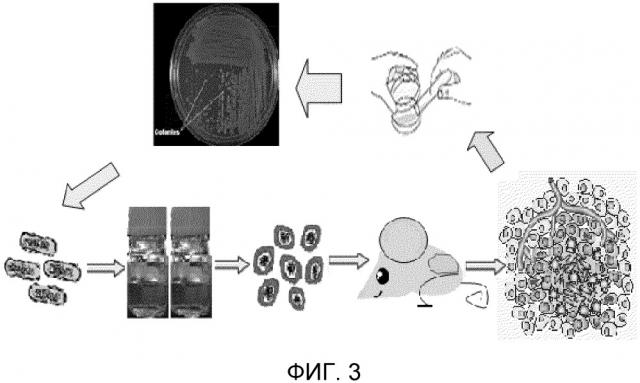
Фигура 3. Схематическое изображение доставки спор и повторной адаптации клостридиальных спор. Мышам (n=3), имеющим опухоли различных размеров (от поддающихся обнаружению до 0,45 см3), в/в вводили 108 КОЕ спор. Рост и объем опухоли у мышей оценивали через день, используя ультразвук и цифровые штангенциркули. Кроме того, оценивали промежуток времени до изменения цвета поверхности опухоли, образование некроза/жидкости/гноя в опухоли и выход жидкости/гноя/разрыв опухоли, время и количество спор в опухолях, рост/уменьшение/исчезновение опухоли, а также любые токсические проявления и изменения поведения у животных. Только те опухоли, которые показывают выход жидкости/гноя/разрыв опухоли или образо