Новые производные каннабидиол-хинона
Иллюстрации
Показать всеНастоящее изобретение относится к новым производным каннабидиол-хинона формулы (I) или к их фармацевтически приемлемым солям
где R представляет собой атом углерода линейной или разветвленной группы, представленной алкоксикарбонильной группой; или где R представляет собой атом азота линейной или разветвленной группы, представленной алкиламинной или бензиламинной группами, применяемыми для лечения заболеваний, опосредованных PPRAg, а также к содержащей предлагаемые соединения композиции. 2 н. и 6 з.п. ф-лы, 15 ил., 10 пр.
Реферат
Область техники
Настоящее изобретение относится к новым производным каннабидиол-хинона и синтезу этих соединений. Кроме того, настоящее изобретение относится к применению указанных соединений в качестве лекарственного средства, а также для терапии, в частности, в качестве модуляторов гамма-рецепторов активации пролиферации пероксисом (PPARg), для лечения заболеваний и состояний, восприимчивых к модуляции PPARg. Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные соединения, и к способу лечения заболеваний с помощью указанных соединений.
Уровень техники
Ядерные рецепторы (NR) представляют большой интерес для исследования и разработки лекарственных средств. NR представляют собой лиганд-зависимые факторы транскрипции, которые обладают способностью непосредственно взаимодействовать с ДНК, регулируя транскрипционную активность генов-мишеней. Данные рецепторы играют важную роль в развитии, клеточном гомеостазе и метаболизме, и они вовлечены в широкий круг заболеваний, в связи с чем прилагаются усилия для их изучения и разработки новых лекарственных средств для фармацевтической промышленности.
В новейшей номенклатуре ядерных рецепторов подсемейство 1 С (NR1C) включает три подтипа рецепторов активации пролиферации пероксисом (PPAR) млекопитающих: PPARα (также называемый NR1C1), PPARβ/δ (также называемый NR1C2) и PPARγ (также называемый PPARg, рецептор глитазона или NR1C3). PPAR контролируют экспрессию генных сетей, участвующих в адипогенезе, липидном обмене, воспалении и поддержание метаболического гомеостаза [Barish et al., 2006]. PPAR активируют транскрипцию генов путем связывания с элементами последовательностей ДНК, известных как элементы ответа пролиферации пероксисом (PPRE) в регуляторной области генов-мишеней PPAR [Poulsen et al., 2012]. Кроме того, PPAR негативно регулируют транскрипцию генов воспалительного ответа посредством антагонизма сигнальных путей белка-активатора-1 (АР-1), ядерного фактора каппа-В (NF-kB), переносчика сигнала и активатора транскрипции 3 (STAT3) и ядерного фактора активированных Т-клеток (NFAT) [Vanden Bergheetal. 2003].
Среди PPAR особый интерес представляет PPARg, так как он участвует в регуляции образования адипоцитов, чувствительности к инсулину и воспалительных процессов [Fievet et al. 2006] [Stienstra et al. 2007] [Tontonoz and Spiegelman, 2008]. PPARg экспрессируется в ряде тканей, включая жировую ткань, клетки скелетной мускулатуры, остеокласты, остеобласты, клетки иммунной системы, а также центральную и периферическую нервную систему. Очевидно, что PPARg является "мастером" или доминирующим регулятором адипогенеза, в связи с тем фактом, что он одновременно является необходимым и достаточным для дифференциации жировых клеток. Регуляторные области большого числа генов, которые играют важную роль в липогенезе и чувствительности к инсулину, такие как аР2, LPL, адипонектин и Glut4, содержат сайты связывания с PPARg [Rosen and MacDougald, 2006]. Следовательно, активация PPARg в жировой ткани воздействует на чувствительность к инсулину во всем организме.
В дополнение к участию этого рецептора в регуляции метаболического гомеостаза, сообщалось о новых возможных механизмах действия PPARg, включая в особенности противовоспалительные, противоопухолевые и антифиброзные свойства [Zhao et al., 2006]. Блокирование сигнализации TGFb/Smad путем активации PPARg приводит к уменьшению отложения коллагена при печеночном, легочном и почечном фиброзе [Ferguson et al., 2009] [Wang et al., 2007] [Zhang et al., 2009]. С другой стороны, активация PPARg оказывает противовоспалительное действие на несколько типов клеток путем ингибирования экспрессии провоспалительных генов, тем самым снижая образование цитокинов, металлопротеиназ и белков острой фазы [Tontonoz and Spiegelman, 2008]. Они также действуют путем повышения противовоспалительных цитокинов и ингибирования экспрессии индуцибельной синтазы окиси азота (iNOS) [ et al., 2007]. Интересно отметить, что агонисты PPARg продемонстрировали противовоспалительное и нейропротекторное действие на нескольких экспериментальных моделях болезни Паркинсона, бокового амиотрофического склероза, рассеянного склероза и инсульта, а также в ряде клинических исследований [Bernardo and Minghetti, 2008]. В этом отношении было показано, что агонисты PPARg имеют высокий уровень экспрессии в предшественниках нейронов (NP), обработанных ретиноевой кислотой, и они участвуют в двух стадиях дифференцировки нейронов эмбриональных стволовых клеток мыши во время и после выработки NP [Ghoochani et al., 2012]. Кроме того, в генетическом смысле необходимо формально рассматривать PPARg как ген-супрессор опухолей. Они экспрессируются в различных опухолевых клетках, а активация PPARg лигандами приводит к ингибированию пролиферации клеток или индукции апоптоза [Tachibana et al., 2008] [Tontonoz and Spiegelman, 2008].
Положительные эффекты активации PPARg с помощью специфических лигандов агонистов можно использовать для лечения некоторых хронических заболеваний, таких как сахарный диабет, атеросклероз, ревматоидный артрит, фиброз печени, воспалительные заболевания кишечника, нефропатия, псориаз, заживление ран на коже, склеродермия (SSc), нейродегенеративные и нейровоспалительные расстройства и рак.
Среди активаторов лигандов PPARg наибольшее клиническое значение имеют тиазолидиндионы (TZD) [Lehmann et al., 1995]. По этой причине в клинической практике до сих пор широко применяют росиглитазон и пиоглитазон. Они оказывают похожее воздействие на гликемический контроль, а также вызывают целый ряд похожих нежелательных явлений, таких как увеличение массы тела, задержка жидкости и повышенный риск сердечной недостаточности, которые, по-видимому, опосредованы активностью PPARg. Действительно, недавно в Европе отменили росиглитазон, а в США ограничили его применение вследствие повышенного риска сердечнососудистых явлений у пациентов с сахарным диабетом 2 типа.
Несмотря на то, что TZD являются сильнодействующими полными агонистами PPARg (PPARg-fa), побочные эффекты, обусловленные механизмом их действия, ограничивают полный терапевтический потенциал данных соединений [Gelman et al., 2007] [Ciudin et al., 2012]. Но физиологическая и терапевтическая значимость пути PPARg способствовала проведению новых исследований, посвященных разработке новых классов молекул, которые уменьшают или устраняют нежелательные явления [Ahmadian et al., 2013]. Таким образом, был достигнут значительный прогресс в исследовании и разработке селективных модуляторов PPARg (PPARg-m), как более безопасной альтернативы PPARg-fa. Доклинические и клинические данные ясно свидетельствуют о том, что селективные PPARg-m в перспективе могут стать следующим поколением агонистов PPARg: эффективных сенсибилизаторов инсулина с превосходным профилем безопасности, по сравнению с PPARg-fa. [Doshi et al.2010].
В этом отношении природные и синтетические каннабиноиды рассматриваются как PPARg-m, которые уменьшают воспалительный процесс посредством активации PPARg. Некоторыми примерами PPARg-m на основе каннабиноидов являются аджулемовая кислота [Liu et al., 2003], [Burstein S. 2005], WIN55212-2 [Sun and Bennett, 2007], 9Δ-ТНС и CBD [O'Sullivan 2007] и CBG [Granja et al., 2012].
Были описаны некоторые хинононовые производные каннабиноидов, такие как CBD-Q (HU-311, в настоящем изобретении также называемый VCE-004) и CBG-Q (VCE-003) [Kogan et al., 2004] [Granja et al., 2012]. Интересно отметить, что VCE-004 (также известный как HU-331) демонстрировал концентрацию ЕС50, составляющую 5 μM, таким образом проявляя в четыре раза более высокую аффинность связывания по сравнению с исходной молекулой CBD (ЕС50 21 μМ), и VCE-003 показал значительное усиление аффинности связывания с PPARg (ЕС50 2,2 μM) по сравнению с исходной молекулой CBG (ЕС50 12,7 μМ) [Granja et al., 2012]. Также были описаны другие CBD-хиноны, такие как CBD-1,4-дигидроксихинон, 4-метил-CBD-хинон и 4-формил-метокси-CBD-хинон, и они проявили более высокую аффинность связывания с PPARg по сравнению с исходной молекулой CDB [WO 2011117429 А1]. Однако выполнение синтеза таких соединений представляется очень сложным, и полученные соединения очень нестабильны, что делает их непригодными для фармацевтической разработки.
Хиноны представляют собой класс токсичных промежуточных соединений, которые могут приводить к различным опасным эффектам in vivo, включая острую цитотоксичность и иммунотоксичность [Bolton et al., 2000]. Механизмы, с помощью которых хиноны вызывают данные эффекты, могут быть достаточно сложными. Хиноны являются акцепторами Михаэля и повреждение клеток может происходить из-за алкилирования важных клеточных белков и/или ДНК. Альтернативно, хиноны являются высоко активными окислительно-восстановительными молекулами, которые могут вступать в окислительно-восстановительный цикл с их полухиноновыми радикалами, приводя к образованию активных форм кислорода (АФК), что может привести к серьезному окислительному стрессу внутри клеток через образование окисленных клеточных макромолекул, включая липиды, белки и ДНК [Monks and Jones, 2012]. Хотя существуют многочисленные примеры соединений на основе хинонов с терапевтическим применением, опасения по поводу неспецифической токсичности и отсутствия селективности, возможности быть акцепторами Михаэля редко закладывают в разработку прототипов лекарственных средств.
Путь Keap1-Nrf2 является главным регулятором цитопротекторных ответов на эндогенный и экзогенный стресс, вызванный активными формами кислорода (АФК) и электрофилами. Ключевыми сигнальными белками пути являются ядерный фактор транскрипции-2 (родственный эритроидному фактору 2) (Nrf2), который связывает вместе небольшие белки Maf с элементом антиоксидантного ответа (ARE) в регуляторных областях генов-мишеней. В обычных условиях Nrf2 сохраняется в цитоплазме благодаря ингибитору Keap1 (Kelch ЕСН-связанный белок 1). Когда клетки подвергаются окислительному стрессу, воздействию электрофилов или химиопрофилактических агентов, Nrf2 освобождается от Keap1-опосредованной репрессии и активирует экспрессию генов, зависящую от элемента антиоксидантного ответа (ARE), с целью поддержания клеточного окислительно-восстановительного гомеостаза [Na and Surh, 2013].
Nrf2 может защищать клетки и ткани от разнообразных токсикантов и канцерогенов путем усиления экспрессии ряда цитопротекторных генов. Исследования показали, что так же как Nrf2 защищает нормальные клетки, Nrf2 также может защищать раковые клетки от химиотерапевтических агентов и способствовать развитию опухолей [Na and Surh 2013]. Раковые клетки переживают постоянный эндогенный окислительный стресс и становятся устойчивыми к воздействию некоторых противораковых агентоа, которые вызывают цитотоксичность за счет образования АФК. В таких условиях, активный путь Nrf2 может поддерживать подходящий окислительно-восстановительный баланс в раковых клетках, сохраняя уровни АФК в пределах диапазона, который способствует их росту и выживанию. Предположительно, длительное накопление или активация Nrf2 обеспечивает для подгруппы предраковых или раковых клеток оптимальные условия для пролиферации, а также возможность избежать апоптоза, метастазировать и переносить терапевтическое вмешательство.
Как известно, ингибирование гиперэкспрессии Nrf2 изменяет фенотипические характеристики раковых клеток, тем самым подтверждая данное предположение [Sporn and Liby, 2012]. Конститутивная гиперактивация Nrf2 наблюдается во многих типах злокачественных новообразований, таких как плоскоклеточный рак, рак легких, рак молочной железы, рак желчного пузыря, рак предстательной железы, рак почки, эпендимомы, эпителиальная карцинома яичников, рак эндометрия и рак поджелудочной железы [Na and Surh, 2013]. У больных раком пациентов с постоянно повышенным уровенем экспрессии Nrf2 в опухолях, в целом наблюдается более низкий уровень выживаемости [Solis et al., 2010]. Таким образом, активация Nrf2 рассматривается как прогностический молекулярный маркер для определения статуса прогрессирования рака и способствует развитию природной и приобретенной устойчивости к химиотерапии. Таким образом, данный антиоксидантный фактор транскрипции также может выступать как протоонкоген, и усиленная активность Nrf2 способствует возникновению солидного рака и устойчивости к химиотерапии [Sporn and Liby, 2012].
С целью улучшения только агонистической активности PPARg, но не допуская активацию Nrf2 во избежание возможных побочных эффектов, в рамках настоящего изобретения была разработана серия новых соединений, начиная с VCE-004 и каннабидиоловой кислоты (CBDA) в качестве опорных соединений. Авторами настоящего изобретения было неожиданно обнаружено, что производные CBD-хинона (производные CBD-Q) с определенными модификациями в положении 3 позволяют получить новые соединения с высоким агонистическим эффектом PPARg, но которые при этом не проявляют электрофильную (активации Nrf2) и цитотоксическую активности. Таким образом, новые соединения подходят для лечения хронических заболеваний, чувствительных к модуляции PPARg.
VCE-004 (соединение I), предшественник производных CBD-Q с II по X согласно настоящему изобретению, представляет собой агонистический лиганд PPARg, который также активирует фактор транскрипции Nrf2, являющийся клеточным сенсором окислительного/электрофильного стресса, отражающим образование АФК в клетках, обработанных VCE-004. Поэтому длительное лечение данным типом производных CBD-Q, которые активируют путь Nrf2, может привести к прогрессированию опухоли, как было объяснено выше. Кроме того, хроменопиразоледионы (chromenopyrazolediones), которые являются структурными аналогами CBD-Q, вызывают цитотоксичность в клетках рака простаты посредством индукции активных форм кислорода (АФК) и PPARg-зависимых механизмов [Morales et al., 2013]. Таким образом, окисление молекулы CBD позволяет получить класс соединений CBD-Q, таких как, например, VCE-004, которые активируют PPARg, а также вызывают АФК-опосредованную активацию Nrf2.
Такие производные CBD-Q согласно настоящему изобретению отличаются от соединений, описанных Коганом и др. [Kogan et al., 2004] и Моралесом и др. [Morales et al., 2013], так как модификации в положении 3 придают соединениям настоящего изобретения способность активировать PPARg и защищают от глутамат-индуцированной цитотоксичности без активации Nrf2. Кроме того, производные CBD-Q с модификациями в положении 3 также ингибируют TGFb-индуцированную транскрипцию и экспрессию гена коллагена. Соединения, описанные в настоящем изобретении, также отличаются от соединений, описанных в WO 20011117429, которые являются нестабильными, их трудно синтезировать, и их никогда не тестировали на активацию Nrf2. Производные CBD-Q, описанные в настоящем изобретении, также показали удивительно низкую цитотоксичность на клеточных линиях нейронного происхождения по сравнению с VCE-004 (соединение I), известного из уровня техники.
Краткое описание изобретения
Исходя из предшествующего уровня техники, задача настоящего изобретения заключается в создании новых производных каннабидиол-хинона (производных CBD-Q), которые проявляют активность при модуляции PPARg, не вызывая активацию Nrf2 и цитотоксичность.
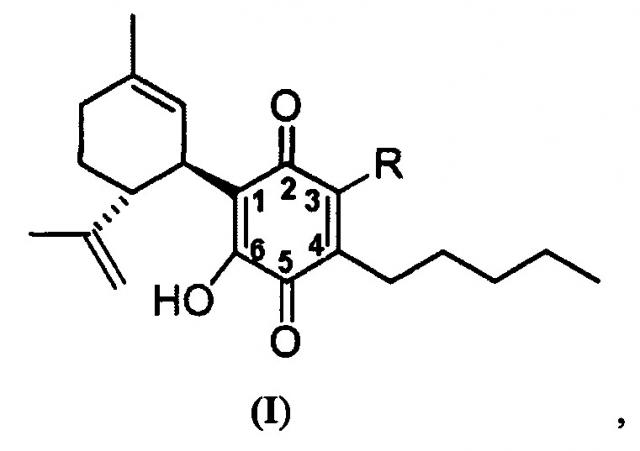
Более конкретно, в настоящем изобретении соединения представляют собой производные каннабидиол-хинона (производные CBD-Q) формулы (I):
где R представляет собой атом углерода линейной или разветвленной группы, представленной: алкильной, арильной, алкенильной, алкинильной, ацильной или алкоксикарбонильной группами; или где R представляет собой атом азота линейной или разветвленной группы, представленной: алкиламинной, ариламинной, алкениламинной или алкиниламинной группами. Кольцо хинона пронумеровано произвольным образом, чтобы показать, в каком положении кольца произведена замена заместителей для визуализации производных CBD-Q настоящего изобретения. Поскольку номенклатура IUPAC могла бы позволить это, нумерацию кольца хинона сохраняли (см. производные формулы II до X, при этом положение 3 указанного кольца хинона являлось положением, где происходили все замены заместителей и номенклатура указанных производных совпадала и отражала данный факт). Однако, когда группы заместителей, связанные в положении 3 кольца хинона, изменяли нумерацию положений вышеуказанного кольца хинона, предписанную номенклатурой IUPAT, применяли результирующую номенклатуру (outcoming nomenclature), хотя только по внешнему виду замена в положении 3 кольца хинона была как будто пропущена, но на самом деле это не так, как это показано с помощью графических формул производных, представленных формулами с XI по XV.
В предпочтительном варианте реализации соединения согласно настоящему изобретению представляют собой соединения формулы (II), (III), (IV), (V), (VI), (VII), (VIII), (X), (XI), (XII), (XIII), (XIV) и (XV).
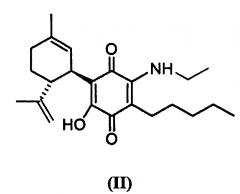
(1'R,6'R)-3-(Этиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R)-3-(Пентиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
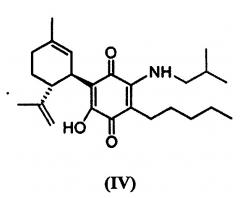
(1'R,6'R)-3-(Изобутиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R)-3-(Бутиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R)-3-(Метиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R)-3-(Изопропиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R)-3-(Бензиламин)-6-гидрокси-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R)-3-(Неопентиламин)-6-гидрокси-3'-метил-)-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
(1'R,6'R) 3-(Изопентиламин)-6-гидроксиамин-3'-метил-4-пентил-6'-(проп-1-ен-2-ил)-[1,1'-би(циклогексан)]-2',3,6-триен-2,5-дион
Метил-4-гидрокси-5-((1R,6R)-3-метил-6-(проп-1-ен-2-ил)циклогекс-2-енил)-3,6-диоксо-2-пентилциклогекса-1,4-диенкарбоксилат
Фенилэтил-4-гидрокси-5-((1R,6R)-3-метил-6-(проп-1-ен-2-ил)циклогекс-2-енил)-3,6-диоксо-2-пентилциклогекса-1,4-диенкарбоксилат
(Е)-3,7-Диметилокта-2,6-диенил-4-гидрокси-5-((1R,6R)-3-метил-6-(проп-1-ен-2-ил)циклогекс-2-енил)-3,6-диоксо-2-пентилциклогекса-1,4-диенкарбоксилат
(1R,4S)-1,7,7-Триметилбицикло[2.2.1]гептан-2-ил-4-гидрокси-5-((1R,6R)-3-метил-6-(проп-1-ен-2-ил)циклогекс-2-енил)-3,6-диоксо-2-пентилциклогекса-1,4-диенкарбоксилат
(1R,2R,4R)-1,5,5-триметилбицикло[2.2.1]гептан-2-ил-4-гидрокси-5-((1R,6R)-3-метил-6-(проп-1-ен-2-ил)циклогекс-2-енил)-3,6-диоксо-2-пентилциклогекса-1,4-диенкарбоксилат
Предшественника VCE-004 (соединение I) для производных CBD-Q с II по X формулы I согласно настоящему изобретению можно легко синтезировать из CBD (ТНС Pharma, Германия; ссылка: THC-1073G-10).
Соединения с XI по XV согласно настоящему изобретению можно синтезировать, используя в качестве исходного вещества природные каннабиноиды CBDA (каннабидиоловая кислота) (ТНС Pharma, Германия; ссылка: ТНС-1232-100), посредством замещения некоторых конкретных радикалов.
Как будет понятно ниже из примеров и графических материалов, модификации в положении 3', содержащиеся в общей формуле I, придают соединениям согласно настоящему изобретению способность активировать PPARg для защиты от глутамат-индуцированной цитотоксичности и ингибировать TGFb-индуцированную выработку коллагена. Данные соединения также показали удивительно низкую цитотоксичность на клеточных линиях нейронного происхождения по сравнению с VCE-004, находящимся на современном уровне техники.
Соединения согласно настоящему изобретению также включают аналоги, производные, таутомерные формы, изомеры, стереоизомеры, полиморфы, фармацевтически приемлемые соли, фармацевтически приемлемые сольваты и их композиции.
В рамках настоящего описания термин "аналог/и" относится к любому объекту, который является структурным производным или гомологичен соединениям формулы (I).
В контексте настоящего изобретения термин "производное/ые" соединений формулы (I) следует интерпретировать как любой аналог CBD-хинона, всегда замещенный в положении 4' и демонстрирующий фармакологические свойства, связанные с этим замещением в положении 4', как это определено в настоящем документе, но при этом указанный аналог также имеет замещенные группы в других положениях молекулы CBD-Q, отличающихся от групп, представленных в указанной формуле (I).
Термин "таутомеры" относится к структурным изомерам органических соединений, которые легко взаимопревращаются химическим способом (таутомеризация).
Термин "изомеры" или "стереоизомеры" относится к соединениям, которые имеют одинаковый химический состав, но различаются расположением атомов или групп в пространстве.
В данном описании термин "полиморф" относится к кристаллическим формам одного и того же химического состава, но с разным пространственным расположением молекул, атомов и/или ионов, образующих кристалл.
Термин "фармацевтически приемлемая соль" относится к любой фармацевтически приемлемой соли, которая при введении пациенту позволяет получить (прямо или косвенно) соединение, как описано в настоящем документе. Такие соли предпочтительно являются кислотно-аддитивными солями с физиологически приемлемыми органическими или неорганическими кислотами. Примеры кислотно-аддитивных солей включают кислотно-аддитивные соли минеральных кислот, такие как, например, гидрохлориды, гидробромиды, гидройодиды, сульфаты, нитраты, фосфаты, и органические кислотно-аддитивные соли, такие как, например, ацетаты, трифторацетаты, малеаты, фумараты, цитраты, оксалаты, сукцинаты, тартраты, малаты, манделаты, метансульфонаты и n-толуолсульфонаты. Примеры аддитивных солей оснований включают неорганические соли, такие как, например, соли натрия, калия, соли кальция и аммония, и органические соли щелочных металлов, такие как, например, этилендиамины, этаноламины, N,N-диалкиленэтаноламины, триэтаноламины и соли основных аминокислот. Тем не менее, следует принимать во внимание, что фармацевтически неприемлемые соли также входят в объем настоящего изобретения, так как их можно применять для получения фармацевтически приемлемых солей. Методики получения солей являются общеизвестными в данной области техники.
Термин "сольват" в соответствии с настоящим изобретением следует понимать как любую форму активного соединения в соответствии с настоящим изобретением, в которой указанное соединение связано нековалентной связью с другой молекулой (обычно с полярным растворителем), включая, в частности, гидраты и алкоголяты.
Еще один вариант реализации настоящего изобретения относится к применению соединений формулы (I) или их производных в качестве лекарственных средств, в частности, как агонистов PPARg для рецепторов PPARg, которые не вызывают активацию Nfr2, в частности, при лечении таких заболеваний, как атеросклероз, воспалительные заболевания кишечника, ревматоидный артрит, фиброз печени, нефропатия, псориаз, заживление ран на коже, регенерация кожи, панкреатит, гастрит, нейродегенеративные расстройства, нейровоспалительные расстройства, склеродермия, рак, гипертония, ожирение, диабет II типа и других заболеваний, которые можно лечить с помощью агонистов PPARg.
Другой вариант реализации настоящего изобретения относится к применению соединений формулы (I) для получения композиции с более низкой цитотоксичностью для лечения заболеваний, связанных с PPRAg, таких атеросклероз, воспалительные заболевания кишечника, ревматоидный артрит, фиброз печени, нефропатия, псориаз, заживление ран на коже, регенерация кожи, панкреатит, гастрит, нейродегенеративные расстройства, нейровоспалительные расстройства, склеродермия, рак, гипертония, ожирение, диабет II типа и других заболеваний, которые можно лечить с помощью агонистов PPARg.
Альтернативный вариант реализации настоящего изобретения относится к применению указанных выше соединений формулы (I) или их производных самих по себе или приготовленных в виде композиций, в частности в виде фармацевтических композиций, которые содержат по меньшей мере одно из соединений согласно настоящему изобретению в сочетании с по меньшей мере другим активным соединением, имеющим кумулятивную или синергическую биологическую активность. В качестве альтернативы, указанные композиции могут быть приготовлены с по меньшей мере одним инертным ингредиентом в качестве носителя или вспомогательного вещества, таким как: сорастворители, поверхностно-активные вещества, масла, увлажняющие вещества, смягчающие вещества, консерванты, стабилизаторы и антиоксиданты. Можно использовать любой фармакологически приемлемый буфер, например, Трис-буфер или фосфатный буфер.
В рамках настоящего описания термины "активное соединение или активный компонент" следует понимать в качестве синонимов, определяющих химическое соединение, которое оказывает терапевтическое воздействие при введении человеку или животному.
Типичные композиции включают в себя соединения согласно настоящему изобретению или их производные, ассоциированные с фармацевтически приемлемыми вспомогательными веществами, которые, в качестве примера, могут быть носителями или разбавителями. Такие композиции могут быть в форме капсулы, саше, бумаги или в другом виде. При изготовлении композиций можно применять обычные способы получения фармацевтических композиций. Например, целевое соединение обычно смешивают с носителем или разбавляют носителем, или заключают в носитель, который может быть в форме ампулы, капсулы, саше, бумаги или в другом виде. Когда носитель служит в качестве разбавителя, он может быть твердым, полутвердым или жидким материалом, который действует как основа, вспомогательное вещество или среда для активного соединения. Целевое соединение может быть адсорбировано на гранулированном твердом объекте (container), например, на саше. Некоторые примеры подходящих носителей представляют собой воду, растворы солей, спирты, полиэтиленгликоли, полигидроксиэтоксилированное касторовое масло, арахисовое масло, оливковое масло, лактозу, каолин, сахарозу, циклодекстрин, амилозу, стеарат магния, тальк, желатин, агар, пектин, аравийскую камедь, стеариновую кислоту или низшие алкиловые эфиры целлюлозы, кремниевую кислоту, жирные кислоты, амины жирных кислот, моноглицериды и диглицериды жирных кислот, сложные эфиры пентаэритрита и жирных кислот, полиоксиэтилен, гидроксиметилцеллюлозу и поливинилпирролидон. Подобным образом, носитель или разбавитель может содержать любой материал с замедленным высвобождением, известный в данной области техники, такой как глицерилмоностеарат или глицерилдистеарат, по отдельности или в смеси с воском. Составы также могут содержать смачивающие агенты, эмульгаторы и суспендирующие агенты, консервирующие агенты, подслащивающие агенты или вкусовые агенты. Составы согласно настоящему изобретению могут быть приготовлены таким образом, чтобы обеспечить быстрое, замедленное или отсроченное высвобождение активного ингредиента после введения пациенту с использованием процедур, хорошо известных в данной области техники.
Фармацевтические композиции могут быть стерилизованы и смешаны, при необходимости, со вспомогательными агентами, эмульгаторами, солями для воздействия на осмотическое давление, буферами и/или красящими веществами и тому подобным, которые не реагируют нежелательным образом с активными соединениями.
Композицию можно применять для лечения заболеваний, таких как атеросклероз, воспалительные заболевания кишечника, ревматоидный артрит, фиброз печени, нефропатия, псориаз, заживление ран на коже, регенерация кожи, панкреатит, гастрит, нейродегенеративные расстройства, нейровоспалительные расстройства, склеродермия, рак, гипертония, ожирение, диабет II типа и других заболеваний, которые можно лечить с помощью агонистов PPARg.
Один предпочтительный вариант реализации настоящего изобретения относится к способу введения, который может представлять собой любой способ, который эффективно доставляет целевое соединение к подходящей или требуемой области воздействия, например, как пероральный, назальный, местный, легочный, чрескожный или парентеральный способ введения, например, ректальный, подкожный, внутривенный, интрауретральный, внутримышечный, интраназальный способ, а также в виде офтальмологический раствора или мази.
Для назального введения препарат может содержать целевое соединение, растворенное или суспендированное в жидком носителе, в частности, в водном носителе, для аэрозольного применения. Носитель может содержать добавки, такие как солюбилизирующие агенты, например, пропиленгликоль, поверхностно-активные вещества, усилители абсорбции, такие как лецитин (фосфатидилхолин), или циклодекстрин, или консерванты, такие как парабены.
Для получения составов для местного применения, целевое соединение помещают в дерматологический носитель, как известно в данной области техники. Количество целевого соединения для введения и концентрация соединения в составе для местного применения будет зависеть от носителя, системы доставки или выбранного устройства, клинического состояния пациента, побочных эффектов и стабильности соединения в составе. Таким образом, лечащий врач назначает соответствующий препарат, содержащий соответствующую концентрацию целевого соединения, и выбирает количество состава для введения в зависимости от клинического опыта работы с конкретным пациентом или с подобными пациентами.
Для офтальмологического применения целевые соединения готовят в виде растворов, суспензий и мазей, подходящих для применения в качестве глазных лекарственных форм. Как правило, в указанных формах концентрации являются такими, как описано выше для препаратов местного применения.
Для перорального введения можно готовить либо твердые, либо жидкие единичные дозированные формы. Для получения твердых композиций, таких как таблетки, целевое соединение можно смешивать с обычными ингредиентами, такими как тальк, стеарат магния, дикальцийфосфат, алюмосиликат магния, сульфат кальция, крахмал, лактоза, аравийская камедь, метилцеллюлоза и функционально подобными фармацевтическими материалами, такими как разбавители или носители.
Капсулы получают смешиванием целевого соединения с инертным фармацевтическим разбавителем и наполнением твердой желатиновой капсулы подходящего размера этой смесью. Мягкие желатиновые капсулы получают механическим капсулированием суспензии соединения с приемлемым растительным маслом, светлым вазелиновым маслом или другим инертным маслом. Можно получать жидкие единичные дозированные формы для перорального введения, такие как сиропы, эликсиры и суспензии. Водорастворимые формы можно растворять в водном носителе вместе с сахаром, ароматизирующими агентами и консервантами с образованием сиропа. Эликсир готовят с применением водно-спиртового (например, этанола) носителя с подходящими подсластителями, такими как сахар и сахарин вместе с ароматизирующими агентами. Суспензии можно получать на водной основе с помощью суспендирующего агента, такого как аравийская камедь, трагакант, метилцеллюлоза и тому подобных.
Составы, подходящие для парентерального применения, очевидны для среднего специалиста в данной области, например, как применение подходящих инъекционных растворов или суспензий. Стерильный состав подходит для различных местного или парентерального способов введения, включая интрадермальный, внутримышечный, внутрисосудистый и подкожный.
В дополнение к целевому соединению, в зависимости от состава и требуемого способа доставки, композиции могут содержать фармацевтически приемлемые, нетоксичные носители или разбавители, которые включают основы, обычно применяемые для образования фармацевтических композиций для введения животным или людям. Разбавитель выбирают таким образом, чтобы сильно не влиять на биологическую активность комбинации.
Примерами таких разбавителей, которые особенно подходят для инъекционных составов, являются вода, различные солевые растворы, растворы органических или неорганических солей, раствор Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или состав может содержать добавки, такие как другие носители; адъюванты; или нетоксичные, нетерапевтические, неиммуногенные стабилизаторы и тому подобное.
Кроме того, в композиции могут содержаться вспомогательные вещества. Примеры включают сорастворители, поверхностно-активные вещества, масла, увлажнители, смягчающие вещества, консерванты, стабилизаторы и антиоксиданты. Можно применять любой фармакологически приемлемый буфер, например, Трис-буфер или фосфатный буфер. Эффективными количествами разбавителей, добавок и вспомогательных веществ являются те количества, которые эффективны для получения фармацевтически приемлемого состава с точки зрения растворимости, биологической активности и т.д.
Целевое соединение может быть включено в микросферы. Целевое соединение может быть помещено в альбуминовые микросферы, из которых можно получить такие микросферы в виде сухого порошка для назального введения. Другие материалы, пригодные для получения микросфер, включают агар, альгинат, хитозан, крахмал, гидроксиэтилкрахмал, альбумин, агарозу, декстран, гиалуроновую кислоту, желатин, коллаген и казеин. Микросферы можно получать различными способами, известными специалистам в данной области техники, например, такими как процесс распылительной сушки или процесс эмульгирования.
Например, альбуминовые микросферы можно получить путем добавления кроличьего сывороточного альбумина в фосфатном буфере в оливковое масло при перемешивании с получением эмульсии вода в масле. Затем в эмульсию добавляют раствор глутарового альдегида и перемешивают эмульсию до сшивки альбумина. Затем микросферы можно выделить с помощью центрифугирования, удалить масло и промыть микросферы, например, с помощью с петролейного эфира, а затем этанола. И, наконец, микросферы можно просеять, собрать и высушить с помощью фильтрации.
Крахмальные микросферы можно получить путем добавления теплого водного раствора крахмала, например, картофельного крахмала, к нагретому раствору полиэтиленгликоля в воде при перемешивании с образованием эмульсии. После образования двухфазной системы (с раствором крахмала в качестве внутренней фазы) далее смесь охлаждают до комнатной температуры при перемешивании, после чего внутренняя фаза превращается в гелевые частицы. Затем эти частицы отфильтровывают при комнатной температуре и суспендируют в растворителе, таком как этанол, после чего эти частицы снова отфильтровывают и оставляют высыхать на воздухе. Микросферы можно делать более твердыми с помощью хорошо известных процедур сшивки, таких как термическая обработка или применение химических сшивающих агентов. Подходящие агенты включают диальдегиды, включая глиоксаль, малоновый диальдегид, янтарный альдегид, адипиновый альдегид, глутаровый альдегид и фталевый альдегид, дикетоны, такие как бутадион, эпихлоргидрин, полифосфаты и бораты. Диальдегиды применяют для поперечной сшивки белков, таких как альбумин, путем взаимодействия с аминогруппами, и дикетонами из оснований Шиффа с аминогруппами. Эпихлоргидрин активирует соединения с нуклеофилами, такими как амино или гидроксил с образованием эпоксидного производного.
Другой предпочтительный вариант реализации настоящего изобретения представляет собой схему приема лекарственного средства. Термин "стандартная лекарственная форма" относится к физически дискретным единицам, пригодным в качестве единичных доз для субъектов, например млекопитающих, таких как люди, собаки, кошки и грызуны, причем каждая единица содержит заданное ко