Аналитическая тест-система по определению чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии
Иллюстрации
Показать всеИзобретение относится к области молекулярной биологии, медицины и онкологии. Предложена аналитическая тест-система для определения чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии на основе мультиплексной ПЦР в режиме реального времени, включающая в себя список генов-маркеров CD74, CFI, CSF3, DNAJC24, FGF5, HCFC2, ИСК, IL15, IL1RAPL2, IL8, ITGA7, LEPR, MAP3K13, MAPKAPK3, MDK, PDGFRA, PDIK1L, PIK3CA, S100PBP, SCARB2, STK4, ТМЕМ54, TNFAIP6, TNFRSF1B, TRAF4 и тканеспецифичных референсных генов-хаускиперов GAPDH, АСТВ, RPN1, GUSB, инструкцию, планшеты для проведения ПЦР и смесь для амплификации. Изобретение позволяет провести анализ в короткий срок и с небольшими материальными затратами. 1 з.п. ф-лы, 1 ил., 4 табл., 2 пр.
Реферат
Область техники, к которой относится изобретение
Изобретение относится к области молекулярной биологии, медицины, онкологии и касается аналитической тест-системы для определения чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии и подбора оптимального для терапии штамма онколитического вируса посредством определения в клетках опухоли уровня экспрессии генов-маркеров чувствительности к онколитическим вирусам методом мультиплексной ПЦР в режиме реального времени.
Уровень техники
Для широкомасштабного внедрения онколитической биотерапии в клинике требуется решить проблему непредсказуемости терапевтического действия и, как следствие, - пока еще мало впечатляющих результатов клинических испытаний. С одной стороны, у части пациентов наблюдается впечатляющий терапевтический эффект вплоть до полного выздоровления, а с другой - у многих пациентов данный штамм может вообще не оказывать действия, в то время как он может быть эффективным при лечении опухоли другого пациента. Причина таких различий кроется в особенностях опухолей разных пациентов, когда раковые клетки могут либо экспрессировать все необходимые для вирусного цикла клеточные компоненты (например, рецепторы для проникновения вируса, или факторы, способствующие образованию и выходу из клетки инфекционных вирионов, тем самым обеспечивая дальнейшие циклы заражения опухолевых клеток до их полного уничтожения), либо не экспрессировать, и в этом случае опухоль оказывается к данному штамму нечувствительна.
Восприимчивость опухолевых клеток к вирусам обусловлена также подавлением врожденного иммунитета, в частности интерфероновой системы [Gollamudi R., Ghalib М.Н., Desai K.K., Chaudhary I., Wong В., Einstein M., Coffey M., Gill G.M., Mettinger K., Mariadason J.M., et al. 2010. Intravenous administration of Reolysin, a live replication competent RNA virus is safe in patients with advanced solid tumors. Invest New Drugs. 28, 641-649]. В основе утраты этих механизмов лежит, по-видимому, тот факт, что при утрате функции гена р53, которая происходит в большинстве опухолей, происходит активация экспрессии транспозонов, синтез самокомплементарных транскриптов и индукции интерферона, что тормозит рост злокачественных клеток [Haseley A., Alvarez-Breckenridge С., Chaudhury A.R., Kaur В. 2009. Advances in oncolytic virus therapy for glioma. Recent Pat CNS Drug Discov. 4, 1-13]. Преодоление этого блока достигается инактивацией систем индукции интерферона и/или интерферонового ответа, что делает клетки чувствительными к вирусной инфекции. Врожденный противовирусный иммунитет обеспечивается функцией нескольких многокомпонентных сигнальных путей, которые в клетках разного тканевого происхождения функционируют в различающихся режимах. Поэтому и генетические повреждения, приводящие к их утрате, могут проявляться во множестве звеньев этих сигнальных путей. В зависимости от характера этих повреждений чувствительность данной опухоли к вирусам может сильно различаться, что сказывается на эффективности терапии [Stojdl, D.F., Lichty, В., Knowles, S., Marius, R., Atkins, H., Sonenberg, N. & Bell, J.C. (2000) Exploiting tumor-specific defects in the interferon pathway with a previously unknown oncolytic virus. Nature Medicine 6, 821-825].
Идентификация новых биомаркеров, сопряженных с реакцией опухолевых клеток на биотерапию, - новая зарождающаяся область биомедицинских исследований, которая создает основу для персонифицированной медицины. Ранее такие задачи не ставились, поскольку исследователи сосредотачивались на разработке отдельных штаммов онколитических вирусов, испытании их эффективности и механизмов действия. При этом исследователи не ставили вопрос о прогнозировании действия. Хотя для многих онколитических вирусов показана связь с экспрессией или дефектами некоторых молекул.
Например, для вируса болезни Ньюкасла (NDV) показано, что он предпочтительно реплицируется в Rac1-активированных клетках. После проникновения в клетку NDV вирус взаимодействует с Rac1, реорганизует актин в синцитиальной клетке, который участвует в процессе репликации. В конечном счете, внутриклеточное напряжение принуждает зараженную клетку глиомы подвергнуться некрозу [Puhlmann J., Puehler F., Mumberg D., Boukamp P., Beier R. 2010. Racl is required for oncolytic NDV replication in human cancer cells and establishes a link between tumorigenesis and sensitivity to oncolytic virus. Oncogene. 29, 2205-2216].
А для парвовирусов необходимо, чтобы клетка находилась строго в S-фазе клеточного цикла, когда возможна амплификация их генома [Rommelaere, J. & Tattershall, P. (1990). Oncosuppression by parvoviruses, pp. 41-57. In Handbook of Parvoviruses. Edited by P. Tijssen. Boca Raton, FL: CRC Press]. В то же время, реовирус и вирус везикулярного стоматита (VSV) являются РНК-содержащими вирусами и сами кодируют белки, необходимые для репликации собственного генома, что делает их независимыми от S-фазы, но добавляет им дополнительную стадию, предшествующую репликации, - трансляцию и сопряженные с ней проблемы антивирусной защиты клетки. Снятие блока, препятствующего трансляции, происходит при активации ras-пути [Strong, J.Е., Coffey, М.С., Tang, D., Sabinin, P. & Lee, P.W.K. (1998). The molecular basis of viral oncolysis: usurpation of the Ras signaling pathway by reovirus. EMBO Journal 12, 3351-3362], что дает частичное обоснование этой селективности по отношению к трансформированным клеткам. VSV чрезвычайно чувствителен к IFN-опосредованным противовирусным эффектам и зависит от клеток, которые имеют неисправный EFN-путь, что делает репликацию возможной [Stojdl, D.F., Lichty, В., Knowles, S., Marius, R., Atkins, H., Sonenberg, N. & Bell, J.C. (2000) Exploiting tumor-specific defects in the interferon pathway with a previously unknown oncolytic virus. Nature Medicine 6, 821-825].
Некоторые клеточные факторы способствуют вирулентности, как правило, они участвуют в повышении транскрипции вирусных генов, содействуют слиянию вируса с клеткой и запускают сильные воспалительные реакции. Клеточные факторы, такие как белок теплового шока 72 (heat-shock protein 72, hsp72), nectin 1, TLR-2 и TLR-3 являются детерминантами вирулентности для вируса кори (MV), вируса осповакцины (VV) и вируса простого герпеса - 1 (HSV-1) соответственно [Carsillo Т, Traylor Z, Choi С, Niewiesk S, Oglesbee M. Hsp72, a host determinant of measles virus neurovirulence. J Virol 2006; 80:11031-9; Hutchens M, Luker KE, Sottile P, Sonstein J, Lukacs NW, Nunez G, et al. TLR3 increases disease morbidity and mortality from vaccinia infection. J Immunol 2008; 180:483-91; Kopp SJ, Banisadr G, Glajch K, Maurer UE, Grunewald K, Miller RJ, et al. Infection of neurons and encephalitis after intracranial inoculation of herpes simplex virus requires the entry receptor nectin-1. Proc Natl Acad Sci USA 2009; 106:17916-20]. Hsp72 может быть индуцирован физиологическими возбудителями, такими, как, например лихорадка, и он критичен для репликации VV [Hung JJ, Chung CS, Chang W. Molecular chaperone Hsp90 is important for vaccinia virus growth in cells. J Virol 2002; 76(3):1379-90], HSV-1 [Tanguy Le Gac N, Boehmer PE. Activation of the herpes simplex virus type-1 origin-binding protein (UL9) by heat shock proteins. J Biol Chem 2002; 277(7):5660-6], VSV [Qanungo KR, Shaji D, Mathur M, Banerjee AK. Two RNA polymerase complexes from vesicular stomatitis virus-infected cells that carry out transcription and replication of genome RNA. Proc Natl Acad Sci USA 2004; 101(16):5952-7] и MV [Vasconcelos DY, Cai XH, Oglesbee MJ. Constitutive overexpression of the major inducible 70 kDa heat shock protein mediates large plaque formation by measles virus. J Gen Virol 1998; 79(Pt 9):2239-47].
Таким образом, на сегодняшний день, исходя из уровня техники, существует потребность в создании подобных аналитических тест-систем для определения чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии и подбора оптимального для терапии штамма онколитического вируса посредством определения в клетках опухоли уровня экспрессии генов-маркеров чувствительности к виротерапевтическим агентам.
Раскрытие сущности изобретения
Сущность изобретения заключается в обеспечении способа определения чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии и подбора оптимального для терапии штамма онколитического вируса. Для решения этой задачи была создана аналитическая тест-система для определения уровней экспрессии генов-маркеров чувствительности к онколитическим вирусам методом мультиплексной ПЦР.
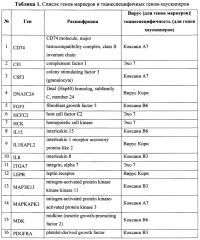
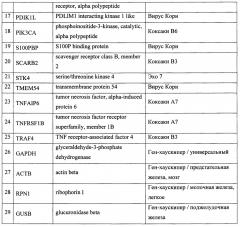
Основным признаком данного изобретения является список генов, состоящий из генов-маркеров чувствительности злокачественных опухолей к онколитическим вирусам и референсных генов-хаускиперов, специфичных для злокачественных новообразований определенного гистогенеза (опухоли мозга, легкого, предстательной, молочной и поджелудочной желез). Список генов для ПЦР приведен в табл. 1, №:1-25 для генов-маркеров, №:26-29 для генов-хаускиперов.
Второй важный признак изобретения - праймеры для амплификации генов, список которых приведен в табл. 1, и олигонуклеотидные зонды, меченные флуоресцентными метками для детекции продуктов амплификации. Последовательности специфических праймеров и олигонуклеотидных зондов приведены в табл. 2 и перечне последовательностей SEQ ID NO: 1-87.
Третий важный признак изобретения - разделение генов маркеров на группы с целью совместного анализа в мультиплексной схеме ПЦР в режиме реального времени с целью повышения воспроизводимости результатов и сокращения времени проведения процедуры. Схема разделения на группы генов приведена на Фиг. 1.
Определение уровня экспрессии генов маркеров, которые вошли в список, приведенный в табл. 1, №:1-25, в образцах злокачественных опухолей позволяет проводить прогноз чувствительности данной опухоли к различным онколитическим вирусам, тем самым позволяет проводить персонифицированный подбор противоопухолевой вирусной терапии. Для нормирования результатов используется совместное определение уровня экспрессии генов маркеров с тканеспецифичными генами-хаускиперами (табл. 1, №:26-29).
Для определения уровня экспрессии генов маркеров и генов «домашнего хозяйства, список которых приведен в табл. 1, №:1-29, проводится ПЦР в режиме реального времени с использованием набора специфических праймеров для амплификации участков генов и олигонуклеотидных зондов, меченных парой флуорофор-гаситель, для детекции продуктов амплификации. Последовательности праймеров и зондов представлены в табл. 2 и перечне последовательностей SEQ ID NO: 1-87.
Краткое описание чертежей и таблиц
Фиг. 1. Схема разделения списка определяемых генов на группы для совместного определения путем проведения мультиплексной ПЦР. Над чертой представлены гены-маркеры, а под чертой указан(ы) ген(ы) - хаускипер(ы), если генов несколько, это означает, что ген-хаускипер тканеспецифичен и его следует выбирать в зависимости от типа исследуемой ткани. В нижней части лунки указан примерный размер ампликона (п.о.).
Таблица 1. Список генов-маркеров и тканеспецифичных генов-хаускиперов, определяемых с помощью аналитической тест-системы. В первом столбце указано сокращенное название гена, а во втором - полное, в третьем столбце для гена-маркера соответствующий ему вирус, а для гена-хаускипера - тканеспецифичность.
Таблица 2. Праймеры для амплификации генов маркеров, генов-хаускиперов и олигонуклеотидные зонды для детекции продуктов амплификации. Для каждого из праймеров и зондов приведена информация о определяемом гене, их последовательность, температура отжига и GC-состав.
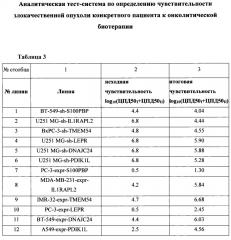
Таблица 3. Изменение онколитических свойств вируса кори в отношении линий с модифицированной экспрессией генов-биомаркеров. В таблице представлены результаты изучения способности вируса кори селективно убивать и реплицироваться на модельных линиях опухолевых клеток с нормальной (столбец 3) и модифицированной (столбец 4) экспрессией генов-маркеров (S100PBP, IL1RAPL2, ТМЕМ54, LEPR, DNAJC24, PDIK1L), где sh - линии с подавленной экспрессией генов; expr - линии с гиперэкспрессией генов.
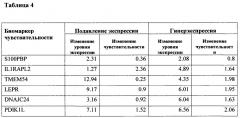
Таблица 4. Взаимосвязь изменения экспрессии биомаркеров и изменения чувствительности к самонацеливающемуся штамму вируса кори.
Осуществление изобретения
Задача настоящего изобретения состоит в создании способа определения чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии и подбора оптимального для терапии штамма онколитического вируса.
Для определения чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии были выбраны гены-маркеры, определение экспрессии которых позволяет прогнозировать чувствительность опухоли к различным онколитическим вирусам. Выбор генов-маркеров чувствительности к различным онколитическим вирусам производился на основе биоинформатического анализа результатов транскриптомного секвенирования, а затем для функциональной оценки значимости выбранных маркеров было проведено изучение репликативной способности различных онколитических вирусов при размножении в модельных культурах злокачественных опухолей человека с искусственно модифицированной экспрессией, выявленных биомаркеров in vitro. Окончательный список генов приведен в табл. 1. Оптимальное нормирование результатов осуществляется путем определения уровня экспрессии референсных тканеспецифичных генов-хаускиперов.
Для обеспечения оптимальных условий ПЦР необходимо использовать специфические праймеры для амплификации и специфические олигонуклеотидные зонды для детекции продуктов амплификации. Выбор последовательности праймеров для проведения ПЦР, является важнейшим этапом разработки тест-системы. К праймерам для ПЦР в режиме реального времени выдвигались следующие основные требования:
- длина - 18-30 п.н
- GC-состав - 40-60%
- температура отжига (Тт) - 50-65°С
- длина ампликона - 90-150 п.н.
Также желательно, чтобы Тт праймеров была близка между собой, в то же время температура плавления зондов должна быть на 5-10°С выше (при этом примерно одинакова для всех зондов). Это условие диктуется необходимостью взаимодействия зонда с ампликоном до того, как полимераза начнет синтезировать комплементарную цепь ДНК. Только в этом случае будет обеспечено эффективное разрушение зонда за счет 5'-экзонуклеазной активности Taq-полимеразы (пик 5'-экзонуклеазной активности - около 60°С). Для исключения возможности формирования димеров праймеров как минимум четыре 3'-концевых нуклеотида не должны быть комплементарны самому праймеру, праймеру в паре или зонду. Желательно, чтобы последовательность не содержала повторов и протяженных участков из одного типа нуклеотидов (более 4-5 азотистых оснований одного типа подряд). В результате проведения работ были подобраны специфические праймеры и зонды, отвечающие приведенным выше требованиям, соответствующие последовательности приведены в табл. 2 и перечне последовательностей SEQ ID NO: 1-183.
Для обеспечения мультиплексного формата ПЦР было проведено компьютерное моделирование взаимодействия всех праймеров и зондов с последовательностями кДНК и между собой. Кроме этого, была исключена возможность неспецифической гибридизации (с использованием сервиса www.blast.ncbi.nlm.nih.gov/Blast.cgi) для предотвращения получения ложноположительных результатов. Все определяемые гены были объединены в группы для совместного определения, схема представлена на фиг. 1. Концентрации каждой пары праймеров и флуоресцентных зондов определялись эмпирически.
Приведем последовательность анализа с использованием данной аналитической тест-системы. Выделение РНК проводится на специальных колонках. Затем на матрице РНК проводится синтез кДНК с использованием олиго(дТ) праймеров и обратной транскриптазы M-MLV.
Для проведения мультиплексной ПЦР в режиме реального времени проводится в 96-луночном планшете, в лунках которого лиофилизированы специфические праймеры и флуоресцентные олигонуклеотидные зонды. В лунки планшета вносится образцы кДНК и смесь для амплификации, содержащая Taq-полимеразу в соответствующем буфере и смесь дНТФ (дАТФ, дГТФ, дЦТФ, дТТФ).
Для синтеза праймеров и олигонуклеотидных зондов используют фосфоамидитный синтез с помощью автоматических ДНК/РНК синтезаторов.
Для детекции используются олигонуклеотидные зонды, меченные следующими парами флуорофоров и тушителей:
- FAM-BHQ1 (492/518 нм);
- TAMRA-BHQ2 (553/580 нм);
- JOE-BHQ1 (520/548 нм);
- Су5-BHQ2 (643/672 нм).
Амплификаторы, которые могут быть использованы для проведения анализа, должны содержать соответствующие каналы детекции, например следующие амплификаторы: StepOnePlus ("AppliedBiosystems", США), Bio-RadCFX96 ("BioRad", США), Rotor-GeneQ («QIAGEN», Германия) и LightCycler® 96 Real-Time PCR System («RocheDiagnostics», Швейцария).
Описание алгоритма автоматического анализа данных выходит за рамки данного изобретения. Далее приводятся примеры, которые показывают применение созданной аналитической тест-системы. Следует понимать, что приводимые примеры служат исключительно для иллюстрации и не предназначены для ограничения объема притязаний, выраженных в формуле изобретения. На основании настоящего описания специалист в данной области сможет легко предложить свои варианты и модификации осуществления изобретения, не отходя от общей концепции настоящего изобретения и без привлечения собственной изобретательской деятельности, так что должно быть понятно, что такие варианты и модификации также будут входить в объем притязаний настоящего изобретения.
Примеры осуществления изобретения
Пример 1. Верификация взаимосвязи генных маркеров с чувствительностью к онколитическому вирусу кори путем подавления и гиперэкспрессии соответствующих генов
Методом лентивирусной трансдукции был получен ряд модельных линий с измененной экспрессией (подавлением и гиперэкспрессией) генов-маркеров чувствительности к панели онколитических вирусов. Для функциональной оценки значимости следующих генов-маркеров: S100PBP, IL1RAPL2, ТМЕМ54, LEPR, DNAJC24, PDIK1L, было проведено изучение репликативной способности онколитического вируса кори при размножении в модельных культурах злокачественных опухолей человека с искусственно модифицированной экспрессией выявленных биомаркеров in vitro. В таблице 3 представлены результаты изучения способности вируса кори селективно убивать и реплицироваться на модельных линиях опухолевых клеток с нормальной (столбец 3) и модифицированной (столбец 4) экспрессией генов-маркеров (S100PBP, IL1RAPL2, ТМЕМ54, LEPR, DNAJC24, PDIK1L). В таблице 4 представлены данные, отражающие взаимосвязь изменения экспрессии отдельного биомаркера и связанное с этим изменение чувствительности к вирусу. Было показано, что изменение уровня экспрессии всех генов-маркеров влияет на онколитические свойства вируса кори, но наиболее значительное влияние (изменение чувствительности ~ на 2 порядка) обнаружено при подавлении экспрессии гена IL1RAPL2 и гиперэкспрессии генов ТМЕМ54, LEPR, DNAJC24, PDIK1L.
Пример 2.
Образцы опухолей получали из Национального медицинского исследовательского радиологического центра, часть образца помещали в раствор RNAlater и выделяли из нее РНК с помощью набора RNAqueous-96 kit (Ambion), а из второй части образца получали первичные культуры. Затем на матрице РНК синтезировали кДНК с помощью набора Mint (Евроген). кДНК использовали для анализа экспрессии генов-маркеров с помощью данной аналитической тест-системы. Полученные первичные культуры тестировали на чувствительность к онколитическим вирусам.
Всего было получено и протестировано 67 образцов опухолей различного гистогенеза. Полученные данные ПЦР соответствовали результатам тестирования первичных линий на чувствительность к вирусам in vitro.
Аналитические тест-системы по определению чувствительности злокачественной опухоли конкретного пациента к онколитической биотерапии
Таблица 2. Последовательности праймеров для амплификации и олигонуклеотидных зондов для детекции продуктов амплификации
| SEQ ID NO | Название гена | Длина ампликона (п.н.) и GC-состав, % | Тип олигонуклеотида | Нуклеотидная последовательность 5' ^ 3' | Длина, п.н. | Температура отжига, °С | GC состав, % |
| 1 | CD74 | 197 (60) | Прямой праймер | ACAAACTGACAGTCACCTCC | 20 | 56 | 50 |
| 2 | Обратный праймер | GTGCATCACATGGTCCTCTG | 20 | 56 | 5 | ||
| 3 | Зонд | TTCCCAAGCCTCCCAAGCCTGTGAGCAA | 28 | 67 | 57 | ||
| 4 | CFI | 190 (42) | Прямой праймер | GTGAGGTGGACTGCATTACA | 20 | 55 | 50 |
| 5 | Обратный праймер | AAGGAAACGAATTGTGGGAGG | 20 | 56 | 48 | ||
| 6 | Зонд | GTTGGCTGTGCAGGCTTTGCATCTGTG | 27 | 66 | 56 | ||
| 7 | CSF3 | 193 (65) | Прямой праймер | AGTTGGGTCCCACCTTGG | 18 | 56.5 | 61 |
| 8 | Обратный праймер | TCCAGGAAGCTCTGCAGAT | 19 | 55.5 | 53 | ||
| 9 | Зонд | GCAGATGGAAGAACTGGGAATGGCCCC | 27 | 66 | 59 | ||
| 10 | DNAJC24 | 178(39) | Прямой праймер | ATGATGGCGGTTGAGCAG | 18 | 56 | 56 |
| 11 | Обратный праймер | TGAACTTCTGTACACATTCCTCC | 23 | 55 | 43 | ||
| 12 | Зонд | GGGAGCAGACCCATCTGCAAATATATCAGACCT | 33 | 65 | 48 | ||
| 13 | FGF5 | 195 (62) | Прямой праймер | ACTGATAGGAACCCTAGAGGC | 21 | 56 | 52 |
| 14 | Обратный праймер | GCAGATGGAAACCGATGCC | 19 | 56.5 | 58 | ||
| 15 | Зонд | CTTGGAGCAGAGCAGTTTCCAGTGGAGC | 28 | 65 | 57 | ||
| 16 | HCFC2 | 174 (44) | Прямой праймер | AACACGGCTACGAATCAGTG | 20 | 56 | 50 |
| 17 | Обратный праймер | CCATAACCAACGACTTGCTTGTA | 23 | 56 | 43 | ||
| 18 | Зонд | CTGCCCATGGATTTGTCTGTGATGGTACCAG | 31 | 65 | 52 | ||
| 19 | HCK | 179 (56) | Прямой праймер | ATCCGGGATAGCGAGACC | 18 | 56 | 61 |
| 20 | Обратный праймер | CCCTTCTTGTAGTGGTCCAC | 20 | 55 | 55 | ||
| 21 | Зонд | TTTGTCCGTGCGAGACTACGACCCTCG | 27 | 66 | 59 | ||
| 22 | IL15 | 190 (37) | Прямой праймер | TTGGGAACCATAGATTTGTGCAG | 23 | 56 | 43 |
| 23 | Обратный праймер | AGAGAAAGCACTTCATTGCTGTT | 23 | 56 | 39 | ||
| 24 | Зонд | GCTTCCTAAAACAGAAGCCAACTGGGTGAATGT | 33 | 65 | 45 | ||
| 25 | IL1RAPL2 | 175 (42) | Прямой праймер | AGAGTCTGGGCCAATGATCTA | 21 | 55 | 48 |
| 26 | Обратный праймер | GCAGGTATAATTCGCCAGGT | 20 | 56 | 50 | ||
| 27 | Зонд | GGTGAAATAAGGCTTCTCAAAGAGCATCTTGGAG | 34 | 64 | 44 | ||
| 28 | IL8 | 186 (44) | Прямой праймер | TGCCAAGGAGTGCTAAAGAAC | 21 | 56 | 48 |
| 29 | Обратный праймер | TCTGCACCCAGTTTTCCTT | 19 | 55 | 47 | ||
| 30 | Зонд | CTGAGAGTGATTGAGAGTGGACCACACTGCG | 31 | 66 | 55 | ||
| 31 | ITGA7 | 193 (58) | Прямой праймер | CTGACTCCATGTTCGGGATC | 20 | 55 | 50 |
| 32 | Обратный праймер | TAGCCGAAGCTCTTGATGC | 19 | 56 | 53 | ||
| 33 | Зонд | CTTTCCAGATATTGCAGTGGGTGCCCCC | 28 | 66 | 57 | ||
| 34 | LEPR | 192 (41) | Прямой праймер | CTTGTGTGCAGTCTATGCTGT | 21 | 56 | 48 |
| 35 | Обратный праймер | GGCTTCCAAAGTAAAGTGACATT | 23 | 55 | 39 | ||
| 36 | Зонд | ATTGGAGCAATCCAGCCTACACAGTTGTCATG | 32 | 65 | 47 | ||
| 37 | MAP3K13 | 184 (43) | Прямой праймер | AAGTCTCAGGCTGAATGGAG | 20 | 55 | 50 |
| 38 | Обратный праймер | CCATGTATAAATTATTCGCCCGC | 23 | 56 | 43 | ||
| 39 | Зонд | GAAGAACTGATTCGAAGGCGCAGAGAAGAGCTC | 33 | 66 | 52 | ||
| 40 | MAPKAPK3 | 160 (48) | Прямой праймер | AGATAATGCGGGATATTGGCAC | 22 | 56 | 45 |
| 41 | Обратный праймер | GCATTTTGGGTGGTCTCCTTA | 21 | 56 | 48 | ||
| 42 | Зонд | AAGGAGAAAGACGCAGTGCTTAAGCTCACC | 30 | 65 | 50 | ||
| 43 | MDK | 184 (67) | Прямой праймер | GCGGTCGCCAAAAAGAAAG | 19 | 56 | 53 |
| 44 | Обратный праймер | CAAACTCCTTCTTCCAGTTGCA | 22 | 56 | 45 | ||
| 45 | Зонд | AGCGAGTGCGCTGAGTGGGC | 20 | 66 | 70 | ||
| 46 | PDGFRA | 193 (48) | Прямой праймер | TTGAAGGCAGGCACATTTACA | 21 | 56 | 43 |
| 47 | Обратный праймер | TGTCTGCTGTCGTAGGAGG | 19 | 56 | 58 | ||
| 48 | Зонд | TTCTGCCATTATACCTTGTCGCACAACTGATCC | 65 | 33 | 45 | ||
| 49 | PDIK1L | 168 (40) | Прямой праймер | GATGTCCCACGGCTCTAATTC | 21 | 56 | 52 |
| 50 | Обратный праймер | TTACGATTGGGTTTCCTGGAC | 21 | 55 | 48 | ||
| 51 | Зонд | TGATCCCAGAAGCGCCTATTATTTGTGGTTTGTG | 34 | 65 | 44 | ||
| 52 | PIK3CA | 167 (41) | Прямой праймер | AGTAGGCAACCGTGAAGAAAAG | 22 | 56 | 45 |
| 53 | Обратный праймер | GAGGTGAATTGAGGTCCCTAAGA | 23 | 56 | 48 | ||
| 54 | Зонд | TTGCTATCGGCATGCCAGTGTGTGAATT | 28 | 65 | 46 | ||
| 55 | S100PBP | 196 (45) | Прямой праймер | TGAAGGGATCAGCCCCAATA | 20 | 56 | 50 |
| 56 | Обратный праймер | TTGACTTGTGTGAACCACCAT | 21 | 55 | 43 | ||
| 57 | Зонд | TGCCTGACAGTGAGAACCCTACGTCTGTATTC | 32 | 65 | 50 | ||
| 58 | SCARB2 | 143 (42) | Прямой праймер | AGATGGAGATTCTTTTCACCCAC | 23 | 55 | 43 |
| 59 | Обратный праймер | CAGGAACTTTATACCGAAAGGCA | 23 | 56 | 43 | ||
| 60 | Зонд | TGTCTTCCCATCTGACTTTTGCAGGTCAGTGT | 32 | 65 | 47 | ||
| 61 | STK4 | 191 (51) | Прямой праймер | GGATTCTGGCACGATGGTT | 19 | 56 | 53 |
| 62 | Обратный праймер | GCATGGTCTCATCCCTTCTTTT | 22 | 56 | 45 | ||
| 63 | Зонд | GCCAGCACCATGACTGATGGAGCCAATAC | 29 | 66 | 55 | ||
| 64 | TMEM54 | 173 (59) | Прямой праймер | GGGCCATGTGAGCTTCAT | 18 | 56 | 56 |
| 65 | Обратный праймер | GGTAGCGTGACAACACGAT | 19 | 56 | 53 | ||
| 66 | Зонд | CTCAAGATGCGGTGGCTCTGCAGTACTG | 28 | 65 | 57 | ||
| 67 | TNFAIP6 | 141 (50) | Прямой праймер | TCTGGCAAATACAAGCTCACC | 21 | 56 | 48 |
| 68 | Обратный праймер | GCCCTTAGCCATCCATCC | 18 | 56 | 61 | ||
| 69 | Зонд | GGCGGCCATCTCGCAACTTACAAGC | 25 | 66 | 60 | ||
| 70 | TNFRSF1B | 178 (57) | Прямой праймер | CGGGCCAACATGCAAAAG | 18 | 56 | 56 |
| 71 | Обратный праймер | CAGATGCGGTTCTGTTCCC | 19 | 56 | 58 | ||
| 72 | Зонд | TCTGGAACTGGGTTCCCGAGTGCTTGAG | 28 | 66 | 57 | ||
| 73 | TRAF4 | 204(60) | Прямой праймер | CAGGAGAGTGTCTACTGTGAGAA | 23 | 56 | 48 |
| 74 | Обратный праймер | AGTGCCCACACCACATTG | 18 | 56 | 56 | ||
| 75 | Зонд | CG |