Соединения, образующие пролекарства
Иллюстрации
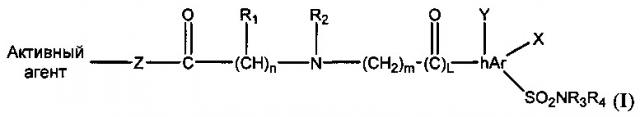
Показать всеИзобретение описывает соединения-пролекарства, имеющие общую структуру: Активный агент - (кислота)-(линкер) - SO2NR1R2:
где R1 представляет собой Н, С1-С12алкил или С1-С12алкилС6-С10арил; hAr представляет собой С6-С10арил или 5-7-членное моноциклическое гетероциклическое кольцо или 7-10-членное бициклическое гетероциклическое кольцо, содержащее 1-4 гетероатома, выбранных из N, О и S; R2 представляет собой Н или С1-С12алкил; R1 и R2 могут быть объединены с образованием 3-7-членного кольца, содержащего до одного гетероатома; каждый R3 и R4 независимо представляет собой Н или С1-С12алкил; X и Y представляют собой Н; Z представляет собой О; и активный агент представляет собой андроген, эстроген или прогестин. Соединения, имеющие указанную общую структуру (1), имеют более высокую активность при пероральном введении по сравнению с немодифицированной исходной молекулой. 2 н. и 15 з.п. ф-лы, 3 табл.
Реферат
УРОВЕНЬ ТЕХНИКИ
1. Область техники
Изобретение в целом относится к производным биологически активных молекул, которые имеют более высокую биодоступность при пероральном введении и, соответственно, обладают более высокой биологической активностью по сравнению с исходным биологически активным лекарственным средством.
2. Описание уровня техники
Множество эндогенных веществ, природных продуктов и синтетических веществ, обладающих полезными терапевтическими свойствами, при пероральном введении имеют высокий эффект «первого прохождения». Это означает, что указанные молекулы быстро подвергаются метаболизму или выводятся из организма, и, соответственно, для обеспечения целевого биологического эффекта требуется применение относительно высоких доз.
Типовые соединения, обладающие высоким эффектом первого прохождения, представляют собой половые стероиды, такие как эстрогены и андрогены. Например, естественные гормоны эстрадиол и тестостерон имеют низкую биодоступность при пероральном введении, что значительно ограничивает их применение.
Для преодоления указанного недостатка на протяжении многих лет проводятся обширные исследования.
Традиционные сложные эфиры, такие как эстрадиол-17-бензоат, или сложные эфиры жирных кислот, например, те, что присутствуют в тестостерона энантате, характеризуются в некоторой степени улучшенной пероральной биодоступностью.
Было показано, что производные сульфокислоты являются особенно перспективными. В патенте США №5705495 и Европейских патентах ЕР 1273590 и 1284273 были описаны производные сульфокислоты и эстрадиола, обладающие более высокой эстрогенной активностью после перорального введения по сравнению с эстрадиолом.
Для дальнейшей разработки фактически было выбрано одно производное J955 (эстрадиола сульфамат). J995 имел более высокую эстрогенную активность после перорального введения по сравнению с эстрадиолом и этинилэстрадиолом в пробе Аллена-Дойзи у самок крыс после овариэктомии (Walter Elger et al., J. Steroid Biochem. Molec. Biol. Vol 55 395-403, 1995). Разработку J995 были вынуждены прекратить после того, как было определено, что J995 также действовал как ингибитор сульфатазы у женщин.
В патенте США №7507725 и Европейском патенте ЕР 1294402 указанная концепция была расширена и сведена к соединениям, состоящим из трех различных фрагментов: активный ингредиент-(группа-разделитель)-SO2NR1R2. Было выдвинуто предположение о том, что указанные соединения связываются с эритроцитами. Активный ингредиент может представлять собой молекулу стероида, но также и другие лекарственные средства, такие как мочегонные средства, агонисты дофамина и т.д. Описанная группа-разделитель может состоять из углеродной цепи или ароматического кольца или комбинации указанных групп.
Указанная концепция позднее была расширена до определенных классов веществ (патенты США №6841548; 6956031; 6958327; заявка на патент США №2005/2277625; патент США №7534780; публикация международной заявки WO 03/104253).
Несмотря на то, что описанные соединения имели активность, несколько превышающую активность исходных лекарственных средств в определенных биологических исследованиях, природа описанной группы-разделителя и сульфонамидного фрагмента обеспечивает соединения с очень низкой растворимостью в воде, что значительно ограничивает возможность их применения в качестве лекарственных средств.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В первом варианте реализации аминосодержащие производные имеют следующую общую формулу (I):
где n равен 0-4; m равен 0-4; L равен 0-1;
R1 представляет собой Н, алкил, циклоалкил, арил, алкиларил, гетероарил или галоген;
hAr представляет собой арил, гетероарил, алкил, алкиларил или алкилгетероарил;
R2 представляет собой Н, алкил, циклоалкил, арил, гетероарил, галоген, арилсульфонамид, гетероарилсульфонамид, алкиларилсульфонамид или алкилгетероарилсульфонамид;
R1 и R2 могут быть объединены с образованием циклоалкила или 3-7-членного кольца, содержащего до одного гетероатома;
каждый R3 и R4 независимо представляет собой Н, алкил, циклоалкил, арил, гетероарил, ацил, циано, галоген, гидрокси, алкокси;
каждый X и Y независимо представляет собой Н, галоген, циано, гидрокси, алкокси, алкил, арил, гетероарил;
Z представляет собой О или NR1;
O=C-(CH)n-R1 имеет R- или S-конфигурацию.
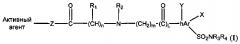
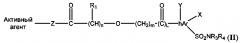
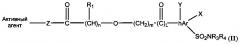
Во втором варианте реализации кислородсодержащие производные имеют общую формулу (II)
где n равен 0-4; m равен 0-4; L равен 0-1;
R1 представляет собой Н, алкил, циклоалкил, арил, гетероарил или галоген;
hAr представляет собой арил или гетероарил;
каждый R3 и R4 независимо представляет собой Н, алкил, циклоалкил, арил, гетероарил, ацил, циано, галоген, гидрокси, алкокси;
каждый X и Y независимо представляет собой Н, галоген, циано, гидрокси, алкокси, алкил, арил, гетероарил;
Z представляет собой О или NR1;
O=C-(CH)n-R1 имеет R- или S-конфигурацию.
В другом варианте реализации замещенные алкильные производные имеют следующую общую формулу (III):
где n равен 0-1; m равен 1-4;
Z представляет собой О или NR1;
каждый R1 и R2 независимо представляет собой галоген, или R1 и R2 объединены с образованием циклоалкила.
Согласно другому аспекту в некоторых вариантах реализации настоящего изобретения предложена фармацевтическая композиция, содержащая соединения формулы I, II или III в фармацевтически приемлемом носителе.
Согласно другому аспекту в некоторых вариантах реализации настоящего изобретения предложен противозачаточный продукт и продукт для гормонозаместительной терапии, содержащий соединения формул I и II, приведенных далее.
Для лучшего понимания последующего подробного описания в вышеуказанном описании в общих чертах отмечены отличительные признаки настоящего изобретения. Дополнительные отличительные признаки и преимущества, которые описаны далее, составляют предмет, определенный формулой изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ
Следует понимать, что настоящее изобретение не ограничено конкретными устройствами или способами, которые безусловно могут быть различными. Также следует понимать, что терминология, используемая в настоящем описании, предназначена для описания исключительно конкретных вариантов реализации и не является ограничивающей. При использовании в настоящем описании и прилагаемой формуле изобретения формы единственного числа включают ссылки на отдельные объекты и их совокупность, если из контекста явным образом не следует иное. Кроме того, слово «может» используют в настоящем описании в качестве свободного термина (т.е. обладает потенциалом, имеет возможность), но не обязательного термина (т.е. должен). Термин «включает» и их производные обозначают «включает, но не ограничивается ими». Термин «сопряженный» обозначает связанный непосредственно или косвенно.
Если отсутствуют иные определения, то все технические и научные термины, используемые в настоящем описании, имеют значения, общепринятые специалистами в данной области техники.
Термин «алкил», используемый в настоящем описании, в общем случае относится к химическому заместителю, содержащему одновалентную группу CnH2n, где n представляет собой целое число больше нуля. В некоторых вариантах реализации n равен от 1 до 12. Термин «алкил» включает разветвленный или неразветвленный одновалентный углеводородный радикал. Примеры алкильных радикалов включают, но не ограничиваются ими, метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил, пентил, 3-пентил, гексил, гептил, октил, нонил, децил, ундецил, додецил. Алкильную группу, содержащую 1-6 атомов углерода, называют «низшим алкилом». Подходящие низшие алкильные радикалы включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, 2-пропенил (или аллил), н-бутил, трет-бутил и изобутил (или 2-метилпропил).
Термин «циклоалкил» обозначает группы, содержащие алифатическую цепь, замкнутую с образованием кольцевой структуры. Количество атомов углерода в алифатической цепи может находиться в диапазоне от трех до 12. Типовые циклоалкильные группы включают циклопропил, циклобутил, циклопентил и циклогексил.
Термин «алкокси» в общем случае относится к группе -OR, где R представляет собой низший алкил, замещенный низший алкил, арил, замещенный арил, аралкил или замещенный аралкил. Подходящие алкоксирадикалы включают, но не ограничиваются ими, метокси, этокси, фенокси, трет-бутокси, метоксиэтокси и метоксиметокси.
Термин «галоген» используют в настоящей заявке для описания атомов фтора, брома, хлора и йода.
Термин «гидроксил» используют в настоящей заявке для описания группы -ОН.
Термин «арил» используют для описания ароматического заместителя, который может представлять собой отдельное кольцо или несколько колец, которые являются конденсированными, связанными посредством ковалентной связи или общей группы, такой как этиленовый фрагмент. Ароматическое(-ие) кольцо(-а) включает(-ют), но не ограничивается(-ются) ими, фенил, нафтил, бифенил, дифенилметил и 2,2-дифенил-1-этил. Арильная группа также может быть замещена заместителями, включая, но не ограничиваясь ими, алкильные группы, атомы галогенов, нитрогруппы, карбоксильные группы, алкокси и фенокси, с образованием «замещенной арильной группы». Заместители могут быть присоединены по любому положению арильного радикала, которое в иных случаях занято атомом водорода.
Термин «гетероцикл», используемый в настоящем описании, в общем случае относится к закрытой кольцевой структуре, в которой один или более атомов в кольце представляют собой элементы, отличающиеся от углерода. Гетероцикл может включать ароматические соединения или неароматические соединения. Гетероциклы могут включать кольца, такие как тиофен, пиридин, изоксазол, фталимид, пиразол, индол, фуран или аналоги указанных колец, конденсированные с бензолом. Примеры гетероциклов включают тетрагидрофуран, морфолин, пиперидин, пирролидин и т.д. В некоторых вариантах реализации «гетероцикл» обозначает стабильное 5-7-членное моноциклическое или бициклическое или 7-10-членное бициклическое гетероциклическое кольцо, которое может быть насыщенным или ненасыщенным и состоит из атомов углерода и 1-4 гетероатомов (например, N, О и S), причем гетероатомы азота и серы необязательно могут быть окисленными, а атом азота необязательно может быть четвертичным, и включает любые бициклические группы, в которых какое-либо из определенных выше гетероциклических колец конденсировано с бензольным кольцом. В некоторых вариантах реализации гетероциклы могут включать циклические кольца, содержащие атомы бора. Гетероциклическое кольцо может быть присоединено к соседней группе через любой гетероатом или атом углерода с образованием стабильной структуры. Гетероциклические кольца, описанные в настоящей заявке, могут быть замещены по атому углерода или атому азота, если получаемое соединение является стабильным. Примеры указанных гетероциклов включают, но не ограничиваются ими, 1Н-индазол, 2-пирролидонил, 2Н,6Н-1,5,2-дитиазинил, 2Н-пирролил, 3Н-индолил, 4-пиперидонил, 4аН-карбазол, 4Н-хинолизинил, 6Н-1,2,5-тиадиазинил, акридинил, азоцинил, бензофуранил, бензотиофенил, карбазол, хроманил, хроменил, циннолинил, декагидрохинолинил, фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, индолинил, индолизинил, индолил, изобензофуранил, изохроманил, изоиндолинил, изоиндолил, изохинолинил (бензимидазолил), изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксазолидинил, оксазолил, фенантридинил, фенантролинил, фенарсазинил, феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиридазинил, пиридинил, пиридил, пиримидинил, пирролидинил, пирролинил, пирролил, хиназолинил, хинолинил, хиноксалинил, хинуклидинил, карболинил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, тетразолил, тиантренил, тиазолил, тиенил, тиофенил, триазинил, ксантенил. Также включены конденсированные кольца и спиросоединения, содержащие, например, указанные выше гетероциклы. Термин «гетероарил» имеет значение, эквивалентное гетероциклу, и указанные термины используют взаимозаменяемо.
Термин «фармацевтически приемлемые соли» включает соли, полученные в результате взаимодействия с участием фармацевтически приемлемых нетоксичных оснований или кислот, включая взаимодействие неорганических или органических оснований с неорганическими или органическими кислотами. Фармацевтически приемлемые соли могут включать соли, полученные из неорганических оснований, включая соли алюминия, аммония, кальция, меди, железа (III), железа (II), лития, магния, марганца (III), марганца (II), калия, натрия, цинка и т.д. Примеры включают соли аммония, кальция, магния, калия и натрия. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещенных аминов, включая природные замещенные амины, циклических аминов и основных ионообменных смол, таких как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-дибензилэтилендиамин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и т.д.
Список сокращений
AcOH - уксусная кислота
Boc - трет-бутилкарбамат
Cbz - бензилкарбамат
DCC - дициклогексилкарбодиимид
ДХМ - дихлорметан
DIC - диизопропилкарбодиимид
DMAP - N,N-диметил-4-аминопиридин
ДМФ - диметилформамид
ДМСО - диметилсульфоксид
EDCI - гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида
EtOAc - этилацетат
HOBt - гидрат 1-гидроксибензотриазола
ВЭЖХ - высокоэффективная жидкостная хроматография
Основание Хюнига - диизопропилэтиламин
ИКС - инфракрасная спектроскопия
ЖХСД - жидкостная хроматография среднего давления
ЯМР - ядерный магнитный резонанс
пТСК - пара-толуолсульфокислота
PDC - дихромат пиридиния
TBAI - йодид тетрабутиламмония
TBAF - фторид тетрабутиламмония
TBS - трет-бутилдиметилсилил
TBSCl - трет-бутилдиметилсилилхлорид
ТГФ - тетрагидрофуран
ТСХ - тонкослойная хроматография
Варианты реализации, описанные в настоящей заявке, направлены на устранение недостатков соединений, известных из уровня техники, и описывают молекулы пролекарств, обладающих значительно повышенной пероральной активностью по сравнению с исходными молекулами.
Было выдвинуто предположение о том, что введение гетероатомов, таких как азот или кислород, в линкерную группу может увеличивать растворимость и, следовательно, пероральную активность молекул. В указанном контексте особенно эффективными могут быть аминокислоты. Описаны сложные эфиры аминокислот и стероидов. В патентах Китая CN 102127137 и 102079771 раскрыты сложные эфиры аминокислот с эстрогенами, обладающие противоопухолевой активностью и имеющие хорошую растворимость в воде. В патенте Франции FR 2774989 описаны пептиды эстрадиола, обладающие противоопухолевой и цитотоксической активностью. В патенте Германии DE 4029499 описаны дифосфонатные производные эстрадиола для лечения остеопороза. В Европейском патенте ЕР 351561 описаны производные эстратриендиола в качестве неопластических соединений, и в патенте США №4615835 описаны сложные эфиры стероидов и нитрозокарбамоиламинокислот, обладающие высокой противоопухолевой активностью.
В настоящем изобретении заявлены соединения, содержащие следующие фрагменты:
Активный ингредиент - (кислота)-(линкерная группа) - SO2NR1R2.
Активный ингредиент может представлять собой любой активный ингредиент, содержащий по меньшей мере одну гидрокси- или аминогруппу. Активный ингредиент предпочтительно выбран из андрогенов, анаболических агентов, антиандрогенов, эстрогенов, прогестинов или соединений, действующих на ЦНС.
В одном из вариантов реализации активный ингредиент представляет собой андроген, такой как тестостерон, где функциональная группа представляет собой 17-гидроксигруппу. Типовым андрогеном является 7α,11β-диметилэстра-4,9-диен-17-ол, где функциональная группа представляет собой 17-гидроксигруппу.
В другом варианте реализации активный ингредиент представляет собой эстроген. Типовыми эстрогенами являются эстрадиол или эстриол, где функциональная группа представляет собой 16- или 17-гидроксигруппу.
В одном из вариантов реализации активный ингредиент представляет собой прогестин, такой как тримегестон, и функциональная группа представляет собой 21-гидроксигруппу.
Соединения, описанные в настоящей заявке, действуют как пролекарство, которое обеспечивает захват активного агента эритроцитами. Возможность захвата указанных соединений эритроцитами обеспечивается группой формулы SO2NR3NR4; где R3 и R4 независимо друг от друга представляют собой Н, алкил, циклоалкил, арил, гетероарил, ацил, циано, галоген, гидрокси или алкокси. Пролекарства согласно настоящему изобретению обеспечивают возможность эффективного перорального введения или значительного улучшения пероральной активности активных агентов, таких как эндогенные вещества, природные вещества и синтетические вещества, со свойствами, подходящими для терапии, имеющих высокий «эффект первого прохождения».
В первом варианте реализации аминосодержащие производные имеют следующую общую формулу (I):
где n равен 0-4; m равен 0-4; L равен 0-1;
R1 представляет собой Н, алкил, циклоалкил, арил, алкиларил, гетероарил или галоген;
hAr представляет собой арил, гетероарил, алкил, алкиларил или алкилгетероарил;
R2 представляет собой Н, алкил, циклоалкил, арил, гетероарил, галоген; арилсульфонамид, гетероарилсульфонамид, алкиларилсульфонамид или алкилгетероарилсульфонамид;
R1 и R2 могут быть объединены с образованием циклоалкила или 3-7-членного кольца, содержащего до одного гетероатома;
каждый R3 и R4 независимо представляет собой Н, алкил, циклоалкил, арил, гетероарил, ацил, циано, галоген, гидрокси, алкокси;
каждый X и Y независимо представляет собой Н, галоген, циано, гидрокси, алкокси, алкил, арил, гетероарил;
Z представляет собой О или NR1;
O=C-(CH)n-R1 имеет R- или S-конфигурацию.
Во втором варианте реализации кислородсодержащие производные имеют общую формулу (II)
где n равен 0-4; m равен 0-4; L равен 0-1;
R1 представляет собой Н, алкил, циклоалкил, арил, гетероарил или галоген;
hAr представляет собой арил, гетероарил, алкил, алкиларил или алкилгетероарил;
каждый R3 и R4 независимо представляет собой Н, алкил, циклоалкил, арил, гетероарил, ацил, циано, галоген, гидрокси или алкокси;
каждый X и Y независимо представляет собой Н, галоген, циано, гидрокси, алкокси, алкил, арил, гетероарил;
Z представляет собой О или NR1;
O=C-(CH)n-R1 имеет R- или S-конфигурацию.
В другом варианте реализации замещенные алкильные производные имеют следующую общую формулу (III):
где n равен 0-1; m равен 1-4;
Z представляет собой О или NR1;
каждый R1, R2 независимо представляет собой галоген, или R1 и R2 объединены с образованием циклоалкила.
В другом варианте реализации замещенные гетероарильные производные имеют следующую общую формулу (IV):
где n равен 0-1; m равен 1-4;
каждый R1 и R2 независимо представляет собой Н, галоген, алкил, алкенил, циклоалкил, алкокси, ацил;
hAr представляет собой арил, гетероарил;
Z представляет собой О или NR1;
каждый X и Y независимо представляет собой Н, галоген, циано, гидроксил, алкокси, алкил, циклоалкил, арил, гетероарил или ОАс.
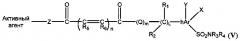
В другом варианте реализации замещенные гетероарильные производные имеют следующую общую формулу (V):
где n равен 0-2; m равен 0-1; L равен 0-4;
каждый R1, R2 независимо представляет собой Н, галоген, циклоалкил, алкил, арил, гетероарил, ацил, циано, галоген, гидроксил или алкокси;
R1 и R2 могут быть объединены с образованием циклоалкила;
каждый R3 и R4 независимо представляет собой Н, алкил, циклоалкил, арил, гетероарил, ацил, циано, галоген, гидрокси или алкокси;
каждый R5 и R6 независимо представляет собой Н, алкил, арил, галоген, алкокси, циклоалкил;
hAr представляет собой арил, гетероарил;
Z представляет собой О или NR1;
каждый X и Y независимо представляет собой Н, галоген, циано, гидроксил, алкокси, алкил, арил или гетероарил;
Q представляет собой О.
В другом варианте реализации замещенные гетероарильные производные имеют следующую общую формулу (VI):
где n равен 0-1;
каждый R1 и R2 независимо представляет собой Н, галоген, алкил, алкенил, циклоалкил, циано, алкокси или ацил;
hAr представляет собой винил, ацетилен, арил, гетероарил;
hAr' представляет собой арил, гетероарил;
Z представляет собой О или NR1;
каждый X и Y независимо представляет собой Н, галоген, циано, гидроксил, алкокси, алкил, циклоалкил, арил, гетероарил или ацил.
Согласно другому аспекту в некоторых вариантах реализации настоящего изобретения предложена фармацевтическая композиция, содержащая соединения формул I-VI в фармацевтически приемлемом носителе.
В конкретных вариантах реализации настоящего изобретения предложен противозачаточный продукт и продукт для гормонозаместительной терапии, содержащий соединения формул I и II, приведенных ниже.
Описанные выше соединения можно вводить в состав фармацевтической композиции, содержащей соединение любой из формул (I)-(VI) и фармацевтически приемлемый носитель. В зависимости от способа введения можно применять дополнительные вспомогательные вещества.
Для обеспечения эффективной дозировки соединений, описанных в настоящей заявке, можно применять любые подходящие способы введения. Например, можно применять пероральный, ректальный, местный, парентеральный, внутриглазной, внутрилегочный, интраназальный способы и т.д. Лекарственные формы включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли и т.д. В определенных вариантах реализации пероральное введение композиций, описанных в настоящей заявке, может быть эффективным.
Следующие примеры приведены для демонстрации предпочтительных вариантов реализации изобретения. Специалисты в данной области техники должны понимать, что способы, раскрытые в последующих примерах, представляют собой способы, предложенные авторами настоящего изобретения для эффективной реализации изобретения, и, таким образом, их можно рассматривать как предпочтительные варианты реализации. Тем не менее, специалистам в данной области техники после изучения настоящего изобретения должно быть понятно, что можно проводить множество изменений конкретных раскрытых вариантов реализации и добиваться при этом аналогичных или схожих результатов, не выходя за рамки сущности и объема изобретения.
Экспериментальная часть. Предложенные пролекарства
(13S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]-фенантрен-17-иловый эфир 3-сульфамоилбензойной кислоты 1А синтезировали согласно описанию, приведенному в литературе (патент США №7507725 и Европейский патент ЕР 1294402).
(13S,17S)-17-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]-фенантрен-3-иловый эфир сульфаминовой кислоты J995 синтезировали согласно описанию, приведенному в литературе (патент США №5705495 и Европейские патенты ЕР 1273590 и 1284273).
Схема 1
2А можно синтезировать, как показано на схеме 1. Простой эфир эстрадиол-3-TBS 7 обрабатывали бензилоксиацетилхлоридом в присутствии пиридина с получением сложного эфира 2, из которого путем дебензилирования получали соединение 3. Этерификация 3 с использованием 3-хлорсульфонилбензоилхлорида в присутствии пиридина приводила к получению 3-TBS-защищенного Е2, которое подвергали десилилированию с использованием фторида тетрабутиламмония с получением 2А.
3А можно синтезировать, как показано на следующей схеме 2.
Схема 2
Промежуточные соединения 2 и 3 получали, как показано на схеме 1. Проводили сочетание соединения 3 с 4-сульфамоилбензойной кислотой с использованием DCC и пиридина с получением 3-TBS производного 3А, из которого путем десилилирования с использованием фторида тетрабутиламмония получали 3А.
(13S,17S)-3-(трет-бутилдиметилсилилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-иловый эфир 2-(бензилокси)уксусной кислоты (2):
В раствор стероида 7 (0,5 г, 1,29 ммоль) и пиридина (0,13 г, 1,67 ммоль) в безводном дихлорметане (10 мл) при 0°С добавляли бензилоксиацетилхлорид (0,31 г, 1,67 ммоль). После перемешивания указанного раствора в течение 45 минут добавляли воду. Реакционную смесь трижды экстрагировали дихлорметаном. Объединенные органические слои промывали нас. NaHCO3, солевым раствором и сушили над безв. Na2SO4. Удаляли растворитель в вакууме и очищали неочищенный продукт путем колоночной хроматографии (SiO2, гексан-этилацетат) с получением 2 (640 мг, 93%). 1Н ЯМР (δ, CDCl3, 300 МГц): 7,27-7,38 (m, 5Н, ArH), 7,13 (d, J=8,4 Гц, 1Н, ArH), 6,62 (dd, J1=8,4 Гц, J2=2,6 Гц, 1Н, ArH), 6,55 (d, J=2,4 Гц, 1H, ArH), 4,82 (t, J=8,7 Гц, 1Н, -СН), 4,65 (s, 2Н, -ОСН2), 4,11 (s, 2H, -OCH2), 2,81 (m, 2Н, -СН2), 0,97 (s, 9Н, Si-CH3), 0,82 (s, 3Н, -СН3), 0,18 (s, 6Н, Si-СН3).
(13S,17S)-3-(трет-бутилдиметилсилилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-иловый эфир 2-гидроксиуксусной кислоты (3):
Раствор соединения 2 (0,64 г, 1,19) в этилацетате перемешивали с 5% палладием на углеродной подложке (0,06 г, 0,6 ммоль) и гидрировали под давлением 20 psi (138 кПа) в течение 1 часа. Фильтровали раствор для удаления катализатора и выпаривали досуха. Полученный неочищенный остаток очищали путем колоночной хроматографии (SiO2, гексан-EtOAc) с получением 3 (0,47 г, 89%). 1Н ЯМР (δ, CDCl3, 300 МГц): 7,21 (d, J=8,4 Гц, 1H, ArH), 6,60 (dd, J1=8,4 Гц, J2=2,6 Гц, 1H, ArH), 6,55 (d, J=2,4 Гц, 1Н, ArH), 4,81 (t, J=8,8 Гц, 1Н, -СН), 4,15 (d, J=2,4 Гц, 2Н, -ОСН2), 2,80 (m, 2Н, -СН2), 0,97 (s, 9Н, Si-СН3), 0,82 (s, 3Н, -СН3), 0,18 (s, 6Н, Si-СН3).
2-((13S,17S)-3-(трет-бутилдиметилсилилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 3-сульфамоилбензойной кислоты:
Раствор 3 (0,2 г, 0,45 ммоль) и пиридина (0,05 г, 0,6 ммоль) в дихлорметане (10 мл) при -20°С обрабатывали, добавляя по каплям раствор 3-сульфамоилбензоилхлорида (0,14 г, 0,6 ммоль) в дихлорметане. После перемешивания в течение 30 минут при -20°С реакционную смесь нагревали до 8°С и гасили раствором NH4OH (3 мл) и перемешивали еще 30 минут. Реакционную смесь трижды экстрагировали дихлорметаном. Объединенные органические слои промывали водой, солевым раствором и сушили над безводным Na2SO4. Удаляли растворитель в вакууме и очищали неочищенный остаток путем колоночной хроматографии (SiO2, гексан-EtOAc) с получением 2А, защищенного 3-TBS (0,24 г, 85%). 1Н ЯМР (δ, CDCl3, 300 МГц): 8,64-8,66 (m, 1H, ArH), 8,28-8,31 (m, 1Н, ArH), 8,12-8,16 (m, 1H, ArH), 7,63 (t, J=7,9 Гц, 1H, ArH), 7,09 (d, J=8,4 Гц, 1H, ArH), 6,60 (dd, J1=8,4 Гц, J2=2,6 Гц, 1H, ArH), 6,54 (d, J=2,4 Гц, 1H, ArH), 4,89 (s, 2H, -OCH2), 4,80 (t, J=8,8 Гц, 1H, -CH), 2,80 (m, 2H, -CH2), 0,97 (s, 9H, Si-CH3), 0,79 (s, 3H, -CH3), 0,18 (s, 6H, Si-CH3).
2-((13S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 3-сульфамоилбензойной кислоты (2А)
Раствор простого эфира 3-TBS-2A (0,24 г, 0,38 ммоль) в безводном ТГФ (10 мл) обрабатывали фторидом тетрабутиламмония (0,13 г, 0,42 ммоль). После перемешивания в течение 1 часа при КТ добавляли воду и трижды экстрагировали EtOAc. Объединенные органические слои промывали водой, солевым раствором и сушили над безводным Na2SO4. Удаляли растворитель в вакууме и очищали неочищенное вещество путем колоночной хроматографии (SiO2, гексан-EtOAc) с получением 2А (0,16 г, 82%). ИКС (см-1): 3352, 3257, 2926, 2858, 1727, 1499, 1221, 1159, 1127, 1039, 750. 1Н ЯМР (δ, CDCl3, 300 МГц): 8,65-8,66 (m, 1H, ArH), 8,28-8,31 (m, 1Н, ArH), 8,12-8,16 (m, 1H, ArH), 7,63 (t, J=7,8 Гц, 1H, ArH), 7,12 (d, J=8,4 Гц, 1H, ArH), 6,61 (dd, J1=8,4 Гц, J2=2,6 Гц, 1Н, ArH), 6,54 (d, J=2,4 Гц, 1Н, ArH), 5,08 (s, 2Н, -NH2), 4,95 (s, 1H, -ОН), 4,83 (s, 2Н, -ОСН2), 4,80 (t, J=8,9 Гц, 1Н, -CH), 2,79 (m, 2H, -CH2), 0,73 (s, 3Н, -CH3). 13C ЯМР (δ, CDCl3, 75 МГц): 167,64, 164,50, 153,38, 138,09, 133,79, 132,33, 130,90, 130,44, 129,52, 127,93, 126,48, 115,23, 112,70, 84,23, 61,64, 49,61, 43,66, 43,13, 38,47, 36,81, 29,49, 27,40, 27,09, 26,12, 23,20, 12,03.
2-((13S,17S)-3-(трет-бутилдиметилсилилокси)-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 4-сульфамоилбензойной кислоты:
В раствор 3 (0,22 г, 0,5 ммоль) и 4-сульфамоилбензойной кислоты (0,24 г, 1,15 ммоль) в пиридине (10 мл) добавляли n-TsOH (0,08 г, 0,5 ммоль), затем 1М раствор DCC в дихлорметане (0,24 г, 1,15 ммоль). После перемешивания при КТ в течение 72 часов добавляли воду и доводили pH реакционной смеси до 7 путем добавления 4н. хлороводородной кислоты. Реакционную смесь трижды экстрагировали этилацетатом и объединенные органические слои промывали водой, солевым раствором и сушили над безводным Na2SO4. Удаляли растворитель в вакууме и очищали неочищенный остаток путем колоночной хроматографии (SiO2, гексан-EtOAc) с получением простого эфира 3-TBS-3A (0,27 г, 86%). 1Н ЯМР (δ, CDCl3, 300 МГц): 8,23 (d, J=8,5 Гц, 2Н, ArH), 8,02 (d, J=8,5 Гц, 2Н, ArH), 7,10 (d, J=8,4 Гц, 1H, ArH), 6,61 (dd, J1=8,4 Гц, J2=2,5 Гц, 1Н, ArH), 6,53 (d, J=2,4 Гц, 1Н, ArH), 4,89 (s, 2Н, -ОСН2), 4,80 (t, J=8,9 Гц, 1H, -СН), 2,80 (m, 2Н, -СН2), 0,97 (s, 9Н, Si-СН3), 0,78 (s, 3Н, -СН3), 0,18 (s, 6Н, Si-СН3), 0,18 (s, 6Н, Si-CH3).
2-((13S,17S)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 4-сульфамоилбензойной кислоты (2А):
Согласно описанию способа получения 2A TBS группу удаляли путем обработки простого эфира 3-TBS-3A (0,26 г, 0,4 ммоль) с использованием TBAF⋅3Н2О (0,3 г, 0,45 ммоль) с получением 3А (0,2 г, 95%). ИКС (см-1): 3386, 3265, 2930, 2853, 1731, 1549, 1225, 1167, 1122, 1039, 765. 1Н ЯМР (δ, CDCl3, 300 МГц): 8,15 (d, J=8,5 Гц, 2Н, ArH), 7,95 (d, J=8,5 Гц, 2Н, ArH), 7,05 (d, J=8,4 Гц, 1H, ArH), 6,55 (dd, J1=8,4 Гц, J2=2,5 Гц, 1Н, ArH), 6,49 (d, J=2,4 Гц, 1Н, ArH), 4,91 (s, 2Н, -ОСН2), 4,74 (t, J=8,8 Гц, 1H, -СН), 2,80 (m, 2Н, -СН2), 0,73 (s, 3Н, -СН3). 13С ЯМР (δ, CDCl3, 75 МГц): 167,59, 164,68, 154, 146,91, 137,91, 133,79, 132,40, 131,30, 130,36, 126,23, 115,09, 112,61, 84,17, 61,54, 49,48, 49,38, 49,10, 48,81, 48,68, 43,55, 42,99, 38,42, 36,68, 33,57, 29,39, 27,26, 27,03, 25,99, 25,42, 24,73, 23,06, 11,86.
2-((13S,16R,17R)-16-(трет-бутилдиметилсилилокси)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 3-сульфамоилбензойной кислоты
Раствор 25 (0,7 г, 1,2 ммоль) и пиридина (0,19 г, 2,43 ммоль) в дихлорметане (10 мл) при -20°С обрабатывали, добавляя по каплям раствор 3-сульфамоилбензоилхлорида (0,58 г, 2,43 ммоль) в дихлорметане. После перемешивания в течение 30 минут при -20°С реакционную смесь нагревали до 8°С и гасили раствором NH4OH (3 мл) и перемешивали еще 30 минут. Реакционную смесь трижды экстрагировали дихлорметаном. Объединенные органические слои промывали водой, солевым раствором и сушили над безводным Na2SO4. Удаляли растворитель в вакууме и очищали неочищенный остаток путем колоночной хроматографии (SiO2, гексан-EtOAc) с получением 3- и 16-TBS-защищенного 24А (0,78 г, 84%). Полученное соединение (0,28 г, 0,37 ммоль) обрабатывали TBAF (0,12 г, 0,37 ммоль) с получением простого эфира 16-TBS-24A (0,2 г, 84%). 1Н ЯМР (CDCl3-ДМСО, 300 МГц): 8,66-8,67 (m, 1H, ArH), 8,30-8,33 (m, 1Н, ArH), 8,13-8,15 (m, 1H, ArH), 7,65 (t, J=7,8 Гц, 1Н, ArH), 7,11 (d, J=8,4 Гц, 1H, ArH), 6,59 (dd, J1=8,4 Гц, J2=2,2 Гц, 1Н, ArH), 6,55 (d, J=2,2 Гц, 1Н, ArH), 4,96 (s, 2Н, -ОСН2), 4,52 (d, J=4,7 Гц, 1Н, -СН), 4,06 (m, 1H, -СН), 2,73 (m, 2Н, -СН2), 0,89 (s, 9Н, Si-СН3) 0,74 (s, 3Н, -СН3), 0,05 (s, 6Н, Si-CH3).
2-((13S,16R,17R)-3,16-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 3-сульфамоилбензойной кислоты:
16-TBS-защищенное 24А (0,2 г, 0,3 ммоль) обрабатывали 4н. HCl (0,02 г, 0,5 ммоль) с получением 24А (0,16 г, 97%). ИКС (см-1): 3346, 2933, 2856, 1737, 1728, 1342, 1225, 1168, 1132, 913, 731. 1Н ЯМР (CDCl3-ДМСО, 300 МГц): 8,54-8,56 (m, 1Н, ArH), 8,19-8,22 (m, 1H, ArH), 8,07-8,10 (m, 1Н, ArH), 7,58 (t, J=7,9 Гц, 1H, ArH), 7,03 (d, J=8,6 Гц, 1Н, ArH), 6,56 (dd, J1=8,4 Гц, J2=2,2 Гц, 1H, ArH), 6,49 (d, J=2,2 Гц, 1Н, ArH), 4,90 (s, 2Н, -ОСН2), 4,52 (d, J=4,7 Гц, 1Н, -СН), 4,06 (m, 1Н, -СН), 2,73 (m, 2Н, -СН2), 0,74 (s, 3Н, -СН3).
2-((13S,16R,17R)-16-(трет-бутилдиметилсилилокси)-3-гидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 4-сульфамоилбензойной кислоты:
В раствор 25 (1,1 г, 1,9 ммоль) и 4-сульфамоилбензойной кислоты (0,95 г, 4,4 ммоль) в пиридине (10 мл) добавляли n-TsOH (0,3 г, 1,71 ммоль), затем 1М раствор DCC в дихлорметане (4,4 мл, 1,15 ммоль). После перемешивания при КТ в течение 72 часов добавляли воду и доводили pH реакционной смеси до 7 путем добавления 4н. хлороводородной кислоты. Реакционную смесь трижды экстрагировали этилацетатом и объединенные органические слои промывали водой, солевым раствором и сушили над безводным Na2SO4. Удаляли растворитель в вакууме и очищали неочищенный остаток путем колоночной хроматографии (SiO2, гексан-EtOAc) с получением простого эфира 3- и 16-TBS-25A (0,71 г, 51%). Полученное соединение (0,51 г, 0,67 ммоль) обрабатывали TBAF (0,2 г, 0,67 ммоль) с получением простого эфира 16-TBS-25A (0,4 г, 93%). 1Н ЯМР (CDCl3-ДМСО, 300 МГц): 8,23-8,26 (m, 2Н, ArH), 8,01-8,04 (m, 2Н, ArH), 7,12 (d, J=8,4 Гц, 1Н, ArH), 6,63 (dd, J1=8,1 Гц, J2=2,1 Гц, 1Н, ArH), 6,55 (d, J=2,4 Гц, 1Н, ArH), 4,91-4,93 (m, 5Н, -ОСН2, -ОН, -NH2), 4,68 (s 1Н, -СН), 4,29-,32 (m, 1Н, -СН), 2,81 (m, 2Н, -СН2), 0,89 (s, 9Н, Si-СН3) 0,77 (s, 3Н, -СН3), 0,05 (s, 6Н, Si-СН3).
2-((13S,16R,17R)-3,16-дигидрокси-13-метил-7,8,9,11,12,13,14,15,16,17-декагидро-6Н-циклопента[а]фенантрен-17-илокси)-2-оксоэтиловый эфир 4-сульфамоилбензойной кислоты:
Согласно описанию способа получения 24А простой эфир 16-TBS-25A (0,45 г, 0,69 ммоль) обрабатывали 4н. HCl (0,07 г, 2,07 ммоль) с получением 25А (0,32 г, 87%). ИКС (см-1): 3485, 3409, 2929, 2859, 1740, 1720, 1424, 1345, 1221, 1178, 1117, 913, 608. 1Н ЯМР (CDCl3-ДМСО, 300 МГц): 8,19 (d, J=8,5 Гц, 2Н, ArH), 7,99 (d, J=8,5 Гц, 2Н, ArH), 7,61 (шир.s, 1Н, ОН), 7,02 (d, J=8,6 Гц, 1H, ArH), 6,51 (dd, J1=8,1 Гц, J2=2,1 Гц, 1H, ArH), 6,42 (d, J=2,4 Гц, 1H, ArH), 5,02 (s, 3H, -OCH2, -OH), 4,72 (d, J=5,5 Гц, 1H, -CH), 4,11 (m, 1H, -CH), 2,68 (m, 2H, -CH2), 0,69 (s, 3H, -CH3).
Схема 5
Вос-глицин-ОН (2,0 г, 2 экв.) обрабатывали 1-этил-3-(3-диметиламинопропил)-карбодиимидом (EDCI, 2,2 г, 2 экв.) в ДХМ (30 мл) в течение 1 часа при КТ. Затем добавляли эстрадиол 7 (2,1 г, 1 экв.) и 4-диметиламинопиридин (DMAP, 0,7 г, 1 экв.) и полученную смесь перемешивали при КТ в течение 20 часов. Концентрировали реакционную смесь и очищали остаток путем хроматографии на силикагеле с использованием 60-100% ДХМ в гексанах в качестве элюента с получением сложноэфирного продукта 8 в виде белого твердого вещества (2,1 г, выход 68%).
Сложный эфир 8 (2,0 г) обрабатывали трифторуксусной кислотой (ТФУ, 6 мл) в ДХМ (30 мл) при КТ в течение 24 часов. После завершения взаимодействия реакционную смесь разбавляли толуолом (30 мл) и удаляли трифторуксусную