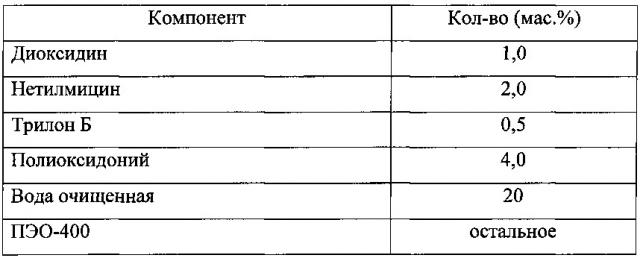
Фармацевтическая комбинированная композиция для местного и наружного применения на основе диоксидина
Иллюстрации
Показать всеГруппа изобретений относится к фармацевтическим композициям, применяемым при лечении обширных гнойно-некротических посттравматических, послеоперационных ран. Композиции для наружного или местного применения по изобретению содержат 0,1-5 мас.% диоксидина, гидрофильную основу и по меньшей мере одну целевую добавку, выбранную из ряда: 0,5-6,5 мас.% анестетика, 0,05-16 мас.% комплекса протеолитических ферментов, 0,001-5 мас.% синтетического антибактериального средства, снижающего резистентность микроорганизмов, 0,5-5 мас.% антибиотика, 0,05-12,5 мас.% синтетического иммуномодулятора, димексид, стимулятор репаративных процессов, антимикотик. Разработанная комбинированная композиция создает оптимальные условия для сокращения сроков проведения системной антимикробной и противогрибковой терапии, позволяет ускорить процесс заживления, улучшить условия для заживления ран. 4 н. и 15 з.п. ф-лы, 1 табл., 43 пр.
Реферат
Изобретение относится к медицине и ветеринарии, а именно к фармацевтическим препаратам, применяемым при лечении обширных гнойно-некротических посттравматических, послеоперационных ран, обширных ожогов, а также ран после хирургического лечения острых гнойных заболеваний кожи и мягких тканей (абсцедирующие фурункулы, карбункулы, маститы, гидрадениты, рожа и др.), при лечении больных с обширными атеросклеротическими и венозными трофическими язвами, с синдромом диабетической стопы, осложненных инфекционным процессом, вызванным высокорезистентными грамположительными и грамотрицательными аэробными и анаэробными микроорганизмами, грибами, устойчивыми к подавляющему большинству антимикробных и противогрибковых препаратов.
Разработанная комбинированная композиция для местного и наружного применения на основе диоксидина создает оптимальные условия для сокращения сроков проведения системной антимикробной и противогрибковой терапии, позволяют ускорить процесс заживления, улучшить условия для заживления ран.
Известно, что развитие инфекции может происходить, если количество микробов превышает 105 на 1 г ткани раны. "Критический" уровень бактериальной обсемененности может быть значительно меньшим при наличии в ране мертвых тканей или инородных тел, а также при нарушении факторов сопротивляемости организма, нарушении кровообращения, иннервации (Блатун Л.А. и др. «Клинико-лабораторная эффективность современных мазей на полиэтиленгликолевой основе при лечении гнойных ран». Антибиотики и химиотерапия, 1999 г., № N7, стр. 25-31).
Гнойно-воспалительный процесс заболевания мягких тканей представляет собой сложный комплекс реакций, развивающихся в организме в ответ на повреждение тканей. Течение раневого процесса условно делится на три основные фазы.
Фаза I - фаза воспаления, состоящая из двух последовательных периодов: сосудистых изменений и очищения раны за счет подавления микрофлоры и отторжения (рассасывания) нежизнеспособных тканей. В сосудистый период фазы воспаления расширяются сосуды в тканях, прилегающих к стенкам и дну раны; начинается и постепенно усиливается экссудация плазмы и выход лейкоцитов из кровеносных сосудов. Экссудат и клеточные элементы, выделяющие протеолитические ферменты, разжижают участки омертвевших тканей.
Сосудистый период сменяется периодом очищения, разжижением некротических тканей, с отторжением вместе с мелкими инородными телами, удалением их из раны током экссудата, приобретающего характер гноя (//feldsherstvo.ru/186.html). При наличии гноя, очага тканевого распада в ране повышается концентрация парааминобензойной кислоты (ПАБК), которая необходима для жизнедеятельности микроорганизмов.
В I фазе раневого процесса характерной особенностью гнойной раны является наличие в ней гнойно-некротического детрита. Первичные некрозы в ране возникают в результате прямого воздействия механической травмы и микробных токсинов в зоне повреждения. Механизм образования вторичных некрозов более сложен. Развитие гнойного процесса в ране происходит путем разрушения иммунолейкоцитарного барьера экзо- и эндотоксинами бактерий, оказывающими некротизирующее действие на ткани, а также их протеолитическими ферментами и гиалуронидазой, вызывающей деполяризацию основного вещества соединительной ткани.
Таким образом, инфекция проникает в более глубоко расположенные ткани, вызывая их некроз и создавая тем самым благоприятные условия для дальнейшей жизнедеятельности микроорганизмов. При разрушении клеток в ткани выделяются протеолитические и другие гидролитические ферменты, которые оказывают повреждающее действие на стенки раны.
Причиной "вторичных" некрозов является также расстройство регионарной микроциркуляции, вызванное гнойным расплавлением. Нарушение обменных процессов с накоплением недоокисленных продуктов и прогрессирующая локальная гипоксия обусловливают развитие ацидоза, гиперкалиемии и увеличение осмотического давления в тканях. Результатом этих реакций является прогрессирующая гипергидратация тканей, крайняя степень которой ведет к развитию и распространению некроза. Некротические ткани в начальной фазе воспаления обычно плотно фиксированы к дну и краям раны, количество их при неблагоприятном течении процесса может возрастать за счет вторичных некрозов.
При этом возникает ситуация, когда для местного лечения раны необходим подбор препарата, высокоактивного в отношении основного возбудителя (как аэробного, так и анаэробного компонента гнойного процесса), обладающего некролитическими свойствами, длительной осмотической активностью или, наоборот, свойствами, направленными на предупреждение высыхания раневой поверхности, стимуляцию роста грануляций, а в дальнейшем - не препятствующими формированию эпителия (Блатун Л.А. и др. «Клинико-лабораторная эффективность современных мазей на полиэтиленгликолевой основе при лечении гнойных ран». Антибиотики и химиотерапия, 1999 г., №7, стр. 25-31).
После очищения раны в ближайшие сутки (на 3 день) начинается фаза II раневого процесса - фаза регенерации, для которой характерно развитие грануляционной ткани вследствие новообразования капилляров и миграции значительного количества фибробластов. Максимальное количество макрофагов достигается на 6 день и сохраняется на высоком уровне на протяжении 2 недель. Фибробласты раны в этот период активно продуцируют фибронектин и коллаген III типа, замещая ими утраченный матрикс. Постепенно на смену этого процесса приходит продукция коллагена I типа, волокна которого стабилизируются мукополисахаридами межуточного вещества соединительной ткани. Синтез коллагена и белково-полисахаридных комплексов соединительно-тканного матрикса непосредственно связан с процессом новообразования капилляров.
Формирующиеся ткани представляют собой своеобразную биологическую основу, из которых происходит миграция фибробластов, продуцирующих коллаген. На ранних стадиях заживления раны молодые микрососуды обеспечивают доставку кислорода к клеткам, активно синтезирующим белок в ране, так как процессы синтеза в очаге воспаления требуют значительного энергетического обеспечения. Эпителизация раны начинается в первые часы после повреждения. Клетки эпителия, расположенные по краям раны, сдвигаются в сторону раны. В этот период они теряют свою дифференцировку. Грануляционная ткань становится более плотной, число микрососудов, макрофагов, тучных клеток и фибробластов уменьшается.
В течение первых суток образуется 2-4 слоя клеток базального эпителия. При этом эпителий может наползать на покрывающий рану фибрин, лейкоцитарно-некротические массы или грануляционную ткань. Прочной эпителизация раны становится лишь при нарастании эпителия на грануляционную ткань, в других случаях эпителий погибает. Эпителизация небольших по величине ран осуществляется в основном за счет миграции клеток, начинающейся с базального слоя. Рана размером более 0,1 см эпителизируются за счет не только миграции, но и митотического деления клеток эпителия. Дифференцировка мигрирующего эпидермиса выявляется уже в период миграции. При дифференцировке растущего эпителия в клетках его появляется зернистость, поверхностные слои подвергаются ороговению, базальный слой клеток по своей структуре приближается к структуре клеток переходного эпителия. Новообразованный эпителиальный покров отличается от здорового отсутствием потовых и сальных желез, а так же волосяных фолликулов.
В настоящее время, в связи с увеличением числа ран с вялотекущим процессом заживления за счет снижения иммунного статуса, высокой аллергизации пациентов лечение ран в фазе регенерации требует учета возможностей перевязочных средств. Перевязочные средства во 2-ой фазе раневого процесса, особенно на ранней стадии регенерации, должны обеспечивать условия для нормального течения процессов пролиферации клеток регенераторной ткани, благотворно влиять на ангиогенез, подвижность и синтез эпителиальных клеток.
Фаза III - фаза организации рубца и эпителизации характеризуется уменьшением числа фибробластов, снижением активности ферментов, упорядочиванием коллагеновых волокон под воздействием коллагеназы нарастающего эпидермиса. За счет сокращения гладкомышечных клеток происходит сближение краев раны. Первичный нежный коллаген замещается более прочным, в результате чего образуется рубец.
Нормальное заживление ран с формированием полноценного рубца завершается через 25-29 дней с момента их возникновения. В тоже время нередко выявляются признаки перехода острого раневого воспалительного процесса в хронический. В такой ране отмечается возрастание миграции в рану мононуклеарных клеток и уменьшение гранулоцитарных клеток, миграция Т- и В-лимфоцитов. Замедленное течение воспалительного процесса, тенденция к хронизации могут быть обусловлены прогрессированием аутоиммунного механизма.
Перечисленные фазы раневого процесса наблюдают при всех ранах, но они бывают выражены в разной степени, в зависимости от вида заживления: первичным натяжением, вторичным натяжением или под струпом - фаза регенерации, образования и созревания грануляционной ткани.
Между фазами нет резкой границы. Более того, в обширных ранах с рваными ушибленными краями все три фазы могут наблюдаться одновременно, в то время как на одном участке рана уже очистилась и заполняется грануляциями, на другом - еще только разрастается молодая грануляционная ткань на дне раны, а на третьем - еще продолжается затянувшийся период очищения, т.е. первая воспалительная фаза, и отчетливо видны участки некротизированных тканей, ограниченные от прилежащих тканей ростом грануляционной ткани (http://feldsherstvo.ru/186.html).
Свежие раны до момента покрытия их грануляциями способны всасывать токсины, бактерии, продукты распада тканей. Раны, покрытые грануляциями, практически не обладают всасывающей способностью.
Нарушение процесса заживления находится в прямой зависимости не только от общих и местных факторов, но и от неправомерного использования устаревших препаратов для местного лечения ран: гипертонического раствора хлорида натрия, ихтиоловой, стрептоцидовой, тетрациклиновой, фурациллиновой, гентамициновой и других мазей на жировой основе.
В I фазе раневого процесса все лечебные препараты должны обладать широким спектром антимикробного действия (с антибактериальной, антикандидозной и вирулоцидной активностью), высокими осмотическими свойствами, чтобы обеспечить интенсивный отток экссудата из глубины раны в повязку, отторжение и расплавление некротических тканей и эвакуацию раневого содержимого. Также они должны обеспечивать проникновение лекарства в зону повреждения для создания терапевтической эффективности, а также оказывать противовоспалительное и обезболивающее действие. При этом всасывание в кровь должно быть минимальным для снижения общих токсических эффектов («Фармакокоррекция раневого процесса», http://www.provisor.com.ua/archive/2007/N15/process.php).
Во II фазе раневого процесса, наряду с подавлением оставшихся в небольшом количестве микробов или вновь появившихся госпитальных штаммов, в ране вследствие нарушения асептики и антисептики в момент перевязок препарат должен обеспечивать оптимальные условия для роста грануляций.
Применяемые для местного лечения ран лекарственные препараты должны соответствовать современным требованиям, предъявляемым к лекарственным средствам этой фармакотерапевтической группы: обладать противовоспалительным действием, тормозить развитие раневого и перифокального воспаления в тканях, подавлять рост микроорганизмов в ране и, что особенно важно, оказывать антибактериальное действие в отношении госпитальных штаммов бактерий, полирезистентных к антибиотикам и антисептикам.
Полимерным гидрофильным водорастворимым основам таких препаратов должны быть присущи осмотические и сорбционные свойства, то есть они должны адсорбировать некротизированные клетки, продукты распада и воспаления, очищая таким образом рану, но не должны вызывать осмотического лизиса здоровых клеток и препятствовать росту грануляций.
Многие современные препараты для местного лечения ран перестали обладать необходимой антимикробной активностью из-за формирования к ним резистентности микроорганизмов. Как показывают многочисленные исследования, изменилась структура возбудителей гнойных осложнений ран. Наряду с традиционными грамположительными и грамотрицательными аэробными микроорганизмами значительная доля приходится на анаэробные микроорганизмы, грибы (http://bibliofond.ru/view. aspx?id=556568).
Широкое, зачастую бесконтрольное и недостаточно обоснованное использование в медицине антибиотиков, антимикотиков, кортикостероидов и иммунодепрессантов, нарушение рекомендаций по их применению привело к распространению штаммов, обладающих множественной устойчивостью к антимикробным препаратам.
Известны плазмиды стафилококков, несущие гены устойчивости к пенициллину, гентамицину, тетрациклину, метициллину, линкомицину, сульфаниламидам, а также к антибиотикам нового поколения: фторхинолонам, цефалоспоринам II и III поколений, гликопептидам и другим. («Современные подходы к терапии инфекционных заболеваний кожи». И.М. Кириченко, http://old.consilium-medicum.com/media/consilium/06_01c/12.shtml).
Наблюдается низкая чувствительность протеев и стафилококков в ассоциации к наиболее широко применяемым в практике «старым» антибиотикам (ампициллину, карбенициллину, эритромицину, линкомицину, ристомицину, левомицетину, тетрациклину). При этом большинство штаммов протеев и стафилококков, выделенных в монокультуре, оказались резистентными к «старым» антибиотикам: пенициллину, тетрациклину и левомицетину.
С учетом этого оправдана разработка лекарственных форм для лечения ран, содержащих не антибиотики, а антисептики, резистентность микроорганизмов к которым развивается медленнее («Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном». Медицина, здоровье, http://uchi-referat.ru/medicina-zdorove/2921-razrabotka-sostava-i-tehnologii-polucheniyа-mazi-soderzhashhey-biokompleks-kobalta-s-furazolidonom.html).
Применение антисептиков при местных и системных инфекционных процессах вызвано рядом целей:
1) предупреждение генерализации процесса;
2) снижение численности популяции и подавление жизнедеятельности находящихся в инфекционном очаге микробов;
3) предупреждение перехода острых местных инфекционных процессов в хроническую форму в результате суперинфекции, реинфекции и вторичной инфекции, заноса микроорганизмов из внешней среды, с других областей тела больного или в результате активации местной аутофлоры;
4) сохранение нормальной микрофлоры в пораженном органе, а в случае изменения ее восстановление.
Для профилактической и терапевтической антисептики ран имеется большой выбор антисептиков. Однако и для антисептиков в настоящее время наблюдается снижение к ним чувствительности бактерий («Эффективность лечения гнойно-воспалительных заболеваний мягких тканей препаратом «Абсил1»», автореферат дис. канд. мед. наук (14.00.27) / Л.А. Лацерус - Иркутск, 1999 г.).
В настоящее время отмечается значительное распространение среди больничных и внебольничных штаммов-микроорганизмов биологически устойчивых форм к широко применяемым антисептикам («Разработка состава и технологии получения мази, содержащей биокомплекс кобальта с фуразолидоном», «Медицина, здоровье», http://uchi-referat.ru/medicina-zdorove/2921-razrabotka-sostava-i-tehnologii-polucheniya-mazi-soderzhashhey-biokompleks-kobalta-s-furazolidonom.html).
К 90-м годам XX века появились публикации о микробной контаминации почти всех используемых в практике медицины типов антисептиков и обнаружении в них представителей всех систематических групп бактерий и грибов (Суфияров Р.С. «Лечение гнойно-воспалительных заболеваний мягких тканей протейно-стафилококковой природы», автореферат дисс. канд. мед. наук (14.00.27) / Р.С. Суфияров - Уфа, 1998 г.).
Несколько лет назад в Индии был обнаружен ген NDM-1, который обеспечивает бактерии устойчивостью к огромному числу антибиотиков, включая карбапенемы. Появление этого гена уже зафиксированы и в других странах, включая Великобританию и США. Инфекции, содержащие ген NDM-1, становятся очень опасными и поддаются лечению только сложной смесью препаратов (https://nplus1.ru/news/2015/11/19/panresistance).
Формирование устойчивости микроорганизмов к широко используемым в клиниках препаратам диктует необходимость разработки и внедрения новых комплексных лекарственных средств с широким спектром терапевтической активности не только в отношении аэробного, но и анаэробного компонента и грибов, а также для соответствующих фаз раневого процесса.
Следует отметить, что все травматические, большинство ожоговых ран и многие хирургические раны первично микробно загрязнены. Первоначальное загрязнение раны состоит из сапрофитов, насчитывающих более 200 видов. В течение 24 часов из загрязненной раны исчезают сенные бациллы и почвенные бактерии и остаются обычно стафилококки как господствующая микрофлора. Стрептококки и грамотрицательные бактерии проникают вторично. Поэтому основным объектом борьбы с нагноением ран в начальной стадии I фазы раневого процесса следует считать стафилококки.
В последние 30 лет в практике лечения гнойных ран различной локализации и генеза с успехом используются многокомпонентные мази на ПЭГ основе (левосин, левонорсин, метрокаин, левомеколь) в состав которых входит левомицетин, показывающий достаточно высокую активность в отношении госпитальных штаммов грамположительных микроорганизмов и недостаточно активных в отношении Ps. aeruginosa, Acinetobacter spp. Proteus spp., E coli.
Этот недостаток отсутствует у мазей для лечения ран в I фазе раневого процесса, в состав которых введен диоксидин («Диоксидин 5%», мазь «Диоксиколь», «Лидоксиколь»). Для лечения гнойных ран во II фазе раневого процесса известна мазь с диоксидином «Метилдиоксилин».
Состав вышеуказанных мазей следующий.
Мазь «Диоксидин 5%»: диоксидин - 5%, нипагин - 0,08%, эфир пропиловый параоксибензойной кислоты (пропилпарабен) - 0,02%, ПЭО-400 - 74,9%, ПЭО-1500 - 20% (http://www.piluli.ru/product525505/product_info.html).
Мазь «Диоксиколь»: диоксидин - 1%, метилурацил - 4%, тримекаин - 4%, ПЭО-400 - 72,8%, ПЭО-1500 - 18,2% («Теория и практика местного лечения гнойных ран» под ред. Б.М. Даценко, Киев, изд-во «Здоровье», 1995 г., стр. 241).
Мазь «Лидоксиколь»: диоксидин - 1%, метилурацил - 4%, лидокаина гидрохлорид - 2%, ПЭО-400 - 73,8%. ПЭО-1500 - 19,2%. (Т.В. Пушкина и др. «Экспериментальная оценка химиотерапевтической эффективности и токсичности новой лекарственной формы диоксидина - мази «Лидоксиколь»», Химико-фармацевтический журнал, том 42, №7, 2008 г., стр. 34-37; патент RU 2283088, А61K 9/06, 10.09.2006, «Комбинированное противомикробное средство для лечения гнойных ран»).
Мазь «Метилдиоксилин» - диоксидин - 1%, метилурацил - 10%, винилин - 15%, ПЭО-400 - 31%, эмульгатор №1 - 8%, вода дистиллированная - 35% (http://medlec.org/lek2-63461.html).
Кроме того, на основе диоксидина известна газообразная фармацевтическая композиция в виде аэрозоля «Диоксизоль», в ее составе (г/упаковку): диоксидин - 0,6, тримекаин - 3,0, проксанол-268 - 12,6, 1,2-пропиленгликоль - 20,3, вода очищенная - 13,5, хладон-12 - 10,0 («Теория и практика местного лечения гнойных ран» / Под ред. Б.М. Даценко, Киев, изд-во «Здоровье», 1995 г., стр. 260).
Известные фармацевтические комбинированные композиции с диоксидином имеют следующие недостатки.
Как указано выше, изменилась структура возбудителей гнойных осложнений ран. Наряду с традиционными грамположительными и грамотрицательными аэробными микроорганизмами значительная доля приходится на анаэробные микроорганизмы, которые высокочувствительны к действию диоксидина, а также на грибы и простейшие, которые в основном не чувствительны к действию диоксидина.
Известные фармацевтические композиции с диоксидином обладают высокой антианаэробной активностью, но не имеют выраженного некролитического действия, что важно при лечении гнойных ран в I фазе раневого процесса.
Кроме того, минимальные подавляющие концентрации (МПК, мкг/мл) диоксидина по отношению P. aeruginosa (125,0-1000,0 мкг/мл), S. aureus (62,5-1000,0 мкг/мл), Streptococcus spp.(64,0->1000,0 мкг/мл) значительно выше, чем для других аэробных и анаэробных бактерий («Сложные вопросы антимикробной химиотерапии», Е.Н. Падейская, таблица 1 и таблица 2, журнал «Инфекции и антимикробная терапия», том 3/№5/2001 г, www.consilium-medicum.com/article/8003).
В качестве композиции сравнения нами выбрана фармацевтическая композиция в виде мягкой формы - мази по патенту RU 2283088, А61К9/06, 10.09.2006.
В указанном патенте описано противомикробное средство для лечения гнойных ран в виде мази, содержащее антибактериальное средство - диоксидин, средство, ускоряющее процессы клеточной регенерации - метилурацил, местноанестезирующее средство, основу - полиэтиленоксиды, отличающееся тем, что в качестве местноанестезирующего средства содержит лидокаина гидрохлорид, основы - полиэтиленоксид 400 и 1500, при массовом соотношении диоксидина, метилурацила, лидокаина гидрохлорид 1:4:2 и полиэтиленоксида 400 и 1500 (3,5-3,6):1.
Эта композиция, как и мазь «Диоксиколь», характеризуется широким антибактериальным спектром в отношении грамположительных и грамотрицательных аэро- и анаэробных бактерий с преимущественной наиболее высокой активностью в отношении облигатных анаэробов. При этом она по спектру действия идентична мази «Диоксиколь» (Т.В. Пушкина и др. «Экспериментальная оценка химиотерапевтической эффективности и токсичности новой лекарственной формы диоксидина - мази «Лидоксиколь»», Химико-фармацевтический журнал, том 42, №7, 2008 г., стр. 34-37).
Выбранная в качестве прототипа композиция имеет все вышеуказанные недостатки, присущие известным композициям с диоксидином.
Наиболее перспективный и реальный метод, ограничивающий появление и накопление устойчивых бактерий в организме или компенсирующий снижение терапевтической активности фармацевтической композиции из-за резистентности к ним патогенных микроорганизмов, - это повышение эффективности терапии за счет использования комбинаций различных антимикробных компонентов в одном фармацевтическом препарате.
Для эффективного лечения гнойных ран в настоящее время достаточно широко применяются комбинированные препараты, которые выпускаются в фиксированных лекарственных формах. В их состав обычно входят два-три антимикробных средства. Выбор сочетания компонентов комбинированных композиций предусматривает:
1) усиление активности комбинированной композиции по сравнению с действием препарата, содержащего один активный компонент;
2) расширение спектра действия комбинированной композиции, включая активность и в отношении резистентных штаммов к тому или другому компоненту в сочетании;
3) возможность снижения частоты развития лекарственной устойчивости к определенной группе антимикробных препаратов в композиции;
4) улучшение переносимости лекарств, уменьшение частоты и тяжести побочных реакций, в первую очередь, за счет снижения лечебных доз препарата («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина». Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр.1 -6).
Задачей предлагаемого изобретения является создание фармацевтической комбинированной композиции в виде жидкой, мягкой, твердой и газообразной лекарственной формы на основе диоксидина, основы и целевых добавок, обеспечивающей лечение гнойных ран и ожогов, гнойно-воспалительных заболеваний кожи и др. и улучшающей условия очищения ран от гнойно-некротических тканей, подавляющей рост микрофлоры, резистентной к подавляющему числу антибактериальных препаратов, сокращающей сроки периода острого гнойного процесса.
При использовании предлагаемого изобретения могут быть получены следующие технические результаты: повышение терапевтической активности в сравнении с известными препаратами, в том числе к штаммам микроорганизмов, резистентных к отдельным компонентам композиции, улучшение течения раневого процесса, быстрое очищение раны, снижение содержания гнойного отделяемого и признаков местных воспалительных реакций, обеспечения анестезирующего эффекта, сокращение времени реконвалесценции.
Для решения поставленной задачи в настоящем изобретении предлагается фармацевтическая комбинированная композиция для наружного и местного применения, содержащая диоксидин, основу, и, по меньшей мере, одну целевую добавку, выбранную из ряда: анестетик, стимулятор репаративных процессов, а также из ряда дополнительных целевых добавок: бактериолитический, протеолитический, коллагенолитический фермент или их комплекс, антибиотик, синтетическое антибактериальное средство (кроме антибиотика), в том числе вещество, снижающее резистентность микроорганизмов, антимикотик, иммуномодулятор, при следующем соотношении компонентов (мас.%):
| диоксидин | 0,1-5,0 |
| анестетик | 0,5-6,5 |
| стимулятор репаративных процессов | 0,5-10,5 |
| антибиотик | 0,05-5,0 |
| антимикотик | 0,5-3,5 |
| фермент или комплекс ферментов | 0,05-20,00 |
| синтетическое антибактериальное средство | 0,001-15,500 |
| иммуномодулятор | 0,05-12,50 |
| основа | остальное |
Предлагаемая фармацевтическая комбинированная композиция в качестве анестетика содержит лидокаин или тримекаин, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве стимулятора репаративных процессов содержит вещества, выбранные из ряда: ксимедон, метилурацил, солкосерил, пантотеновая кислота в виде, например, кальция пантотената, этаден или их физиологически приемлемую смесь, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве антибиотика содержит вещества, выбранные из ряда: офлоксацин, ципрофлоксацин, нетилмицин, амикацин, левомицетин, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве антимикотика содержит клотримозол или циклопироксоламин, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве бактериолитического, протеолитического, коллагенолитического фермента или их комплекса содержит лизоамидазу, или ультрализин, или имозимазу, или лизоцим, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве синтетического антибактериального средства, в том числе снижающего резистентность микроорганизмов, содержит вещество, выбранное из ряда: хинофурил, этилендиаминтетрауксусная кислота, ее динатриевая соль - трилон Б, производное диаминопиримидина триметоприм, димексид, поверхностно-активный антисептик или их физиологически приемлемую смесь, не ограничиваясь ими.
В качестве синтетического антибактериального средства в виде поверхностно-активного антисептика, снижающего резистентность микроорганизмов, композиция содержит вещество, выбранное из ряда: мирамистин, декаметоксин, катапол, полигексанид, октенидин, натрия лаурилсульфат, не ограничиваясь ими.
Предлагаемая фармацевтическая комбинированная композиция в качестве иммуномодулятора содержит вешества, выбранные из ряда: полиоксидоний, циклоферон, тилорон, не ограничиваясь ими.
Кроме того, композиция содержит, при необходимости, по меньшей мере, одни компонент из ряда: консервант, стабилизатор, неионогенный детергент, солюбилизатор или их смесь.
Предлагаемая фармацевтическая комбинированная композиция в качестве основы содержит гидрофильные вещества, выбранные из ряда: проксанол (эмуксол), полиэтиленоксид, пропиленгликоль, поливинилпирролидон, гель полиэтиленоксида 1500, глицерогидрогель на основе глицератов кремния, альгинат кальция или магния, сополимер акриловой кислоты, натрий-карбоксиметилцеллюлозу, окисленную целлюлозу, метилцеллюлозу, глицерин, или физиологически приемлемую смесь в различных их сочетаниях, обеспечивающих реологические требования к основе в зависимости от лекарственной формы фармацевтической комбинированной композиции и, в случае необходимости, в смеси, по меньшей мере, с одним веществом из ряда: фосфатный буферный раствор, очищенная вода, вазелиновое масло, эмульгатор, спирты высших жирных синтетических фракций, цетиловый спирт, стеариловый спирт, винилин, повидон или их комбинации.
Предлагаемая фармацевтическая комбинированная композиция выполнена в виде жидкой лекарственной формы: раствора, суспензии, не ограничиваясь ими, или мягкой лекарственной формы: мази, геля, линимента, суппозиториев, не ограничиваясь ими, или твердой лекарственной формы: капсул для ректального иди вагинального применения, или в виде газообразной лекарственной формы: аэрозоля или спрея.
В качестве основного активного вещества предлагаемой комбинированной композиции вместе с целевыми добавками используется синтетическое антибактериальное вещество, не являющееся антибиотиком, - диоксидин (1,4-ди-N-окись-2,3-бис-(оксиметил)-хиноксалина), представляющее собой зеленовато-желтый кристаллический порошок без запаха, горького вкуса. При комнатной температуре это вещество растворимо в воде до 1%, при 37°С - до 3%, разлагается под действием света со снижением активности («Теория и практика местного лечения гнойных ран», под редакцией проф. Б.М. Даценко, Киев, изд-во «Здоровье», 1995 г., стр. 152).
В основе механизма действия диоксидина лежит повреждение биосинтеза ДНК микробной клетки с глубокими нарушениями структуры нуклеотида при действии субингибирующих концентраций. Диоксидин избирательно тормозит образование ДНК в клетке микроорганизма, не влияя на образование РНК и протеина. Он провоцирует структурные нарушения мембраны клетки и нуклеотида микроорганизма, ингибирует действие бактериальной нуклеазы и токсинов.
Производные диаминопиримидина потенцируют активность ди-N-окисей хиноксалина, к которым относится диоксидин. Это позволяет снизить концентрацию диоксидина при их совместном применении. Производными диаминопиримидина являются: пириметамин, триметоприм, тетроксоприм, метиоприм, бродимоприм, орметоприм («Антимикробные препараты в ряду производных сульфаниламида, диаминопиримидина, 5-нитроимидазола, ди-N-оксихиноксалина». Падейская Е.Н., РМЖ №21 от 04.11.1997 г., стр. 1-6).
В России в качестве лекарственного средства зарегистрированы пириметамин и триметоприм.
Производные диаминопиримидинов избирательно ингибируют в микробной клетке дигидрофолатредуктазу (фермент ДФР) с последующим нарушением синтеза тетрагидрофолиевой кислоты. Диаминопиримидины имеют широкий антимикробный спектр. Например, триметоприм активен в отношении грамположительных и грамотрицательных аэробных бактерий (http://www.zdravosil.ru/lekarstvennye-sredstva-dlya-lecheniya-bakterialnyx/page/126/).
Диоксидин характеризуется широким антибактериальным спектром, бактерицидным типом действия. Он высокоактивен в отношении анаэробных бактерий с преимущественной наиболее высокой активностью в отношении широкого спектра облигатных анаэробов - спорообразующих и не образующих споры (неклостридиальных). Кроме того, препарат активен в отношении грамотрицательных и грамположительных аэробных условно-патогенных бактерий - возбудителей гнойной инфекции, а также в отношении некоторых облигатных патогенов - сальмонелл, шигелл, холерного вибриона, иерсиний.
В опытах с аэробными микроорганизмами диоксидин наиболее активен в отношении грамотрицательных бактерий: нейссерий, энтеробактерий - сальмонелл, шигелл, холерного вибриона, кишечной палочки, клебисиелл. Штаммы синегнойной палочки и грамположительные бактерии - стафилококки, стрептококки более устойчивы к диоксидину (Е.Н. Падейская. «Сложные вопросы антимикробной химиотерапии», «Инфекции и антимикробная терапия», 2001 г., том 3, №5).
Диоксидин менее активен в отношении некоторых грамположительных бактерий - Staphylococcus spp., S. aureus, S. pyogenes (Руководство «Рациональная антимикробная фармакотерапия» / Под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, изд-во «Литтерра», 2003 г., стр. 750-752).
Диоксидин действует на штаммы бактерий, устойчивые к другим противобактериальным лекарственным средствам, включая антибиотики. Возможно развитие лекарственной устойчивости бактерий к нему.
При местном применении диоксидин не обладает раздражающим действием, кроме того он способствует более быстрому течению репаративных процессов и эпителизации раны («Антибактериальный препарат диоксидин: особенности биологического действия и значение в терапии различных форм гнойной инфекции». Падейская Е.Н., «Инфекция и антимикробная терапия», 2001 г., 5, стр. 150-155).
При обработке ожогов и нагноившихся ран препарат эффективно очищает поверхность раны и стимулирует процесс восстановления тканей («Все о диоксидине», www.tiensmed.ru/news/dioxidin-x2a.html).
Бактерицидные концентрации диоксидина зависят от вида бактерий, микробной нагрузки и экспозиции, они превышают МПК (минимальную подавляющую концентрацию) в 2-4 раза. К диоксидину чувствительны клинические штаммы бактерий с полирезистентностью к антибиотикам. В отношении бактероидов МПК диоксидина составляет 0,062-2,000 мкг/мл, пептококков - 0,2-0,5 мкг/мл, клостридий - 1-2 мкг/мл («Теория и практика местного лечения гнойных ран» / Под ред. В.М. Даценко, Киев, изд-во «Здоровье», 1995 г., стр. 152, 153).
Выработка устойчивости бактерий к диоксидину и возможность появления госпитальных штаммов, резистентных к нему, значительно ниже, чем развитие резистентности микробов к антибиотикам. То есть лекарственная устойчивость к диоксидину развивается достаточно медленно. Как правило, отсутствует перекрестная устойчивость с другими классами антимикробных препаратов.
Диоксидин хорошо сочетается с антибактериальными лекарственными средствами других фармакологических групп. Целесообразно введение диоксидина в комбинированную антибактериальную терапию, когда необходима активность в отношении анаэробной флоры, синегнойной палочки, полирезистентных штаммов стафилококков. Возможно комбинированное применение диоксидина с бета-лактамами, ванкомицином, аминогликозидами, фторхинолонами (Руководство «Рациональная антимикробная фармакотерапия» / Под редакцией д.м.н. В.П. Яковлева и д.м.н. С.В. Яковлева, из-во «Литтерра», 2003 г., стр. 750-752).
Диоксидин проявляет бактерицидную активность в диапазоне концентраций от 0,1% до 5%. Он выпускается в виде 0,5% и 1,0% водного раствора, 1% и 5% мази, а также аэрозолей. В сочетании с полиэтиленоксидами антибактериальная активность диоксидина усиливается в 18-20 раз. («Теория и практика местного лечения гнойных ран» / Под ред. Б.М. Доценко, Киев, изд-во «Здоровье», 1995 г., стр. 152).
Активность диоксидина повышается в анаэробных условиях, причем величины МПК в этом случае могут быть снижены в 8-128 раз, так как происходит активация свободнорадикальных процессов в условиях анаэробиоза. Повышение активности в анаэробных условиях характерно для всех производных ди-N-хиноксалина с антимикробной активностью, и не описано для других классов антимикробных веществ. В этом принципиальное отличие механизма действия диоксидина от механизма действия других антимикробных препаратов. В условиях анаэробиоза, в том числе и в инфицированном организме, диоксидин активирует свободнорадикальные процессы, индуцируя образование активных форм кислорода. (Е.Н. Падейская. «Сложные вопросы антимикробной химиотерапии». «Инфекции и антимикробная терапия», том 3, №5, 2001 г.).
Диоксидин индуцирует генные мутации, а также летальные мутации в зародышевых клетках млекопитающих. Это свидетельствует о потенциальной генетической опасности диоксидина. При этом токсические эффекты диоксидина проявляются в основном при внутривенном введении. Мутагенная активность диоксидина непосредственно связана с ДНК-тропным действием препарата. Процесс дозозависимый и проявляется, как в опытах с м