Полипептид, гликозилированный сиалилированной сахарной цепью
Иллюстрации
Показать всеИзобретение относится к области биохимии. Описана группа изобретений, включающая гликозилированный полипептид, обладающий активностью интерферона β и имеющий лучшее удерживание в крови по сравнению с природным человеческим интерфероном β (варианты), и фармацевтическая композиция, содержащая вышеуказанный гликозилированный полипептид. В одном из вариантов гликозилированный полипептид содержит гликозилированные аминокислоты в 4-6 положениях, и причем все из невосстанавливающих концов сахарных цепей являются сиалилированными. В другом варианте изобретения гликозилированный полипептид представляет собой любой полипептид, выбранный из группы, состоящей из: (1) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID NO. 1; (2) полипептида, состоящего из аминокислотной последовательности, представленной SEQ ID NO. 1, в которой от одной до десяти аминокислот удалены, замещены или добавлены; (3) полипептида, обладающего 90% или более гомологией с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID NO. 1. Изобретение расширяет арсенал гликозилированных полипептидов, обладающих активностью интерферона β. 3 н. и 12 з. п. ф-лы, 16 ил., 4 табл., 15 пр.
Реферат
Область техники, к которой относится изобретение
Настоящее изобретение относится к полипептиду, гликозилированному сиалилированной сахарной цепью. В частности, настоящее изобретение относится к полипептиду, обладающему активностью интерферона β, гликозилированному высокооднородными сиалилированными сахарными цепями.
Сведения о предшествующем уровне техники
Природный человеческий интерферон β (IFN-β) представляет собой гликопротеин, состоящий из 166 аминокислотных остатков. Интерферон β принадлежит семейству цитокинов и, как известно, вовлечен в иммунорегулирующее действие, антивирусную активность и ингибирующее клеточный рост действие. Кроме того, человеческий интерферон β содержит три Cys в положениях 17, 31 и 141 природной аминокислотной последовательности и один сложный N-связанный олигосахарид при Asn в положении 80. Кроме того, известно, что человеческий интерферон β содержит дисульфидную связь по Cys в положениях 31 и 141.
Интерферон β в качестве фармацевтического средства получают с использованием экспрессионной системы на основе клеток, и классифицируется на IFN-β-1а или IFN-β-1b в зависимости от хозяина для экспрессии. IFN-β-1а получают в экспрессионной системе на основе клеток яичника китайского хомячка (СНО), и он представляет собой гликопротеин, содержащий сахарные цепи, сходные с природным интерфероном β. С другой стороны, IFN-β-1b экспрессируется в Е. Coli и представляет собой белок без сахарных цепей.
Известно, что IFN-β-1а обладает более сильным действием по сравнению с IFN-β-1b в отношении иммуногенности, антивирусной активности и противоопухолевых свойств. Кроме того, структура сахарной цепи, содержащаяся в гликопротеине, как известно, оказывает сильное влияние на фармакокинетику.
Кроме того, известно, что такие эффекты, как улучшение физической стабильности, устойчивости к тепловому воздействию и стабильности в плазме белка, достигаются путем связывания водорастворимого полимера, такого как полиэтиленгликоль (PEG), с белком. Имеются сообщения, касающиеся пегилированного IFN-β с такими предполагаемыми эффектами. Например, имеются сообщения, касающиеся комплекса IFN-β, который пегилирован на N-конце IFN-β-1b (патентная литература 1 и 2). Также, имеются сообщения, касающиеся комплекса IFN-β, который пегилирован на N-конце IFN-β-1а (патентная литература 3). Такие модификации могут действительно способствовать вышеуказанным стабильностям белка, но при этом вызывают проблемы, связанные с тем, что они понижают активность IFN-β в качестве фармацевтического средства. Например, сообщалось, что активность значительно уменьшается в случаях, например, когда молекулярная масса PEG составляет 20000 или выше (непатентная литература 1).
С учетом описанных выше проблем, связанных с пегилированием, имеется также сообщение, касающаяся выбора положения, которое может сохранять активность IFN-β даже в случае присоединения высокомолекулярного PEG для сайт-специфического пегилирования (патентная литература 4). Однако, поскольку PEG представляет собой соединение, которое не существует in vivo, до сих пор не было проведено надлежащего исследования, касающегося накопления, безопасности и эффективности длительного введения пегилированного IFN-β.
Между тем, имеется сообщение, касающееся сайт-специфических гликозилированных комплексов IFN-β (патентная литература 5). В патентной литературе 5 в аминокислотную последовательность природного IFN-β введена аминокислотная мутация, таким образом, что природный IFN-β содержит консенсусную последовательность (Asn-X-Ser/Thr), которая будет являться сайтом узнавания для N-связанной сахарной цепи, и это экспрессируется в клетках яичника китайского хомячка (СНО). Однако таким способом получают аминокислотные мутации, которые отличаются от подлежащей гликозилированию аминокислоты, для введения консенсусной последовательности. Также, в целом известно, что в случае экспрессии клетками СНО будет возникать неоднородность сахарных цепей.
Перечень ссылок
| [Патентная литература 1] | Опубликованная заявка на патент США №2009/0214472 |
| [Патентная литература 2] | Заявка на патент США №7829659 |
| [Патентная литература 3] | Заявка на патент США №7446173 |
| [Патентная литература 4] | Международная публикация №2005/019260 |
| [Патентная литература 5] | Международная публикация №02/074806 |
| [Непатентная литература 5] | J. Control. Rel. Vol. 88, pp. 35-42 (2003) |
Краткое описание изобретения
Проблемы, подлежащие решению с помощью изобретения
Например, для модификации полипептида интерферона β используют PEG для улучшения физической стабильности, теплостойкости, стабильности в плазме, и тому подобного, интерферона β, как описано выше. Однако, как описано выше, активность интерферона β в качестве фармацевтического средства может уменьшаться в случае модификации с использованием PEG. Кроме того, так как PEG не представляет собой вещество, которое существует in vivo, то имеется проблема, связанная с неблагоприятными явлениями, индуцированными лекарственным средством вследствие накопления in vivo.
С другой стороны, существует также пример модификации полипептида интерферона β сахарной цепью. Однако, как описано выше, известно, что в случае получения гликозилированного интерферона β путем экспрессии в клетках СНО, возникает неоднородность в добавленном типе сахарной цепи или добавленном положении. В случае, когда сахарные цепи не являются однородными, существует вероятность того, что действие лекарственного препарата как лекарственного средства будет различаться между партиями, и, кроме того, возникает недостаток, связанный с коротким периодом удерживания в крови природного гликозилированного интерферона β.
Способы решения проблем
В результате всестороннего исследования, проведенного авторами настоящего изобретения для решения указанных выше проблем, было обнаружено, что гликозилированный полипептид, имеющий лучшее удерживание в крови и лучшую противоопухолевую активность по сравнению с природным человеческим интерфероном β, может быть получен путем замещения аминокислот в 4-6 положениях гликозилированными аминокислотами, при этом все невосстанавливающие концы сахарной цепи являются сиалилированными в полипептиде интерферона β.
Другими словами, в одном аспекте настоящее изобретение относится к гликозилированному полипептиду, обладающему активностью интерферона β, при этом указанный гликолизированный полипептид представляет собой любой полипептид, выбранный из группы, состоящей из следующих с (1) по (4):
(1) полипептид, состоящий из аминокислотной последовательности, представленной SEQ ID NO. 1;
(2) полипептид, состоящий из аминокислотной последовательности, представленной SEQ ID NO. 1, где одна или несколько аминокислот, удаленных, замещены или добавлены,
(3) полипептид, который является аналогом интерферона β; и
(4) полипептид, имеющий 80% или более гомологии с полипептидом, состоящим из аминокислотной последовательности, представленной SEQ ID NO. 1,
в котором аминокислоты в четырех-шести положениях являются замещенными гликозилированными аминокислотами, и в котором все невосстанавливающие концы указанной сахарной цепи являются сиалилированными.
В одном аспекте настоящего изобретения указанная соответствующая гликозилированная аминокислота, каждая, может независимо представлять гликозилированный Cys или гликозилированный Asa.
В одном аспекте настоящего изобретения сахарные цепи в указанной соответствующей гликозилированной аминокислоте все могут быть независимо выбраны из группы, состоящей из дисиало-сахарной цепи, трисиало-сахарной цепи и тетрасиало-сахарной цепи.
В одном аспекте настоящего изобретения сахарные цепи в указанной соответствующей гликозилированной аминокислоте все могут быть независимо выбраны из группы, состоящей из следующей формулы (1), формулы (2), формулы (3) и формулы (4).
Химическая формула 1
Химическая формула 2
Химическая формула 3
Химическая формула 4
В одном аспекте настоящего изобретения сахарные цепи в указанной соответствующей гликозилированной аминокислоте все могут быть идентичными.
В одном аспекте настоящего изобретения, по меньшей мере, одна из указанных соответствующих гликозилированных аминокислот может присутствовать в положении, соответствующем положению, выбранному из группы, состоящей из положений 1, 3, 7, 24, 25, 28, 29, 32, 35, 38, 41, 42, 45, 46, 47, 48, 49, 50, 70, 75, 79, 99, 103, 106, 107, 109, 112, 115, 123, 130, 136, 139 и 164 в аминокислотной последовательности, представленной SEQ ID NO. 1.
Кроме того, в одном аспекте настоящего изобретения все из указанных соответствующих гликозилированных аминокислот могут представлять собой такие аминокислоты, которые не присутствуют в положении, соответствующем положениям 2, 5, 6, 9, 12, 13, 16, 19, 20, 23, 27, 33, 37, 39, 40, 43, 53, 54, 55, 57, 58, 61, 62, 64, 65, 68, 69, 73, 78, 83, 86, 87, 90, 93, 94, 100, 124, 125, 128, 131, 132, 138, 141, 142, 145, 148, 149, 152, 153, 156, 159,160 или 163 в аминокислотной последовательности, представленной SEQ ID NO. 1.
В одном аспекте настоящего изобретения, по меньшей мере, одна из указанных соответствующих гликозилированных аминокислот может присутствовать в положении, соответствующем положению, выбранному из группы, состоящей из положений 1, 3, 41, 48, 75, 79, 107, 112, 123 и 136 в аминокислотной последовательности, представленной SEQ ID NO. 1.
В одном аспекте настоящего изобретения, по меньшей мере, три из указанных соответствующих гликозилированных аминокислот могут присутствовать в положении, соответствующем положению, выбранному из группы, состоящей из положений 1, 3, 41, 48, 75, 79, 107, 112, 123 и 136 в аминокислотной последовательности, представленной SEQ ID NO. 1.
В одном аспекте настоящего изобретения указанные соответствующие гликозилированные аминокислоты все могут присутствовать в положении, соответствующем положению, выбранному из группы, состоящей из положений: 1, 3, 7, 24, 25, 28, 29, 32, 35, 38, 41, 42, 45, 46, 47, 48, 49, 50, 70, 75, 79, 99, 103, 106, 107, 109, 112, 115, 123, 130, 136, 139 и 164 в аминокислотной последовательности, представленной SEQ ID NO. 1.
В одном аспекте настоящего изобретения указанный гликозилированный полипептид может быть синтезирован химически.
Кроме того, в одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей:
(1) указанный гликозилированный полипептид и/или его фармацевтически приемлемую соль, и
(2) фармацевтически приемлемый носитель.
В одном аспекте настоящего изобретения указанную фармацевтическую композицию можно применять для терапии или предупреждения заболевания, связанного с интерфероном β. В настоящем документе указанное заболевание может быть выбрано из группы, состоящей из опухоли головного мозга, кожной злокачественной меланомы, хронического активного гепатита В, хронического гепатита С, подострого склерозирующего панэнцефалита, компенсированного цирроза печени С и множественного склероза.
Кроме того, в одном аспекте настоящего изобретения последовательность гликозилированного полипептида, аминокислота в гликозилированной аминокислоте, тип и структура сахарной цепи в гликозилированной аминокислоте, положение аминокислотного замещения гликозилированной аминокислотой, способ синтеза гликозилированного полипептида в качестве фармацевтической композиции, описанной ранее, могут представлять собой любую комбинацию, выбранную соответственно из указанных выше групп.
Эффекты изобретения
Гликозилированный полипептид согласно настоящему изобретению имеет однородную структуру сахарной цепи, так как он может быть синтезирован химически. Таким образом, в соответствии с настоящим изобретением может быть обеспечен гликозилированный полипептид, обладающий активностью интерферона β, со стабильным качеством и меньшей вариабельностью между партиями, а также фармацевтическая композиция, содержащая указанный выше гликозилированный полипептид.
Кроме того, гликолизированный полипептид согласно настоящему изобретению может представлять собой полипептид, содержащий добавленную к нему сахарную цепь, которая существует in vivo. Таким образом, в соответствии с настоящим изобретением может быть обеспечен гликолизированный полипептид, который является безопасным для организма человека, даже при длительном введении, а также фармацевтическая композиция, содержащая указанный выше гликолизированный полипептид.
Кроме того, в соответствии с настоящим изобретением может быть обеспечен гликозилированный полипептид, имеющий более высокое удерживание в крови и более высокую противоопухолевую активность по сравнению с природным интерфероном β, а также фармацевтическая композиция, содержащая указанный выше гликолизированный полипептид.
Гликолизированный полипептид согласно настоящему изобретению продемонстрировал более высокое удерживание в крови и, кроме того, более высокую противоопухолевую активность по сравнению с природным интерфероном β.
Несмотря на то, что пегилированный интерферон β, известный в качестве традиционного метода, является улучшенным в отношении удерживания в крови по сравнению с природным человеческим интерфероном β, улучшения противоопухолевой активности не наблюдается. Удивительным является то, что с помощью настоящего изобретения улучшение удерживания в крови, которое сходно или превышает удерживание в крови пегилированной формы, может быть достигнуто путем использования сахарной цепи, имеющей более низкую молекулярную массу, чем PEG, а также то, что противоопухолевая активность была значительно улучшена в гликозилированной форме согласно настоящему изобретению, даже когда она не была улучшена в пегилированной форме. Таким образом, гликозилированный полипептид в соответствии с настоящим изобретением, по-видимому, обладает высокой активностью интерферона β и является чрезвычайно полезным для лечения заболевания, связанного с интерфероном β.
Краткое описание чертежей
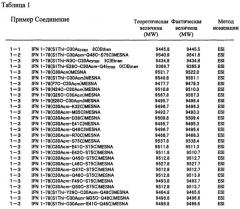
На фигуре 1 представлен масс-спектр, показывающий результаты выполнения масс-спектрометрии (метод ионизации ESI) на 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C), полученном в примере 3-1, и 2-6 моносиало(S1C-Q48C-N79C-K107C-R112C-R123C), полученном в примере 4-1.
На фигуре 2 представлен снимок, показывающий результаты выполнения SDS-PAGE на 2-6 дисиало(S1C-Q48C-N79C-K107C-R112-R123C), полученном в примере 3-1, и 2-6 моносиало(S1C-Q48C-N79C-K107C-R112C-R123C), полученном в примере 4-1.
На фигуре 3 представлен масс-спектр, демонстрирующий результаты выполнения анализа методом высокоэффективной жидкостной хроматографии (HPLC) с нормальными фазами на компонентах сахарной цепи 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C), полученном в примере 3-1, и 2-6 моносиало(S1C-Q48C-N79C-K107C-R112C-R123C), полученном в примере 4-1.
На фигуре 4 представлен график, показывающий изменение концентрации в плазме для каждого гликозилированного полипептида при подкожном введении 2-6 дисиало(S1C-Q48C-N79C-K107C), 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C) и 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C).
На фигуре 5 представлена таблица, показывающая фармакокинетические параметры для каждого гликозилированного полипептида при подкожном введении 2-6 дисиало(S1C-Q48C-N79C-K107C), 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C) и 2-6 дисиало(S1C-Q48C-N79C-K107C-K112C-R123C).
На фигуре 6 представлены графики, показывающие изменение концентрации в плазме для каждого гликозилированного полипептида при внутривенном и подкожном введении 2-6 дисиало(S1C-Q48C-N79C-K107C) и 2-6 моносиало(S1C-Q48C-N79C-K107C). График слева показывает изменение концентрации в плазме для каждого гликозилированного полипептида при внутривенном введении, и график справа показывает изменение концентрации в плазме для каждого гликозилированного полипептида при подкожном введении.
На фигуре 7 представлена таблица, показывающая фармакокинетические параметры для каждого гликозилированного полипептида при внутривенном и подкожном введении 2-6 дисиало(S1C-Q48C-N79C-K107C) и 2-6 моносиало(S1C-Q48C-N79C-K107C).
На фигуре 8 представлен график, показывающий изменение концентрации в плазме для каждого гликозилированного полипептида при внутривенном введении 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C) и 2-6 моносиало(S1C-Q48C-N79C-K107C-R112C-R123C).
На фигуре 9 представлена таблица, показывающая фармакокинетические параметры для каждого гликозилированного полипептида при внутривенном введении 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C) и 2-6 моносиало(S1C-Q48C-N79C-K107C-R112C-R123C).
На фигуре 10 представлен график, показывающий изменение концентрации в плазме для каждого гликозилированного полипептида при подкожном введении 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C) и PEG20K-модифицированного IFN-β.
На фигуре 11 представлена таблица, показывающая фармакокинетические параметры для каждого гликозилированного полипептида при подкожном введении 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C) и PEG20K-модифицированного IFN-β.
На фигуре 12 представлен график, показывающий результаты оценки противоопухолевой активности у мышей с раком желчных протоков, которым подкожно вводили 2-6 дисиало(S1C-Q48C-N79C-K107C), 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C), 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C) и 2-6 дисиало(S1C-N3C-Q48C-N79C-K107C-R112C).
На фигуре 13 представлен график, показывающий результаты оценки противоопухолевой активности у мышей с раком желчных протоков, которым подкожно вводили 2-6 дисиало(S1C-Q48C-N79C-K107C-K112C-R123C) и 2-6 моносиало(S1C-Q48C-N79C-K107C-R112C-R123C).
На фигуре 14 представлен график, показывающий результаты оценки противоопухолевой активности у мышей с раком желчных протоков, которым подкожно вводили 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C), 2-6 трисиало(S1C-С48С-N79C-K107C-R112C-R123C) и 2-6 тетрасиало(S1C-Q48C-N79C-K107C-R112C-R123C).
На фигуре 15 представлен график, показывающий результаты оценки противоопухолевой активности у мышей с раком желчных протоков, которым подкожно вводили 2-6 дисиало(S1C-Q48C-N79C-K107C-R112C-R123C) и PEG20K-модифицированный IFN-β.
На фигуре 16 показана аминокислотная последовательность интерферона β-1b (SEQ ID NO. 1) в качестве примера аминокислотной последовательности интерферона β согласно настоящему изобретению.
Описание вариантов осуществления
Настоящее изобретение относится полипептиду, гликозилированному сиалилированной сахарной цепью. В частности, настоящее изобретение относится к гликозилированному полипептиду, обладающему активностью интерферона β, гликозилированному высокооднородными сиалилированными сахарными цепями.
В настоящем документе «сахарная цепь» относится к соединению, образованному одним или несколькими сахарными звеньями (моносахарид и/или его производные), соединенными друг с другом. Когда два или более сахарных звеньев соединяются друг с другом, каждое сахарное звено является связанным вследствие конденсации дегидратацией посредством образования гликозидной связи. Такие сахарные цепи включают, но без ограничения, например, широкий спектр таких как моносахариды и полисахариды, содержащиеся in vivo (глюкозу, галактозу, маннозу, фукозу, ксилозу, N-ацетилглюкозамин, N-ацетилгалактозамин, сиаловую кислоту, и их комплексы и производные), а также сахарные цепи, образованные при деградации или происходящие из сложных биологических материалов, такие как деградированные полисахариды, гликопротеины, протеогликаны, глюкозаминогликаны и гликолипиды.
Предпочтительной сахарной цепью в настоящем документе является сахарная цепь, которая не ослабляет активность интерферона β комплекса интерферона. Такая сахарная цепь конкретным образом не ограничена и может представлять собой сахарную цепь, которая существует в виде гликоконъюгата in vivo (такого как гликопептид или гликопротеин, протеогликан и гликолипид), или может представлять собой карбогидрат, который не существует в виде гликоконъюгата in vivo.
Сахарная цепь, которая существует в виде гликоконъюгата in vivo, является предпочтительной в том отношении, что комплекс интерферона согласно настоящему изобретению вводят in vivo. Примеры сахарной цепи, которая существует в виде гликоконъюгата in vivo, включают Ν- или О-связанные сахарные цепи и тому подобное, которые представляют собой сахарные цепи, связанные с пептидом или белком in vivo в виде гликопептида или гликопротеина.
В одном аспекте настоящего изобретения предпочтительно используют N-связанную сахарную цепь. N-связанные сахарные цепи могут включать, например, форму с высоким содержанием маннозы, сложную форму или гибридную форму, при этом особенно предпочтительной является сложная форма.
Сахарные цепи в настоящем документе характеризуются тем, что все невосстанавливающие концы сахарной цепи являются сиалилированными. Выражение «все невосстанавливающие концы сахарной цепи являются сиалилированными» в настоящем документе означает, например, что оба из двух невосстанавливающих концов являются сиалилированными в случае биантенарной сложной сахарной цепи, все из трех невосстанавливающих концов являются сиалилированными в случае триантенарной сложной сахарной цепи, и все из четырех невосстанавливающих концов являются сиалилированными в случае четырехантенарной сложной сахарной цепи.
Используемый здесь термин «сиалилирование» означает, что сиаловая кислота связана с невосстанавливающим концом сахарной цепи. Сиаловая кислота является общим термином для нейраминовой кислоты, содержащей замещенную аминогруппу или гидроксильную группу. В настоящем изобретении сиаловая кислота, присутствующая на невосстанавливающем конце сахарной цепи, может включать любую или все замещенные формы нейраминовой кислоты, поскольку она не ослабляет или значительно не снижает активности интерферона гликозилированного полипептида настоящего изобретения. Помимо этого, в процедуре сиалилирования сахарной цепи в гликозилированном полипептиде в соответствии с настоящим изобретением предпочтительно используется природная сиаловая кислота в отношении того, что гликозилированный полипептид согласно настоящему изобретению вводят in vivo. Например, N-ацетилнейраминовая кислота (Neu5Ac), ацетилированная в положении 5, или N-гликолилнейраминовая кислота (Neu5Gc), модифицированная гликолевой кислотой в положении 5, и тому подобное, известны как природные сиаловые кислоты.
В одном аспекте настоящего изобретения конкретные примеры сахарных цепей, содержащие все из невосстанавливающих концов сиалилированными, включают, например, сложную сахарную цепь N-связанной сахарной цепи, поскольку известно, что сахарная цепь существует in vivo. В качестве сложной сахарной цепи N-связанной сахарной цепи также включены цепи, которые отличаются по своему механизму связывания, присутствию или отсутствию фукозы, присутствию или отсутствию модификации на заместителе боковой цепи, и тому подобное, поскольку содержат основной скелет сахарной цепи, в целом известный как сложная сахарная цепь N-связанной сахарной цепи. В зависимости от различия в разветвленной структуре сахарной цепи, примеры N-связанной сложной сахарной цепи могут включать, например, дисиало-сахарную цепь, трисиало-сахарную цепь и тетрасиало-сахарную цепь. Другими словами, используемый здесь термин «дисиало» относится к N-связанной сложной сахарной цепи, которая имеет биантенарную структуру и содержит невосстанавливающие концы, все из которых являются сиалилированными. Аналогичным образом термин «трисиало-сахарная цепь» относится к N-связанной сложной сахарной цепи, которая имеет триантенарную структуру и содержит невосстанавливающие концы, все из которых являются сиалилированными. Аналогичным образом, «тетрасиало-сахарная цепь» относится к N-связанной сложной сахарной цепи, которая имеет четырехантенарную структуру и содержит невосстанавливающие концы, все из которых являются сиалилированными.
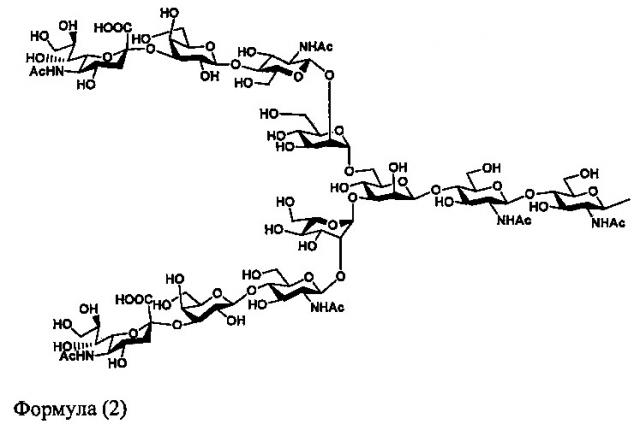
В частности, эти сахарные цепи могут включать α2-6-дисиало-сахарную цепь, представленную следующей формулой (1), α2-3-дисиало-сахарную цепь, представленную формулой (2), α2-6-трисиало-сахарную цепь, представленную формулой (3), α2-6-тетрасилао-сахарную цепь, представленную формулой (4), и тому подобное.
Химическая формула 5
Химическая формула 6
Химическая формула 7
Химическая формула 8
Сиалилированные сахарные цепи, представленные здесь, не ограничиваются указанными выше конкретными примерами и включают такие цепи, в которых механизм связывания между сахарной цепью и сиаловой кислотой различается, такие как α2-3-трисиало-и α2-3-тетрасиало-сахарные цепи. Что касается механизма связывания, все разветвленные цепи в сиалилированной сахарной цепи могут иметь сходный механизм связывания, или могут включать различные механизмы связывания.
Кроме того, сиалилированная сахарная цепь в настоящем документе также включает цепи, которые имеют добавленную фукозу. Конкретные примеры сложной сахарной цепи, содержащей добавленную фукозу, могут включать следующую формулу (13) в случае дисиало-сахарной цепи, следующую формулу (15) и формулу (16) в случае трисиало-сахарной цепи, и следующую формулу (17) в случае тетрасиало-сахарной цепи.
Химическая формула 9
Химическая формула 10
Химическая формула 11
Химическая формула 12
В одном аспекте настоящего изобретения сахарные цепи соответствующей гликозилированной аминокислоты в гликозилированном полипептиде настоящего изобретения могут быть все идентичными или могут также содержать различные сахарные цепи. Используемое здесь выражение «сахарные цепи соответствующей гликозилированной аминокислоты в гликозилированном полипептиде являются идентичными» относится к тому факту, что когда аминокислоты в 4-6 положениях замещены гликозилированными аминокислотами согласно настоящему изобретению, тип составляющего сахарную цепь сахара, порядок связывания и механизм связывания являются идентичными в пределах гликозилированного полипептида при сравнении сахарных цепей гликозилированных аминокислот в 4-6 положениях с друг с другом.
Кроме того, в одном аспекте настоящего изобретения в композиции, содержащей гликозилированный полипептид согласно настоящему изобретению, каждая сахарная цепь в гликозилированном полипептиде предпочтительно является по существу однородной. Используемое здесь выражение «каждая сахарная цепь в гликозилированном полипептиде является по существу однородной» относится к тому факту, что когда каждую сахарную цепь сравнивают между гликозилированными полипептидами для каждого положения гликозилирования, положения на полипептиде являются идентичными, и тип составляющего сахарную цепь сахара в каждом положении, порядок связывания и механизм связывания между сахарами являются по существу идентичными в каждой сахарной цепи. В настоящем изобретении каждая сахарная цепь в гликозилированном полипептиде является однородной, по меньшей мере, на 90% или более предпочтительно на 95% или более, и наиболее предпочтительно на 99% или более.
Композиция, содержащая гликозилированный полипептид, характеризующаяся тем, что каждая сахарная цепь в гликозилированном полипептиде является по существу однородной, имеет стабильное качество и особенно предпочтительна в таких областях, как изготовление лекарственных средств и проведение анализов. Доля однородных сахарных цепей может быть измерена, например, методом с использованием HPLC, капиллярного электрофореза, масс-спектрометрии и т.п.
Используемая здесь «аминокислотная последовательность, представленная SEQ ID NO. 1», представляет собой аминокислотную последовательность интерферона β-1b (смотри фигуру 16). Интерферон β-1b, как известно, содержит делецию Met в положении 1 и Cys в положении 17, замещенный на Ser в природном человеческом интерфероне β.
Используемый здесь «гликозилированный полипептид» относится, например, к полипептиду, состоящему из аминокислотной последовательности, представленной SEQ ID NO. 1, содержащий аминокислоты в 4-6 положениях, замещенные «гликозилированными аминокислотами».
Используемая здесь «гликозилированная аминокислота» представляет собой аминокислоту, содержащую присоединенную к ней Сахарную цепь, при этом сахарная цепь и аминокислота могут соединяться посредством линкера.
Тип аминокислоты, подлежащей гликозилированию, конкретным образом не ограничен, и можно использовать любую из природных и неприродных аминокислот.
Когда сахарная цепь и аминокислота соединены посредством линкера, с точки зрения свойств легкости связывания с линкером, предпочтительная аминокислота гликозилированной аминокислоты представляет собой аминокислоту, содержащую две или более карбоксильных групп в молекуле, такую как аспарагиновая кислота и глутаминовая кислота; аминокислоту, содержащую две или более аминогрупп в молекуле, такую как лизин, аргинин, гистидин и триптофан; аминокислоту, содержащую гидроксильную группу в молекуле, такую как серии, треонин и тирозин; аминокислоту, содержащую тиольную группу в молекуле, такую как цистеин; и аминокислоту, содержащую амидную группу в молекуле, такую как аспарагин и глутамин. В частности, с точки зрения реакционной способности предпочтительными являются цистеин, аспарагин, аспарагиновая кислота, глутаминовая кислота, лизин, аргинин, серии, треонин и глутамат.
В отношении любого гликозилированного полипептида согласно настоящему изобретению предполагается, что, если структура сахарной цепи, структура, отличная от сахарной цепи, сайт гликозилирования и количество добавленных сахарных цепей являются идентичными, то отсутствует значительное различие в периоде полувыведения из крови гликозилированного полипептида согласно настоящему изобретению в случаях, когда гликозилированной аминокислотой является гликозилированный Asn и когда гликозилированной аминокислотой является гликозилированный Cys.
В случае, когда сахарная цепь и аминокислота соединены посредством линкера, в качестве линкера можно использовать линкеры, которые широко применяются в данной области, примеры которых могут включать -NH-(CO)-(CH2)a-CH2- (где а означает целое число, которое конкретно не ограничено, при условии, что не ингибирует целевую функцию линкера, но предпочтительно представляет собой целое число от 0 до 4), С1-10-полиметилен, -CH2-R- (где R представляет собой группу, полученную путем удаления одного атома водорода из группы, выбранной из группы, состоящей из алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, карбоциклической группы, замещенной карбоциклической группы, гетероциклической группы и замещенной гетероциклической группы), -(СО)-(СН2)а-(СО)- (где а означает целое число, которое конкретно не ограничено, при условии, что не ингибирует целевую функцию линкера, но предпочтительно представляет собой целое число от 0 до 4), и тому подобное.
Способ получения гликозилированного полипептида согласно настоящему изобретению не ограничен каким-либо образом его описанием (например, описанием «гликозилированный полипептид, содержащий аминокислоту, является замещенным гликозилированной аминокислотой»), и гликозилированный полипептид, полученный любым из способов А или В, описанных ниже, включен в «гликозилированный полипептид, содержащий аминокислоту, является замещенным гликозилированной аминокислотой». Кроме того, например, гликозилированный полипептид, в котором сахарная цепь без какой-либо присоединенной аминокислоты соединяется напрямую или посредством линкера с аминокислотой на пептиде; гликозилированный полипептид, в котором сахар или сахарная цепь дополнительно добавлена к сахарной цепи, добавленной в гликозилированный полипептид для удлинения уже добавленной сахарной цепи; гликозилированный полипептид, в котором одна или несколько аминокислот соединяются с аминогруппой и/или карбоксильной группой гликозилированной аминокислоты, и дополнительно связаны с одним или несколькими фрагментами интерферона β; и гликозилированный полипептид, в котором сахарная цепь, содержащая присоединенную к ней аминокислоту, соединяется посредством линкера с аминокислотой на пептиде, и т.п. также включены в гликозилированный полипептид согласно настоящему изобретению, при условии совпадения конечных структур.
В одном аспекте настоящего изобретения положения для замещения «аминокислот в 4-6 положениях», описанные выше в отношении гликозилированных аминокислот, должны быть выбраны с учетом различных аспектов таким образом, чтобы активность интерферона β не уменьшалась при замещении гликозилированной аминокислоты. Например, Asn в положении 80 (соответствующем положению 79 в аминокислотной последовательности, представленной SEQ ID NO. 1), где сахарная цепь соединена с природным интерфероном β, является предпочтительным в настоящем документе в качестве положения, подлежащего замещению гликозилированной аминокислотой.
В одном аспекте настоящего изобретения положение замещения для гликозилированной аминокислоты предпочтительно выбрано таким образом, чтобы оно не препятствовало формированию конформации интерферона β в процессе сворачивания полипептида. Для того, чтобы избежать нарушения формирования конформации интерферона β, положение замещения для гликозилированной аминокислоты может представлять собой положение аминокислот, присутствующих на поверхности конформационной структуры, когда интерферон β сформировал конформацию, сходную с природной. Другими словами, положение может представлять собой положения аминокислот, которые не находятся вблизи поверхности конформационной структуры, когда интерферон β сформировал конформацию, сходную с природной (также называемые здесь как «положения неповерхностных аминокислот»). Кроме того, в одном аспекте настоящего изобретения положением замещения для гликозилированной аминокислоты предпочтительно не является рецептор-связывающий сайт интерферона β. Авторы настоящего изобретения провели всесторонние исследования данных, полученных в результате анализов, таких как конформационный анализ интерферона β, для определения положений неповерхностных аминокислот интерферона β, и определили положения, которые могут нарушать другое конформационное формирование, или положения, которые могут нарушать связывание с рецептором. На основании этого, в одном аспекте настоящего изобретения гликозилированные аминокислоты предпочтительно не присутствуют в положении, соответствующем положениям 2, 5, 6, 9, 12, 13, 16, 19, 20, 23, 27, 33, 37, 39, 40, 43, 53, 54, 55, 57, 58, 61, 62, 64, 65, 68, 69, 73, 78, 83, 86, 87, 90, 93, 94, 100, 124, 125, 128, 131, 132, 138, 141, 142, 145, 148, 149, 152, 153, 156, 159, 160 или 163 в аминокислотной последовательности, представленной SEQ ID NO. 1. Кроме того, специалисты в данной области, ознакомленные с данным описанием, смогут надлежащим образом изучить сходство непредпочтительных положений замещения для гликозилированной аминокислоты в соответствии с этими положениями.
В одном аспекте настоящего изобретения положение замещения для гликозилированной аминокислоты предпочтительно не представляет собой Cys в положениях 31 и 141, который образует дисульфидную связь в природном интерфероне β (соответствующих положениям 30 и 140 в аминокислотной последовательности, представленной SEQ ID NO. 1).
Авторы настоящего изобретения провели всестороннее перспективное исследование, описанное выше, для синтеза множества гликозилированных полипептидов, содержащих различные аминокислоты в аминокислотной последовательности, замещенные гликозилированными аминокислотами, и провели их измерение на активность интерферона β. В результате было обнаружено, чт