Суперагонисты гликопротеинового гормона длительного действия
Иллюстрации
Показать всеГруппа изобретений относится к биотехнологии и медицине, в частности к модифицированным гликопротеиновым гормонам, имеющим активность суперагонистов, и их применению при лечении состояний, связанных с активностью гликопротеинового гормона. Предложен модифицированный полипептид альфа-субъединицы, выбранный из группы, состоящей из дикого типа полипептида альфа-субъединицы крупного рогатого скота (SEQ ID NO: 2), дикого типа полипептида альфа-субъединицы овцы (SEQ ID NO: 3), дикого типа полипептида альфа-субъединицы лошади (SEQ ID NO: 4), дикого типа полипептида альфа-субъединицы свиньи (SEQ ID NO: 5), в который внесены по меньшей мере одно замещение аминокислоты дикого типа на основную аминокислоту в положении 15, 17, 18, 20 и/или 24 и одна, две или три аминокислотные вставки непосредственно после положения 6 или 7. Указанный модифицированный полипептид альфа-субъединицы способен связываться с полипептидом бета-субъединицы с образованием гормона из семейства гликопротеиновых гормонов. Образованный модифицированный гликопротеиновый гормон применяют для стимулирования овуляции. Полученные аналоги гликопротеиновых гормонов длительного действия демонстрируют повышенную биоактивность как in vitro так in vivo по сравнению с аналогом дикого типа, полезны для лечения субъектов, проявляющих низкую экспрессию рецепторов или недостаточный рецепторный ответ, и для лечения любого состояния, связанного с активностью гликопротеинового гормона. 5 н. и 4 з.п. ф-лы, 11 ил., 8 табл.
Реферат
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Данное изобретение относится в целом к модифицированным гликопротеиновым гормонам, имеющим активность суперагонистов, и их применению при лечении состояний, связанных с активностью гликопротеинового гормона. Более конкретно, настоящее изобретение относится к модифицированным молекулам гликопротеинов, содержащих аминокислотные замещения и один или более вставленных пептидов в альфа-субъединицах, по сравнению с альфа-субъединицами дикого типа, причем такие модифицированные молекулы обладают улучшенными фармакологическими свойствами по сравнению с гликопротеинами дикого типа.
УРОВЕНЬ ТЕХНИКИ
Гонадотропины фоллитропин (фолликул-стимулирующий гормон, FSH) и хорионический гонадотропин (CG), лютропин (лютеинизирующий гормон, LH) и тиреотропный гормон (тиреотропный гормон, TSH) составляют семейство гликопротеиновых гормонов. Каждый гормон является гетеродимером из двух нековалентно связанных субъединиц: альфа и бета. В тех же видах аминокислотная последовательность альфа-субъединицы идентична во всех гормонах, в то время как последовательность бета-субъединицы является гормон-специфичной (Pierce, Ann Rev. Biochem 50: 465-495 (1981)). Тот факт, что последовательности субъединиц высоко сохранны от рыб до млекопитающих, означает, что эти гормоны эволюционировали от общего белка-предка (Фонтейн, Gen. Comp Endocrinol 32: 341-347. (1977)).
Предыдущие исследования с измененными гликопротеиновыми гормонами показали обнадеживающие данные. Например, в дополнение к обеспечению модифицированных гликопротеиновых гормонов с повышенной активностью, дальнейшие мутации показали увеличение рецепторов сродством связывания (см., например, WO 2005/089445 и WO 2005/101000). Тем не менее, в то время как аффинность была увеличена, исследования показали, что модифицированные гликопротеиновые гормоны были очищены настолько же быстро, если не быстрее, чем их аналоги дикого типа. Для того, чтобы генерировать клинически полезный суперагонист с повышенной активностью, модифицированный гликопротеиновый суперагонист должны иметь повышенный период биологического полураспада в дополнение к улучшению аффинности связывания рецептора. Тем не менее, предыдущие попытки дальнейших модификаций гликопротеиновых гормонов увеличить период полураспада и повысить биодоступность были менее чем удовлетворительными, и вместо этого модифицированные гликопротеиновые гормоны продемонстрировали только ослабленный ответ.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение касается модифицированного гликопротеинового гормона, содержащего аминокислотную последовательность, по меньшей мере одно консервативное замещение основной аминокислоты в Q13, EL4, Р16 или Q20 и инсерцию VNVTINVT (SEQ ID NO: 20) между D3 и Q5 альфа-субъединицами в гликопротеиновом гормоне.
В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон содержит по меньшей мере два или по крайней мере три основных аминокислотных замещения в Q13, Р16 и Q20. В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон дополнительно содержит основное аминокислотное замещение в EL4. В некоторых вариантах воплощения изобретения основная аминокислота представляет собой аргинин.
В некоторых вариантах воплощения изобретения альфа-субъединица содержит аминокислотную последовательность с по меньшей мере 85% идентичностью относительно SEQ ID NO: 11 и дополнительно содержит бета-субъединицу лютенизирующего гормона (LH), хорионического гонадотропина (CG), фолликулостимулирующего гормона (FSH) или тиреотропного гормона ((TSH). В некоторых вариантах воплощения изобретения альфа-субъединица происходит от человеческой альфа-субъединицы (SEQ ID NO: 6).
Настоящее изобретение включает модифицированный гликопротеиновый гормон, содержащий аминокислотную последовательность с по меньшей мере одним основным консервативным аминокислотным замещением на K15, K17, K20 или K24 и инсерцию NVTINV (SEQ ID NO: 1) между F6 и Т7 альфа-субъединицей гликопротеинового гормона.
В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон содержит по меньшей мере два, или по крайней мере три, или по крайней мере четыре основных аминокислотных замещения на K15, K17, K20 и K24. В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон дополнительно содержит основное аминокислотное замещение на Е18. В некоторых вариантах воплощения изобретения основная аминокислота представляет собой аргинин.
В некоторых вариантах воплощения изобретения альфа-субъединица содержит аминокислотную последовательность с по меньшей мере 85% идентичностью относительно SEQ ID NO: 7 и дополнительно содержит бета-субъединицу лютеинизирующего гормона (LH), хорионического гонадотропина (CG), фолликулостимулирующего гормона (FSH) или тиреотропного гормона ((TSH). В некоторых вариантах воплощения изобретения альфа-субъединицы получают из крупного рогатого скота, свиней, овец или альфа-субъединицы (SEQ ID NO: 2, SEQ ID NO: 5, SEQ ID NO: 3, соответственно).
Настоящее изобретение включает модифицированный гликопротеиновый гормон, содержащий аминокислотную последовательность с по меньшей мере одним консервативным замещением основной аминокислоты на K15, K20, Е18 или K24, и инсерцию NVTINV (SEQ ID NO: 1) между F6 и Т7 или, альтернативно, инсерцию NV между F6 и Т7 плюс инсерцию INV между Т7 и Т8 альфа субъединицы гликопротеинового гормона.
В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон содержит по меньшей мере два, или по крайней мере три, или по крайней мере четыре основные аминокислотных замещения в K15, Е18, K20 и K24. В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон включает инсерцию NVTINV (SEQ ID NO: 1) между F6 и Т7 альфа-субъединицей. В некоторых вариантах воплощения изобретения модифицированный гликопротеиновый гормон включает инсерцию NV между F6 и Т7 плюс инсерцию INV между Т7 и Т8 альфа-субъединицей. В некоторых вариантах воплощения изобретения основная аминокислота представляет собой аргинин или гистидин. В некоторых вариантах воплощения изобретения основная аминокислота представляет собой аргинин.
В некоторых вариантах воплощения изобретения альфа-субъединица содержит аминокислотную последовательность с по меньшей мере 85% идентичностью относительно SEQ ID NO: 4 и дополнительно содержит бета-субъединицу лютеинизирующего гормона (LH), хорионического гонадотропина (CG), фолликулостимулирующего гормона (FSH) или тиреотропного гормона ((TSH). В некоторых вариантах воплощения изобретения альфа-субъединица происходит из конской альфа-субъединицы (SEQ ID NO: 4).
Настоящее изобретение также относится к способу стимуляции гликопротеинового рецептора у животного, включающему введение указанных выше модифицированных гликопротеиновых гормонов данному животному. Настоящее изобретение также относится к способу стимуляции овуляции у животного, включающему введение любого из вышеперечисленных модифицированных гликопротеиновых гормонов данному животному. В некоторых вариантах воплощения изобретения животным является человек, корова, овца, свинья или конь.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг. 1 показано сАМР стимуляции в CHO-FSHR клетках с выбранными bFSH аналогами, производимыми временной трансфекцией. На Фиг. 1А показано сравнение FolltropIn®-V (pFSH), bFSH-WT (дикого типа) с bFSH-5R аналогом. На Фиг. 1B показано ослабление биологической активности в in vitro hFSH-TR4402 аналога (переходной 4402) на два N-концевые расширения (ANITV, NITV) и одной внутренней неогликолизации (V78N) (SPA сАМР). На Фиг. 1С показано сравнение DFSH-5R аналогов с инсерцией 1 (5R + инсерция 1) и инсерцией 2 (5R + инсерция 2).
На Фиг. 2А и 2В показано РK скрининг различных аналогов bFSH после однократной подкожной инъекции мышам. В каждом эксперименте 5 мышей использовали для каждого препарата. Образцы крови брали через 24, 32 и 48 часов после инъекции, плазменные уровни были вычтены и были выражены данные в % от введенной дозы (% ID). FSH в образцах плазмы анализировали с использованием FSH ELISA (Endodrine Technologies).
На Фиг. 3A-D проиллюстрирован анализ производства различных партий TR55601. Фиг. 3А иллюстрирует анализ гетерогенности заряда с помощью IEF и затем вестерн-блоттингтинга. Субоптимальное сиалилирование Партии 3 (дорожки 2 и 3) находится в резком контрасте с оптимальными сильно кислыми изоформами, обнаруженными в партии 4 (полосы 5 и 6). Дорожка 1, IEF 3-10 маркер; Дорожка 2, TR55601/Партии 3 (8 мкг); Дорожка 3, TR55601/Партии 3 (4 мкг); Дорожка 4 и 8, TR4401 (LUG); Дорожка 5, TR55601/Партии 4 (8 мкг); Дорожка 6, TR55601 /Партии 4 (4 мкг); Дорожка 8, IEF 3-10 маркер. Фиг. 3В иллюстрирует анализ заряженных изоформ с помощью нейраминидазы (холерный вибрион), IEF и Вестерн-блоттинг.Необработанные TR55601/Партия 4 образца (дорожки 2 и 3) и TR55601 /Партия 4 образец, обработанные нейраминидазой перед нанесением 3-10 IEF гель (полосы 4-6). Дорожка 1, IEF 3-10 маркер; Дорожка 2, необработанная TR55601/Партия 4 (8 мкг); Дорожка 3, необработанная TR55601/Партия 4 (4 мкг); Дорожка 4, обработанная TR55601/Партия 4 (4 мкг); Дорожка 5, обработанная TR55601 /Партия 4 (2 мкг); Дорожка 6, обработанная TR55601/Партия 4 (1 мкг). Профиль IEF для нейраминидаза дигестированных изоформ сместился в диапазоне pI от 7,8 до 10,0. Средний сдвиг pI составляет приблизительно 5 единиц рН и множественные полосы (близко к 10 полосам) превращаются в одну основную полосу (pI ~9,5) и три слабые полосы (pI 7,8-10,0), указывая, что большинство наблюдаемых гетерогенностей заряда (Фиг. 3А - Партия 4) зависит от концевых остатков сиаловой кислоты, с небольшими другими модификациями, такими как деамидирование и/или протеолитическая деградация. Остаточные основные группы (PI 4.8-5.5), приведенные на Фиг. 3В, являются неспецифическими, полученных от подготовки нейраминидазы. На Фиг. 3С проиллюстрировано анализ заряженных изоформ TR55601-Партия 5 по IEF 3-10 в пи градиентном геле (IEF 3-10 с последующим вестерн-блоттингтингом. Дорожка 1, IEF 3-10 маркер; Дорожка 2, TR55601-Партия 5 (4 мкг); Дорожка 3, TR55601-Партия 5 (4 мкг); Дорожка 4, TR55601-Партия 4 (4 мкг); Дорожка 5, TR55601-Партия 4 (8 мкг); Дорожка 6, TR55601-Партия 3 (4 мкг); дорожка 7, TR55601-Партия 3 (8 мкг). На Фиг. 3D показан SDS-Вестерн-блоттинг анализ TR55601 Партии 5 по сравнению с TR55601 Партией 4 и Fol-V. Дорожка 1, маркерный белок; Дорожка 2: Партия 4, 500 мкг; Дорожка 3: Партии 5, LUL; Дорожка 4: пустая дорожка; Дорожка 5: Партии 4, 4 мкг; Дорожка 6: Партия 5, 1 мкг; Полоса 7: Fol-V, 673 мкг; Дорожка 8: маркерный белок.
На Фиг. 4 приведены результаты классического биотестирования Steelman-Pohley с hCG увеличением яичников вес у незрелых (22 дня) самок крыс Спрэга-Доули. Массу яичников определяли через 72 часа после приема препарата. Данные представлены в виде среднего общего веса яичников двух яичников + SEM (n=5 на дозу, в группе). Крысы были стимулированы одной инъекцией испытуемого изделия или носителя, с добавлением 40 ME hCG. Были использованы следующие лекарственные группы: 1 группа получала hCG только (не FSH), группы 2-5 получали TR55601 партия 4 (0, 0,33 мкг, 1,0 мкг, 3,33 мкг, и 10 мкг, соответственно слева направо), группы 6-8, получали FolltropIn-V® (3,333 мкг, 10,000 мкг, и 30,000 мкг соответственно слева направо), и группа 9-10 получала TR4401 (1,0 мкг и 3,33 мкг).
На Фиг. 5 приведен протокол синхронизации фолликулярной волны для суперовуляции, индукции овуляции и фиксированным временем искусственного осеменения. В 8 инъекциях FolltropIn-VR (Bioniche) заменяли одной или двумя инъекциями TR55601.
На Фиг. 6 показано среднее число фолликулов (от 3 до 5 мм в диаметре) во время суперстимуляционной обработки мясных коров, получавших 60 мкг rFSH заданной одним им инъекции или 300 мкг FolltropIn-V (контроль) проведенной дважды в день IM инъекции в течение 4 дней (3 эксперимента комбинированные).
На Фиг. 7 показано среднее число фолликул 6 до 8 мм в диаметре при суперстимуляционной обработке мясных коров, обработанных 60 мкг rFSH заданной одной внутримышечной инъекцией или 300 мг FolltropIn-V (контроль), проведенной дважды в день IM ежедневных инъекций в течение 4 дней (3 эксперимента комбинированные).
На Фиг. 8 показано среднее число фолликулов > 9 мм в диаметре во время суперстимуляционной обработки мясных коров, получавших 60 мкг rFSH заданной одной внутримышечной инъекцией или 300 мкг FolltropIn-V (контроль), проведенной дважды ежедневной внутримышечной инъекцией более 4 дней (3 эксперимента объединены).
На Фиг. 9 показаны профили среднего диаметра всех фолликулов > 3 мм в диаметре во время суперстимуляционной обработки мясных коров, получавших 60 мкг rFSH заданной одной внутримышечной инъекцией или 300 мг FolltropIn-V (контроль), проведнной дважды ежедневной внутримышечной инъекцией более 4 дней (3 эксперимента объединены).
На Фиг. 10А приведено сравнение производства сАМР для инсерции в альфа-субъединицы человека (А2), инсерции без амино-концевого валина (Инсерция 2), 5 аргинина замещений только без инсерции (5R) и контроля только среды. Фиг. 10В показывает ЕС50 для трех испытанных конструкций.
На Фиг. 11А приведено сравнение производства сАМР в ответ на человеческую модифицированную альфа-субъединицц с инсерцией SEQ ID NO: 1 и модифицированную альфа-субъединицу крупного рогатого скота, которые не имеют инсерции. На Фиг. 11В приведено сравнение производства сАМР в ответ на человеческую модифицированную альфа-субъединицу и субъединицы крупного рогатого скота с и без различных инсерций.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает молекулы модифицированного суперактивного гликопротеинового гормона, показывающие удивительно повышенную эффективность и повышенный период биологического полураспада по сравнению с их аналогами дикого типа. Модифицированные означает, что, в то время как белок содержит аминокислотную последовательность, которая отличается от гликопротеиновых гормонов дикого типа, последовательность была изменена так, что она не совпадает с известной гликопротеиновой последовательностью другого вида гормонов. Суперактивность может быть оценена в соответствии с различными параметрами, в том числе активностью и эффективностью. Эффективность является параметром биологической активности, которая определяется путем измерения половины максимального ответа. Различия в эффективности определяются путем сравнения значения ответа гликопротеиновых гормонов аналога на полпути между базовым и максимальным значением (ЕС50) по сравнению гликопротеиновым гормоном дикого типа. Ответы гликопротеинового гормона могут быть измерены in vitro с использованием очищенных белков, или могут быть оценены следующей переходной трансфекцией нуклеиновой кислоты, кодирующей модифицированный белок. Ответы гликопротеинового гормона также могут быть измерены in vivo, то есть у животного, реагирующего на аналоги гликопротеинового гормона. Такие ответы охватывают любой известный клеточный или биологический и количественный или качественный ответ гликопротеинового гормона с его рецептором, например, производство сАМР, синтез белков, таких как прогестерон, способность к оплодотворению, скорость образования бластоцистов, развитие эмбриона в оплодотворенной яйцеклетке, и т.д. Эффективность (Vмакс) или максимальная реакция - это еще один параметр биологической активности. Как обсуждалось в данной заявке, параметры биологической активности могут изменяться в зависимости от количества рецепторов и связывания рецептора в анализе клеточной линии. В системах с меньшим количеством рецепторов или нарушенной связью, различия более заметны в плане Vmax (эффективность). В системах, где происходит надэкспрессия рецепторов, различия в эффективности более заметны.
Например, в тех случаях, когда модифицированный гликопротеиновый гормон является модифицированной FSH или CG молекулой, in vivo количественные и качественные параметры, такие как количество ооцитов, скорость оплодотворения и бластоцисты и скорости образования зародышей, могут быть измерены в максимально эффективной дозе для числа ооцитов. Максимально эффективной дозой для числа ооцитов является оптимальное количество суперактивного FSH для качества ооцитов и их количества. Максимально эффективная доза для числа ооцитов зависит от массы и скорости метаболизма животного. Например, максимально эффективная доза для большего животного с более медленной скоростью метаболизма, больше, чем максимально эффективная доза для меньшего животного с более высокой скоростью метаболизма. Максимально эффективная доза определяется эмпирически для каждого животного.
Однако, независимо от используемой системы, белки модифицированного суперактивого гликопротеинового гормона в соответствии с данным изобретением могут демонстрировать по меньшей мере, приблизительно от 2 до 10 кратное увеличение эффективности или по меньшей мере приблизительно 20-кратное, 30-кратное, 40-кратное, 50-кратное, 60-кратное, 70-кратное, 80-кратное, 90-кратное или даже 100-кратное увеличение активности по сравнению с диким типом, или увеличение максимальной эффективности от 2 до 10%, или по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, или даже 100%-ное увеличение максимальной эффективности по сравнению с аналогом дикого типа. Суперактивные аналоги в соответствии с данным изобретением могут также обеспечивать приблизительно 5-10 кратное увеличение активности или от 5% до 10% увеличение максимальной эффективности по сравнению с FSH дикого типа. Некоторые из модифицированных белков в соответствии с данным изобретением могут демонстрировать по меньшей мере приблизительно от тридцати до пятидесяти кратное увеличение активности или от 30% до 50% увеличение максимальной эффективности по сравнению с диким типом. Таким образом, белки модифицированного гликопротеинового гормона в соответствии с данным изобретением могут быть полезны для лечения субъектов с низким количеством рецепторов или недостатками в ответе рецептора, так как модифицированный белок в соответствии с данным изобретением может поддерживать по меньшей мере на 10-кратное увеличение эффективности или 10%-ное увеличение максимальной эффективности даже в системах с низким количеством рецепторов или ответом.
Скорость всасывания модифицированного суперактивного гликопротеинового гормона может привести к увеличению продолжительности действия. Аналог модифицированного гликопротеинового гормона с уменьшением скорости поглощения и увеличения продолжительности действия может быть полезен для гипосенситивных субъектов, таких как тех, кто страдает от бесплодия. Скорость поглощения измеряют при помощи Ka. Скорость выведения измеряют при помощи Ke.
Молекулы модифицированного гликопротеинового гормона в соответствии с данным изобретением включают модифицированные белки видов, выбранных из группы, состоящей из человека, крупного рогатого скота, лошадей, свиней, овец, мышей, крыс, кроликов, приматов и др. Гликопротеиновый гормон рыб (также известный как GTH-1) может использоваться в аквакультуре, то есть, для того, чтобы помочь росту находящихся под угрозой исчезновения или других видов рыб в неволе. Другие виды модифицированных гликопротеиновых гормонов могут быть использованы в сельском хозяйстве для разведения, и далее в лабораторных условиях для тестирования влияния различных комбинированных мутаций на различные мужские и женские состояния, связанные с гликопротеиновым гормоном.
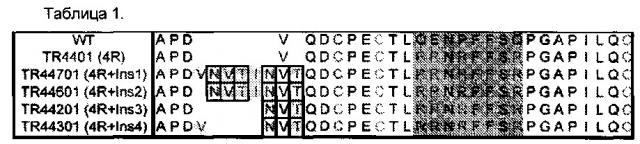
Молекулы модифицированного гликопротеинового гормона других видов имеют замещения в положениях, соответствующих положениям, в модифицированных молекулах гликопротеинового гормона человека (например, Таблица 1), крупного рогатого скота (см. Таблица 2), овец, лошадей и свиней, описанные в данной заявке, которые могут быть идентифицированы с помощью любой программы выравнивания, включая, но не ограничиваясь, применение программ DNASIS, ALIONment, SIM и GCG, таких как Gap, BestFit, FrameAlign и Compare.
Молекулы модифицированного гликопротеинового гормона в соответствии с данным изобретением включают, по меньшей мере, модифицированную альфа-субъединицу, где альфа-субъединица содержит по меньшей мере две основные аминокислоты, например на лизиновых остатках. В альфа-субъединицах человека, основные аминокислоты могут быть введены в положениях 13, 14, 16 и 20 дикого типа человеческой альфа-субъединицы (SEQ ID NO: 6). В других видах, основные аминокислоты могут быть введены в положениях, соответствующих положениям 15, 17, 20 и 24 дикого типа бычьей альфа (SEQ ID NO: 2), дикого типа свиньи альфа (SEQ ID NO: 5) и дикого типа овец альфа (SEQ ID NO: 3), и положениях 15, 20 и 24 дикого типа лошадей альфа (SEQ ID NO: 4). Глутаматный остаток в положении 18 (бычий, свиной, овечий и лошадиный) может быть также замещен основной аминокислотой. В некоторых вариантах воплощения изобретения основная аминокислота может представлять собой аргинин или гистидин. В некоторых вариантах воплощения изобретения основная аминокислота может быть аргинином.
Пептид с последовательностью NVTINV (SEQ ID NO: 1) или TNVTINV (SEQ ID NJ: 12), или VNVTINVT (SEQ ID NO: 20) может быть вставлен между аминокислотами D3 и Q5 человеческой альфа-субъединицы (SEQ ID NO: 6), а также между F6 и Т7 альфа-субъединицы крупного рогатого скота, свиней, овец и лошадей.
Альтернативно, альфа-субъединица модифицированного гликопротеинового гормона быков, свиней, овец или коней может включать инсерцию NV между F6 и Т7 плюс инсерцию INV между Т7 и Т8. Модифицированные белки в соответствии с данным изобретением могут также содержать дополнительные замещения, особенно консервативные замещения, которые не изменяют улучшенные свойства белка. Обычно, однако, такие модифицированные белки содержат менее чем пять замещений в положениях, иных, чем те, которые перечислены выше, и могут проявлять полную идентичность аминокислотной последовательности с соответствующим дикого типа гликопротеиновым гормоном альфа в положениях, иных, чем указанные выше положения.
Основные аминокислоты включают аминокислоты лизин, аргинин и гистидин, а также любые другие основные аминокилоты, которые могут быть модификацией любой из этих трех аминокислот, синтетическими основными аминокислотами, которые обычно не встречаются в природе, или любой другой аминокислотой, которая положительно заряжена при нейтральном рН. Основные аминокислоты, в частности, выбраны из группы, состоящей из лизина и аргинина.
Примеры модифицированных альфа молекул, имеющих основные аминокислотные замещения и пептидную инсерцию, показаны в SEQ ID NO: 11 (человека), SEQ ID NO: 7 (быка), SEQ ID NO: 8 (овцы), SEQ ID NO: 10 (свиньи), и SEQ ID NO: 9 (лошадей). Настоящее изобретение относится к модифицированным гликопротеинам с аминокилотными последовательностями с по меньшей мере 80%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше идентичностью с любой из SEQ ID NO: 7 до 11.
Модифицированные альфа-субъединицы белков модифицированного гликопротеинового гормона в соответствии с данным изобретением могут также иметь альфа-субъединицу, содержащую два, три, четыре или пять основных аминокислотных замещений. Замещенные аминокислоты могут быть остатками лизина, глутаматными остатками, остатками пролина или глутаминовыми остатками. Например, бычьи альфа-субъединицы дикого типа, один или более из лизинов в положениях 15, 17, 20 и 24 могут быть замещены, а также глутамат в положении 18, основной аминокислотой, такой как аргинин и гистидин. В дикого типа человеческих альфа-субъединицах, один или более из глутаминов в положениях 13 и 20 могут быть замещены, а также глутамат в положении 14 и пролин в положении 16 основной аминокислотой, такой как аргинин и гистидин. В дикого типа свиной альфа-субъединице, один или более из лизинов в положениях 15, 17, 20 и 24 могут быть замещены, а также глутамат в положении 18, основной аминокислотой, такой как аргинин и гистидин. В дикого типа овечьей альфа-субъединице, один или более из лизинов в положениях 15, 17, 20 и 24 могут быть замещены, а также глутамат в положении 18, основной аминокислотой, такой как аргинин и гистидин. В дикого типа лошадиной альфа-субъединице, один или более из лизинов в положениях 15, 20 и 24 могут быть замещены, а также глутамат в положении 18, основной аминокислотой, такой как аргинин и гистидин.
В качестве примера, дополнительно модифицированные бычьи альфа-субъединицы представлены в последовательностях, изложенных в SEQ ID NO: 13 до 19 и 22. Настоящее изобретение относится к модифицированным гликопротеинам с аминокислотными последовательностями с по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше идентичностью с любой из SEQ ID NO: 13 с 19 и 22.
В качестве примера, дополнительно модифицированные лошадиные альфа-субъединицы представлены в последовательностях, изложенных в SEQ ID NO: 38 до 42. Настоящее изобретение обеспечивает модифицированные гликопротеины с аминокислотными последовательностями с по меньшей мере 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или выше идентичностью с любой из SEQ ID NO: 43 до 45.
Дополнительно модифицированные альфа-субъединицы могут быть сконструированы путем сравнения аминокислотных последовательностей рассматриваемой альфа-субъединицы с последовательностями других видов, чтобы определить соответствующие основные остатки в белках других видов. Такие способы описаны в патенте США 6,361,992, который включен в данную заявку в качестве ссылки в полном объеме. Рассмотрение может быть также предоставлено относительной биологической активности гликопротеинового гормона из различных видов, чтобы выбрать виды для сравнения и замещения. Кроме того, гомологическое моделирование на основе структуры смежных гликопротеиновых гормонов полезна, чтобы идентифицировать остатки аминокислот на поверхности. Чтобы изменить дополнительные аминокислотные позиции, гликопротеиновый гормон последовательности людей и не-людей могут быть выровнены с помощью стандартных компьютерных программ, такой как DNASIS (Hitachi Software Engineering) или любой другой программы выравнивания, перечисленных выше, в том числе, но не ограничиваясь приведенным, ALIONment, SIM и GCG программы, таких как Gap, BestFit, FrameAlign и Compare. Аминокислотные остатки, которые отличаются между человеческим и не-человеческим гликопротеиновым гормоном, могут быть замещены с помощью одного из указанных выше методов, и полученный гликопротеиновый гормон анализировали на его эффективности с помощью одного из упомянутых в данной заявке анализов.
Соответственно, данное изобретение также представляет модифицированный FSH белок, имеющий повышенную активность по сравнению с FSH дикого типа тех же видов, содержащие модифицированные альфа-субъединицы описанные в данной заявке.
Данное изобретение также представляет модифицированный LH белок, имеющий повышенную активность по сравнению с дикого типа LH тех же видов, содержащих модифицированные альфа-субъединицы описанные в данной заявке.
Данное изобретение также представляет модифицированный TSH белок, имеющий повышенную активность по сравнению с дикого типа TSH из тех же видов, содержащих модифицированные альфа-субъединицы. описанные в данной заявке. Данное изобретение также представляет модифицированный CG белок, имеющий повышенную активность по сравнению с дикого типа CG из тех же видов, содержащих модифицированные альфа-субъединицы описанные в данной заявке.
Настоящее изобретение также охватывает фрагменты аналогов, описанных в данной заявке, которые имеют суперагонистическую или антагонистическую активность. Например, фрагменты модифицированных альфа-цепей в соответствии с данным изобретением могут быть использованы отдельно или в сочетании с любым фрагментом или полной длиной бета цепи, чтобы создать суперагонистические соединения. В некоторых случаях, фрагменты молекул модифицированной альфа-субъединицы согласно данному изобретению также могут быть использованы в качестве антагонистов, например, чтобы ограничить продолжительность активности терапевтического гликопротеинового гормона, после того как он был введен.
Данное изобретение также представляет последовательности нуклеиновых кислот, кодирующих модифицированные гликопротеиновые гормоны, описанные в данной заявке. Данное изобретение также представляет нуклеиновые кислоты, которые кодируют полипептиды с консервативными аминокислотными замещениями. Нуклеиновые кислоты в соответствии с данным изобретением могут кодировать полипептиды, которые транспортируют сахар. Выделенные нуклеиновые кислоты могут иметь по меньшей мере приблизительно 30%, 40%, 50%, 60%, 70%, 80% 85%, 90%, 95% или 99% идентичность последовательности с указанными выше последовательностями. Выделенные нуклеиновые кислоты могут кодировать полипептид, имеющий аминокислотную последовательность, имеющую идентичность, по меньшей мере приблизительно 30%, 40%, 50%, 60%, 70%, 80%, 85%, 90%, 95%, или последовательность, идентичную 99% аминокислотных последовательностей, кодируемых определенными выше номерами доступа. Выделенная нуклеиновая кислота, кодирующая транспортер, может гибридизоваться с определенными выше последовательностями нуклеиновых кислот.
Нуклеиновая кислота, кодирующая белок модифицированного гликопротеинового гормона, может быть генетически слита с последовательностями, контролирующими экспрессию, для экспрессии. Подходящие последовательности, контролирующие экспрессию, включают промоторы, которые применимы в целевом организме-хозяине. Такие промоторы хорошо известны специалистам в данной области для различных хозяев прокариотических и эукариотических организмов и описаны в литературе. Например, такие промоторы могут быть выделены из природных генов или могут быть синтетическими или химерными промоторами.
Данное изобретение также представляет кассеты экспрессии для инсерции нуклеиновой кислоты, кодирующей белок модифицированного гликопротеинового гормона в целевых молекулах нуклеиновых кислот, таких как векторы. Для этого, кассета экспрессии снабжена нуклеотидными последовательностями в 5'- и 3'-флангах, чтобы облегчить удаление из и инсерции в определенных положениях последовательности, как, например, сайты узнавания ферментов рестрикции или последовательности-мишени для гомологичной рекомбинации, как, например, катализируемой рекомбиназами. В дополнение к кассете нуклеиновой кислоты или молекуле экспрессии в соответствии с данным изобретением, вектор может содержать дополнительные гены, такие как маркерные гены, которые позволяют выбор упомянутого вектора в клетку-хозяин, приемлемую в подходящих условиях. Как правило, вектор также содержит один или несколько источников репликации. Векторы могут также содержать терминаторные последовательности, чтобы ограничить длину за пределами транскрипции нуклеиновой кислоты, кодирующей транспортеры в соответствии сданным изобретением.
Предпочтительно, чтобы молекулы нуклеиновых кислот, содержащихся в векторах, были функционально связаны с последовательностями, контролирующими экспрессию, позволяющими экспрессию, то есть обеспечивающими транскрипцию и синтез транслируемой РНК, в прокариотических или эукариотических клетках.
Термин ''изолированный'' относится к молекулам, отделенным от других компонентов клеток/тканей (например, ДНК или РНК), которые присутствуют в природном источнике макромолекулы. Термин ''изолированные'', используемый в данной заявке, также относится к нуклеиновой кислоте или пептиду, который по существу не содержит клеточного материала, вирусного материала, и культуральной среды, когда их получают способами рекомбинантных ДНК, или, по существу, свободным от химических предшественников или других химических веществ, при химическом синтезе. Кроме того, выделенная нуклеиновая кислота или пептид может включать кислоты или пептидные фрагменты нуклеиновых кислот, которые не встречаются в природе в виде фрагментов, и не будут найдены в естественном состоянии.
Термины ''плазмид'' и ''вектор'' используются взаимозаменяемо, поскольку плазмид является наиболее часто используемой формой вектора. Тем не менее, изобретение предназначено, чтобы включать такие другие формы векторов экспрессии, которые имеют эквивалентные функции и которые станут известны в данной области, относящейся к данной заявке. Вектор может быть любой из нескольких нуклеиновых кислот, в которую желательная последовательность может быть вставлена ограничением и лигированием для транспортировки между различными генетическими средами или для экспрессии в клетке-хозяине. Векторы, как правило, состоят из ДНК, РНК, хотя векторы также доступны. Векторы включают, но не ограничиваются ими, плазмиды и фагемиды. Клонирующий вектор является тем, который способен к репликации в клетке-хозяине, и который дополнительно характеризуется одним или более сайтов эндонуклеазной рестрикции, в которых вектор может быть вырезан определяемым образом и в который желаемая последовательность ДНК может быть лигирована так, чтобы новый рекомбинантный вектор сохранял свою способность к репликации в клетке-хозяине. В случае плазмид репликация требуемой последовательности может происходить много раз, так как плазмид увеличивается числом копий внутри бактерии-хозяине или всего одино раз в хозяине перед воспроизведением хозяина путем митоза. В случае фага репликация может активно происходит во время литической фазы или пассивно во время лизогенной фазы.
Векторы могут дополнительно содержать промоторную последовательность. Промотор может включать нетранслируемую последовательность нуклеиновой кислоты, как правило, расположенную выше по потоку кодирующей области, которая содержит сайт для того, чтобы инициировать транскрипцию нуклеиновой кислоты. Область промотора может также включать другие элементы, которые действуют как регуляторы экспрессии генов. В других вариантах воплощения настоящего изобретения вектор экспрессии содержит дополнительную область, чтобы помочь в выборе клеток, которые имеют вектор экспрессии. Последовательность промотора часто ограничена (включительно) на ее 3'-конце сайтом инициации транскрипции и проходит выше (5' направление), чтобы включить минимальное число оснований или элементов, необходимых для инициации транскрипции на уровне выше фоновых детектируемых значений. В промоторной последовательности можно найти сайт инициации транскрипции, а также домены связывания белка, ответственного за связывание РНК-полимеразы. Эукариотические промоторы часто, но не всегда, содержат TATA боксы и CAT боксы. Активация промоторов может быть специфической для определенных клеток или тканей, например, с помощью транскрипционных факторов, которые экспрессируются только в определенных тканях или промотор может быть повсеместным и способным к экспрессии в большинстве клеток или тканей.
Векторы могут дополнительно содержать один или несколько маркерных последовательностей, пригодных для использования при идентификации и селекции клеток, которые были превращены или трансфицированы вектором. Маркеры включают, например, гены, кодирующие белки, которые увеличивают или уменьшают сопротивление или чувствительность к антибиотикам или другим соединениям, гены, которые кодируют ферменты, деятельность которых детектируется стандартными анализами, известными в данной области (например, (3-галактозидаза или щелочная фосфатаза), и гены, которые заметно влияют на фенотип трансформированных или трансфицированных клеток, хозяев, колоний или бляшек. Векторы могут быть теми, которые способны к автономной репликации и экспрессии структурных генов, присутствующих в продуктах сегментов ДНК, к которому они функционально присоединены. Вектор экспрессии тот, в котором желательная последовательность нуклеиновой кислоты может быть встроена ограничением и лигированием так, что он функционально соединен или функционально связан с регуляторными последовательностями, и может быть экспрессирован как РНК-транскрипт.Экспрессия относится к транскрипции и/или трансляции эндогенного гена, трансгену или кодирующей области в клетке.
Кодирующая последовательность и регуляторная последовательность, функционально соединены, когда они ковалентно связаны таким образом, чтобы поместить экспрессию или транскрипцию кодирующей последовательности под влиянием или контролем регуляторных последовательностей. Если желательно, кодирующие последовательности будут транслированы на функциональный белок, две последовательности ДНК, как говорят, функционально соединены, если индукция промотора в регуляторных последовательностях приводит к 5' транскрипции кодирующей последовательности, и если природа связи между двумя последовательностя