N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, способ их получения, фунгицидные и рострегуляторные композиции на их основе
Иллюстрации
Показать всеИзобретение относится к N4-замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, в которой R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, арилметильную группу общей формулы XnC6H5-nCH2 или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(СН2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3. Изобретение также относится к способу получения, к фунгицидной композиции и к рострегуляторной композиции. Технический результат: получены новые соединения общей формулы I, которые эффективны в борьбе с вредоносными грибами, а также могут применяться для увеличения продуктивности сельскохозяйственных культур за счет регулирования роста растений. 4 н.п. ф-лы, 9 табл., 15 пр.
Реферат
Изобретение относится к химии гетероциклических соединений, а именно к N4-замещенным 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолам общей формулы I:
где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(СН2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
а также к их с агрохимически или фармацевтически приемлемым солям.
Соединения общей формулы I могут найти применение в качестве сельскохозяйственных, промышленных, медицинских или ветеринарных фунгицидов, а также регуляторов роста растений.
Изобретение относится также к способам получения соединений общей формулы I, к использованию этих соединений в композициях с другими активными и вспомогательными соединениями для борьбы с грибковыми болезнями сельскохозяйственных культур, животных и человека, а также в композициях для регулирования роста растений.
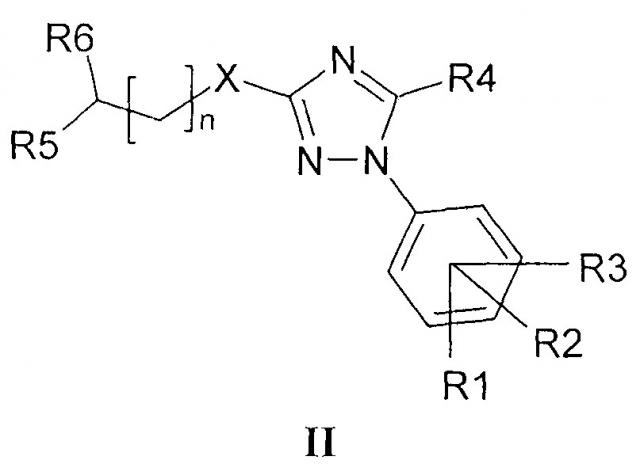
Известен ряд структурных аналогов алкилсульфанил-1,2,4-триазолов общей формулы II, где, означают R1-R3 - независимо водород или галоген; R4 - С1-С6 алкил; R5 и R6 - независимо С1-С6 алкил или образуют, вместе с атомом азота, к которому они присоединены, 5-7-членную гетероциклильную группу, в которой 6-членный гетероциклил может дополнительно содержать один атом кислорода или азота и может быть замещен ацетилом, С1-С6 алкилом или фенилом; X=S-, -SO-, -SO2- или О; и n - целое число, выбранное из 1-8; или их фармацевтически приемлемых солей, стереоизомеров или сольватов, в качестве профилактики и лечения заболеваний или состояний, опосредованных действием на сигма-1-рецепторы.
[Патент RU 2451015 (Российская Федерация) МПК C07D 249/06. Производные 1,2,4-триазола в качестве ингибиторов сигма рецептора / Жажеровик Н., Кумела-Монтанчес X.М., Гойя-Ласа М.П., Дордал Суарэс А., Куберес-Алтисент М.Р. Заявл. 07.11.2007.], заявленных в качестве промежуточных соединений, составляющих фармацевтических композиций.
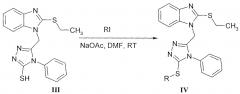
Из близкого N4-фенил-5-(2-этилсульфанил(бензимидазол-1-илметил))-1,2,4-триазол-3-тиона III, полученного реакцией циклоконденсации соответствующего тиосемикарбазида под действием щелочи, в результате алкилирования с различными алкилгалогенидами, в присутствии ацетата натрия получают 3-алкил-сульфанил-N4-фенил-5-(2-этилсульфанил(бензимидазол-1-илметил))-1,2,4-триазолы IV [Eisa Н.М., Barghash A.M., Badr S.M., Farahat A.A. Synthesis and antimicribal activity of certain benzimidazole and fused benzimidazole derivatives// Ind. J. Chem. - 2010. - Vol. 49B. - P. - 1515-1525].
Данные 3-алкилсульфанил-1,2,4-триазолы IV предложено применять в качестве антимикробных препаратов.
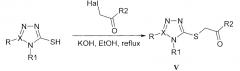
Близким по структуре и по способу получения является ряд 3-алкил-сульфанил-4-арил-5-ариламинометил-1,2,4-триазолов общей формулы V, где, Va Х=С, R=-CH2-NH-(4-CH3C6H4), R1=4-СН3ОС6Н4, R2=NH-(2-СН3С6Н4) или Vb Х=С, R=-CH2-O-C6H5, R1=-CH2C6H5, R2=2,4-F2C6H5O-CH2 или Vc X=C, R=-CH2-S-(4-CH3C6H4), R1=R2=C6H5 или Vd X=N, R1=C6H5, R2=NH(4-CH3C6H4), или IIe X=N, R1=C6H5,, R2=NHC6H5. [Патент UA 89537 (Украина) МПК C07D 257/04, C07D 249/08, A61K 31/00. Алкилированные производные 1,2,4-триазол-3-тиола, 1-фенил-1H-тетразол-5-тиола, которые проявляют противоязвенную активность /. Георгiянц В.А., Дроговоз С.М., Кадамов I.М., Тимофеев М.П., Сааод X., Северiна Г.I., Саiдов Н.Б. Заявл. 15.11.2013.], заявленных в качестве соединений проявляющих противоязвенную активность, получаемых алкилированием соответствующих 1,2,4-триазол-3-тионов различными α-галогенкарбонильными соединениями, в присутствии гидроксида калия в этаноле, с выходами до 85%.
Близким по применению является ряд 5-(1,2,4-триазол-1-илметил)-дигидроизоксазолов VI, где R1 и R2 такие, как водород, алкоксиалкил, галоакил, циклоалкильную группу, фенилалкил, нафтилалкил, арил, гетерил, заявленных в качестве фунгицидов и регуляторов роста растений [Патент US 5156669 (США) 5-(1,2,4-triazol-1-ylmethyl)-isoxazolines / Zierke Т., Kuekenhoehner Т., Frank J., Ammermann E., Lorenz G. Заявл. 09.04.1991].
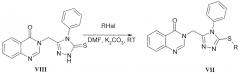
Наиболее близким к заявленным 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолам общей формулы I, как по получению, так и по применению является ряд 3-[(5-алкилсульфанил-4-фенил-1,2,4-триазол-1-ил)метил]хиназолин-4-онов VII, где R означает бензил, фторбензил, хлорбензил, трифторметилбензил, метилбензил, получаемых из 3-[(5-тио-4-фенил-1,2,4-триазол-1-ил)метил]-хиназолин-4-онов VIII алкилированием алкилгалогенидами в диметилформамиде, в присутствии поташа при комнатной тепературе. Соединения VII, обладают фунгицидной активностью [Патент CN 104829598 (Китай) 1,2,4-Triazole sulfide-containing quinazolinone compound, synthetic method and application as plant fungicide / Bao X.; Yan В.; Lv X.; Du H. Заявл. 27.05.2015].
Задача, решаемая данным изобретением, состоит в увеличении эффективности борьбы с вредоносными грибами и расширении ассортимента фунгицидных препаратов, а также увеличении продуктивности сельскохозяйственных культур за счет регулирования роста растений, расширении ассортимента регуляторов роста растений.
Поставленная задача решается получением соединений общей формулы I, обладающих фунгицидной и рострегуляторной активностью, а также в увеличении эффективности фунгицидных и рострегуляторных средств за счет применения N4-замещенных 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I и расширении ассортимента фунгицидных и рострегуляторных препаратов.
Согласно настоящему изобретению, N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, получают взаимодействием N4-замещенных 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионов общей формулы IX, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
с алкилгалогенидами X, где R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
в присутствии оснований: гидроксидов, алкоголятов, карбонатов щелочных металлов, третичных аминов, в полярных апротонных или протонных растворителях при температуре от 20°С до 160°С.
Техническим результатом изобретения являются новые N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, и способ их получения. В указанном патенте [Патент CN 104829598 (Китай)] алкилирование 3-[(5-тио-4-фенил-1,2,4-триазол-1-ил)метил]хиназолин-4-онов алкилгалогенидов предлагается проводить при комнатной температуре в сравнительно трудноудаляемом растворителе в присутствии карбоната калия. Мы предлагаем получать новые N4-замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I, более простым и эффективным малоотходным способом: взаимодействием 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионов общей формулы IX алкилгалогенидами в легко удаляемых дешевых полярных растворителях.
(1,2,4-Триазол-1-ил)ацетгидразид XI получают по описанной в литературе методике [Попков С.В., Алексеенко А.Л., Тихомиров Д.С. Синтез, строение и фунгицидная активность замещенных N2-фенилалкилиден-2-(азол-1-ил)ацетгидразидов // Изв. вузов. Химия и хим. технология. - 2007. - Т. 50, В. 6. - С. 98-101.], далее его ацилируют замещенными тиоизоцианатами в абс. этаноле с получением N4-замещенных-N1-(1,2,4-триазол-1-илацетил)-тиосемикарбазидов XII, где R1 означает циклогексильную, фурфурильную, бензильную группу, которые затем циклоконденсируют в ключевые N4-замещенные 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионы IX, где R1 означает циклогексильную, фурфурильную, бензильную группу, под действием водного раствора гидроксида натрия, с последующим подкислением водным раствором кислот, по описанной в литературе методике [Цаплин Г.В.; Попков С.В. Синтез N4-(бензил)- и N4-(циклогексил)-N1-(1,2,4-триазол-1-илацетил)тиосемикарбазидов и продуктов их циклоконденсации в кислой и основной среде.// Успехи в химии и хим. технологии: сб. науч. тр. Том XXX, №11, М: РХТУ им. Д.И. Менделеева. - 2016. - С. 91-93.].
Успешное применение пестицидов для борьбы с различными вредными организмами в большой степени зависит от препаративной формы препарата и условий, при которых действующее вещество контактирует с вредителями и возбудителями заболеваний растений. В зависимости от физико-химических свойств препарата, его назначения и способа применения выбирается наиболее эффективная и экономичная препаративная форма (композиция), это могут быть, например, дусты, гранулы, микрокапсулированные препараты, смачивающиеся порошки, концентраты эмульсий, мази, вододиспергируемые гранулы, суспензионные концентраты. Препаративные формы помимо действующего вещества, могут включать в свой состав вспомогательные вещества: наполнители, растворители, поверхностно-активные вещества, умягчители воды, синергические добавки и др. Известен препарат триадимефон, который применяют в виде 5, 25%-ного смачивающегося порошка, 10%-ного эмульгирующего концентрата для борьбы с болезнями пшеницы, ржи, ячменя, сахарной свеклы, яблони, огурцов в период вегетации, а также как протравитель семян. [Пестициды и регуляторы роста растений: Справ. изд. / Н.Н. Мельников, К.В. Новожилов, С.Р. Белан. - М.: Химия, 1995, с. 24, с. 287.]
Техническим результатом изобретения также является разработка фунгицидных композиций, состоящих из замещеных 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для борьбы с вредоносными грибковыми болезнями сельскохозяйственных культур, животных или человека. По результатам фунгицидных испытаний in vitro замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы I, выбранные из группы, соединения 13-26 близки или превосходят по фунгитоксичности эталон, известный фунгицид триадимефон (3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-2-бутанон) по отношению к определенным видам грибов фитопатогенов.
Техническим результатом изобретения также является разработка рострегуляторных композиций, состоящих из замещеных 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I в концентрации 0,1-99% и вспомогательных веществ, которые успешно могут быть применены для регулирования роста сельскохозяйственных культур. По результатам рострегуляторных испытаний in vitro замещенные 3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы, выбранные из группы, соединения 11, 21 превосходят используемый в качестве эталонного известный регулятор роста растений - паклобутразол при тестировании в концентрации 10 мг/л проявляют ретардантный эффект, уменьшая длину ростка на 29% и 43% соответственно, а уменьшая сухой веса ростка на 35% и 51% соответственно.
Изобретение может быть проиллюстрировано следующими примерами:
Пример 1. Получение 2-(1Н-1,2,4-триазол-1-ил)ацетгидразида (1)
К раствору 16,92 г (0,12 моль) метилового эфира 1Н-(1,2,4-триазол-1-ил)уксусной кислоты в 25 мл этанола, добавляют 14,96 мл (0,3 моль) 98% гидразин гидрата, кипятят в течение 6 ч., охлаждают, осадок отфильтровывают на фильтре Шотта и промывают этанолом (3×10 мл), получают 13,2 г (78%) 2-(1Н-1,2,4-триазол-1-ил)ацетгидразида, с т.пл. 115-116°С; ср., лит. [Попков С.В., Алексеенко А.Л., Тихомиров Д.С. Синтез, строение и фунгицидная активность замещенных N2-фенилалкилиден-2-(азол-1-ил)ацетгидразидов // Изв. вузов. Химия и хим. технология. - 2007. - Т. 50, В. 6. - С. 98-101] т.пл. 115-116°С.
1Н ЯМР-спектр (δ, м.д.; 3J, Гц): 4,35 с (2Н, NH2); 4,83 с (2Н, СН2); 7,95 т (1Н, C3HTrz); 8,49 т (1H, C5HTrz); 9,42 с (1H,NH).
Пример 2. Получение N4-циклогексил-N1-(1,2,4-триазол-1-илацетил)-тиосемикарбазида (2)
К раствору 2,00 г (0,0142 моль) 2-(1Н-1,2,4-триазол-1-ил)ацетгидразида в 15 мл этанола, добавляют 2,004 г (0,0142 моль) циклогексилтиоизоцианата, кипятят в течение 2 ч, охлаждают, осадок отфильтровывают на фильтре Шотта, получают 5,123 г (93%) 5-(1,2,4-триазол-1-ил)метил-N-фенил тиосемикарбазида с т.пл. 183-184°С, ср., лит. [Цаплин Г.В., Попков С.В. Синтез N4-(бензил) И N4-(циклогексил) -N1-(1,2,4-триазол-1-ил-ацетил)тиосемикарбазидов и продуктов цилклоконденсации в кислой и основной среде // Успехи в химии и химической технологии. - 2016. - Т. 30, №11 (180). - С. 91-93] т.пл. 184-185°С.
1Н ЯМР-спектр (δ, м.д., 3J, Гц): Смесь конформеров А:Б=89:11. 1.20 м (5Н, СНСН22СН26, СН3), 1.55-1.9 м (5Н, СНСН23СН24, CH3), 4.10 уш.с. (1H, СНСН2СН2), 4.98 с (2Н, CH2N), 7.64 уш.с. (1Н, NHCH2C6H5, А) 7.97 с (1H, C5HTrz, Б) 8.01 с (1Н, C5HTrz, А), 8.19 ущ.с. (1Н, NHCH2C6H5, Б), 8.42 с (1H, C3HTrz, Б) 8.54 с (1Н, C3HTrz,A), 9.29 уш.с. (1Н, NHCS, А), 9.37 уш.с. (1Н, NHCS, Б), 9.58 уш.с. (1H, NHCO, Б), 10.20 уш.с. (1Н, NHCO, А).
Аналогично получают другие замещенные тиосемикарбазиды 3,4. (Таблица 1 и 2).
Пример 3. Получение N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона (5)
К раствору 0,192 г (4,8 моль) гидроксида натрия в 10 мл воды, добавляют 1,360 г (4,69 ммоль) N4-бензил-N1-(1,2,4-триазол-1-илацетил)тиосемикарбазида, кипятят в течение 3 ч, подкисляют до рН=6 водным раствором 1М соляной кислоты, выпавший осадок отфильтровывают, высушивают на воздухе, получают 1,163 г (91%) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона, с т.пл. 208-211°С, ср. лит. [Dobosz M., Sikorska М. The reactions of cyclization of thiosemicarbazide deriveties with 1,2,4-triazole system.//Acta Pol. Pharm. - 1994. - Vol. 51, №4-5. - P. 369-376] т.пл. 192-194°C. Rf=0,87 (система: хлороформ : метанол 10:1)
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 5.32 с (2Н, СН2С6Н5), 5.54 с (2H, CH2N), 7.145 д (2Н, С3Н, С5Н, 3J=8.1), 7.30 д (3Н, С2Н, С4Н,C6HAr, 3J=6.6), 7.9 с (1H, C3HTrz),8.52 с (1Н, C5HTrz), 14.03 c (1H, NH).
Аналогично получают другие замещенные 1,2,4-триазол-3-тионы 5, 7, 8. (Таблица 1 и Таблица 2)
Пример 4. Получение N4-фурфурил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона (6)
К раствору 2,0 г (0,014 моль) 2-(1H-1,2,4-триазол-1-ил)ацетгидразида в 35 мл абс. ТГФ и 25 мл абс. ацетонитрила, добавляют 1,972 г (0,014 моль) 2-фурфурилметилтиоизоцианата в 10 мл абс. ацетонитрила, споласкивая колбу (2×5 мл) абс. ацетонитрилом. Реакционную массу кипятят в течение 5 ч, добавляют 0,049 мл триэтиламина (0,0356 г, 0,4 ммоль). После 4ех часового кипячения добавляют 0,05 г (моль) трет-бутилата калия и кипятят еще в течение 2х ч. Смесь растворителей отгоняют на РПИ в вакууме водоструйного насоса, остаток перекристаллизовывают из пропан-2-ола, получают 1,75 г (44%) N4-(фурфурил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона, с т.пл. 219-220°С. Rf0,74 (система: хлороформ : метанол 6:1).
1Н NMR Спектр (δ, м.д., 3J, Гц): 5.34 с (2Н, CH2NN), 5.7 с (2Н, СН2СО), 6.4 д (2Н, ОСН=СНСН=С, 3J=7.3), 7.58 с (1H, OCH), 8.01 с (1Н, C3HTrz),8.67 с (1H, C5HTrz), 13.96 с (1Н, NH).
Аналогично получают другие замещенные 1,2,4-триазол-3-тионы 6,7. (Таблица 3 и 4)
1Н NMR Спектр (δ, м.д., 3J, Гц): 5.34 с (2Н, CH2NN), 5.7 с (2Н, СН2СО), 6.4 д (2Н, ОСН=СНСН=С, 3J=7.3), 7.58 с (1Н, OCH), 8.01 с (1Н, C3HTrz),8.67 с (1H, C5HTrz), 13.96 с (1Н, NH).
*(С4Н3О)СН2 - фурфурил (фуран-2-илметил).
Пример 5. Получение N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9)
К раствору 0,24 г (0,88 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 10 мл ацетона, добавляют 0,21 г (1,5 ммоль) карбоната калия, 0,1441 г (0,88 ммоль) 4-хлорбензилхлорида, кипятят в течение 6 ч. Затем на РПИ в вакууме водоструйного насоса отгоняют растворитель, к остатку добавляют 1 мл воды и экстрагируют хлороформом (3×5 мл), органический слой сушат над сульфатом магния, отфильтровывают, фильтрат упаривают на РПИ в вакууме водоструйного насоса. К остатку в виде масла добавляют 5 мл серного эфира, выпавшие кристаллы отфильтровывают на фильтре Шотта, получают 0,1974 г N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (57%), с т.пл. 104-106°С.
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 4.33 с (2Н, CH2C6H4Cl), 5.22 с (2Н, СН2С6Н5), 5.66 с (2Н, CH2N), 6.86 м (2Н, Ar), 7.27-7.32 м (7Н, Ar), 7.94 с (1H, C3HTrz), 8.58 с (1H, C5HTrz).
Аналогично получают соедиение 12.
Пример 6. Получение N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9)
К раствору 0,408 г (1,5 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 8 мл этанола, добавляют 0,084 г (1,5 ммоль) гидроксида калия. К нагретой до кипения реакционной массе добавляют 0,2415 г (1,5 ммоль) 4-хлорбензилхлорида, растворенного в 3 мл этанола, кипятят в течение 6 ч., упаривают растворитель на РПИ в вакууме водоструйного насоса. Технический продукт растворяют в хлористом метилене (5 мл), перемешивают с 8% водным раствором гидроксида калия в течение 2 ч, органический слой отделяют, водный слой экстрагируют хлористым метиленом (2×5 мл), осушают сульфатом магния, отфильтровывают, фильтрат упаривают на РПИ в вакууме водоструйного насоса, получают 0,303 г (51%) N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 105-106°С.
Пример 7. Получение N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9)
К раствору 0,1904 г (0,7 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 2,5 мл диметилформамида, добавляют 0,107 мл (0,77 ммоль) триэтиламина. К нагретой до кипения реакционной массе добавляют 0,1127 г (0,7 ммоль) 4-хлорбензилхлорида, растворенного в 1 мл диметилформамида, нагревают до 140°С и перемешивают в течение 6 ч., реакционную массу охлаждают, добавляют 20 мл серного эфира, 10 мл воды, отделяют органический слой. Водный слой промывают 2×15 мл серного эфира и 2×5 мл воды. Объединяют органические фазы, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Технический продукт растворяют в хлористом метилене (5 мл), перемешивают с 8% водным раствором гидроксида калия в течение 2 ч, органический слой отделяют, водный слой экстрагируют хлористым метиленом (2×5 мл), осушают сульфатом магния, отфильтровывают, фильтрат упаривают на РПИ в вакууме водоструйного насоса, получают 0,215 г (87%) N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 104-106°С.
Пример 8. Получение N4-бензил-3-изоамилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (10)
К раствору 0,17 г (0,685 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 7 мл ТГФ добавляют 0,148 г (1,07 ммоль) карбоната калия,, кипятят в течение 0.5 ч, добавляют раствор 0,103 г (0,685 ммоль) изоамилбромида в 3 мл ТГФ, через 2 ч. отгоняют растворитель на РПИ в вакууме водоструйного насоса, получают технический продукт в виде масла, который кипятят с изооктаном (5×5 мл), верхний слой декантируют, из остатка отгоняют растворитель на РПИ в вакууме водоструйного насоса, получают 0,15 г N4-бензил-3-(изоамил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (69%), с т.пл. 104-106°С.
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 0.83-0.9 м (7Н, (СН3)2СН), 1.47 к (2Н, СН2СН, 3J=7.3), 3,06 т (2Н, СН2СН2, 3J=7.3), 5.33 с (2Н, СН2С6Н5), 5.70 с (2Н, CH2N), 6.96 м (2Н,), 7.31 м (3Н, CHAr), 7.94 с (1H, C3HTrz), 8.60 с (1Н, C5HTrz)
Пример 9. Получение N4-бензил-3-((4-хлорфенокси)этилсульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (11).
К раствору 0,5 г (1,8 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 18 мл абс. ТГФ добавляют 0,202 г (1,8 ммоль) трет-бутилата калия, кипятят в течение 30 мин, добавляют раствор 0,424 г (1,8 ммоль) 1-(2-бромэтокси)-4-хлорбензола в 4 мл абс. ТГФ, кипятят в течение 9 ч, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Остаток промывают серным эфиром (2×3 мл), получают 0,502 г (66%) N4-бензил-3-((4-хлорфенилокси)этилсульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 97-99°С.
1Н ЯМР-Спектр (δ, м.д., 3J, Гц): 3.46 дд (2Н, CH2S, 3J=6.6, 3J=5.5), 4.20 т (2Н, CH2O, 3J=6.6), 5.32 с (2Н, СН2С6Н5), 5.69 с (2Н, CH2N), 6.92 м (4Н, 4CHAr), 7.26 м (5Н, 5CHAr), 7.93 с (1H, C3HTrz), 8.59 с (1Н, C5HTrz).
Аналогично получают соединения (13-26).
Пример 10. Получение N4-бензил-3-((2-метил-4-хлорфенокси)этил-сульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (27).
К раствору 0,204 г (0,75 ммоль) N4-бензил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тиона в 10 мл абс. ТГФ добавляют 0,0924 г (0,825 ммоль) трет-бутилата калия, кипятят в течение 1 ч, добавляют раствор 0,187 г (0,75 ммоль) 1-(2-бромэтокси)-2-метил-4-хлорбензола в 3 мл абс. ТГФ, кипятят в течение 6 ч, растворитель отгоняют на РПИ в вакууме водоструйного насоса. Остаток промывают серным эфиром (2×3 мл), получают 0,215 г (65%) N4-бензил-3-((2-метил-4-хлорфенокси)этилсульфанил)-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола, с т.пл. 88-90°С.
1Н ЯМР-Спектр (δ, м.д., 3J, Гц): 2.4 с (3Н, CH3Ar), 3.51 т (2Н, CH2S, 3J=5.9), 4.22 т (2Н, CH2O,3J=5.9), 5.34 с (2Н, СН2С6Н5), 5.71 с (2Н, CH2N), 6.92-7.05 м (3Н, 3CHAr), 7.26 м (5H, 5CHAr), 7.94 с (1Н, C3HTrz), 8.60 с (1H, C5HTrz).
Продолжение Табл. 6.
Пример 11. Получение гидрохлорида N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (9*).
К раствору 0,12 г (0,302 ммоль) N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола в 2 мл абс. этанола, добавляют 137 мкл 2.2 М раствора соляной кислоты (0,302 ммоль) в диэтиловом эфире, перемешивают в течение 4 ч., растворитель отгоняют на РПИ в вакууме водоструйного насоса. К остатку в виде масла добавляют 0.2 мл серного эфира, выпавшие кристаллы отфильтровывают на фильтре Шотта, получают 0,123 г гидрохлорида N4-бензил-3-(4-хлорбензил)сульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазола (93%), с т.пл. 93-95°С.
1Н ЯМР Спектр (δ, м.д., 3J, Гц): 4.36 с (2Н, CH2C6H4Cl), 5.25 с (2Н, СН2С6Н5), 5.72 с (2Н, CH2N), 6.86 м (2Н, Ar), 7.27-7.33 м (7Н, Ar), 8.07 с (1Н, C3HTrz), 8.79 с (1Н, C5HTrz).
Пример 12. Композиция концентрата эмульсии
Действующее вещество (N4-(бензил)-3-[2-(3,4-дихлорфенил-окси)этилсульфанил]-5-(1,2,4-триазол-1-илметил)-1,2,4-триазол) 6 г
Алкилбензолсульфокислоты кальциевая соль (АБСК) 2 г
Оксиэтилированный октилфенол (ОП-7) 8 г
Циклогексанон 29 г
Ксилол 16 г
Нефтяной сольвент 29 г.
Пример 13.
Испытания на фунгицидную активность соединений общей формулы I, проводили в экспериментах in vitro. [Методические рекомендации по определению фунгицидной активности новых соединений. Черкассы: НИИТЭХИМ. 1984. 34 с.]. Действие препаратов на радиальный рост мицелия определяли растворением композиции соединения в ацетоне и внесением аликвоты в картофеле-сахарозный агар при 50°С до концентрации 30 мг/л по действующему веществу. Конечная концентрация ацетона в контрольных растворах с действующими веществами составили 1%. В чашки Петри, содержащие 15 мл агаровой среды, наносили иглой культуры грибов на агаровую поверхность. Образцы выдерживали в инкубаторе при 25°С и измеряли радиальный рост через 3 суток. Процент ингибирования рассчитывали по Эбботу по отношению к необработанному контролю. В качестве эталона использовали коммерческий фунгицид триадимефон в той же концентрации. Результаты испытаний представлены в таблице 7.
Обозначения: V.i. - Venturia inaequalis, R.s. - Rhizoctonia solani, F.o. - Fusarium oxysporum, F.m. - Fusarium moniliforme, B.s. - Bipolaris sorokiniana, S.s. - Sclerotinia sclerotiorum.
* - Триадимефон - 3,3-диметил-1-(1,2,4-триазол-1-ил)-1-(4-хлорфенокси)-бутанон-2
Пример 14.
Испытания на рострегуляторную активность соединений общей формулы I, где R1 и R2 разные, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемый из группы, фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группы общей формулы XnC6H5-nO(СН2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(CH2)m, где X означает атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 6, перфторалкильную группу с числом атомов углерода от 1 до 3, n - означает целое число от 0 до 5, m означает целое число от 1 до 3, проводили в экспериментах in vivo на проростках огурца сорта «Единство». Испытания проводили в соответствии с методическими рекомендациями на трехдневных проростках. Растворы соединений, с концентрацией 10 мг/мл вещества в ДМСО, доводили до необходимой концентрации - 10, 0,1 и 0,001 мг/л добавлением дистиллированной воды [Методические рекомендации по проведению лабораторного скрининга синтетических регуляторов роста растений. Под ред. Шаповалова А.А. // Черкассы.: НИИТЭХим. - 1985. - 29 с.].
Семена огурца равномерно раскладывали в чашки Петри на фильтры, смоченные раствором исследуемого вещества; на одну чашку брали 10 семян и 4 мл раствора. Каждый вариант включал х 3 чашки с семенами, которые выдерживали трое суток в термостате при температуре 24°С. Соединения испытывали так же в трех концентрациях - 10; 0,1 и 0,001 мг/л. Контролем служили чашки с дистиллированной водой.
В качестве эталона использовали паклобутразол.
Через 3 дня проводили учет всхожести семян, затем в каждой чашке отбирали по 5 хорошо развитых проростков и измеряли у них длину корня и гипокотиля, определяли суммарную сырую и сухую массу гипокотилей.
Полученные результаты представлены в таблице 8.
* Эталон - паклобутразол(4,4-диметил-2-(1,3,4-триазол-1-ил)-1-(4-хлорфенил)пентанол-3
Пример 15.
Оценку рострегуляторной активности проводили рулонным методом на семенах яровой пшеницы сорта "Дарья". Метод основан на проращивании семян пшеницы предварительно обработанных растворами испытуемых соединений. Используемые конц. соединений 10, 0,1 и 0,001 мг/л.
Семена пшеницы выкладывали в чашки Петри и заливали растворами испытываемых соединений до полного погружения. Спустя 14 часов семена извлекали и укладывали по 30 шт. на заготовку для проращивания. Заготовка состояла из 3 слоев - полоса полиэтиленовой пленки 12×55 см, и такого же размера фильтровальной бумаги и миллиметровки, сверху семена накрывали такой же бумагой, увлажняли опрыскиванием из пульверизатора и, свернув рулоном, помещали в пластиковые стаканчики с 50 мл дистиллированной воды после чего оставляли для прорастания при температуре 22°С.
Через 7 суток проводилась оценка длины, веса ростков и корней пшеницы. Каждый опыт включал себя по 3 повторности по 10 семян. В качестве эталона использовали Паклобутразол. Через 3 дня проводили учет всхожести семян, затем в каждой чашке отбирали по 5 хорошо развитых проростков и измеряли у них длину корня и гипокотиля, определяли суммарную сырую и сухую массу гипокотилей.
Полученные результаты представлены в таблице 9.
* Эталон - паклобутразол (4,4-диметил-2-(1,3,4-триазол-1-ил)-1-(4-хлорфенил)пентанол-3
1. N4-Замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы общей формулы I:
где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, арилметильную группу общей формулы XnC6H5-nCH2 или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(СН2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3 или их агрохимически или фармацевтически приемлемые соли.
2. Способ получения N4-замещенных-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолов общей формулы I, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, арилметильную группу общей формулы XnC6H5-nCH2 или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(CH2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=CH(СН2)m, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
заключающийся в том, что N4-замещенные 5-(1,2,4-триазол-1-илметил)-1,2,4-триазол-3-тионы общей формулы IX, где R1 означает циклоалкильную группу с числом атомов углерода от 3 до 6, арильную группу общей формулы XnC6H5-n, или гетерилметильную группу, выбираемую из группы: фурфурил, тетрагидрофуран-2-илметил, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
вводят во взаимодействие с алкилгалогенидами X, где R2 означает алкильную группу с числом атомов углерода от 1 до 6, арилалкильную группу общей формулы XnC6H5-n(CH2)m, или арилоксиалкильную группу общей формулы XnC6H5-nO(СН2)m, или арилвинилалкильную группу общей формулы XnC6H5-nCH=СН(СН2)m, где X, одинаковые или разные, означают атом водорода или галогена, алкильную группу с числом атомов углерода от 1 до 4, перфторалкильную группу с числом атомов углерода от 1 до 4, n означает целое число от 0 до 5, m означает целое число от 1 до 3,
в присутствии оснований: гидроксидов, алкоголятов, карбонатов щелочных металлов, третичных аминов, в полярных апротонных или протонных растворителях при температуре от 20 до 160°С
.
3. Фунгицидная композиция, содержащая фунгицид в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве фунгицида используют N4-замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы I по п. 1.
4. Рострегуляторная композиция, содержащая регулятор роста растений в концентрации 0,1-99% и вспомогательные вещества, отличающаяся тем, что в качестве регулятора роста используют замещенные N4-замещенные-3-алкилсульфанил-5-(1,2,4-триазол-1-илметил)-1,2,4-триазолы I по п. 1.