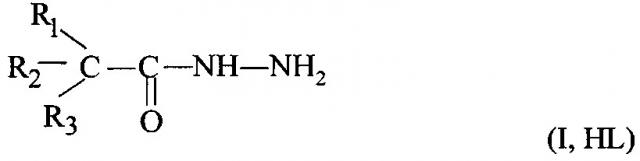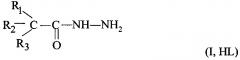Способ извлечения меди(ii) экстракцией из водных сернокислых растворов, содержащих другие металлы
Иллюстрации
Показать всеИзобретение может быть использовано для извлечения меди в присутствии других металлов из продукционных растворов сульфатного выщелачивания экстракцией органическим реагентом. В качестве органического реагента используют раствор гидразидов α-разветвленных третичных карбоновых кислот фракции со средней м.м. 280-290 а.е.м. (ГВИК 1519) общей формулы (1), где R1, R2, R3 - алкильные радикалы, а сумма атомов углерода равна 15-19, в углеводородном растворителе или в его смеси с модификаторами: 2-этилгексанолом или алкилфенолом.
Технический результат - высокая степень и селективность извлечения меди(II) из сернокислых сред с рН<1 в присутствии никеля(II), кобальта(II), железа(III), цинка(II), уменьшение потерь экстрагента, связанных с уносом с водной фазой, увеличение устойчивости к гидролизу и окислению. 3 з.п. ф-лы, 3 ил., 3 табл., 6 пр.
Реферат
Изобретение относится к гидрометаллургии цветных металлов и может быть использовано при переработке растворов выщелачивания окисленных, бедных медных руд, техногенных отходов и отделения меди(II) в присутствии никеля(II), кобальта(II), железа(III), цинка(II).
Необходимость создания настоящего изобретения обусловлена сложностью выделения меди из сульфатных растворов, содержащих примеси никеля(II), кобальта(II), железа(III) и цинка(II).
В настоящее время основным промышленным методом получения меди из водных растворов является комбинация жидкостной экстракции и электролиза [Крейн Ф. Экстракция в гидрометаллургии меди: Развитие и современное состояние // Комплексное использование минерального сырья. - 2004. - №2. - С. 36-55]. Эффективность жидкостной экстракции определяется выбором экстракционного реагента [Радушев А.В., Гусев В.Ю., Набойченко С.С. Органические экстрагенты для меди: обзор // Цветные металлы. - 2002. - №3 - С. 18-27].
Фирмой «Дженерал Миллз» предложен ряд реагентов класса оксиоксимов под общим коммерческим названием LIX [Szymanowski J., Borowiak-Resterna A. Chemistry and analytical characterization of hydroxyoxime structure upon metal-complexing and extraction properties // CRC Crit. Rev. Anal. Chem. - 1991. - Vol. 22. - №1, 2. - P. 519-566. Kordosky G.A. Copper Solvent Extraction: The State of the Art// JOM: J. Miner. Metals and Mater. Sci. - 1992. - Vol. 44. - №5. - P. 40-46]. Реагенты подразделяются на 2 группы: кетоксимы и альдоксимы.
Кетоксимы (LIX 64, LIX 84) имеют хорошие технологические свойства и эффективны при экстракции 1-1,5 г/л меди из растворов с рН ~1,7-1,8, но не подходят для растворов с низким содержанием меди или имеющих более низкое значение рН. В свою очередь, экстрагенты на основе альдоксимов (LIX 860, LIX 860N) не могут быть использованы в чистом виде. Они извлекают медь из более кислых растворов и при ее меньшей концентрации, чем кетоксимы, так как образуют более прочные медные комплексы. Однако эти качества реагентов создают трудности при последующей реэкстракции.
Экстрагенты последнего поколения, эффективные для экстракции меди из сернокислых сред - это смеси кетоксимов и альдоксимов (например, LIX 984N и LIX 973N) [Ramachandra Reddy В., Но Park Kyung, Mohapatra D. Process development for the separation and recovery of copper from sulphate leach liquors of synthetic Cu-Ni-Co-Fe matte using LIX 84 and LIX 973N / Hydrometallurgy 87. 2007. №1-2. P. 57.; Cole P.M., Feather A.M. Asolvent-extraction process to recover copper and nickel from a tankhouse effluent. Proceedings of the Third International Conference, Vol. III. Electrorefining and Hydrometallurgy of Copper. Ed. Cooper, W.C. Dreisinger. P. 607-615]. Однако и они имеют ряд недостатков: токсичны, склонны к гидролизу и окислению [Liu Xiao-rong, Qiu Guan-zhou, Hu Yue-hua. Degradation of LIX 984N and its effecton interfacial emulsion / J. Cent. S. Univ. Technol.: Sci. and Technol. Mining and Met. Science and Technology of Minning and Metallurgy. 2006. V. 13. №6. P. 668-672].
Известен способ извлечения меди(II) из кислых или щелочных растворов экстракцией гидразидами карбоновых кислот или их солями, в том числе гидразидами высших изомерных кислот С10-С25 [Авт. свид. СССР №1136485, МКИ C22B 3/00. Способ извлечения цветных металлов из кислых или щелочных растворов экстракцией. Опубл. 15.06.92, БИ №22]. Недостатками применяемых в этом способе гидразидов является то, что при рН<1 эффективность извлечения меди(II) существенно снижается, а применение реагентов при рН<3-4 без 30-50 масс. % модификаторов затруднительно из-за образования трудно расслаивающихся эмульсий, кроме того, емкость по меди(II) невелика (до 2,5-3 г/л).
Наиболее близким по достигаемому результату решением (выбранным за прототип) является способ экстракции меди(II) из сернокислых сред 0,1-0,2 моль/л растворами гидразидов нафтеновых кислот (ГНК) (м.м. 272 и 258) в смесях 2-этилгексанол - керосин и алкилфенол - керосин в присутствии железа(III), кобальта(II), цинка(II), никеля(II) [Радушев А.В., Гусев В.Ю., Богомазова Г.С. Экстракция меди(II) и никеля(II) из кислых растворов гидразидами нафтеновых кислот.// Современные проблемы химии и технологии экстракции. Т. 2. / Отв. ред. Холькин А.И. и Юртов Е.В. - М.: 1999. - С. 189-194]. ГНК селективно экстрагируют медь(II) при ее содержании менее 1 г/л в присутствии 40-80-кратного количества железа(III) из кислых растворов в интервале рН 0,7-2 на 40-50% за одну ступень экстракции.
Недостатки способа:
- плохая совместимость экстрагентов (0,1-0,2 моль/л) с органическими растворителями, эмульгирование водной фазы (что вызывает необходимость использования до 20-40 об. % модификатора), большие потери реагента с водной фазой;
- низкая устойчивость к гидролизу в кислых средах;
- невысокая емкость органической фазы по меди(II);
- невысокие коэффициенты разделения пар элементов Cu/Ni; Cu/Со и степени извлечения меди(II) в области рН<1-1,5.
Задачей изобретения является разработка способа извлечения меди(II) из водных сернокислых растворов с использованием экстракционного реагента, хорошо совместимого с углеводородными растворителями и модификаторами, уменьшение его потерь с водной фазой, повышение устойчивости к гидролизу и улучшение селективности извлечения меди(II) в присутствии железа(III) или никеля(II), или кобальта(II), или цинка(II) и из более кислых сред, чем рН 1-1,5.
Для решения поставленной задачи предлагается:
Способ извлечения меди(II) экстракцией из водных сернокислых растворов, содержащих другие металлы, отличающийся тем, что в качестве экстрагента используют гидразиды со средней м.м. 280-290 а.е.м. на основе синтетических α-разветвленных третичных карбоновых кислот фракции С15-С19 (ГВИК 1519) общей формулы (I, HL) (где R1, R2, R3 - алкильные радикалы, а сумма атомов углерода равна 15-19), при этом экстракцию осуществляют 0,2-0,6 моль/л раствором гидразидов (I) в углеводородном растворителе или в углеводородном растворителе с добавками 30 об. % модификаторов: 2-этилгексанола или алкилфенола.
Достижение технического результата объясняется:
- наличием у заявляемого реагента гидразидной функционально-активной группы атомов ((C(O)NHNH2)), являющейся селективной по отношению к ионам меди(II) за счет образования в кислых средах прочных катионных комплексов типа [Cu(HL)n]SO4 (где n обычно равно 3, a HL - нейтральная форма реагента), в составе которых ионы меди(II) при экстракции переходят в органическую фазу. Аналогичные комплексы образуют ионы никеля(II), кобальта(II), цинка(II) и железа(III) [Радушев А.В., Гусев В.Ю., Богомазова Г.С. Исследование комплексообразования цветных металлов и железа с гидразидами алифатических карбоновых кислот в растворах // Журнал неорган. химии. 1998. Т. 43. №12. С. 2108-2112; Коган В.А., Зеленцов В.В., Гэбрэлэу Н.В., Луков В.В. Современные представления о строении координационных соединений переходных металлов // Журнал неорган. химии. 1986. Т. 31. №11. С. 2331-2843]. В интервале кислотности среды от рН 1 до 4 моль/л серной кислоты ионы меди(II), никеля(II), кобальта(II), цинка(II) и железа(III) образуют комплексы, отличающиеся прочностью и растворимостью, в результате чего в различной степени переходят в органическую фазу; на этом основано их разделение;
- наличием разветвленного радикала в α-положении к гидразидной группе группе, что улучшает совместимость с органическими разбавителями, а также создает стерические затруднения при протекании реакций гидролиза и окисления функциональной группы, и в итоге повышает химическую устойчивость реагента при многократном использовании в циклах экстракция-реэкстракция;
- наличием гидразидов высших фракций со средней м.м. 280-290 а.е.м., что обеспечивает меньшие, в сравнении с прототипом, потери экстрагента с водной фазой.
Достижение заявляемого эффекта возможно только при использовании всех существенных признаков предлагаемого решения.
Описание способа с использованием соединения (I) в качестве реагента для экстракционного извлечения меди(II) из водных сульфатных растворов в присутствии других цветных металлов в источниках информации не обнаружено.
Сущность предлагаемого решения и возможность его осуществления поясняется примерами 1-6, таблицами и фигурами.
Пример 1. Исследование экстракции меди (II).
В делительную воронку помещали 1,0 мл 0,0578 моль/л стандартного раствора сульфата меди(II), общий объем раствора доводили до 10,0 мл расчетным количеством раствора H2SO4 и воды, затем добавляли необходимый объем 0,4 моль/л ГВИК 1519 в керосине. Воронку встряхивали 2 мин и выдерживали 10 мин для расслоения фаз. Водный слой отделяли, определяли в нем содержание ионов меди(II) атомно-абсорбционным методом. Эффективность экстракции оценивалась по степени извлечения (Е, %) меди в органическую фазу:
где С0 - исходная концентрация металла в водном растворе, мг/л;
Ci - концентрация металла в водном растворе при заданном рН, мг/л.
На фиг. 1 представлена зависимость степени извлечения меди(II) раствором ГВИК 1519 в керосине от рНравн при различном соотношении фаз. Условия проведения опытов: t=20-22°С, СГВИК=0,4 моль/л, CCu=370 мг/л; переменное содержание H2SO4.
Степень извлечения меди(II) 90-99% достигается во всем исследованном диапазоне значений рН (0,3-5). Видно, что возможно, по крайней мере, 5-ти кратное концентрирование меди при извлечении 90-95% в одну ступень. Продолжительность встряхивания 2 мин. обоснована экспериментальными данными, полученными при соотношении фаз Vo:Vв=1:1 и 1:5.
Пример 2. Определение емкости органической фазы
В делительную воронку помещали переменное количество раствора сульфата меди(II) с содержанием меди 20 г/л, 1,0 мл H2SO4 концентрации 0,05 моль/л и воду до объема 10,0 мл. Затем приливали 10,0 мл раствора ГВИК 1519 в керосине и встряхивали 2 мин. После разделения в водной фазе определяли содержание меди. Концентрацию меди в органической фазе рассчитывали из материального баланса. На фиг. 2 представлены изотермы экстракции, по которым определяли емкость органической фазы по меди(II) для разных концентраций реагента в керосине. Для 18%-ного (0,6 моль/л) ГВИК 1519 она оказалась равной 7,2 г/л; у прототипа (гидразидов нафтеновых кислот) емкость раствора с концентрацией 0,2 моль/л составляет 2,5-3 г/л (большую концентрацию ГНК использовать невозможно ввиду плохой совместимости с органическими разбавителями).
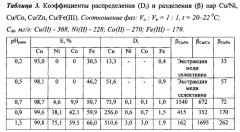
Пример 3. Условия экстракции и разделения пар ионов металлов Cu-Ni, Cu-Со, Cu-Zn, Cu-Fe(III).
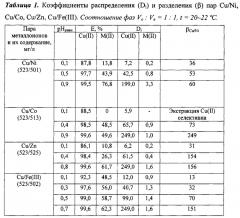
В делительную воронку помещали расчетные количества растворов сульфатов металлов, необходимое количество раствора H2SO4 для создания рН и доводили объем раствора до 10,0 мл дистиллированной водой. Затем добавляли 10,0 мл 0,2 моль/л раствора ГВИК 1519 в керосине. Воронку встряхивали 2 мин и выдерживали 15 мин для расслоения фаз. Водный слой отделяли, определяли в нем содержание ионов металлов атомно-абсорбционным методом и рНравн. Результаты представлены в таблице 1.
Из таблицы 1 видно, что раствор ГВИК 1519 в керосине селективно отделяет медь от никеля (рН 0,1-0,9, βCu/Ni 36-60), кобальта(II) (рН 0,1-0,9, βCu/Co до 249) и цинка (рН 0,1-0,8, βCu/Zn 31-156). Железо(III) частично соизвлекается во всем представленном диапазоне рН 0,1-0,7, причем при рН>0,6 степень его извлечения значительно повышается. Поэтому экстракцию меди(II) в присутствии никеля(II), кобальта(II), цинка(II) и железа(III) следует вести раствором гидразидов (I) в керосине при рН 0,1-0,6.
Пример 4. Экстракция меди(II) в присутствии никеля(II) и кобальта(II) гидразидами ГВИК 1519 в смеси (керосин - 2-этилгексанол).
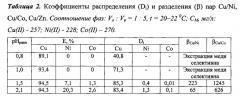
В делительную воронку вносили расчетные объемы растворов сульфатов меди(II), никеля(II) и кобальта(II), необходимое количество раствора H2SO4 для создания рН и воду до объема 10,0 мл. Добавляли 2,0 мл раствора ГВИК 1519 в смеси 70 об. % керосина и 30% об. 2-этилгексанола и встряхивали 2 мин. После 10 мин разделения фаз определяли рНравн и остаточные содержания металлов атомно-абсорбционным методом. Результаты представлены в таблице 2.
Из таблицы 2 следует, что в интервале рН 0,8-1,5 медь(II) извлекается селективно в присутствии никеля(II) и кобальта(II). При использовании 2-этилгексанола с концентрацией менее 30 об. % ухудшается селективность экстракции меди(II); содержание 2-этилгексанола более 30 об. % нецелесообразно из-за увеличения его расхода без дополнительного эффекта по селективности.
Изменение условий экстракции ионов металлов гидразидами ГВИК 1519 в смеси (керосин - 2-этилгексанол) по сравнению с экстракцией ГВИК 1519 в одном керосине можно объяснить сольватированием образующихся комплексов модификатором с последующим изменением характера их распределения между водной и органической фазами.
Пример 5. Экстракция меди(II) в присутствии никеля(II), кобальта(II) и железа(III) гидразидами ГВИК 1519 в смеси (керосин - 2-этилгексанол).
В делительную воронку вносили расчетные объемы растворов сульфатов меди(II), никеля(II) и кобальта(II) и железа(III), необходимое количество раствора H2SO4 для создания рН и воду до объема 10,0 мл. Добавляли 10,0 мл раствора ГВИК 1519 в смеси 70 об. % керосина и 30% об. 2-этилгексанола и встряхивали 2 мин. После 5 мин разделения фаз определяли рНравн и остаточные содержания металлов атомно-абсорбционным методом. Результаты представлены в таблице 3.
Из данных таблицы 3 следует, что в интервале рН 0,2-0,5 никель и кобальт не экстрагируются, железо соэкстрагируется на 30-46%, тогда как степень извлечения меди составляет 93-98%. То есть можно отделить медь(II) от сопутствующих цветных металлов и частично от железа(III) при точной регулировке рН.
Пример 6. Экстракция меди(II) в присутствии никеля(II), кобальта(II) и железа(III) гидразидами ГВИК 1519 в смеси (керосин - алкилфенол).
В делительную воронку вносили расчетные объемы растворов сульфатов меди(II), никеля(II) и кобальта(II) и железа(III), необходимое количество раствора H2SO4 для создания рН и воду до объема 10,0 мл. Добавляли 10,0 мл раствора ГВИК 1519 в смесях керосина и алкилфенола и встряхивали 2 мин. После 5 мин разделения фаз определяли рНравн и остаточные содержания металлов атомно-абсорбционным методом. На фиг. 3 представлены зависимости степени извлечения цветных металлов ГВИК 1519 в смеси (керосин - алкилфенол (30 об. %)) от кислотности среды. Условия проведения опытов: соотношение фаз: Vo:Vв=1:1, t=20-22°С; CM, мг/л: Cu(II) - 1224; Ni(II) - 317; Co(II) - 486; Fe(III) - 986.
Видно, что при экстракции меди(II) в присутствии никеля(II), кобальта(II) и железа(III) 30 об. % алкилфенола (АФ) в смеси с керосином в диапазоне кислотности 0,5 моль/л H2SO4 - рН 0,5 не влияет на количественную экстракцию меди(II), но подавляет экстракцию железа. Это позволяет селективно извлекать медь(II) в присутствии железа(III). Добавка АФ смещает извлечение никеля в область более высоких значений рН и подавляет его экстракцию: при добавлении 30 об. % АФ в области рНравн≤0,6 никель не извлекается, степень извлечения кобальта при кислотности 0,5 моль/л H2SO4 - рН 0,5 увеличивается до 50-60%
Поэтому по п 1.3 экстракцию меди(II) из кислого раствора, содержащего никель(II), кобальт(II), железо(III) осуществляют раствором гидразида ГВИК 1519 (I) в смеси керосина и 30 об. % алкилфенола при рН 0,5-0,5 моль/л H2SO4 с отделением меди(II) от никеля(II), железа(III) и, частично, кобальта(II). При снижении содержания АФ менее 30 об. % снижается селективность извлечения меди(II) по отношению к железу (III), более высокая концентрация АФ чрезмерно повышает вязкость органической фазы.
1. Способ извлечения меди(II) экстракцией из водных сернокислых растворов, содержащих сопутствующие металлы, отличающийся тем, что в качестве экстрагента используют гидразиды со средней молекулярной массой (м.м.) 280-290 а.е.м. на основе синтетических α-разветвленных третичных карбоновых кислот фракции С15-С19 (ГВИК 1519) общей формулы (I)
где R1, R2, R3, - алкильные радикалы, а сумма атомов углерода равна 15-19, при этом экстракцию осуществляют 0,2-0,6 моль/л раствором гидразидов в углеводородном растворителе или в углеводородном растворителе с добавками 30 об.% 2-этилгексанола или 30 об.% алкилфенола.
2. Способ по п. 1, отличающийся тем, что для селективного выделения меди(II) в присутствии никеля(II), кобальта(II), цинка(II) и железа(III) используют раствор гидразидов (I) в углеводородном растворителе, а экстракцию ведут при рН 0,1-0,7.
3. Способ по п. 1, отличающийся тем, что водный сернокислый раствор содержит никель(II), кобальт(II), железо(III), а экстракцию осуществляют раствором гидразида (I) в смеси углеводородного растворителя и 30 об.% 2-этилгексанола при рН 0,2-0,5 с отделением меди(II) от никеля(II) и кобальта(II) и основного количества железа(III).
4. Способ по п. 1, отличающийся тем, что водный сернокислый раствор содержит никель(II), кобальт(II), железо(III), а экстракцию осуществляют раствором гидразида (I) в смеси углеводородного растворителя и 30 об.% алкилфенола при рН 0,5-0,5 моль/л H2SO4 с отделением меди(II) от никеля(II) и железа(III) и частично кобальта(II).