Способ получения диангидридов арилзамещенных
Иллюстрации
Показать всеРеферат
Oh ИСАЙ ИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
336981
Са!оз Советских
Социалистических
Республик
Зависимое от-авт. свидетельства №
Заявлено 07.1.1970 (№ 1386177/23-4) М. Кл. С 07d 5/04 с присоединением заявок №№ 1386181/23-4, 1386185/23-4 и 1386188/23-4
Приоритет
Опубликовано 21.Х|.1972. Бюллетень №;35
Дата опубликования описания 2.II.1973
УДК 547.594.9.07(088.8) Авторы изобретения
Б. И, Западинский, Б. И. Лиогонький и А. А. Берлин
Институт химической физики АН СССР
Заявитель
СПОСОБ ПОЛУЧЕНИЯ ДИАНГИДРИДОВ АРИЛЗАМЕЩЕННЪ|Х
ИЛИ НЕЗАМЕЩЕННЪ|Х АЛИЦИКЛИЧЕСКИХ
ТЕТРАКАРБОНОВЪ|Х КИСЛОТ
Изобретение относится к способу получения новых арилзамещенных или незамещенных алициклических тетракарбоновых кислот, ко2 торые могут найти применение в полимерной промышленности.
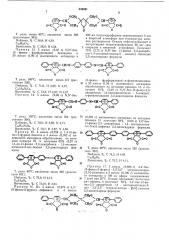
Получаемые согласно изобретению соединения имеют следующие общие формулы б Ф
0 О 0 0 0 О 0
Э2 0 Б
С С ф Г ф
О 0 0 — -с - >, С С
"а
0 0 0 где А — фенилен, дифенилен, диметилдифенилен, дифениленоксид, дифенилен метан или одну из следующих групп
R — атом углерода или четырехвалентный
1,1,3,3-радикал циклогексана, или циклогексан-5-ола, или циклогексан-5-она,  — м- или п-фенилен, 4,4 -дифенилен, à — фенилен, нафтилен, диметилдифенилен, дифениленоксид, дифениленметан, D — фенил, D2 — фенил или нафтил.
0СН СНо0
-CH R СН0CH CH 0
0 0 !! !!
- СЯ2- 0- С-В- C — — 0 — СК Указанные соединения получают при взаимодействии малеинового ангидрида с бисфурановыми производными при слабом нагревании (не выше 80 С) в среде органического растворителя, например тетрагидрофурана, бензола, эфира и т. п.
15 (спирановая группа), Б обозначает — CH=N — à — N=CH — или любое значение А, Комитет по делам изобретений н открытий при Совете Министров
СССР
Dт Вт 0
fl (lIo o \
Вт у„O
336981
-C C=OÄ
10 (найдено
15 о=с» со
-с„, с=о
40
65
Структура получаемых соединений образуется вопреки ожидаемой конденсации только по одному фурановому циклу (из-за смещения электронной плотности при диеновой конденсации малеинового ангидрида с бисфурановыми производными) или в случае
N,N - бисфурфулидендиаминоариленов — по азиновой связи.
Кроме того, процесс можно проводить, не прибегая к выделению и очистке индивидуальных бис-(а-фурил)-ариленов, т. е. в этом случае раствором малеинового ангидрида в бензоле или тетрагидрофуране обрабатывают продукт, выделенный из органической фазы реакционной смеси разложения бисдиазосоли в фуране.
Растворитель реакции выбирают таким, чтобы он растворял целевой диангидрид.
Температуру процесса подбирают такой, чтобы увеличить скорость конденсации, температура ограничена диссоциацией аддукта на аденды.
Осуществление способа показано в следующих примерах.
Пример 1. 2,5 ммоль (0,525 г) 1,4-бис(а-фурил) -бензола и 10 ммоль (0,98 г) малеинового ангидрида в 10 мл тетрагидрофурана нагревают 8 час при 40 — 60 С. Реакционную смесь выливают в избыток эфира, осадок отфильтровывают, сушат в вакууме при 20 С и перекристаллизовывают из теплого (40 — 60 С) ацетонитрила. Получают 73% (0,56 г) 1,4-ди(2,3-дикарбокси - 1,4 - оксоциклогексен-5-ил)бензол 2,3-диангидрида формулы
Т. разл. 100 С; кислотное число 530 (рассчитано 552) .
Найдено, %: С 64,3; Н 3,72.
С 22Н14 0 8.
Вычислено, %: С 65,0; Н 3,44.
Пример 2. Продукт, полученный из органической фазы реакционной смеси разложения хлористого фениленбисдиазония (из
0,025 моль и-фенилендиамина) в фуране, обрабатывают раствором 2 г малеинового ангидрида в 15 мл тетрагидрофурана. После 12 час нагревания при 40 — 60 С реакционную смесь выливают в избыток эфира, осадок отфильтровывают, сушат в вакууме при 20 С и перекристаллизовывают из теплого (40 — 60 С) ацетонитрила. Получают 0,47 г 1,4-ди-(2,3-дикарбокси-1,4 - оксоциклогексен — 5-ил) - бензол
2,3-диангидрида.
При мер 3. 2 ммоль (0,572 г) 4,4 -бис(а-фурил) -дифенила и 8 ммоль (0,784 г) малеинового ангидрида вводят во взаимодействие аналогично примеру 1. Получают 77%
4 (0,74 г) 4,4 -ди- (2,3-дикарбокси-1,4-оксоциклогексен-5-ил) -дифенил 2,3-диангидрида формулы
Т. разл. 100 С; кислотное число
431, рассчитано 465).
Найдено, %: С 69,2; Н 3,86.
С28Н)808.
Вычислено, %: С 69,7; Н 3,74.
Пример 4. Продукт, полученный из органической фазы реакционной смеси разложения хлористого дифенил-4,4 -бисдиазония (из
20 0,025 моль бензидина) обрабатывают малеиновым ангидридом по методике примера 2, и получают 0,64 г 4,4 -ди- (2,3-дикарбокси-1,4оксоциклогексен - 5-ил) -дифенил 2,3-диангидрида.
Пример 5. 0,01 моль (8,26 г) бисфурфурилового эфира терефталевой кислоты и
0,03 моль (2,96 г) малеинового ангидрида нагревают в 150 мл тетрагидрофурана 6 час при
50 80 С. Растворитель удаляют в вакууме, и после перекристаллизации из теплого (40 — 60 С) тетрагидрофурана получают ди-(2,3-дикарбокси-1,4-оксо-5-циклогексениловый эфир) терефталевой кислоты 2,3-диангидрид формулы
О CH20 С» COCH2— и
Go o p oC Cc », 0
Выход 67% (3,34 г); т. разл. 85 С; кислотное число 432 (рассчитано 429) .
Найдено, %: С 59,6; Н 3,58.
С 28 Н i 80 i 2.
Вычислено, %: С 59,8; Н 3,45.
Пример б. 0,01 моль (3,26 г) бисфурфурилового эфира изофталевой кислоты и
0,03 моль (2,96 г) малеинового ангидрида оорабатывают по методике примера 5, и получают 54% (2,82 г) ди- (2,3-днкарбокси-1,4-оксо-5циклогексенилового эфира) изофталевой кислоты 2,3-диангидрида формулы
55 о Caoc < сося
Q=c c=O О О О=С С=О о
Т, разл. около 80 С; кислотное число
426 (429) .
Найдено, %: С 59,8; Н 3,68.
С28Н18О 2.
Вычислено, %: С 59,8; Н 3,45, 336981
О СН,ОС >: C,ОСН О
11
О=С CO О О 0=6 С О о
О СИг СН О с сн
О СН
Г
О=C С;О О CHg СН О О= (найдено (1,06 г): кислотное число (найдено 460, рас15 считано 460).
Найдено, %: С 56,6; Н 4,17.
С зНго012.
Вычислено, %: С 56,6; Н 4,10.
СЯ О си о
" 1 -.О О=С С=О а
ОСН
О С,И
О=С C= О, ОСИ кислотное число 400 (рас60,5; Н 5,08.
Т. разл. 78 С; с итано 402).
Найдено, %: С
С28Н28012.
Вычислено, %
Пример 11.
С 60,4; Н 5,03.
Из 0,01 моль (3,76 г) 3,!1СК О
СН О
СП, О С=-С,, г-.==О
ОБ О осн, о СБ
О=(„,,С=О ОСИ, О
Пример 7. Из 0,01 моль (4,02 г) бисфурфурилового эфира 4,4 -дифенилдикарбоновой кислоты и 0,03 моль (2,96 г) малеинового ангидрида по методике примера 5 получают
Т. разл. 75 С; кислотное число 370 (рассчитано 375).
Найде;ro, %: С 63,9; Н 3,74.
С32Н22012.
Вычислено, %: С 64,2; Н 3,68.
Пример 8. 0,01 моль (2,92 г) 4,4 -бис(а-фур ил) - 3,3,5,5 - тетр а окса спи ро- (5,5) -ундекана растворяют в 75 мл кипящего тетраТ. разл. 85 С; кислотное число
462, рассчитано 460).
Найдено, %: С 56,4; Н 4,15.
С23Н200! 2.
Вычислено, %: С 56,6; Н 4,10.
П р и и е р 9. 3 л.1юль (0,875 г) 4,4 -бис(сс-фури:r) -3,3,5,5 - тетраоксаспиро — (5,5)-ундекапа и 6 м1 оль (0,568 г) малеинового ангидрида в 50 мл эфира выдерживают 7 дней при 20 С, осадок отфильтровывают, сушат на воздухе и перекристаллизовывают из теплого метанола. Выход 4,4 -оис- (2,3-дикарбокси-1,4оксоциклогексен - 5-ил) -3,3 - (5,5 ) - тетраоксаспиро- (5,5) - ундекан 2.3-диапгидрида 74%
Т. разл. 80 С; кислотное число 393 (рассчитано 393).
Найдено, %: С 58,4; Н 4,64.
С28Н28013.
Вычислено, %: С 58,7; Н 4,89.
Пример 12. Из 0,01 1юль (3,74 г) 3.116 ди-(2,3-дикарбокси — 1,4-оксо - 5-циклогексениловый эфир) 4,4 -дифенилдикарбоновой кислоты 2,3-диангидрид формулы гидрофурана и затем добавляют 0,04 моль (3,82 г) малеинового ангидрида. Через 8 час (последние 4 чпс при 60 С) раствор высаживают в избыток эфира, и продукт перекристаллизовывают из теплого метанола (40—
10 60 С). Получают 68% (4,5 г) 4,4 -бис-(2,3-дикарбокси - 1,4 - оксоциклогексен — 5 - ил) - 3,3 (5,5 ) - тетраоксаспиро- (5,5) -ундекан 2,3-диангидрида формулы
2о Пример 10. Из 0,1 люль (36 г) 3,11-бис(сс - фурил) - 2,4,10,12 - тетраоксадиспиро(5,1,5,3)-гексадекана и 0,3 люль (29,4 г) малеипового ангидрида по методике примера 8 получают 82% (45,6 г) 3,11-бис- (2,3-дикарбо25 кси-1,4 - оксоциклогексен-5-ил) -2,4,10,12-тетраоксадиспиро- (5,1,5,3) - гексадекан 2,3-диангидрида формулы бис- (c.-фурил) -15-окси - 2,4,10,12-тетраоксадиспиро-(5,1,5,3)-гексадекана по методике приЗО мера 8 получают 74% (4,23 г) 3,11-бис-(2,3дикарбокси - 1,4 - оксоциклогексен - 5 - ил - 15окси - 2,4,10,12 - тетраоксадиспиро - (5,1,5,3)гексадекан 2,3-днангидрида формулы бис- (и - фурил) - 2,4,10,12 - тетраоксадиспиро35 (5,1,5,3)-гексадеканона-15 по методике примера 8 получают 67% (3,82 г) 3,11-бис- (2,3дикарбокси - 1,4 - оксоциклогексен - 5 - ил)2,4,10,12 - тетраоксадиспиро-(5,1,5,3) - гексадеканон-15 2,3-диангидрида формулы
336981
СИ2О сн о снбо о=с C=o оси
О СИ
0=C, О
СН=К
0=C C=O О=С С=
0 О
Т. разл, 100 С; кислотное число 317 (рассчитано 326).
Найдено, %: С 71,9; Н 4,22; N 4,12.
С42Н28Х208.
Вычислено, %: С 73,3; Н 4,07; N 4,07.
Пример 14. 5 ммоль (2,08 г) N,N -бисО CH=M
0=6 =О
O=C C=
Пример 17. 2 ммоль (0,888 г) 4,4 -бис(5-фенил-2-фурил) - 3,3,5,5 - тетраоксаспироТ. разл. 85 С; кислотное число 392 (рассчи- (5,5)-ундекана и 2 ммоль (0,196 г) малеиновотано 401). го ангидрида в 100 мл эфира выдерживают
Найдено, %: С 72,9; Н 4,13. 30 7 дней при 20 С, Осадок промывают несколько
С34Н2208. раз эфиром, и получают 92% 4,4 -бис-(4-феВычислено, %: С 73,16; Н 3,94. нил-2,3 - дикарбокси - 1,4 - оксоциклогексен-5Пример 16. Из 2 ммоль (0,876 г) 4,4 - ил) - 3,3,5,5 - тетраоксаспиро - (5,5)-ундекан (5-фенил-2-фурил) - дифенила и 4 ммоль 2,3-диангидрида формулы
0СК2 СНБО
<,", — CH С СН
О () О Н2 СН20 О (Т. разл. около 85 С; кислотное число 380 (рассчитано 393) .
Найдено, %: С 58,8; Н 4,30.
С28Н260)3.
Вычислено, %: С 58,9; Н 4,54.
Пример 13. 5 ммоль (2,46 г) N,N -бис(5 - фенил - фурфурилиден) - бензидина и
20 ммоль (1,96 г) малеинового ангидрида в
Т. разл. 100 С; кислотное число 354 (рассчитано 366).
Найдено, %: С 70,5; Н 3,82; N 4,71.
С36Н244ч 208.
Вычислено, %: С 70,7; Н 3,87; N 4,58.
Пример 15. 2 ммоль (0,724 г) 1,4-(5-фенил-2-фурил)-бензола и 4 ммоль (0,392 г) малеинового ангидрида обрабатывают по методике примера 18, и получают 62% (0,57 г)
1,4-ди- (4-фенил - 2,3-дикарбокси - 1,4-оксоциклогексен-5-ил) -бензол 2,3-диангидрида формулы
200 мл тетрагидрофурана перемешивают 6 час в инертной атмосфере при температуре кипения растворителя. Осадок отфильтровывают и экстрагируют тетрагидрофураном 48 час (все
5 операции в инертной атмосфере) . Получают
79% (2,72 г) N,N -бис - (4-фенил - 2,3-дикарбокси-1,4-оксоциклогексен-5 - илиден) - бензидин
2,3-диангидрида формулы (5-фенил - фурфурилиден) -п-фенилендиамина
10 и 20 ммоль (1,96 г) малеинового ангидрида обрабатывают по методике примера 13, и получают 81% (2,48 г) N,N áèñ- (4-фенил-2,3дикарбокси - 1,4-оксоциклогексен - 5-илиден)п-фенилендиамин 2,3-диангидрида формулы
15 (0,392 г) малеинового ангидрида по методике примера 13 получают 68% (0,66 г) 4,4 -бис(4-фенил-2,3 - дикарбокси - 1,4 - оксоциклогексен-5-ил) -дифенил 2,3-диапгидрида формулы
О О
25 Т. разл. 90 С; кислотное число 350 (рассчитано 354).
Найдено, %: С 74,2; Н 4,82.
С40Н2608.
Вычислено, %: С 75,7; Н 4,11.
336981
10 ь î р, с с с с
Ф б,,г
Р Р О Р р илс. ОGHV СН О р снг он 0
o(ф
СБНв СвНв О ф
)o
СБН5 СБИВ О
15 (спирановая группа) — CH,— 0 — С вЂ”  — С вЂ” Π— СН,—, П 1!
0 0
100 С; кислотное число 350 2О
75,7; Н 4,23.
С 75,7; Н 4,11.
Т. разл. около (рассчитано 354)
Найдено, /о. С
С4вН аОз.
Вычислено, % ..
Предмет изобретения 0 — А ДО
С, 1 б Ф б
О О О О О О
О или О
Ф
Э1 О
i о
В, О„О
Составитель Г. Анднон
Техред E. Борисова
Редактор Л. Хорина
Корректоры; Н, Стельмах н О. Тюрина
Заказ 113)2 Изд. М 1866 Тираж 406 Подписное
ЦНИИПИ Комитета по делам изобретений н открытий при Совете Министров СССР
Москва, 7К-36, Раушская наб., д. 4 5
Тйпографня, пр. Сапунова, 2
Т. разл, 80 С; кислотное число 348 (рассчитано 350).
Найдено, %. С 65,6; Н 4,40.
С35Н28012.
Вычислено, %. С 65,7; Н 4,38.
П р и мер 18. Из 2 ммоль (0,876 г) 2,2,5,5 тетрафенил - P-дифурила и 4 ммоль (0,392 г) малеинового ангидрида по методике примера 13 получают 78 /о (0,837 г) 2,2,5,5 -тетрафенил-3,3, 4,4 - тетракарбокси - 1,Г - дициклогексен-1,3,3,4,4 -диангидрида формулы
1. Способ получения диангидридов арилзамещенных или незамещенных алициклических тетракарбоновых кислот следующих общих формул где А — фенилен, дифенилен, диметилдифенилен, дифениленоксид, дифениленметан или
10 одну из следующих групп
25 Б обозначает — СН = N — à — N = СН вЂ” или любые значения А, R — атом углерода или четырехвалентный
1,1,3,3-радикал циклогексана, циклогексан-5ола или циклогексан-5-она, 30  — м- или п-фенилен, 4,4 -дифенилен, à — фенилен, нафтилен, диметилдифенилен, дифениленоксид, дифениленметан, D t — фенил, D — фенил или нафтил, отличающийся
35 тем, что малеиновый ангидрид подвергают взаимодействию с соответствующими бисфурановыми производными в среде органического растворителя, например тетрагидрофурана, при температуре не выше 80 С с последующим
40 выделением целевого продукта известными приемами.
2. Способ по п. 1, отличающийся тем, что процесс взаимодействия малеинового ангидри45 да с соединением, содержащим спирановую группу, осуществляют при 20 — 30 С.