Патент ссср 341236
Иллюстрации
Показать всеРеферат
ОП И
ИЗОБРЕТЕНИЯ
Саюв Саветскит
Социалистическив
Республик
К ПАТЕНТУ
Зависимый от патент а №
Заявлено 26, IÈ.1970 (№ 1418906/2i3-4)
Приоритет 09.IV.1969, № P1918073.5, ФРГ
М. Кл.,С 07d 5i3/I04
:Комитет оа делам изобретений .и вткрытий ори Совете Министрое
СССР
Опуоликовано 05.V1.1972. Бюллетень № 18
УДК 547.8.07.(088.8) Дата опубликования описания 10Х1П.1973
Авторы изобретения
Иностр анцы
Карл Хейнц Вебер, Херберт Мерц, Карл Цейле, Рольф Гиземанн и Петер Даннеберг (Федеративная Республика Германии) Иностранная фирма
«К. Г. Берингер Зон» (Федеративная Республика Германии) Заявитель
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 5-АРИЛ-1Н-1,5БЕНЗОДИАЗЕПИ H-2,4-ДИОНА о
С
С или R
Г 2
1
Предлагается способ получения, новой группы соединений, которые могут найти широкое применение в фармацевтической промышленности, — производных 5-арил-1Н-1,5-бензодиазепин-2,4-диона общей формулы
Ет
3-С
С=
Ъ р,, i r0 5
СН2
С.
О где R> — водород, прямой или разветвленный алкилыный радикал с 1 — 4 атомами углерода, замещенный гидрокси- либо ацилоксигруппой, диалкиламиногруппой с 2 — 4 атомами углерода, аллилыный, циклогексильный, незамещенный фенильный радикал либо моно- или дизамещенный метильной группой, метоксигруппой либо атомом галогена, или бензильный радикал;
R-. — нафтил-, пиримидил-, тиенил- или пиридильный радикал, который может быть замешен метильной группой или атомом галогена;
Кз — водород, трифторметильная или цианогруппа, атом галогана либо низшая ацильная или алкоксикарбонильная группа с 1 — 2 атомами углерода;
К4 — водород, трифторметильная, циа ноили нитрогруппа, атом галогена либо низшая ацильная или алкоксикарбонильная группа; ,R5 — циано-, низшая ацильная или алкоксикарбонильная группа;
Ка — циано-, нитрогруппа,,низшая ацильная или алкоксикарбонильная группа;
R7 — трифторметилыная группа или атом галогена.
Способ состоит в том, что соответствующий
1ь 2-аминодифенил- или 2-аминофенилгетероариламин подвергают реакции обменного разложения с дигалогенидом малоновой кислоты с последующим выделением или алкилированием целевого продукта известными методами.
20 При этом процесс лучше вести в |присутствии органического основания.
Пример 1.
A. 7-Хлор-5-(2-пиридил)-1H - 1,5- бензодиазепин-2,4- (ЗН,5Н) -дион.
25 2,1 г (0,01 моль) 2-(2-пиридиламино)-4-хлоранилина с т. пл. 83 — 85 С растворяют в 50 мл хлороформа, прибавляют 2 г малонилхлорида при температуре 50 С, размешивают 3 — 4 час, выливают,на ледяную воду, отделяют и извле30,кают путем взбалтьтва ния с разведенным аммиаком. Хлороформный слой высушивают, выпаривают растворитель и перекристаллизовы341236
65 вают остаток из метиленхлорида — изопро пилэфира. Получают целевое соединение с т. пл.
268 †2 С.
Б. 7-Хлор-1-метил- 5- (2-пиридил) -IH-1,5-бензод;иазепин-2,4- (ЗН,5Н) -дион.
3 г (0,01 моль) 7-хлор-5-(2-.пиридил) -IН-1,5бензодиазе пин-2,4- (ÇH,5Н) -диона, полученного по Оримеру 1, суспендируют в 100 мл абсолютного тетрагидрофурана и размешивают с
0,6 г чистой 50%-ной дисперсии гидрата натрия 2 час при комнатной температуре. Затем к нему добавляют 3 мл метил йодида и нагревают, размешивая, 6 час до 70 С. Реакционную смесь выпаривают, остаток разбавляют ледяной водой и извлекают путем взбалтывания с метиленхлоридом. Из IlpOMIIToI0> высушенного и частично упаренного раствора получают после добавления изопропилэфира загла вное соединение с т. пл. 232 †2 С после перекристаллизации из этанола или изопропанола.
В. 7-Хлор-1-Р - гидроксиэтил - 5-(2-пиридил)I Н-1,5-бензодиазепин-2,4- (ÇH,5Н) -дион.
3 г (0,01 моль) 7-хлор-5- (2-пиридил)l H-1,5-бензодиазепин-2,4- (ЗН,5Н) -дион суспендируют IB 500 мл мета нала и 25 мл воды. После добавления 10 мл этиленоксида и 1 мл
«Тритона В» размешивают 10 час при комнатной температуре. Затем полученный раствор упаривают, остаток поглощают в метиленхлориде, извлекают .путем взбалтывания с водой, высушивают и выпаривают растворитель. После лерекристаллизации из этанола получают конечный продукт с т. пл. 176 †1 Ñ.
Пример 2. 7-Хлор-1-метил-5-(2-пиридил)I Н-1,5-бензодиазепин-2,4-(ÇH,5Н) -дион.
2,3 г (0,01 моль) 2- (2-пиридиламино) -4-хлорN-метиланилина с т. пл. 115 — 117 С растворяют в 50 мл хлороформа и прибавляют 1,8 г триэтиламина. В,кипящий раствор добавляют
2 г малонилхлорида и нагревают под флегмой
3 час. После переработки реакционной смеси аналогично примеру 1 получают заглавное соединение с т. пл. 233 — 235 С.
Пример 3. 7-Бром-1-метил - 5- (2-пиридил) ) -I Н-1,5-бензодиазепин-2,4- (ÇH,5Н) -дион.
2,8 г (0,01 моль) 2- (2-пиридиламино) -4бром-N-.èåòèëàíèëèIíà с т. пл. 110 — 112 С растворяют в 50 мл метиленхлорида. После добавления 2 мл пиперидина смесь нагревают до кипения, вкапывают в нее 2 г малонилхлорида и нагревают,под флегмой 3 час. После обработки по примеру 1 получают 7-бром-1-метил5- (2-пиридил) -I Н - 1,5-бензодиазепи н - 2,4- (ÇH, 5Н)-дион с т. пл. 197 — 198 С.
Пример 4. 7-Хлор-1-этил-5-(3-пиридил)I.Н-1,5-бензодиазепин-2,4-(ЗН,5Н) -дион.
2,48 г (0,01 моль) 2- (3-пиридиламино) -4хлор-N-этиланилина с т. пл. 88 — 98 С раст воряют в 50 мл хлороформа, добавляют 2 г малонилхлорида и размешивают 3 час при 50 С, После обработки, аналогичной примеру 1, получают бесцветные кристаллы с т. пл. 196—
198 С, П:р и м е р 5. 7-Хлор-1-метил-5- (5-хлор пири4 дил- (2) ) - I H - I 5-.бензодиазепи н - 2 4- (ÇH,5Н)дион.
2,68 г (0,01 моль) 2-(5-хлорпиридил- (2)амино)-4-хлор-N-метиланилина с т,,пл. 117—
119"С растворяют в 50 мл хлороформа, добавляют 2 г малонилхлорида и размешивают
3 час при 50"С. После обработки, как указано в примере l, получают беоцветные кристаллы с т. пл. 216 — 217 (;.
П р и м ер б. 7-Хлор-1-метил-5-(2-пиримидинил) -IН - 1,5 - бензодиазепин - 2,4-(ЗН,5Н)дион.
2,35 г (0,01 моль) 2-(2 пиримидиниламино)4-хлор-N-метиланилина с т. пл. 96 — 98"С растворяют в 50 мл хлороформа, добавляют 2 г морфолина и после добавления 2 г малонилхлорида размешивают 4 час при 50 С. После обработки по пуимеру 1 лолучают бесцветные кристаллы с т. пл. 245 — 246 С.
Пример 7. 1-Этил-7-трифторметил-5- (2пиридил) -1Н-I,5 - бенэодиазепин-2,4-(ÇH,5Н)дион.
2,8 г (0,01 моль) 2-(2-пиридиламино) -4-трифтормепил-М-этиланилина с т. пл. 125 — 12/"С растворяют в 50 мл хлороформа, добавляют
2 г малонилхлорида и размешивают 3 час при
50"С. После обработки, аналогичной примеру
1, получают бесцветные кристаллы с т. пл.
153 †1 С, Пример 8, 1-Бензил - 7-хлор-5-(2-пиридил) -I Í-1,5-бензодиазепин-2,4- (ЗН,5Н) -дион.
3,1 г (0,01 моль) 2- (2-ииридиламино) -4-хлорN-бензиланилина с т. пл. 120 †1 С растворяют в 50 мл хлороформа, добавляют 2 г малонилхлорида и размешивают 3 час,при 50"С.
После обработки,lKBK указано в примере 1, получают бесцветные кристаллы с т, пл. 216—
218 С.
Пример 9. 1-Метил - 5- (2-нитрофенил) -7трифторметил-I Н - 1,5-бензодиазепин-2,4- (ÇH, 5Н) -дион.
3,1 г (0,01 моль) 2-(2-нитрофениламино-4трифторметил-N-метиланили на с т. пл. 110—
111 "С растворяют в 50 мл хлороформа, добавляют 2 г малонилхлорида и размешивают
3 час,при 50 С. После обработки (см. пример 1) получают бесцветные кристаллы с т. пл. 230 — 232 С.
Пример 10. 7-Хлор-1-метил-5-(2-тиенил)I Н-1,5-бензодиазепин-2,4- (ÇH,5Н) -дион.
2,2 г (0,01 моль) 2-(2-тиенил) -4-хлор-N-метиланили на с т. кип. 148 — 150 Cf0,5 мл, полученного из соответствующего ацетата с т. пл.
140 — 142 С, растворяют в 50 мл хлороформа, добавляют 2 г ииперидина и размешивают
3 час при 50 С. После обработки по,примеру 1 получают бесцветные кристаллы с т. пл. 173—
174 С.
Аналогично получают конечные продукты общей формулы RI сФ
- °
О Ш
341236 значения радикалов которой при ведены в таблице.
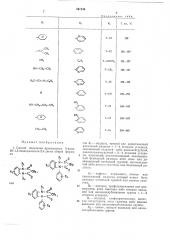
Таблица
R, Rm
Т. пл., С
СН
7 — Cl
209 †2
СН3
164 — 166
7 — Cl
СНз
225 †2
7 — Cl
1ч0з
СН
206 — 208
7 — Cl
СН
209 — 210
7 — CI
CO
7 — Cl
СН
183 †1
С- СНз
tf
7 — CI
205 †2
СН, 7 — С1
177 †1 — СН,— СН вЂ” СНз
145 †1
7 — СОгСНз — СНЗ вЂ” СзНь
-<Р
7 — СРз
164 — 168 — CH3
8 — Сl
194 †1
СНг СНз
194 †1
7 — Сl — СН,— СН, 148 †1
7 — Cl — (Снг)з — СНз (Г
203 †2
8 — Сl — СзНз
341236
Продолжение табл.
Т. пл., С
7 — CI
190 сн — НО
СН
7 — С!
165 †1
7 — СОСН, СН3
С.Нь
134 †1.а
HO — CH CH
7 — СР, 149 †1
«(\
H С вЂ” CO — Π— С,Н, 7 — С!
196 †1
7 — CN
270 — 272
НΠ— CH СН,— СН, 7 — CI
162 †1
7 — С!
182 †1
СН,— СН, 7 — Br
239 †2 или
R, ! ф
0»
CHg
Предмет изобретения
1. Способ,получения производных 5-арил1Н-1,5-бензодиазепин-2,4-диона общей формулы где К вЂ” водород, прямой или разветвленный алкильный радикал с 1 — 4 атомами углерода, замещенный гидро кси- либо ацилоксигруппой, диалкиламиногруппой с 2 — 4 атомами углерода, аллильный, циклогексильный, незамещенный фенильный радикал, либо моно- или дизамещенный метильной группой, метоксигруппой либо атомом галогена, или бензильный радикал;
R, — нафтил-, пиримидил-, тиенил- или пиридильный радикал, который может быть замещен метильной груплой или атомом галогена;
15 Ra — водород, трифторметилыная или цианогруппа, атом галогена либо низшая ацильная или алкоксикарбонильная группа с 1 — 2 атомами углерода;
Rg — водород, трифторметильная, циано20 или нитрогруппа, атом галагана либо низшая ацильная или алкоксикарбонильная группа;
Rq — циано-,,низшая ацильная или алкоксикарбопилыная группа;
341236
Составитель Л. Пеняева
Техред Л. Богданова
Корректор Е. Денисова
Редактор Л. Ильина
Заказ 2439/3 Изд. Хе 1861 Тираж 523 Подписное
ЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров СССР
Москва, 3(-35, Раушская наб., д. 4/5
Типография, пр, Сапунова, 2
Кв — циа но-, нитрогруппа, низшая ацильная или алкоксикарбонильная труппа;
R7 — трифторметильная группа или атом галогена, отличающийся тем, что соответствующий 2-аминодифенил- или 2-аминофенилгетероарил амин подвергают реакции обменного разложения с дигалогенидом малоновой .кислоты с последующим выделением или алкилированием целевого продукта известными методами.
2. Способ по п. 1, отличающийся тем, что процесс ведут в присутствии органического основания.