Способ получения производных пиперазина
Иллюстрации
Показать всеРеферат
363248
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Союз Советских
Социалистических
Республик
Зависимый от патента ¹
Заявлено 13. т 111.1970 (№ 1474896/23-4) М. Кл. С 07d 51)30
С 07d 51:72
С 07с1 51/32
Приоритет 20Х111.1969, № P 1942405.6, ФРГ
Комитет по делам изобретений и открытиЯ при Совете Министров
СССР
УДК 547.861.3.07(088.8) Опубликовано 20.Х11,1972. Бюллетень ¹ 3 за 1973
Дата опубликования описания 7.11.1973
Авторы изобретения
Иностранцы
Курт Клемм, Вольфганг Прюссе и Вольфганг Шетенсак (Федеративная Республика Германии) «Бик-Гульден Ломберг Хемише Фабрик ГмбХ»т (Федератив1!ая Республика Германии) Заявитель
СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПИПЕРАЗИНА
25 (г) Предлагается способ получения новых соединений, производных пиперазина, а именно арилзамещенных пиперазинилалкиламиноурацилов, -урациловых эфиров, -урациловых тиоэфиров, которые проявляют новые фармакологические свойства, кроме того, более эффективны по сравнению с известными аналогами подобного действия и могут найти применение в медицине в качестве фармацевтических препаратов.
Предлагаемый способ основан на извесгиой в органической химии реакции взаимодействия монозамещенного пиперазина с галоидпроизводными ряда пиримидина.
Предлагается способ получения производных пиперазина общей формулы где Rl и R> — атом водорода, прямая или разветвленная, насыщенная или ненасыщенная алкильная группа, содержащая до 6 атомов углерода, или циклоалкильная, или фенильчая группа;
R;; — атом водорода, прямая или разветвленная, насыщенная или ненасыщенная алкильная группа, аралкил, арил или циклоалкил, нитро-, алкиламино-, диалкиламино-, ацильная
5 группы или СОХ1-11 -группа, причем 1х., — алкпльиый радикал, содержащий до 4 атомов углерода, или замещенный фенильиый радикал;
Х вЂ” IXR;-группа, причем R; — -атом водоро1о да, пряма>1 или разветвлснная алкильиая группа, содержащая до 4 атомов углерода, или атом кислорода или серы;
А — прямая или разветвленная, насыщенная и.чи ненасыщенная алкилеиовая Группа;
15 1 — атом водорода или алкильный радикал, содержащий до 6 атомов углерода;
Z — атом водорода или одна или несколь!о алкильных, алкокси- или меркаптоалкильиых групп, в каждой содержится до 6 атомов уг2Q лерода, или трифторметильные группы, или атомы галогена, или их солей, заключающийся в том, что соединения общей формулы
363248
7 i;
1 -
11- 1 -С,, 10
15 где R>, Rz R, Х и А имеют указанные значения;
На1 — атом галогена, предпочтительно атом хлора или брома, подвергают реакции обменного разложения с фенилпиперазином общей формулы где У и Z имеют указанные значения, или с его солью с последующим выделением целевого продукта известными приемами в свободном виде или в виде его соли.
Реакцию проводят при повышенной температуре, предпочтительно при 50 — 150 С, при этом можно применять инертный растворитель, например хлороформ, бензол, толуол или ксилол. Целесообразно добавлять эквивалентное количество основания, такого как триэтиламин, или применять избыток соединения общей формулы 3. В отсутствие инертного растворителя можно вести реакцию в избытке основания. В некоторых случаях возможна реакция в воде как в растворителе.
Предпочтительными являются арилзамещенные пиперазинилалкиламиноурацилы, -урациловые эфиры и -урациловые тиоэфиры общей формулы
1
Ь l; г X Ь вЂ” N 1 / Ъ )
1, Q,g где К, и R — атом водорода, прямая насыщенная алкильная группа, содержащая до
4 атомов углерода, или циклоалкильная, или фенильная группа, причем особенно предпочтительна метильная группа;
R — атом водорода, прямая насыщенная алкильная группа, содержащая до 4 атомов углерода, нитрогруппа, алкиламиногруппа, содержащая до 3 атомов углерода, или диалкиламиногруппа, содержащая до 6 атомов углерода, причем особенно предпочтительны атом водорода, прямая насыщенная алкильная группа, имеющая до 4 атомов углерода, или диэтиламиногруппа;
Х вЂ” NH-группа, NCgHg-группа, атом кислорода или атом серы; . — СН вЂ” СН вЂ” СН -группа, СН (СН ) — СН -группа или
СН вЂ” СН (СНЗ) -группа;
à — атом водорода, метильная группа, одна или две метоксигруппы, этоксигруппа или атом хлора, причем особенно предпочтительна одна метоксигруппа в орто-положении, или их соли.
Предпочтительным является способ получения соединений общей формулы 4 или их солей, заключающийся в том, что соединения общей формулы
65 где R» R, R, Х и А имеют указанные значения;
Наà — атом хлора или брома, подвергают реакции обменного разложения с фенилпиперазином общей формулы
Х
НХ 4 — ix (6) где Z имеет указанные значения, или его солью с последующим выделением целевого продукта известными приемами в свободном виде или в виде его соли.
Получить соли с фармакологически применимыми неорганическими и органическими кислотами можно обычным способом путем растворения основания и добавления необходимого количества кислоты. При получении труднорастворимых солей вместо основания может быть взята также растворимая соль, вместо кислоты — также растворимая соль кислоты.
В качестве органических или неорганических кислот можно, например, применять уксусную, щавелевую, малеиновую, фумаровую, винную, бензойную, памоакислоту, салициловую, полигалактуроновую, поливинилкарбоновые, соляную, серную, фосфорную, амидосульфоновую и метансульфоновую кислоты. Из них желательно употреблять соленую и серную кислоты.
Соли предлагаемых соединений могут быть как легко, так и трудно растворимы в воде, причем трудно растворимые соли особенно желательно использовать для получения форм соединений замедленного действия.
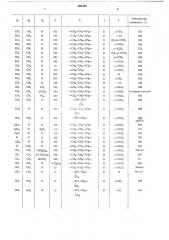
В таблице приведены полученные предлагаемым способом соединения.
Пример 1. 1,3-Диметил-4-{у- (4- (n-толил) пиперазинил-, (1) ) -пропиламино) урацил.
26 г (0,11 моль) и-толилпиперазинкарбоната и 12 г (0,05 моль) 1,3-диметил-4-(у-хлорпропиламино) урацила растворяют в 150 мл этанола, добавляют 200 мл толуола и после отгон ки спирта кипятят с обратным холодильником в течение 2 час, затем фильтруют в горячем состоянии. Фильтрат освобождают в вакууме от растворителя, остаток кипятят с эфиром и отфильтровывают. Для дальнейшей очистки остаток может быть перекристаллизован из ацетона или из метанола.
Получают 11 г (74 О/О от теоретического)
1,3 - диметил-4 - (у-(4-(n-толил) пиперазинил(1))-пропиламино)урацила с т. пл. 174 — 175 С.
Пример 2. 1,3 - Диметил-4-(у-(4-(о-хлорфенил) пиперазинил- (1) ) пропиламино) урацил
363248
10
Пример 3. 1,3-Диметил-4-(у- (4- (2,5-диметоксифенил) пиперазинил - (1) ) пропиламино) урацил.
29,5 г (0,1 моль) дигидрохлорида 2,5-диметоксифенилпиперазина растворяют в воде, подщелачивают при помощи 6 н. натрового щелока и путем экстракции с хлороформом и выпаривания выделяют свободное основание. Его кипятят с обратным холодильником с 11,6 г (0,05 моль) 1,3-диметил-4- (у-хлорпропиламино)урацила в 500 мл ксилола в течение 2 час.
После удаления ксилола в вакууме остаток может быть или перекристаллизован из метанола, смотря, по обстоятельствам, в насадке
Тиле-Папе, или лучше очищен хроматографически на колонне. В качестве неподвижной фазы служит нейтральный силикагель Мерк, в качестве растворителя — смесь уксусного эфира, метанола и концентрированного аммиака в соотношении 20: 4: 1. Получают 11 г (52, о от теоретического) 1,3-диметил-4-(у- (4(2,5-диметоксифенил) пиперазинил - (1) ) пропиламино)урацила с т. пл. 194 — 195 С.
Пример 4. 1,3 - Диметил-4-(у- (4- (о-метоксифенил) пиперазинил - (1) )пропиламино} урацил.
А. 28,2 г (0,11 моль) о-метоксифенилпиперазинкарбоната и 11,6 г (0,05 моль) 1,3-диметил-4- (у-хлорпропиламино) урацила кипятят с обратным холодильником в 150 мл воды в течение 5 час. Для выделения продукта можно или экстрагировать его толуолом в горячем состоянии, причем соединение осаждают из толуольного раствора петролейным эфиром (область кипения 50 — 70 С), или остывший водный реакционный раствор алкализировать с избытком 6 н. натрового щелока н экстрагировать хлороформом. После выпаривания высушенной хлороформенной фазы остаток кристаллизуют из 200 мл эфира и отстаивают. Получают 14,8 г (77 /о от теоретического 1,3-диметил-4- {у- (4 (о-метоксифенил) пиперазинил(1))пропиламино)урацила с т. пл. 156 С.
11,6 г (0,05 моль) 1,3-диметил-4-(у-хлорпропиламино)-урацила и 34 г (0,15 моль) о-хлорфенилпиперазинкарбоната кипятят с обратным холодильником в течение 3 «ас в 350 мл ксилола. Реакционную массу после охлаждения разбавляют 200 мл 6 н. натрового щелока и водную фазу экстрагируют хлороформом. Хлороформенный экстракт и фазу ксилола соединяют, высушивают над сульфатом магния, фильтруют и выпаривают. Коричневый остаток очищают хроматографически на колонне с нейтральным силикагелем Мерк, величина зерна
0,05 — 0,2 мм, растворителем служит смесь из уксусного эфира, метанола и концентрированной NH4OH в соотношении 20:4:1. Образовавшуюся светло-коричневую массу можно перекристаллизовать из метанола с применением активированного угля. Получают 8,5 г (45,/ от теоретического) 1,3-диметил-4- (у- (4- (охлорфенил) пиперазинил - (1) ) пропиламино) урацила с т. пл. 150 — 151 С.
Б. 600 г (2,36 моль) о-метоксифенилпиперазинкарбоната. размешивая, растворяют нагреванием в 3 л ксилола, при этом двуокись углерода улетучивается. При 120 С прикапывают раствор 242 г (1,04 люль) 1,3-диметпл-4- (ухлорпропиламино) урацила в 1,5 л метанола, метанол непрерывно отгоняют. Затем смесь дополнительно размешивают в течение 1 час при 140 С. При этой температуре отсасывают на нутче выпавший во время реакции о-метоксифенилпиперазингндрохлорид и промывают горячим ксилолом.
Из маточного раствора путем охлаждения, отсасывания на нутче, выпаривания, повторHbIx охлаждения и отсасывания на путче выделяют 312 г (81% от теоретического) коричневого сырого продукта, который может быть очищен перекристаллизацией из этанола с а«тивированным углем или выпариванием с ацетоном. Получают 280 г (70 /о от теоретического) 1,3-диметил-4- (y- (4- (о-метоксифенил) пиперазинил- (1) ) пропиламино) урацила с т. пл.
156 С.
Пример 5. 1,3-Диметил - 4- у-(4- (ометоксифенил) пиперазинил - (1))пр опилокси) урацил.
3,1 г (0,11 моль) 1,3-диметил-4-(у-бромпропилокси) урацила и 6,7 г (0,03 моль) о-метоксифенилпиперазинкарбоната нагревают с обратным холоднльггикоi г B 100 мл ксилола B Точение 3 час. После охлаждения массу отфильтровывают от выпавшего гидробромида о-метоксифенилпиперазпна и промывают бензолом.
Фильтрат выпаривают в вакууме и растворяют для последующего хроматографпрования на колонне в небольшом количестве смеси уксусного эфира, метанола, концентрированного аммиака 20: 4: 1. Хроматографию проводят с 280 г нейтрального силикагеля Мерк, величина зерен 0,05 — 0,2 мм.
Получают 3,8 г (88 /о от теоретического)
1,3-диметил-4-(у- (4 - (о-метоксифенил) пиперазинил- (1) ) пропилокси) урацила, перекристаллизованного из уксусного эфира, т. пл. 146—
148 С.
Пример 6. 1,3-Диметил - 4- (f3- (4- (о-метоксифенил) пипер азинил - (1) ) этиламино) урацил.
6,6 г (0,03 лголь) 1,3-диметил-4- (р-хлорэтиламино) урацила н 15,6 г (0,07 лголь) о-метоксифенилпиперазинкарбоната нагревают с обратным холодильником в 200 лгл ксилола в течение 2 «ас. Массу после охлаждения разбавляют 150 мл 6 и. натрового щелока, отделяют органическую фазу и экстрагируют водно-щелочную фазу хлороформом. Органические фазы соединяют, высушивают над сульфагом магния и выпаривают в вакууме. Остаток при помощи короткого кипячения с эфиром доводят до кристаллизации, отфильтровывают и перекристаллизовывают из ацетона. Получают 9 г (80 /о от теоретического) 1,3-диметил-4(P-(4 - (о - метоксифенил)пиперазинил - (1)) этиламино)урацила с т. пл. 169 С.
363248
Rg
КЗ
СНз
СН, СНз
СН
СН, п-СН, NH
175 о-CI
NH
150
195
156
174
СН, СН, NH
121
148
СНз
СН3
155
146
СН
СН, NH
169
114
СН3
СН. о-СН, 162
n-Cl
178
СН3
СН3 о-ОСН, о ОСН, о-ОСН3 о-ОСН3
120
СН3
СН3
Снз н-С,Н, NH
NO3
162
Хн
166
NH
СН, 232 о-ОСН, NH
СН3
СН
238 (хнс!) 218 о-ОСН3
С,Н„
Сзни
Н (155
С,Н, UH
Хн
СН, 204
270
С,Н3
186
iUH
Н с,н, СН
218
Масло
СН3
СН3
СН3
СН, СН
Н
СН
СН3
СН3
162
СН, М (СЗН,) О
Масло
Масло
СН
СН3
Н
СН3
120
СН3 и-СНз
СН, СН3
163
СН
n-CI
СНЭ
СН
СН
СН
СНЗ
СН3
СНЗ
СН
СН3
СН
СНз
СНз
СН3
СН, СН, СН3
СН, (сз 43)3
СОМНсзнз
СО СН3
Н вЂ” СН,— СН,— СН,— — СН,— СН,— СН3— — CH,— СН,— СН,— — СН3 — СН вЂ” СН3— — СН,— СН,— СН,— — CH3 — СН3 — СН3— — СН3 — СН3 — СН3— — СН.— СН.— CH — СН вЂ” СН вЂ” СН— — СН,— СН,— — СН3 — СН3 — ÑÍ3— — СН,— СН,— СН3— — СН вЂ” СН3 — СН3— — СН вЂ” СН,— СН,— — СН,— СН3 — Снз— — СН,— СН,— СН,— — СН вЂ” СН—!
СН„
Снз СН СН
СН3
1 — СН вЂ” СН,— — СН,— СН.— СН,— — СН,— СН,— Снз— — СН,— СН,— СН,— — СН3-CH — СН3— — СН,— СН,— СН,— — СН,— СН,— СН,— — CH3 CH -CH3 — СН,— СН,— СН,— — CH CH CH — СН,— CH3 — CH3—
СН,— СН,— СН, — СН вЂ” СН,— — СН вЂ” СН,— — CH — СН,—
СН, 2,5-ди-ОСН, о-ОСН3 о-Осзнз
2,4-ди-ОСНз м-ОСН, п-ОСН, о-ОСН о-ОСН3 о-ОСН3 о-ОСНз о-ОСН, о-ОСН3 о-ОСН3 о-ОСН3 о-ОСНз о-ОСН3 о-ОСН3 о-ОСНз о-ОСН3
Температура плавления," С1
Основание масло
363248
Продолжение т а б л.
Температура плавления, С1
R, о-ОСН, — CH — CH,— !
СНз
СН3
СН, — СН вЂ” CH,—
230 (дигидрохлорид) сн
СНз
СН, м-CHs — сн — сн,— ! сН3
217 (дигидрохлорид) Снз сн и-СНз — сн — сн,— !
СНз
152 сН3
СНз и-CI
Н вЂ” СН вЂ” CHi
152
СНз
СНз
СН, 1) Приводятся точки плавления оснований, если иет других указаний, >) Пикрат плавится при 173 — 175 С, оскалат прн 155 С, диокгалвт при 173 С, трнгидрохлорпд прн 192 С. з) Тригидрохлорид х 1 Н,О, т. пл. 231 С.
4) Гидрохлорид, т. пл. 225 С.
>) Дигидрохлорид спекается, начиная со 1б2 С. ) Дигидрохлорид, т. пл. 220 -С.
7) Дигидрохлорид спекается, начиная со 170 .С.
Применяемый в примерах 1, 2, 3, 4А и 4Б как исходное соединение 1,3-ди метил-4- (",хлорпропиламино) урацил может быть получен следующим образом. К 225 г (3 моль) 3-аминопропанола при 100 С добавляют постепенно
210 г (1,2 моль) 1,3-диметил-4-хлорурацила.
После окончания реакции, при которой температура поднимается до 150 С, при 110 С реакционную массу разбавляют 200 мл воды и охлаждают до 0 С. Кристаллизат отсасывают и промывают ледяной водой и ацетоном. После высушивания в течение ночи в вакуумном сушильном шкафу при 60 С получают 228 г (90% от теоретического) 1,3-диметил-4- (у-о«сипропиламино)урацила с т. пл. 140 — 143 С.
В суспензию 180 г (0,85 моль) 1,3-диметил-4(у-оксипропиламино)урацила в 800 мл толуола, размешивая, прикапывают 155 мл (2,55 моль) тионилхлорида, охлаждают так долго, чтобы температура не поднималась выше 50 С. После окончания бурного выделения газов смесь медленно нагревают до 100 С, пока выделение газов почти совсем не прекратится. Избыточный тионилхлорид отгоняют в вакууме, осадок отсасывают и промывают бензолом. Он может быть перекристаллпзован из метанола. Получают 167 г (85% от теоретического) 1,3-диметил-4- (у-хлорпропиламино)— урацила с т. пл. 151 — 153 С. Подобным образом из известного 1,3-диметил-4- (р-оксиэтиламино) урацила получают 1,3-диметил-4- ((3хлорэтиламино)урацил с выходом 74% от теоретического, т. пл. 203 С.
1,3 - Диметил-4 - (P-хлорэтиламино) урацил применяют в качестве исходного соединения в примере 6. Оно может быть получено следующим образом. В охлажденную льдом суспензию
20 г (0,1 моль) 1,3-диметил-4- (!3-оксиэтилампно)урацила в 300 мл хлороформа и 16 мл ди35 метилформамида прикапывают смесь 16 мл тионилхлорида в 40 мл хлороформа и размешивают сначала в течение 2 час при охлаждении льдом, а затем в течение 10 час при комнатной температуре. Темно-красный прозрач40 ный раствор разбавляют ледяной водой и раствором бикарбоната натрия и отделяют хлороформенную фазу от водной фазы. Полученный из высушенной и выпаренной хлороформенной фазы остаток перекристаллизовы45 вают из метанола. Получают при дальнейшей обработке маточного раствора 16,1 г (74% от теоретического) 1,3-диметил-4- (P-izopvmaas vно) урацила с т. пл. 203 С.
Примененный в примере 5 исходный 1,3-диметил-4- (у-бромпропилокси) урацил может быть получен следующим образом. При совместном введении эквивалентных количеств
1,3-диметилбарбитуровой кислоты и нитрата серебра в водный раствор выпадает серебряная соль 1,3-диметилбарбитуровой кислоты практически количественно. 10,4 г (0,04 моль) этой соли кипятят с обратным холодильником в течение 90 мин с 40 г (0,2 моль) 1,3-дибромпропана в 200 мл бензола, фильтруют в холодном состоянии и фильтрат выпаривают.
Остаток очищают па колонне с 350 г пеАгрального силикагеля Мерк, величина зерен
0,05 — 0.2 мм. Растворителем служит смесь из уксусного эфира, метанола и концентрирован65 ного аммиака 20:4: 1. Получают 5,4 г (25%
Предмет изобретения
Составитель T. Архипова
Техред T. Курилко
Редактор О. Кузнецова
Корректоры: Е. Сапунова и А. Васильева
Заказ !04/!5 Изд. ЛЪ 74 Тираж 403 Подписное
ЦНИИПИ Комитета по делам изобретений и открытий при Совете Министров СССР
Москва, К-З5, Раушская паб., д. 4/5
Типография, пр. Сапунова, 2 от теоретического) 1,3-диметил-4- (у-бромпропилокси) урацила, перекристаллизованного из уксусного эфира и имеющего т. пл. 113—
115 С.
Способ получения производных пиперазнца общей формулы где Ri и К вЂ” атом водорода, насыщенная или ненасыщенная алкильная группа с прямой или разветвленной цепью, содержащая до " атомов углерода, или циклоалкильная, или фенильная группа;
R3 — атом водорода, насыщенная или ненасыщенная алкильная группа с прямой или разветвленной цепью, аралкил, арил или циклоалкил, питро-, алкиламино-, диалкиламино-, ацильпая группы, или CONHR, -группа, причем R4 — алкильный радикал, содержащий до
4 атомов углерода, или замещенный фенильный радикал;
Х вЂ” ККз-группа, причем R5 — атом водорода или прямая, или разветвленная алкильная группа, содержащая до 4 атомов углерода, или атом кислорода или серы;
А — насыщенная или ненасыщенная алкиленовая группа с прямой или разветвленной цепью;
Y — атом водорода или алкильный радикал, содержащий до 6 атомов углерода;
Z — атом водорода, одна или несколько алкильных, алкокси- или меркаптоалкильпых групп, в каждой содержится до 6 атомов углерода, или трифторметильные группы, или
10 атомы галогена, или из солей, отличающийся тем, что соединения общей формулы
20 где К1, R2 Кз, Х и А имеют приведенные значения; На1 — атом галогена, предпочтительно атом хлора или брома, подвергают взаимодействию с фенилпиперазином общей формулы
30 где Y u Z имеют приведенные значения, или с его солью с последующим выделением целевого продукта известными приемами в свободном виде или в виде его соли.