Способ получения диуретанов хиназолона
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕН ИЯ
К ll AlE Н1У
406356
Союз Советских
Социалистических
Республик
Зависимый от патента №вЂ”
Заявлено 11.Х. 1971 (¹ 1705109/23-4)
Приоритет 13.Х.1970, № P 2050092.9, ФРГ
Опубликовано 05.Х1.1973. Бюллетень № 45
Дата опубликования описания 9Л 11.1974.
М. Кл. С 07d 51/48
Государственный комитет
Совета а!нннстров СССР во делам нзвбрвтеннй н открытий
УДК 547.495.1(088.8)
547.856.1 (088.8) Авторы изобретения
Иностранцы
Ханс-Эгон Кюнцель, Герхард Дитер Вольф, Роберт Бнрлинт, Зигфрид Петерсен, Гюнтер Нишк и Дитер Штейнхофф (Федеративная Республика Германии) Иностранная фирма
«Байер АГ» (Федеративная Республика Германии) Q Г)
ФЬ3а,ь1 мйОЙЯ Д1е
Заявитель
СПОСОБ ПОЛУЧЕНИЯ ДИУРЕТАНОВ ХИНАЗОЛОНА где R — как указано выше;
Z — галоид.
NH — С вЂ” OR !!
l0!
5 где Х вЂ” кислород или сера;
Изобретение относится к способу получения новых диуретанов хиназолона, обладающих биологичеокой активностью.
Известен способ получения N-фенил карбамата общей формулы где R — алкил, содержащий карбоксил, эфирную группу, циан;
Х вЂ” галоид, при взаимодействии амина общей формулы где Х имеет вышеуказанное значение, с соединением общей формулы
Предлагаемый способ получения диурета» нов хиназолона общей формулы
R — алкил, который может быть заме. щен на диалкиламиногрулпу, фурил, тетра гидрофурил, пирролидивил, пи перидил, ген» сагидроазепинил, имидазолил, т риазолил, од. ну или нес колыо гидроксильных грунп, а тая же ци клоалкил, который мажет быть заме» щен на ал кил;
R — алкил или фенил, который может быть замещен на алкил, алкоксигруппу, гало.
406356
H2X— .— С-OR х
R 0 — г — нм !! х
Кн — О.— ОЯ !! .Х ген, заключается в том, что амины общей формулы где R имеет вышеуказанное значение, обрабатывают производными кислоты общей формулы где Х и R — как указано выше;
У вЂ” галоген, предпочтительно хлор
О (! или бром, гру ппа — OCOR, — OR или — S—
СН СООН, в,которой R — алкил, содержащий предпочтительно 1 — 4 атома углерода, п ри необходимости в присутствии а кцептора кислоты, с последующим выделением целевого продукта и звестными приемами. — В указанных выше соединениях R представляет собой разветвленные или неразветвленные CI — C II-, предпочтительно С, вЂ С алкилы, R может содержать один или несколько (пред почтительно 1 — 3) заместителей, например фтор, хлор, бром CI — С4-алкилы, предпочтительно С вЂ” C>-алкил или С вЂ С4алкоксил.
Исходные диамины можно получить известньгми методами, например каталитичес ким гидрированием соответствующих,динитр осоединений, получаемых,из нитроантраниловых кислот и N-замещенных хлористых нитробензимидов в полярном растворителе в присутствии али фатического третичного амина при температуре 0 — 50 С, .или взаимодействием нитроантраниловых 1кислот .с хлористым нитробензоилом с последующей обработкой полученных бензо ксазинонов первичными алифатическими или ароматическими аминами.
В обоих случаях сначала выделяют промежуточные проду1кты, H3 которых получают динитросоединения термической циклизацией в органическом растворителе, например гли|цери.не, при температуре выше 100 С или с помощью дегидратирующих средств.
R представляет собой пред почтительно неразветвленный или разветвленный С,— Сю=, предпочтительно CI — С4-алкил, С вЂ” С7-, пред.почтительно С5-или С -циклоалыил, .которые могут соде ржать один или два из указанных выше заместителей.
В качестве разбавителей, в которых проводят реаицию, можно использовать инертные растворители, 1предпочтительно растворяющие
Зо
65 как,исходные соединения, так н конечные продукты, напри:мер алифатические кетоны, такие, 1как ацетон, ароматические углеводороды, такие, как боязол, толуол или хлорбензол, преимущественно N, N-диалкиламиды низших алифати чеаких карбоновых кислот, такие, как диметилформамид или диметилацетамид, или
N-алкиллактамы, такие, .как N-метилпирролидон.
В качестве аицептора кислоты можно применять третичные органические основания, например карбонаты и гидроокиси щелочных и щелочноземельных металлов, такие, как
ИаОН, К СО, СаСОз, ХаНСОз, триэтиламин или пиридин.
Реакцию проводят при (— 10) †1 С, предпочтительно при 0 — 50 С.
На 1 моль, исходного амина обычно берут не менее 2 моль производного кислоты.
Молярное соотношение между ами ном и производным кислоты составляет =1: 2,1—
1: 3.
Реакцию можно, проводить не только в растворителе, но и в суспензии или в эмульсии, на1пример в воде. Однако в этих случаях рекомендуется применение большого избытка производного кислоты.
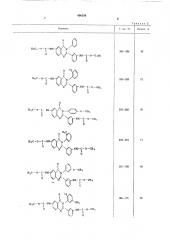
iso предлагаемому способу получены перечисленные в табл, 1 соединения общей формулы
Пример 1. 2-(3 -(Метоксикарбониламино) -фенил)-3 — фенил-6 - метоксикарбониламино-4-(3H)-хиназолон. 32,8 вес. ч. 2-(3 -аминофенил) -3-фанил-6 - амино-4- (3H) -хиназолона растворяют в 150 о б, ч. N-метилпирролидона, при 2 — 5 С прикапывают 25 вес. ч, метилового эфира хлормуравьиной кислоты, перемешивают 4 час при комнатной температуре, .выливают в воду, отсасывают осадок, лерекристаллизовывают из этанола с добавкой активированного угля и получают 34 вес. ч. (76;5% ) целевого продукта, т. пл. 248 — 251 С. Темпе ратура плавления зависит от жристалличности продукта. Для аморфного продукта т. пл. 198—
200 С, хотя по данным элементарного анализа и ИК-слектроокапии он не содержит примесей.
Найдено, %: С 64,8; Н 4,6; О 18,4; N 12,6.
C „Hg(IN4O5.
Вычислено, о о: С 64,86; Н 4,54; О 18,0;
N 12,61.
П р и и е р ы 2 — 12. Апалогично примеру 1 из соотве1ствующих диаминов и эфиров хлормуравьиной кислоты получают указанные в табл. 2 (см. после предмета изобретения) бисуретаны хиназолона.
406356
Таблица !
CH
СН3
H0 — CH — CH
СНЗ
С1 13 (С )15
1-13С, iN — СН,— CH
НЗС *
СОН5
С Н-) СНЗ
СаН5
С,Н„
НЗС"
Ы вЂ” СН3 — СН, НЗС
С.НS!
RO — С вЂ” НМ
)I
5H — (0R!
Пример 13. 2-(3 -(13-Оксиэтоксикарбониламино)-фенил)-3-фенил-6-(Ф - оксиэтоксикарбонилоамино)-4-(ЗН)-хиназолоп, 32,8 вес. ч.2 (3 -аминофенил) -3-фенил-6 - амино-4- (3H) -хиназолопа и 100 вес. ч. карбоната гликоля наПредмет изобретения
1. Способ получения диуретанов хиназолона общей формулы где Х вЂ” кислород или сера;
R — алкил, который может быть замещен на диалкиламиногруппу, фурил, тетрагидрофурил, пирролидинил, пиперидил, гексагидроазепинил, имидазолил, триазолил, одну или несколько гидроксильных групп, а также циклоалкил, который может быть замещен на алкил;
R — алкил, фенил, который может быть замешен на алкил, алкоксигруппу, галоген, отличающийся тем, что амины общей формулы гревают 3 час до 100 С, охлаждают, прибавляют метанол, охлаждают льдом и отсасывают осадок. Выход 26 вес. ч. (53%), т. пл. 232—
235 С.
C6H5.C„.H,, 2 =- С1, 5= С H. — С, На
С,H5 где К имеет вышеуказанное значение, подвергают взаимодействию с производными кислоты оощей форхг улы
У вЂ” С вЂ” 0 — R, !!
Х где Х и К вЂ” как указано выше, 0 !!
У вЂ” галоген, группа — ОСОК, — OR или — S — СН3 — СООН, в котарои
R — алкил, содержащий предпочтительно
1 — 4 атома углерода, прн необходимости в присутствии акцептора кислоты, с последующим выделением целевого продукта известными приемами.
2. Способ Ilo,ï. 1, oTличающийся тем, что реакцию проводят п ри (— 10) — 100 С.
406356
Таблица 2
Формула
Т. пл., С
Выход, оо
N !
204 †2
250 — 253
262 †2
71
252 †2
195 — 198
76
166 †1,С
Н-С- 0- <Н> !!
0 н3 с — 0 — С вЂ” NH !!
Н С вЂ” 0 — С вЂ” Т1Н !! о
0 !!
С
N с
ын- с- о-ск, II о
406356
Т. нл., С
Выход, оо
Формула
О
11
С я С вЂ” o — С вЂ” m. / у — Сн
234 †2
H5C — 0 — С
72
266 †2
Ж
1 — C — 0 — СБ.
ll
143 — 145
11
С
Ю
3IH С вЂ” 0 CH.
267 †2
Сн
1 юк- С - 0 н С— - Сн., 1
СК
155 — 158
Z,С вЂ” n — C — NH !
НЗС 0 C NH
11
0 сн
1 нС вЂ” С н 0-Сън
11
Сн 0
11 в
ii
NH — С вЂ” o -Cz, 11
Продолжение таблицы 2