Способ получения алкилиденпиранов или солей пирилия
Иллюстрации
Показать всеРеферат
ОП ИСА
ИЗОБРЕТЕНИЯ
Союз Советских
Социалистических
Республик
К АВТОРСКОМУ СВИДЕТЕЛЬСТВУ
Зависимое от авт. свидетельства №вЂ”
Заявлено 18.Х.1971 (№ 1706281/23-4) с присоединением заявки №вЂ”
Приоритет
Опубликовано 21.XI.1973. Бюллетень № 46
Дата опубликования описания 01 VII.1974
М. Кл. С 07d 7/14
Государственный комитет
Совета Министров СССР ео делам иэооретений и открытий
УДК 547,812.6(088.8) Авторы изобретения
С. В. Кривун, О. Ф. Возиянова и С. Н. Баранов
Донецкое отделение физико-органической химии
И нститута физической химии им. Л. В. П иса ржев с кого
Заявитель
СПОСОБ ПОЛУЧЕНИЯ АЛ КИЛ ИДЕН П И РАНОВ
ИЛИ СОЛЕЙ ПИРИЛИЯ
3 3
Сн
1 5 14 1 "
+5
2- Y
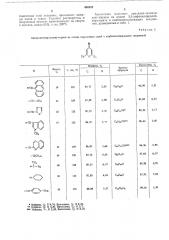
Изобретение относится к новому способу получения алкилиденпиранов нли солей пирилия формулы 1 или II
1 и в которых К1 — атом водорода или алкил;
R2 — алкил, ар ил или гетероциклический остаток или Ri и Ке вместе — атомы, дополняющие циклоалкильное кольцо;
R3 и R6 — незамещенный или замещенный атомом галогена фенил;
R4 и Ке — атом водорода или пары групп
Кз — R4 и Ке — К6 независимо друг от друга— атомы, дополняющие бензольное кольцо;
Х вЂ” атом кислорода, серы или селена и
Y — анион минеральной кислоты; которые могут найти применение в синтезе различных практически важных соединений, например пирилоцианинов — интенсивных красителей для кинофотоматериалов.
Известен способ получения алкилиденпиранов или солей пирилия, заключающийся в том, что пирилиевую соль со свободным а- или уk
Н И Е 406832 положением подвергают взаимодействию с трифенилфосфином, образующуюся пиранилтрифенилфосфониевую соль подвергают взаимодействию с фениллитием, образующийся пи5 ранилиденфосфоран при охлаждении подвергают взаимодействию с альдегидом и затем выделяют алкилиденпиран или переводят его в соль пирилия.
Недостатком известного способа является
10 трудоемкость процесса, связанная с сильным охлаждением и сложной очисткой конечного продукта, и недостаточно высокий выход целевых продуктов — 30 — 40%.
Цель изобретения — упрощение технологии
15 процесса и повышение выхода целевого продукта.
Предлагается способ получения алкилиденпнранов или солей пирилия формулы 1 или II, заключающийся в том, что соль пирилия фор20 мулы П1 где Ra, R4, Ке, R6 и Х имеют указанные значения и Y — — анион минеральной кислоты. подвергают взаимодействию с натриевой
30 солью диэтилфосфита, образующийся пира406832
О=воя), «15 ив«ок
+ ХаОР(ОЕ )а
B5Y X 5
5 а
3 нилфосфонат подвергают взаимодействию с трет-бутилатом калия, реакционную смесь подвергают взаимодействию с карбонильным соединением формулы IV
КЯ2СО где R и К2 имеют указанные значения, и выделяют алкилиденпиран формулы I или переводят его в соль пирилия формулы II действием минеральной кислоты обычными приемами.
Взаимодействие проходит по схеме
О--Р О Ц, Ъ... >
В
С
1i Г1 2
CH
1 5 1 +5 4 и $4 вр,со HY
Способ универсален и позволяет вводить в реакцию самые разнообразные карбонильные соединения (альдегиды и кетоны алифатического, ароматического и гетероциклического ряда), а также варьировать соли пирилия, бензопирилия, тиапирилия, коантилия и другие в широких пределах.
Предлагаемый способ принципиально отличается от известного не только методом проведения реакции и выделения полученного продукта, но и химизмом процесса, использованием других исходных соединений, что сокращает число стадий процесса. Синтез алкилиденпиранов согласно предлагаемому способу проходит без нагревания реакционной смеси (согласно известному способу реакционную смесь кипятят в тетрагидрофуране для разложения промежуточного бетаина), что способствует чистоте целевых продуктов, так как именно на этой стадии лабильные непредельные соединения разрушаются.
Предлагаемым способом синтезируют ряд соединений, которые известными способами не могут быть получены или получаются с незначительными выходами.
Конечные алкилиденпроизводные пиранов, бензопиранов, ксантенов и т. п., а также полученные из них соли пирилия идентифицированы элементарным анализом, ИК-спектрами и некоторые встречным синтезом.
Пример 1. 2,6-Дифенил-4-бензилиденпиран
В трехгорлой колбе, снабженной мешалкой, капельной воронкой и холодильником с хлоркальциевой трубкой, 0,3 г (0,013 моль) натрия в 70 мл абсолютного эфира растворяют с 2,1 г (0,015 моль) диэтилфосфита. Смесь перемешивают в течение 3 — 4 час до полного растворения натрия. При интенсивном перемешивании к полученной натриевой соли диэтилфосфита присыпают 3,3 г растертой соли 2,6дифенилпирилийперхлората.
Соль растворяется и появляется осадок пер; хлората натрия. Реакционную смесь выдерживают при перемешивании в течении 2 час. Полученный пиранилфосфонат в эфирном растворе без выделения смешивают с 1 68 r
10 (0,015 моль) трет-бутилата калия в 100 мл тетрагидрофура на в четырехгорлой колбе с мешалкой, обратным холодильником, капельной воронкой в токе сухого азота. Реакционная смесь становится темно-зеленой. Сразу же прибавляют раствор 1,1 г (0,01 моль) бензальдегида в 10 мл тетрагидрофурана. Тотчас темно-зеленый цвет исчезает и раствор приобретает желтую окраску, Смесь перемешивают в течение 1 час, обрабатывают водой, органический слой отделяют, промывают дважды водой, водный слой дважды экстрагируют эфиром. Из органического экстракта удаляют растворитель и полученный бензилиденпиран кристаллизуют из спирта и гептана. Выход 2,4 r (66%), т. пл. 140 С.
Найдено, %: С 89,54; Н 5,76.
Са4НдаО.
Вычислено, %: С 89,44; Н 5,59.
Алкилиденпиран растворяют в минимальном
30 количестве спирта и добавляют по каплям
1 мл концентрированной хлорной кислоты. Выпадает желтый осадок пирилиевой соли. Выход количественный.
Полученный 2,6-дифенил-4-бензилпирилий35 перхлорат имеет т. пл. 219 С (из уксусной кислоты).
Аналогично получают алкилиденпираны и соответственно замещенные пирилиевые соли с вератровым альдегидом (55%), с бензофе40 ионом (64% ), с 2,4-метоксибензальдегидом (50%), и-нитробензальдегидом (49%), ацетофеноном (46% ), дибензилкетоном (30% ) и др.
Алкилиденпираны с ацетофеноном, дибен45 зилкетоном по реакции Виттига выделить не удается; а с ацетофеноном выход в два раза меньше.
Пример 2. 2,6-Дифенил-4- (дифенилметилен) -пиран
50 К натриевой соли диэтилфосфита (из 0 3 г натрия и 2,1 г диэтилфосфита) в 100 мл абсолютного эфира присыпают 3,3 г (0,03 моль) растертого 2,б-дифенилпирилийперхлората. Реакционную смесь перемешивают до исчезно55 вения суспензии пирилиевой соли (2 час). Полученный эфирный раствор пиранилфосфоната приливают к суспензии 1,68 r (0,015 моль) трет-бутилата калия в 100 мл тетрагидрофурана в токе сухого азота при перемешивании.
60 Реакционная смесь становится темно-зеленой.
Вслед за этим сразу прибавляют раствор 2,1 r (0,011 моль) бензофенона в 20 мл тетрагидрофурана. Раствор приобретает желтую окраску.
Смесь перемешивают в течение 2 — 3 час и
65 оставляют на ночь. После обработки водой ор406832
Таблица 1
Алкилиден-(арилиден)-пираны на основе пирилиевых солей и карбонилсодержащих соединений
РЬ О К, Вычислено, %
Найдено, %
Брутто-формула
Выход, о
Т. пл., С
c»H„o
5,31
90,99
5,50
90 77
210
=СН вЂ” CHS
c,„n„o
67,99
6,15
87,69
5,98
159
СЙ Н1цо$*
5,17
80,24
80,33
5,35
135
=СН
С,V»ON
5,60
86,40
86,30
5,77
132 с„н оы-.
5,93
86,36
86,82
159
5,66
С„Н180
= С(СНз)а
87,64
6,57
87,74
6,81
С,н оо
5,95
89,28
6,07
89,10
148
48 сно
7,00
87,83
87,93
6,62
142
=сн б см
5,30
89,04 сно
5,57
88,88
170 ганический слой отделяют, промывают дважды водой и сушат. Удаляют растворитель и полученный продукт кристаллизуют Н3 спирта и гептана, выход б5%, т. пл. 200 С.
CHú
= С вЂ” от Найдено, %; $9,74. Вычислено, %:,$9,37. Найдено, %: N 3,85, Вычислено, %: N 3,7, Найдено, %: N 3,82. Вычислено, /: N 3,75, Аналогично получают арилиден- (алкилидсн)-пираны на основе 2,б-дифенилпирилийперхлората и карбонилсодержащих соединений, приведенные в табл. 1.
406832
Таблица 2
Пирилиевые соли
Найдено, %
Вычислено, %
Брутто-формула
Т. ил.. С
CI
254 †2
73,72
6,83
СззНазС104
4,58
73,39
6,79
4,40 — СН,— СН, 256 — 257 63,01
9,89
4,87
С49Н„С104
4,99
63,24
9,84
180
C sHnCIOP*
8,09
61,67
4,21
61,61
3,96
8,28
199 †2 67,86
C„H|4CIObN" *
7,31
4,68
7,70
67,75
4,12
260 †2 67,73
С27НЯОCIOÜN
8,00
4,34
68,45
7,49
4,22 з
CH — Ph
190 †1 68,32
4,85
8,81
С2ОНд,С10
68,72
4,91
9,13
249
СззНзз(-104
66,78
4,48
8,50
66,58
5,55
8,56
СН СН вЂ”
240
65,72
С4аНзаС4014
4,31
9,17
4,17
65,71
9,25
Пример 3. 2-Фенил-4-бензилиден-5,6-оензопиран
2,1 г (0,01 моль) 2-фенил-5,6-бензопирилийперхлората присыпают при перемешивании к натриевой соли диэтилфосфита (из О,З г натрия и 2,1 г диэтилфосфита) в эфирном растворе. После исчезновения суспензии пирилиевой соли полученный раствор фосфоната приливают к 1,68 г (0,015 моль) трет-бутилата калия
* Найдено, %: Я 7,24. Вычислено, %: Я 7,50.
** Найдено, %: N 3,34. Вычислено. %: N 3,40.
"""* Найдено, ;„": N 2,84. Вычислено, %: N 2,95. в 100 мл тетрагидрофурана в токе сухого азота. Раствор приобретает ярко-красную окраску, которая при добавлении 1,1 г (0,01 моль) бензальдегида переходит в желтую. После не5 продолжительного перемешивания реакционную смесь обрабатывают водой, органический слой отделяют, промывают водой и сушат.
После удаления растворителя продукт кристаллизуют из спирта, выход 58%, т. пл. 87 С.
406832
20
Р 1...б 1 г
В У
Составитель 3, Латыпова
Техред T. Ускова
Корректор О. Тюрина
Редактор Е. Хорина
Заказ 2800)5 Изд. № 1194 Тираж 511 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий
Москва, Ж-35, Раушская наб., д. 4/5
Типография, пр. Сапунова, 2
Аналогично получают 2,6-ди-п-бромфенил-4бензилиденпиран, выход 56,0%, т. пл. 198 С;
9-бензилиденксантен, выход 61%, т. пл, 115 С;
2,6-дифенил-4-бензилидентиапиран, выход
53,4%, т. пл. 139 С; 2,6-дифенил-4-бензилиденселенапиран, выход 53,4%, т. пл. 140 С, Пример 4, 2,6-Дифенил-4-бензилселенапирилийперхлорат
1 г (0,0025 моль) 2,6-дифенил-4-бензилиденселенпирана растворяют в минимальном количестве ледяной уксусной кислоты и добавляют несколько капель 70%-пой хлорной кислоты. Выпадают желтые кристаллы 2,6-дифенил-4-бензилселенпирилийперхлората, которые кристаллизуют из ледяной уксусной кислоты и нитрометана.
Выход почти количественный.
Пирилиевые соли, приведенные в табл. 2, получают почти с количественным выходом, как описано в примере 4.
Предмет изобретения
Способ получения алкилиденпиранов или солей пирилия формулы 1 или II
П в которых R< — атом водорода или алкил;
R — алкил, арил или гетероциклический остаток или R и R вместе — атомы, дополняющие циклоалкильное кольцо;
Ra u Кв — незамещенный или замещенный атомом галогена фенил;
R4 и Кв — атом водорода или пары групп
Кз — R4 и Кз — Кв независимо друг от друга— атомы, дополняющие бензольное кольцо;
Х вЂ” атом кислорода, серы, или селена и
10 1 — — апион минеральной кислоты, отличающийся тем, что, с целью упрощения технологии процесса и повышения выхода целевого продукта, соль пирилия формулы 111
15 где Кз, R4, Кь Ка и Х имеют указанные значения и Y — анион минеральной кислоты, подвергают взаимодействию с натриевой
25 солью диэтилфосфита, образующийся пиранилфосфонат подвергают взаимодействию с третбутилатом калия, реакционную смесь подвергают взаимодействию с карбонильным соединением формулы IV
30 КО СО, где Ri и К2 имеют указанные значения, и выделяют алкилиденпиран формулы 1 или переводят его в соль пирилия формулы II действием минеральной кислоты обычными
35 приемами.