Способ получения ы-
Иллюстрации
Показать всеРеферат
Союз Советских
Социалистических
Республик
ИЗОБРЕТЕН ИЯ
К ПАТЕНТУ (61) Зависимый от патента— (22) Заявлено 18.03.70 (21) 1413337/23-4 (32) Приоритет 19.03.69 (31) 21529/69
02.04.69 25795/69
11.04.69 28585/69
19.04.69 30455/69
09,05.69 35919,, 69
27.05.69 41504/69!
51) М. Кл. С 07d 27/10
Государственный комитет
Совета Миннвтров СССР оо делам изобретений и открытий (33) Япония
Опубликовано 30.03.74. Бюллетень ¹ 12
Дата опубликования описания 28.05.75 (53) УДК 547.461.4 (088.8) (72) Авторы изобретения
Иностранцы
Акира Фудзинами, Тосиаки Озаки, Сигехиро Ооба, Сигео Ямамото, Кацудзи Нодера, Кацутоси Танака, Кейичиро Акиба, Тадаси Ооиси и Нобуюки Камеда (Япония) Иностранная фирма
«Сумитомо Кемикал Ко, Лтд» (Япония) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ N-(3,5-ДИГАЛОГЕНФЕНИЛ)ИМИДОВ
1 2 где Х и Х вЂ” галогеп;
О
Изобретение относится к области получения новых N-(3,5-дигалогенфенпл)-имидов, которые могут быть использованы в качестве биологически активных соединений.
Известен способ получения N-(3,5-дихлор- 5 фенил)- имидных соединений общей формулы
О где Х, Х вЂ” Cl, А — СН = СН вЂ”,пли — СНе— — СН2, состоящий во взаимодействии 3,5-дихлора нилина с малеиновым или янтарным ангидрядом.
Однако соедине ння, полученные по известному способу, имеют незначительную биологическую активность.
С целью получения соединений, обладаю- 20 гцих повышенной биологической активностью, предлагается способ получения HOBbIx N-(3,5дигалогенфенил) -имидных соединений общей формулы
А — замещенная этпленовая группа формулы где R> — алкпл с 1 — 4 углеродными атомами, галоген, алкилтпогруппа с 1 — 4 углероднымп атомами, низшая алкенилтпо-, низшая ацилтио-, аралкплтио-, феннлтпо-, галогснированная фснплтпо-, метилпроваííая фснплтпо-, фенл1лтз1огруппа, замсщон ная NO, алкплампн с 1 — 6 углеродными атомами, морфолиногруппа, алкилсульфенил с 1 — 10 углероднымп атомами или аралкилсульфенпл;
R. — водород, алкил с 1 — 4 углероднымп атомами пли галоген при условии, что Я,— алкил, если R — алкил; R, — галоген, если если R, — галоген и R, отличен от алкпла, если R> — водород;
А также может представлять собой циклопропиленовую группу формулы
422!43
73
-С, Л„
I c
-С !
1 6 где Р;,, R., R;, Rr, — водород или алкил с 1 — 4 углеродными атомами, или А — тримстилен, ц>иклогекс>плен-!,2-:ц>;>клогексен>илен - 1,2-циклогексадиенилен-1,2 или о-фенилен.
Способ состоит в том, что моно- N-(3,5-дигалогенфе>нил) -амиддикарбоновой кислоты общей формулы
О
ll
1 « 11 — СА -COOH подвергают дегидратации при температуре
20 — 250 С.
В качестве дигидратирующего агента можно применять ангидрид кислоты, пятихлористый фосфор, хлорокись фосфора, пятиокись фосфора, ацетилхлорид или тионилхлорид.
Процесс мож>но вести в присутствии инертного органического растворителя.
Соединения, полученные согласно изобретению, обладают повышенной биологической активностью по сравнению с известными.
Пример 1. Смесь, состоящую из 0,1 моль полуамида N- (3,5-дигалоидфенил) -янтарной кислоты, 50 мл уксусного анги>дрида и 1 г безводного ацетата натрия загружают в четырехгорлую колбу на 100 мл и нагревают при перемешивании при 100 С в течение 1 час. После этого уксусную кислоту,и уксу"..ый ангидрид отгоняют в вакууме, остаток промывают водой и сушат, при этом получают N-(3,5-днгалоидфенил) -сукцинимид с хорошим вы;одом. Если нужно, то ведут перекристаллизацию из этанола для получения чистого продукта.
Полуамид N-фенилянтарной кислоты легко получают из соответствующего производного ангидрида янтарной кислоты и производного а>нилина. Типичные представители янтарного ангидрида и анилина приводятся ниже.
Получают следующие ангидриды янтарной кислоты:
2-метилтиоянтарный;
2-этилтиоянтарный;
2-и-пропилтиоянтарный;
2-изопропилтиоянтарный;
2-и-бутилтиоянтарный;
2-изобутилтиоянтарный;
2-втор-бут,илтиоянтарный;
2-трет-бутилтиоянтарный;
2-и-амилтиоянтарный;
2-изоа милтиоянтарный;
2-трет-амилтиоянтарный;
2-гексилтиоянтарный;
2-гептилтиоянтарный;
25
2-октнлтиоянтарный;
2-нон илтяоя нта р н ы й;
2-децилтиоянтарный;
2-фенилтиоянтарчый;
5 2-(о-хлорфенилтио)-янтарный;
2-(м-хлорфенилтио)-янтарный;
2-(n-хлорфенилтио)-янтарный;
2-(о-метилфенилтио) -я>нтарный;
2- (л -метилфенилтио) -янтарный; !
О 2- (n-метилфенилтио) -янтарный;
2- (и-нитрофенилтио) -янтарный;
2-бензилтиоянтарный;
2-ди метил аминоянтарный;
2-(ди-и-пропиламино)-янтарный;
2-(ди-изопропиламино)-янтарный;
2-(ди-и-бутиламино)-янтарный;
2- (ди-,изобутиламино) -янтарный;
2-(ди-и-амилоаминс)-янтарный;
2-(ди-изоамнламнно) -я>нтарньш;
20 2-дигексилами>ноя: —:тар;>ь>й;
2-пирролндннянтарный;
2->ниьерндинянтарнь>й
2- морфолинянта рный.
Получены также следующие анилины:
3,5-дифторанили>;
3,5-дихлорàrrrurr»;
3,5-диброманилин;
3,5-дииоданили>н.
Таким образом .получают соединения, у>ка30 занные в табл. 1.
Пример 2. Смесь, состоящую из О,!люль производного моноамида М -фенилциклопропандикарбоновой кислоты, 50 г уксусного ангидрида и 1 г безводного ацетата,натрия, заЗ5 гружают в четыре>хгорлую колбу на 100 мл и нагревают при перемешивании и 100 С в течение 30 аии. Потом уксусный ангидрид и укс„ сную кислоту отгоняют в вакууме, остаток про.:ывают водсй и сушат, Прн этом получают
40 N-фенилциклопрспандикарбоксимидное производнсе. Для получения чистого продукта ведут перекристаллизацию из эта нала.
П ро извод>нос моноа мида Х-фен ил циклопрог! a rr Kap>oo!oeoA !
45 этом способе, легко получают по обычному способу, из соответствующи.-. анг дрида циклопропандикарбоновой кислоты и анили>на.
Типичными представителями циклопропандикарбсновсго антидрида и анилина являются
50 пр иведенные ниже соединения, нс OHH не ограничивают сущность этого изооретения.
АнгrrgpHrrbr:
1-метилциклопропандикарбоновый;
3-метилциклопропандикарбонсвый;
1,2.диметилци>клопропандикарбоновый;
1,3-диметилцикло пропа>нд икарбонсвый;
3,3-диметилциклопропандикарбоновый;
1,3,3-триметилциклопропандикарбоновый;
1,2,3,3 - тетраметилциклопропандикарбоно
>вый.
Анилины:
3,5-дихлоранилин;
3,5-диб ром а,нили>н;
3,5-дииоданилин;
55 3,5-дифторанилин.
С!
Сс. ч
L ! т! ! !
Ф:( о
4L o
Z0l со со
С уI>
С4 х
С
С4
И ! /с С4
\!с †...Р
I I
a — V V=O б
Г
О. о д ! о
» с-С рс
:с рй ° ! о —
I«l Ьс С (!"-с
" -! ) Л.«!
: с»
С - :
C С-.-.
СЬ
X о
О. !
»
&" в- -с
С«!
°
«с! о
da иидд
С:(Ж о
Й
С
LO
Сс с м
Ж
С
С 4 ж
С
Ьс 4
M — U
1 I
0=v v=O
,/ 4 -с
422143 с с
С С.:!
° 4 l
Т> — "
С4
С
С 4
С-4,«Сс
С-:
С ! ! р !
С! - „7 б ж г
С 4
CG г-.
С 3
1: I (C) L. оо
«»
L с«
««С
«
C)
«
L с
Ф с
CL о
QJ г. и о г.
«j
Р с о
L (р о
« Ф оИ
«)
«/1 х х о о о
v — v
tA
422143
Р Я» о о о
«л х х >-«
1 х х
О О
v х р1
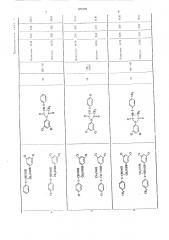
Таблица 2 . -(3,5-дигалоидфеиил) -имид
Аиалиа (. — галоид, 0!0) В, I
Т..,С/ код, о,;, 1
С!
27,69
Вычислено 51,59 2,76! 30,5 — 132,0
1Ь I;ie! IO !
51,38 2,41
5,38
276!
Вг
46,33! ! 0
И B1"
iСН вЂ” С
К С М СН вЂ” С.
II Вг (0
Вычислено 38,29
2,05
4,06
133,5 — 135,0
Найдено
37,99
46,57
1,82
4,27
С!
24,96
Вычис вено 54 95
4,93
3,90
98 165,0 — 167,0 Найдено 55,08
4,68, 24,75
3,72
С1
24,9 Вычислено 54,95
3,90 4,93
97 127,5 — 129,5
4,74 24,9
55,00
3,81
Найдено
Cl
24,9
Вычислено 54,95
4,93
3,90
97 34,5 — 137,0 (5,12 25,1
Найдено 54,83
3,76
Вг
42,8
2,97
Вычислено 41,85
3,76
95 161,0 — 162,5 !
3,65 42,9
Найдено 41,92
3,04
54,3
Сн 0 ! II
OH i гс — С
Hi С вЂ” С
С,, I Х 98
1 И 3
Н 0
Вычислено 33,43
3,00
2,37
170 — 172
2,92 54,6
2,15
Найдено 33,58
Й Моноамид М-фс и:лцикг!оироца!!,!икар!3оiIoIIuй ":!c.!сты
Моноам!!д N-(3 .5 -и:!i. 0ðIII! .Illlл) — !ги i;IOи р О I! а i . ! I I! а и б О! l о в О!! и!!слоти
Мопоамид N-(3.5 -либромфсни1) -циклоиропандикарбоновой кислоты
Ыоноамид 1,2-димстил-N-(3,5 -дпклорфе16 иил)-циклопропаидикарбоновой кислоты
Моноамид 1,3- или 2,3диметил-!4- (3,5 -диклорфенил) -циклодипропацдикарбоновой кислоты
Моноамид 3,3-диметил- I
-! 4-(3,5 -диклорфеиил)-циклонропаидикарбоновой кислоты
Моноамид 1,3- или 2,3-ди метил-N- (3,5 -дибромфеиил) -циклопропандикарбоиовой кислоты
Моиоамид 1,3- или 2,3
-диметил-N-(3,5 - ди иодфенил) -циклопропаидикарбоновой кислоты
Структурная формула
С1
И
2 о
СН 0
I! С1 .С вЂ” С;
М С вЂ” С
II Ci
СН 0
СН 0
I! С
СН /
С I 1ч, б
Я СН-С !!
С1
0 а
СН: СН вЂ” С, Ci
С
СН-, СН вЂ” С"
И Q
0!
С Н, Х !
422143
С 3 ссо
С Э
С
cj
С
OO
С
CD со с:
СЛ со
С
С 3
L о1
С»Э
СО со о о г.
С5 о
Х î
Ю д
L со
С "l
С
-3. о
>.
О о со
С
2 г ф= о=О
:а о о о
rJ о о бахиджа о х ! х
С, C
Ф
СД о, г.
Q.
F и
F о
Х
Д о о
GJ с
Ф о о С> о
Cl
Ю(Я б О
l р=и O=О
20
Ct
С
С (LJ
1о
CC:
tCt
СО
СО
С..
С1
СО
СО
+ о
=f о о
1о
СЧ
t О
1 СО с
С
Г;
Б
СО
422!43 о
С
Г к
GC г-. ()
CJ
Ci с>
С 1
4 «»
\» с" с>
» с»
« с«»
tD
D сч
4D
«4» сс
«4»
4«»
CD
4«»
i«» с»
С4 с2 с»
4«»
О«»
L с о
Г»!
«:)
С> с 3
« »
1 с»
« >
4
4«» с»
Ъ»»
44»
4 Ж
«.» С» сэ
»«Ч 4-. 4
«,»
4 д
«3
4 -4
«.р >
1 1
«»= .» =C
/ с»
«»
-с»
«»
«4
«Р
«»» с»
«» 4»
4 °
2 — »
С 4
«4 и т2
»44
«ч р
«.2, 4 4
«» — «»
4 л
Й
«
"е
«2
»»
7» 4 44 — rQ
4J 5
«»
D !
daICIVdP
Zfl
«44
«,2 — V
О= 2
С» «=»
4 )
V4 с
«7 — «.2
1 ,2 «.2
4«4
Ж И
«.2
° -4 (.) Р
» ч 7
v V
/ » (» 44»
° 4
V х х
O О
С:» «2
«.» «4
:а
V 4Р
1 х
7»
1 72
Д
«» 1» ж х
«»
Ы:а
«» Т х"
«Э
° °
v — v
O=V V=O
„,б
Г." .,-1
« »
Ф-4 Ю °
CD сч
««
LJ
С !
СО
L
L«J
С)
OO
С«3
СЪ
CD
С«Э
LQ о о г.
С3 о сг
CJ г
CJ о )
С3
СЧ
OO () (о
М о
O( о о
L х
О О
О 3 х «
V — V
422143 х о
О О
Т) х рб«
u — CD (х
О
Ы х гР—
I о
CJ
Cg
m х о о ( /Ъ
«л сч х ж 7 — « (O=u с. =о / х х
О Х о О
Т.2 з !
:а (Vl
92
Таблица 4 (Т. ил., чС
Анализ, Структурная форну.l3 кислоты к c>
) !
Вычислено 43,12;
2 !7 5,03 38,19
Ci О
П С1
1ч У 128,5 — 129,5 94
CH C
11 С1
2,04 5,17 (11айд2но
37,97
42,98
1,87 4,34
Вы и.слено 37.19
93
132 — 36
1!
2,01 4,26
Найдено 37.25
l,6 4,48 45,31
Вычи;,ëåíо 38,38
188 — Р90
90! л50 4.32
45,57
Каи лен о 38,31
1.65
3,81 Вычислено 32,69
153,0 — 156,0 90 (! Найде;.;о 32,53
l,53
3,5) i, 5
Вь;числено 29,89
186 — 190
37
3,47
29 -,4
Найдено
1,38
Л1опоамид Х-(3,5 дигалоидфенил) -ян1;ной
C i — CHCOOH C i сн,сок н, С1
Ci
Ci — СНСОМН
СИ СООЯ
I Вг-СНСОЮН
СН СООЕ С>
ВГ-СНСО ОН С1
СН2СО.1Н
С1 — CHCOOP. С1
С1 СНСОКН
C1 — СНСООИ ВГ
СН СОН
ВГ
36!
ВГ
Ci-CaCOXH, I
CHqCOOH ВГ
В1- - CHCOOH С1
ВГ-CHCOM
ВГ, Ci о
СН-С
Я
СН2-C !
С) О
П
CH — C
СК с
И
С! О
С, и Вг
cH-c i
СН-С" II ДГ
О!
Bl О
lI С!
СН-С г Г
СН вЂ” С
II С1
3 О
М-(3,5-л;и алоидфеи и1) -lI, и
4221.:3
10
Таблица 5
N-(3,5-Дигалоидфенил) -п..1iiä
Моноагяид М-(3,5 - дпгалоидфенпл) -яптарноп
1 . .„,алпа 0
Структурная форгиула
Т. пл., С
1-1 f N кислоты
5,03 38,19
2,17
Выипс епо 43 12
С1- СИ вЂ” С
С1
1 М )
4Q
Ci снсоон С1
СКСОКЧ-WWF
С1
127,0 — 129,0 87
4,89 38,25
Найдено 43,33 2,07
1 ! (!
Вычислено 32,69 1,65 (3,81
С1-CH С, СН2-С"
11 Вг
CHCOOH
1(СНСО1 К
Вг
152,5 — 155,5
Напдено 32,78 1,46 3,74
25 г Нр, =H — Ъ.. Ъ
f — C . 3
-с
Р"В
П р и 1 е р 8 . О,! гяоль полу амида N-(У,5 дигалоидфе ил) -янтарной кислоты загружают в четыре горлую колбу па 100 лл. Затем в колбу постепенно по каплям добавляют при перемешивании 50 г тпонилхлорида, затем перемешивапие продолжают с обратной перегонкой еще 1 час. По окончании реакции реакционную смесь выливают в ледяную воду для разложения изоытка тиопилхлорида. В этом случае выпавшие кристаллы выделяют фильтрованием и сушат после промывки их водой. Получают производное N- (3,5 -дигалоидфенил) -3-хлорсукцинимида с хорошим выходом. После перекристаллизации из смеси бензол-этанол получспот чистый п родукт.
Предмет изобретения
1. Способ получения N- (3,о-дигалоге нфе«ил) -имидов общей формулы де Х и Х вЂ” галоген;
1 — замешенная этиленовая группа формулы де Rt — алкил с 1 — 4 углеродными атомамп, алоген, алкилтиогруппа с 1 — 10 углеродными томами, низшая алкенилтио-, .низшая алкил35
Примерами полуамида л- (3,5 -дигалоидфенил)-малеиповой кислоты являются; полуампд х1- (3,5 -дифторфвнил) -малепновой кислоты, полуамид Х-(3,5 -днхлорфенил)-малеиновой кислоты, полуамид N-(3,5 -дпбромфенил)-малеиновой кислоты, полуам1 д N-(3,5 -дииодфенгил)-малеиновой кислоты.
Результаты синтезов по указанному способу приводятся в табл. 5.
15 тио-, аралкилтио-, фенилтио-, галогенированная фенилтио-, метилированная фенилтио-, фенилтиогруппа, замещвнная К02, диалкиламино- с 1 — 6 углеродными атома ми, циклическая вторичная аминогруппа с С 4 — 5, морфолиногруппа; R2 — водород, алкил с 1 — 4 углеродным и атомами или галогвн при условии, что
R> — алкил, если R, — алкил;
R — галоген, если R, — галоген, и К, отличен от алкила, если Rz — водород;
А также может представлять собой циклопропилвновую группу формулы
422143!! P Р1 — Гq — i ООН
CH — R-, обозгначяег я лкпл — гялоген; при А CH — К, 1
СН вЂ” R
15 где R, л К каждыми
1 — 4 ат" мов углерода, а
27.05.69, ¹ 4150-1/69
2 ) пл:i галоген, АСН вЂ” R !
CH — Ра, 25
Составитель Т. Калинина
Текред F. Борисова
Ко!:11«! Оо О. Тюрина
Редактор 1. Герасимова
Заказ 767/,. Изд. 1586 Тираж 506
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий
Москва, K-35, Раушская наб., д. 4/5
Тип. XBpbK. фил. пред. «Патент» где Ка, R4, Кв Кв — водород t.ëè алкил с
1 — 4 углеродными атоиами, или A-триметилен, цикл огексилен- 1,2-циклогексенилен - 1,2-циклогексядиенилен - 1,2- или о-фенилен, отличающийся тем, что моно- {3.5-лигалогенфенил)— ямиддикарбоновой кислоты оощей;!;ирму. ы: где Х, Х, А имеют вышеуказанные значвния, подвергают дегидратации при температуре
20 — 250 С.
2. Способ по п. 1, отличающийся тем, что процесс ведут в присутствии,дегидратирующего агента, например ангидрида кислоты, в среде инертного органического растворителя.
19.03.69 согласно заявке № 21529/69 при
R> — алкилтио- с 1 — 10 атомами углерода, аралкилтио-, фенилтио-, гялогенирова нный фенилтио-, метилированный фен..1лтио-, .нитрованный фенилтио-, диалкиляминогруппа с
С 1 — 6, циклическая вторичная аминогруппя
С 4 — 5:или AIорфолиíî"ýóïïà: R) — водо)о.,: а X;r Х вЂ” галоген;
02.04.69, № 2579569 при Ка, К, Кв и Яв каждый обозначает водород или алкил 1 — 4 атомов углерода, а Х и Х вЂ” гялоген;
5 11.04,69, № 28585/69 при Х и Х вЂ” гялоген, А=С1-1,. - — CH;
С4,.
19.04.69, ¹ 30455/69 при А — циклогексилен - 1,", ц)гклогексен:к1ен — 1.2, циклогек "a10 диенилен - 1,2 пли о -..енилсн: я Х я,— гялоген;
09.05.69, № 35919 69, пви А C H — R, 1 где К; — галоген; Яз — всдор)од з Х ги Х оооз .ëчают гялогген;
18.03.70, № 1413337/23-4 пр:t г-:,е 17 — алкенилтиогруппя; R. — водород;
X:i Х вЂ” галоген.