Патент ссср 433670
Иллюстрации
Показать всеРеферат
ОП ИСАН ИЕ
ИЗОБРЕТЕНИЯ
К ПАТЕНТУ
Союз Советских
Социалистинеских
Республик (») 433676 (61) Дополнительный к патенту (22) Заявлено 10.11.71(21) 1715000/23-4 (22)Приоритет10.11.70(31)98919/70 (33) Япония — — т
i (43) Опубликоваио25.06.74Яюллетеиь №23 (51) М. Кл.
С 07С 69/74
Гасударственный канитвт
Юаввта Министров СССР
as делам иэссрвтвний . и открытий (Я) УДК547.514.48 (088.8) (45) Дата опубликования описания06.01.76 и (72) Авторы Иностранцы иаобретения Масаясу Куроно, Фусае Ко юто и „,Масаки Хаяши (Япония) Иностранная фирма
Оно Фармасьютикал Ко, Лтд (Япония) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОСТАГЛАНДИНОВЫХ ЭФИРОВ
Изобретение относится к способу полу:) чения новых простагландиновых эфи. p0a, представляющих собой эфиры проста гландинов Е, Е, 1, А или А
1 2 26 1 ( обладающих высокой физиологивеской ак-, I тивностыо. . (Известен способ получения депнлового эфира простагландина А, заключающийся, в том, что простагландий А подвергают взаимодействию с диазодеканом.
Однако при осуществлений таких способов нельзя получить непосредственно . эфир спирта, содержащий гетероатом, на1 пример атом азота, или гидроксильную группу, которая Ъетко дегидратируется вну.(.римолекулярно, или стерически затруд пенный спирт.
Предложен, способ получения эфиров, Т заключающийся в том, что соответствующий простагландин, например простаглан» дин, Е, превращают в соль с помощью
1 третичного амина, например триэтиламина, полученную соль подвергают реакции с
;пивалоилгалогенидом, образующийся при
1" этом смешанный ангидрид кислоты подвер- гают взаимодействию со спиртом или фе иолом, причем в зависимости от природы спирта или фенола образуются различные
15 эфиры простагландинов.
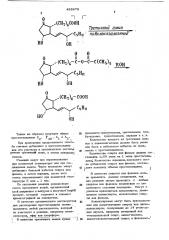
В качестве примера приводится уравне ние реакпии получении эфира простаглант дина E
433670
О
1 (С008
Н0
ОН
О О
)! с-о-с c(cH,1, О 5831
ИО
ОН " 5 Б11
НО
Таким же образом получают эфиры простагландинов Е, У „, А и А„.
При проведении предложенного способа сначала добавляют к простагландину или его раствору в органическом раство, рителе третичный амин, а затем пивалож1 галоид.
Реакцию ведут при перемешивании при комнатной температуре или при ох-: ,лаждении льдом. Через несколько минут добавляют большой избыток спирта или фенола, а затем пиридин, после чего смесь перемешивают при комнатной тем»: пературе 5 мин — 1 час.
По окончании реакции реакционную смесь промывают водой, органический слой упаривают в вакууме и получают сырой продукт, который отделяют и очишают хроматографией на силикагеле.
В качестве органического растворителя для растворения простагландина можно применять любой растворитель, который не участвует в реакции, например метиленхлорид, эфир или хлороформ.
В качестве третичного амина лучше г
Трвпииный амин
С Н11 пабалцилгалпгени3
35 применять триметиламин, триэтиламин, три бутиламин, триоктиламин, пиридин и т. п.
Количество каждого из третичных аминов и пивалоилгалоида должно быть равно или быть в небольшом избытке по срав»
40,нению с простагландином.
Количество спирта или фенола должно составлять 1-50 моль на 1 моль простагландина Количество пиридина, вносимого после добавления спирта или фенола, состав4р 1ляет половину объема простагландина.
В качестве спиртов или фенолов мож-, но применять разные соединения, так как реакцию можно проводить с . любым
50 спиртом или фенолом независимо от химического строения последних. Могут с успехом применяться алкилспирты, замешенные алкилспирты, моноатомные спир: ты или фенолы.
55 Алкилспиртами могут быть прямоцепоч, ные или разветвленные спирты или циклоалкилспирты, содержащие до 14 углерод, ных атомов, например метиловый или тетрадециловый спирт, циклогексанол, I
60 циклогексилметиловый спирт; а фенолами433670
: фенол, Ф -нафтол, м-трифтормвтилфенол и т. п.
Предлагаемый способ можно применять для получения известных"простагландиновых эфиров. Кроме того, по изобретению ., получают новые простагландиновые эфиры, например простагландин А - 2-диме1 тиламиноэтиловый эфир; простагландин Š— 2,2,3,3,4,4,5,5-октафтор-1-пентиловый эфир, тетрагидрофурфуриловый эфир; простагландин Е -8-оксиокаи ловый эфир, Й -нафтиловыЯ эфир, -нафтиловый эфир, 5, 6, 7,8-тетрагидро-, -2-нафтиловый эфир, g (1,1,3,3-тетраметилбутил)-фениловьИ эфир, 2-пропоксиэтиловый эфир, феноксиэтиловый эфир, 2-диметиламиноэтиловый эфир, 2-диэтиламиноэтиловый эфир, 2-фталимидилэтиI ловый эфир, пиперониловый эфир, тетра1 гидрофурфуриловый эфир, 2-пиридиметило- вый эфир, 3-пиридиметиловый эфир, 4—
-оксибутиловый эфир, 6-оксигексиловый эфир, глицериновый моноэфир, 2,2,3,3,,4,4,5,5-октафтор-1-фениловый эфир, 8-карбоксиэтоксиэтиловый эфир, 9-карбоксиэтоксинониловый эфир, 11-карбоксиэтоксиундециловый эфир, простагландин ц Д, нафтиловый эфир, 9-карбоэтоксиниловый эфир.
Пример 1. 22,3 мг простагландина Е растворяют в 1 мп сухого метилен. 1 хлорида и к раствору добавляют 7 мг триэтиламина. Через 5 мин добавляют 8,3 мг пивалоилхлорида. Смесь перемешивают при комнатной температуре 10 мин и затем добавляют О, 18 мл 2,2,3,3,4,4, 5,5-октафтор-1-пентанола и 0,99 мл пиридина, после чего смесь перемешивают при комнатной температуре 1 час. Затем в реакционную смесь добавляют 25 мл этилаце- .. тата и смесь промывают водой. Этилацетатный слой отделяют и сушат над сульфатом натрия, потом упаривают в вакууме.
l Полученный концентрат очищают путем хроматографии на колонке с силикагелем.
Продукт сначала элюируют смесью циклогексана и этилацетата (2:1), а затем очи шают с помощью тонкослойной хроматографии, после чего элюируют смесью цикло-, гексана и этилацетата (1:1), получают
24,7 мг 2,2,3,3,4,4,5,5-октафтор-1-пен тилового эфира простагландина E с вы1 ходом 69% в виде бесцветных кристаллов. .
В ИК-спектре имеются полосы поглощения (хлороформный раствор) при 3380 (гидроксильная группа), 2920, 2850,1740 (эфир, кетон), 1450, 1230, 11 50, 1110 (С-З ), 1080 и 970 см 1
Вычйслено, %: С 52,81;, Н 6,38;
F26,73
С Н 0 F
25 36 5
Найдено, %: С 52,99: Н 6,49;
Р 26,58.
Пример 2. 44 мг простагландина
Е растворяют в 3 мл сухого метилен2 хлорида и к раствору добавляют 14 мг триэтиламина и 16,6 мг пивалоилхлорида. Смесь перемешивают при комнатной температуре в течение 10 мин и добавляют 400 мг октаметиленгликоля и 0,2 мл пиридина. Затем смесь перемешивают при комнатной температуре в течение 1 часа.
Реакционную смесь разбавляют 50 мл циклогексана и хроматографируют на колонке с 10 г силикагеля. Побочный продук и спирт элюируют смесью циклогексана и этилацетата сначала при соотношении 4:1, а затем при 3:2. Затем продукт элюируют этилацетатом и получают 35,3 мг 8-оксиоктилового эфира простагландина Е с выходом 58,6% в виде бесцветных кри25 сталлов.
В ИК-спектре имеются полосы поглощения при 3380 (гидроксильные группы)
2920, 2850, 1740.. (зфир, кетон), 1460, 1245, 1160, 1080 и 970 см 1-.
Вычислено, %: С 69,6; Н 10,07.
Найдено, %: С 69,84; Н 10,31.
Пример 3. 3 1,0 мг простагландина F2 растворяют в 3 мл сухого метиленхлорида. К раствору добавляют 5 9,73 мг триэтиламина и 11,6 мг пивалоилхлорида. После перемешивания смеси в течение 10 мин при комнатной температуре в нее добавляют 250 мг С(-нафтола и
0,13 мл пиридина. Далее смесь перемешива
4О ют при комнатной температуре еще 1 час.
Затем раствор разбавляют 50 мл циклогексана и, хроматографируют на колонке с 10 r силикагеля. Сначала элюируют побочный н последовательно смесью
4б циклогексана и этилацетата при соотноше» ниах 4:1, 3:2 и 1:.1. Затем продукт по- . следовательно элюируют смесью циклогек-. сана и этилацетата (2:3) и этилацетатом и получают 29,4 мг. Ч -нафтилового эфира простагландина с выходом 70% га в виде бесцветных кристаллов.
В ИКспектре имеются полосы поглощения (хлороформный раствор) при 3380 (гидроксильная группа), 29 20, 2850, 1750 (зфир), 1600, 15 10, 1460, 1260, 1130 и 970 см 1-.
Вычислено, %: С 74 97; Н 8,39
Найдено, %: С 75,08 /-/8,45.
60, .Пример 4. 36,8 мг, проста433670
7 гландина A растворяют в 1 мл сухого
1 метиленхлорида, затем к раствору добавляют 12,2 мг триэтиламина и 14,5 мг пиевлоилхлорида, после чего раствор пе-, ! 5 ремешивают при комнатной температуре в течение 10 мин, добавляют 0,2 мл ди метиламиноэтанола и 0,1 мл пиридина.
Реакционную смесь перемешивают еще в течение 1 часа при комнатной температу» ре, после чего ее растворяют в 50 мл этилацетата и промйвают водой. После обычной обработки сырой продукт очища- . ют с помощью хроматографии на колонке, состоящей из 5 г силикагеля, и получают при элюировании этилацетатом 27,2 мг 2-диметиламиноэтилового эфира простагландина А с выходом 61Уо. Получа10
1460 и 970 см
Вычислено, Уо.. С 70,72; Н 10,14;
N 3,44.
30 ют светло-желтое маслянистое вещество.
B ИК-спектре имеются полосы (хлороформный раствор) при 3450 (гидроксильная группа), 2920, 2760 (Я -СН ), 3
2850, 1735 (эфир), 1710 (кетон), 1585, 25
Найдено, %: С 70,96; Н 10,23;
ЯЗ, 18.
Пример 5. 33,4 мг простагландина А растворяют в 1 мл сухого метиленхлорида и к раствору добавляют 11,1 мг,триэтиламина и 13,2 мл пивалоилхлорида. Раствор перемешивают при комнатной температуре в течение 10 мин и добавляют к нему 0,2 мл н. децилового, спирта и 0,1 мл пиридина. Смесь перемешивают еще в течение 1 часа при комнатной температуре. Затем реакционную смесь разбавляют 50 мл циклогексана и хроматографируют на колонке с 10 г силикагеля. Спирт элюируют сначала циклогексаном, а затем смесью циклогексана и этилацетата (последовательно при соотношении
10:1 и 8:1). Получают 28,0 мг, н.децилового простагландина А с выходом
59% в виде светло-желтого маслянистого вещества.
В ИК-спектре имеются полосы при
3415 (гидроксильная группа), 2935, 2860, 1735 (эфир), 1710 (кетон), 1590, 1460 и 975 см 1
Вычислено, й: С 75,90; Н 10,62.
Найдено, й: С 75,72; Н 10,91.
Аналогично получают следующие эфиры, приведенные в таблице.
СО
Я о л
С0
CD
Л о
С0
00 о
СО
Io
CD
CD
CU о и
Ф
Ц ф ф х о
t
С0
CQ
С0 о
Я
СО
СО о о
0Q о ,о
СО Ф о о л о л(С о> о к
Ф к о
tQ о
СО
С0 о Ф о о
CU о о
fQ л»0
CD о С0
Оо
w C0
t о
<о
t» t
» CD
Оо Ф СО
»- о
° -1 о
С0
1-» о
СО л1 о с л о
tQ
С4 л о о сО л» о
О
С0 л о
Ч
CU
° -1 о о
tQ î л
СО
СО o
» (» CD о
С0
<о (С0
1-»
tQ
СО
t» t Ж о о
СО»О т» Я
„О) о о
t t т.» о
С0
СО
Гт-1 о оо
tQ C
CQ p
СЧ»
tQ
rr o
t Г» лй
» о
tQ
CQ
С4 оо
СО т т я лл
О»0
Яв
Л Щл оо
tQ 1 со О
Сц л оо
С0
"а ощ
n o
С ) лч о о
CD t
cu CD оо
e4 t»
О) (U 1-» оо
on с
С 3» оо
СЧ tQ
0) л я л оо
СО
n Gl
С ) т-» оо
СО »Q п
С ) т» со
СО»
Щ р
СО» о (О
СтЗ оо
СО ф
СО С4 сО л оо
О С0 Ф о о - к
t= o 4
»л о о о
Э ф
Ш Л
Ф о ж а а о
М
o o
Qj ф а л
О к к о
Л х о
f Ъ !
I ф
Ct
f»
t" д
I а
СО О к
СО Й т-» т-» ф и ф. д
Я у, о
В
И
Ш и о о
М
I о
Ф д
> о х к й:(СЧ 0) И
-9 ф
1 5 д
Ф о о ! о
0»
М о
И
М о о
Оо
С0 Щ
1-( о
t CD о
iQ n
С0 т-» (т-1 о
О со
tQ т-» сО л
СЧ о
on
Л С4
0) w
СЯ
- CD оо
Щ
СО »Q
СО т» оо о
СОЕ аО со л со t» с л сна оо оо
Я С0 hJ 1
CDw CDw ят» яЛ»
433670 оо
»О Щ що л1 оо
С С0
CD т.»
Я 1-» оо
0Q tQ щ с 4 т-»
Ф
A д
»ю
Ж
Ф ц ф f
Я с
ОО о
CQ я т.»
Оо
CQ сО С0
1-»
ОО 3
hl о О
С 3
С) 1-»
»О по
1 р л < оо
СО»
Я,-» оо
hl С0
О)
СЧ W
Oо oО Ф
tQ
nî, CD
О О
Щ що р, л» о<
О) л оо
Щ 3
СО (Ч с ) л»
СО
t cO
СО л О)
\»О)
1, л
С3 о л
Ol о»
Ю
° -4 о
С9
СО о» сО
ГО о
Я
CD (О
CO о» (О
СO
СЧ о
Г»
1-4 о
t л с сО
t о о л сГ о
СО о о. л (О л
С ) о сГ
О
ГО
t0 о
t о
С9
Я ч о
СМ
О
D) л1 о
С")
СЧ л о л1
Го л о
t0 Й л о
СО
"Г о (О с л1 о 1" 1 0
Я
„СО о
<о
t t
° -(Я о о
Ю ч о (О
Ч о
tQ л о (О Ф л1 о о
СО л о
С9
t л о со
l л о 1
Г
1- о Г
1-1 о
t о оо (q t
CD
CU
OoCD СО с о оо
ГО Гао я л1 о
ГО О
СО t
hl CD оо СО ао я л оо
o co л щ л
Иб
3e
ГО о
Г0 О
CO t
nl CD о, ао
CO Гe4 CD о
ГО О
CO t
Я О) о ао
СО t оГ CD оо
Я t
CD O я л4 оо я л
CD w
nl л оо
Cu t
CD O
Я 4 оо
nl Г
CD O с4 л оо
Я СО
CD СЧ я л оо
СО tO д) л л1 оо
О СО
С9 оо сО СО щ л л оо
O C0 Ф л щ л оо
СО (0 с9 л1 л1 оо сО СО аФ
YJ л
Э о
Ж
Гч
0) а о о о
g o
И м ф м
Ш й
) СЯ о55
Л 3
l е
Щ Ж
ГО
Ф л а а
4 о
1 м
Г Ъ
Ю
А
Ф
О
Ц ж
М о
Э
g о
3С
l о
Ф о
3С
Е
Ц f
Б ф о
3 ,Я 3
Дц о, g o
"о
1 ю
CV И 9
Ф о
oО
al O ) л(O ГО
ГО
CD л я л оа
t0 Al р) 1
1-1
М о (ч
Ъ
l о !
Л
Ц
СГ
С9 а о
Г- CO (О СО
o o
Я СО
CD CD о л
СО
1 л 1- е
СО
СМ
1- 1- а о са
t Г л
ОО ,0 О
СО CO Г с) оГ о оо
ДОСГСО
CD t-CDO
CD д 1-4
ОOOО
CO t cO C0. сопл л с 3 (О СО
CD Г
CD rt
СО CO
Оо
CO ГС CD оо л
Оо р) щ л
Ж о
Г.е Ф и а о
o o
О (g
Ш И
g (-в
ГО Ж
° ГО
l ф 1-4
СЧ 4 а
СЧ 1
433670
Ф
Щ и
К
3, Д Ф о
Ш
Ф
Ц оо я л4
0) w я л оо
СО ГО щ л
С9 1-1
М о
ГО О
Г - t CD оо
tQ cO
СО W я л
М о о 4
03
hl о
° «т т-!
CD о, ю-т (О
lQ о тт о Ф
CD (О (О
CD о1
° Ч
Я о
Ф4 Ф т о т-т
СЧ (О о о
CD
Я
Я
l о
Г о
CD
Я т-т о тт
t т-т о т-т
t т-т
tQ с0
С» т-4 о во
t t
СЧ CD о (О
oQ
СЯ оо
lQ СО
CQ тт
СЯ оо сЧ С0
CD O \1 т-(о
cv o
CD t
nl CD оа
tQ Ф
Фя
CQ т4 оо
O CQ т-1
Щ т-1
g o
< o
К 1 8 о 1
С9
iQ
О) (О о
СЯ о
CO
"1 г-1
tQ
Я
l т"т о
Я
oD
О1
Ж
% о
6
С
8 !
1 и
"О1 и б
lQ
03 tQ
О) l сц О)
lQ O т1 Я Ф т!1т
Я ° .4
Л о е
1 g о 33670
433670
Составитель В.Пастухова
Редакто;Г-3агpебелbнаsr Техред Н.Ханеева Корректор Т добровольская
Заказ (фО Изд. hh фЦ Тираж 506 Подписное
Ц11ИИПИ Государственного комитета Совета Министров СССР по делам иэобретений и открытий
Москва, 113035, Раушская наб., 4
Предприятие «Патепт», Москва, Г-59, Бережковская наб., 24
Предмет изобретения
1, Способ получения простагландиновых эфиров, о т л и ч а ю ш и и с я тем, что простагландин подвергают взаимодейст» вию с третичным амином, полученную соль подвергают реакции с пивалоилгалогенидом, образуюшийся при этом смешанный ангидрид кислоты подвергают взаимодействию . со спиртом или фенолом с последуюшим выделением целевого продукта известным способом.
2. Способ по п. 1, о т л и ч а ю шийс я тем, что применяемый в качестве исходного простагландин представляет собой
1 простагландин Е, простагландин Е
1 2 простагландин F, простагландин А
2g 1 или простагландин А
2
3. Способ по п. 1, о т л и ч аюшийс я тем, что в качестве третичного амина примейяют триметиламин, триэтиламин, трибутиламин, триоктиламин или пиридин.
4 С .Способ поп, 1, отличаюшийся тем, что взаимодействию с ангидридом кислоты подвергают спирт или фенол в количестве 1-50 моль на 1 мсаь
15 простаглайдина.