Способ получения 6-ацетокси-2,5,7,8-тетраметил-2-(4",8",12"- триметилтридецил)-хромана
Иллюстрации
Показать всеРеферат
ОП ИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДЕТЕДбСТВУ (61) Дополнительное к авт. свид-ву (22) Заявлено 27,06,7 3 (21) 1947 237/23-4 с присоединением заявки № (23) Приоритет (43) Опубликовано 05.01.77 Бюллетень № 1 (4б) Дата опубликования описания27.04.77
Союз Советских
Социалистических
Республик (11) 4607 23 (51) М. Кл е
С 07 D 7/22
Государствениый коиитет
Совета Мииистров СССР по делаы иэооретений и открытий (53) УДК547.814.1: .577. 161.3(088.8) (72) Авторы P. П. Евстигнеева, И. К. Сарычева, М. С. Байнова и Г. И. Базилевская изобретения (71) Заявитель
Московский ордена Трудового Красного Знамени институт тонкой химической технологии им. M. В, Ломоносова (54) СПОСОБ ПОЛУЧЕНИЯ 6-АЦЕТОКСИ-2,5,7,8-ТЕТРАМЕТИЛ-2 -(4, 8, 1 2 -ТРИМЕТИЛТРИДЕЦИЛ) -ХРОМАНА
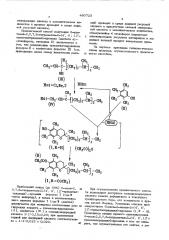
СН сн,соо
СНд (, >a и
СН Цсв,),-cH) -cH з з
Изобретение относится к усовершенствованному способу получения 6-ацетокси-2,5, 7, 8-тетраметил-2-(4, 8, 1 2 -триметилтридецил)-хромана, ацетата оС -токоферола (витамина Е) формулы
Известен способ получения ацетата <<в
-токоферола (витамина Е) конденсацией и триметилгидрохинона с изофитолом в присутствии катализатора в среде органического растворителя; затем образующийся С -токоферол после промывки и отгонки растворителя ацетилируют уксусным ангидридом и 20 выделяют целевой продукт известными приемами.
В качестве катализатора используют кислоты Льюиса, например хлористый цинк, хлористьтй алюминий, трехфтористый бор в 25 свободном состоянии или в виде комплекса, например диэфирата.
При использовании протонных кислот, например серной, фосфорной и других, С-токоферол не образуется, только при совместном применении протонных кислот с кислотами Льюиса в качестве катализатора получают С-токоферол почти с ".оличественным выходом.
Указанные катализаторы способны дезактивироваться под влиянием влаги (А1 С1
Zn_#_е ), имеют непостоянный состав(АРСР), легко воспламеняются (BFp 2/СеН (аО). Соединения трехфтористого бора и фтористого водорода — одного из продуктов их гидролиза, относительно мало доступны и токсичны. Используются легко воспламеняющиеся растворители, например петролейный эфир, тетралин, бензол; трудно удалять не всту» пивший в реакцию триметилгидрохинон из-за образования стойких эмульсий при промывке водным раствором едкого кали.
С целью упрощения процесса и повышения чистоты продукта согласно изобретению в качестве катализатора используют сильнук
460723 ций) проводят в среде ледяной уксусной кислоты в присутствии сильной минеральной кислоты в каталитическом количестве, образующийся С токоферол подвергают ацетилированию уксусным ангидридом и выделяют целевой продукт известными приемами.
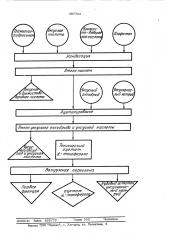
На чертеже приведена технологическая схема процесса, осуществляемого предлага10 емым способом.
© З СН3
I 1 си =Си-С-((CH )g-CHg -CHg
ОН (ш)
На1 =Cl,Вг,3
ННО1 сн
На 1-СН1-CH=C-(0Н
СН с (( (I,R=H) BC 0) R (R) сн,со
СН
О
С 3 Н3
СН М вЂ” СН- -СНз
СН
3 (i, R =Ñ0CH,) Наибольший выход (до 98%) 6-окси-2, so
5,7,8-тетраметил-2-(4, 8, 12 «триметилтридецил) -хромана формулы Х (где и
-атом водорода), а также и соответствующего ацетата формулы Х (где Я -ацетил) достигается при молярном соотношении реа- 55 гирующих веществ - триметилгидрохинона (Il ), изофитола (II< ) и галоидоводородной кислоты 1: 1 0,15-0,20; при применении серной или фосфорной кислоты соответственно - 1:1 0,015 - 0,020. 60 минеральную кислоту в каталитическом количестве и процесс проводят в среде ледяной уксусной кислоты.
Предлагаемый способ получения 6-ацетокси-2,5,7,8-тетраметил-2-(4, 8, 12триметилтридецил)-хромана (ацетата aC—
-тоноферола, витамина Е) заключается в том, что конденсацию триметилгидрохинона формулы II с изофитолом формулы III (см. приводимую далее схему химических реакПри осуществлении предлагаемого способа используют доступные галоидоводородные кислоты вместо дефицитного и токсичного трехфтористого бора, его комплексов и других кислот Льюиса. Устранена очистка промежуточного 6-окси-2-метил-2-(4, 8, 12 -триметилтридецил)-хромана (1, R = Н-), Проводится стадия прямого ацетилирования
6-окси-2,5,7,8-тетраметил-2-(4, 8, 12 триметилтридецил)-хромана в том же аппарате, где осуществляется его синтез, в реПример 2. Получение 6-ацетокси-2,5,7,8 гетраметил-2(4,8,12 гриметилтридецил)-хромана проводят в тех же условиях при использовании в качестве катализатора вмесго бромистоводородной кислоты йодистоводородной (А = 1,56) и м 20 соляной (о. = 1,19) кислот. Выходы в тех же условиях соответственно 98 и 80%.
Пример 3. Получение 6-ацетоеси-2, 5,7,8-тетраметил-2-(4, 8, 12 триметиатридецил)-хромана проводят в условиях предыдуших опытов при использовании в качестве катализатора вместо бромистоводородной кислоты серной (d," = 1,83) в количестве 0,02 моль йа молярное соотнс шение исходных веществ. Выход в тех же условиях 92-94%.
1. Способ получения 6-ацетокси-2,5,7, 8-тетраметил-2-(4, 8, 12 -триметилтри
Ъ > децил) -хромана конденсацией триметилгидрохинона с изофитолом. в присутствии катализатора в среде органического раствори» теля с последующим ацетилированием продукта конденсации уксусным ангидридом и очисткой целевого продукта известными приемами, отличающийся тем, что, с целью упрощения процесса и повышения чистоты продукта в качестве катализатора используют сильную минеральную кислоту в каталитическом количестве и в качестве органического растворителя используют ледяную уксусную кислоту, 2. Способ по п. 1, о т л и ч а ю ш и йс я тем, что триметщиидрохинон, изофитол и галоидводороъую кислоту берут в молярном соотношении 1:1.0,15-0,20.
3. Способ по и. 1, о т л и ч а ю щ и йс я тем, что триметилгидрохинон, изофитол серную или фосфорную кислоту берут в молярном соотношении 1:1:0,015-0,020, 460723 зультате чего количество технологических стадий сокращено с 17 до 5. Уменьшено общее время процесса получения 6-ацетокси-2,5,7,8-тетраметил-2-(4, 8, 12 гриметилтридецил)-хромана, исходя из триметилгидрохинона (П ) и изофитола (Ш ) в среднем с 30 до 10 ч. Огне- и взрывоопасные растворители заменены уксусной кислотой. Токсичные вещества заменены менее вредными. Практически полностью
10 используются применяемые реагенты, в результате почти полностью исключены отходы производства, Пример 1. К смеси 45,6 г (0,3 моль) триметилгидрохинона, 90 мл ледяной уксусной и 10,7 г (0,05 моль) бромистоводородной (d<о = 1,37) кислот при перемешивании в токе азота при 75-80ОС прибавляют в течение 1 ч 89,0г (0,3 моль) изофитола. Реакционную массу перемешива20 ют в этих условиях в течение 2 ч, после чего отгоняют 60 мл кислоты. Полученные кислоты используют повторно в конденсации после добавления рассчитанного количества уксусного ангидрида и бромистоводородной кислоты. К остатку добавляют 61,2 г (0,6 моль) уксусного ангидрида и 1,0 г уксусного натрия и проводят ацетилирование в течение 2 ч при 120 С. Уксусную о кислоту и уксусный ангидрид удаляют в ва- 30 кууме (10-15 мм рт.ст.). Полученный технический ацетат о(гокоферола фракционируют. Выход 133,3 г (94%); т.кип. 205208 С (0,3 мм pr.cT.); lq 1,49851,4972; Й f 0,60 (нейтральная окись алк zs миния, П степень активности; система: петролейный эфир — эфир 10,1), 0,55 (силуфол UV 254, бензол); УФ вЂ” спектр: иск(в спирте) 285 мм (Е 1 <„, 4246; 0,01 /-ный раствор) . 40
Найдено, %: С 78,66; Н 11,07.
Сз Н. Оз
Вычислено, %: С 78,76: Н 11,09
Формула изобретения