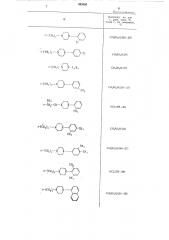
Способ получения фенилимидазолидинонов
Иллюстрации
Показать всеРеферат
1 Щ1 « н!-Т». к ИИЧЬЖ
ОП ИСАНИ1:
ИЗОБРЕТЕНИЯ и 492085
Союэ Советских
Социалистических
Республик
К ПАТЕНТУ (61) Дополнительный к патенту № (51) М. Кл. С 07с1 49/00 (22) Заявлено 14.11.73 (21) 1791532/1970171/
/23-4 (23) Приоритет 31.05.72 (32) 07.06.71 (31) А 4920/71 (33) Австрия
Опубликовано 15.11.75. Бюллетень ¹ 42
to уаарстоеккый комитет
Совета Иивистров СССР по делам изобретеиий и открытий (53) УДК 547.781.785 (088.8) Дата опубликования описания 09.06.76 (72) Авторы изобретения
Иностранцы
Антон Ментруп, Эрнст-Отто Рент, Курт Шромм и Петер Даннеберг (ФРГ) Иностранная фирма
«К. Х. Берингер Зон» (ФРГ) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ФЕНИЛИМИДАЗОЛИДИНОНОВ причем А — радикал
В, / — К .и 07ll .и Я 2 ч 1 „.-С=„ /
Сп С11, — CHR — Q — А, — CHR2 — А и — Π— СНК2 — CHR — Q — А
Изобретение относится к способу получения новых соединений — фенилимидазолидинонов, обладающих физиологической активностью.
Применение широко известного способа синтеза имидазолидонов на основе этилендиаминов позволило синтезировать новые соединения, обладающие ценными свойствами. Описываемый способ получения фенилимидазолидинонов формулы 1 где R означает атом водорода, низшую алкильную или алкоксигруппу или атом галогена, R — одну из групп в мета- или пара-положении
Q означает неразветвленную или разветвленную алкиленовую цепь с 1 — 4 атомами углерода, R> — атом водорода, низшую алкоксигруппу или группу — Π— СΠ— Rs, R2 — атом водорода или метильную группу, R3 и R4 могуч быть одинаковыми или различными и означают атом водорода, низшую алкильную или алкоксигруппу, атом галогена или трифторметильную группу или вместе образуют приконденсиронанное алифатическое или ароматическое пяти- или шестичленное
20 кольцо, Ко — низшую алкильную группу, которая может быть замещена галогеном, или алкоксиили диалкиламиногруппу, Z — ароматическое кольцо с 1 — 2 гетероато25 мами, к которому может быть приконденсировано и бензольное кольцо, 11 3
Я вЂ” хл нх!
11Н СН вЂ” R
Нг СН2
CH2 — снг сн
Снз
/ 1 1
Снг !
Снг Снг
60
СН, R" — атом водорода или низший неразветвленный или разветвеленный алкильный, алкенильный, алкинильный или диалкилампноалкильный радикал или аралкильный радикал, заключающийся в том что производные этилендиамина формулы II где R, R, R" имеют указанные значения, подвергают циклизации путем взаимодействия с производными угольной кислоты или с металлическими цианатами в присутствии кислот. В качестве производных угольной кислоты используют фосген, сложные эфиры хлоругольной кислоты, сложные эфиры угольной кислоты, N,N -карбонилдиимидазол, мочевину. Вместо аминов формулы II можно применять и такие соединения, как карбаматы, мочевины и хлориды карбаминовой кислоты.
Если соединения согласно изобретению образуют рацематы или диастереомерные антиподные пары, они обычным методом могут быть разделены на диастереомерные рацематы или на отдельные оптические антиподы.
Исходные продукты частично описаны или могут быть получены обычными методами синтеза.
Пример 1. 15,5 г (0,05 моля) 1- (2- (4-аминофенил) -этил) -4-(2 - этилфенил) — пиперазина в 85 мл ледяной уксусной кислоты смешивают с 1,6 г параформальдегида и раствором
4,1 г цианида калия в 7 мл воды при 15—
20 С и выдерживают в течение ночи при комнатной температуре, в результате чего реакция заканчивается. Образовавшийся продукт имеет т. пл. 137 — 138 С и его в среде метанола с PtO> в качестве катализатора гидрируют и в бензоле смешивают с указанным количеством N,N - карбонилдиимидазола, растворенного в тетрагидрофуране. Смесь в течение ночи оставляют стоять при комнатной температуре, затем в течение 2 ч кипятят с обратным холодильником и образовавшийся продукт выделяют в форме основания (т. пл. 178—
181 С). Аналогично получают соединения формулы I, где R означает водород, à R имеет значения
> /
21-СН2 СН,— Ч Х вЂ” С Н:
2 2 Ь
/1- О- СН2 — CH 2— N Ж /
Пример 2. 1-(4 — Имидазолидинон - (2)илфенилметил) -4-фенилпиперазин.
13,35 г 1-фенил-4- (4-аминобензил) -пиперазина в 85 мл ледяной уксусной кислоты смешивают с 1,6 г параформальдегида и раствором 4,1 г цианида калия 1в 7 мл воды прои 15—
20 С. После многочасового стояния при комнатной температуре образуется цианмевила1миновое соединение, которое гидрируют в метаноле над PtO>. Получен1ное производ1ное этилендиамина растворяют в бензоле и смешивают с рассчитанным количеством N,N -карбонилдиимидазола, растворенного в тетрагидрофуране. Оставляют стоять в течение нескольких часов при комнатной температуре и затем кипятят в течение 2 ч с обратным холодильником. Получают указанное соединение с т. пл.
218 С (из этанола) . Соответственно примеру 2 получают следующие соединения: — Х Х-СН, 11 M— - H
I 1 / б
СН СН2 — с, Х NCHz х ИИ
О ;-СН, С1 3
C H сн,- сн, П р " м е р 3. 1 - (4 - Имидазолидинон- (2)илфенэтил) -4- (2-пиридил) -пиперазин.
14,1 г 1-(4 - аминофенэтил)-4-(2 - пиридил)пиперазина в 85 мл ледяной уксусной кислоты
65 смешивают с 1,6 г параформальдегида и с
492085
Щ-CH — 3 К
/ /
15
0
С
11Х Х
С11 СИг
Кислота/т. пл. или т. разл. соли, . С и/или т. пл, основания, С
П-(CHã) — N
СНЭSO H/211
195
СНзSOçН/191
223
С21 раствором 4,1 г цианида калия в 7 мл воды при 15 — 20 С и оставляют стоять в течение ночи при комнатной температуре. При этом реакция заканчивается, Образовавшееся цианэтиламиносоединение в среде метанола в присутствии Р10я в качестве катализатор а гидрируют в соответствующее производное этилендиамина. Это производное в бензоле смешивают с рассчитанным количеством
N,N -карбонилдиимидазола, растворенного в тетрагидрофуране. После стояния в течение ночи при комнатной температуре в течение
2 ч кипятят еще с обратным холодильником и полученное соединение
/W
11й и С11 011,- — N Х
СН вЂ” Сц, . / изолируют как основание; т. пл. 200 С. Дигидрохлорид основания имеет т. пл. 299 — 302 С.
Аналогично примерам 1 — 3 получают следующие соединения:
1l-q N 3 С,,-С11,-С11,-h;
ѻ,— 011, 11
1-(4 - Импдазолпдппон - (2) - илфенэтил).
4-(3 - хлорфеннл)-пиперазин.
1- (4 - Имидазолпдпнон - (2) - илфенэтил)25 4- (2-хинолил) -пиперазпн.
1-(4-(3 - Метилпмидазолпдинон - (2) -пл)фенэтил) -4- (2 - метилфенил) -пипер азин.
1- (4- (3 - и - Бутилимидазолидинон- (2) -ил)фенэтил) - 4 - (2-метилфснил)-пиперазин.
30 1 (1- (4 - Имидазолидпнон - (2) — илфенил)1-ацетплоксиэтил)-4- (2 - метплфенил) — пиперазин.
1-(1-(4 - Импдазолидннон - (2) - илфенил)1- метилкарбамоплоксиэтил)-4- (2 - мстплфе35 нил)-пиперазин.
1- (1- (4 - Имидазолидинон - (2) - илфенил)1-этоксиэтил) - 4 - (2 - метилфенил)-пиперазин. 10 Аналогично получают соединения формулы 1, в которых R означает водород. значения Г пригедепы в таблице, 492085
Продолжение
С Нз$0зН/263 — 265
СНз$0зН/241
СНзSO3Н/271
СНзSOçН/216 — 217
Н С I/299 — 301
СНзSOзН/325
СНз$0зН/269 — 271
НСI/278 — 280
СНз$0зН/235 — 236
)-1CI-I,),— X X
/ \ l
С1
Л(СНг), М Ж С1
1 /
/ (С112)»
Кислота/т, пл, или т. разл. соли, С и/или т, пл. основания, СС
492085
Rf
СН-а
СН, На (\ и (СНя), К Я
П-(СНг) 3 3 3
I \
-Сн,-сн—
\ ./
Сн, СН СН-- N
1 CHъ
à — С н — Си — м N г
Сн, k
Прополжение
Кислота/т. пл, или т. разл. соли, С и/или т. пл. основания, сс
СНЗБОЗН/295 — 298
С Н зSOÇH/255 — 256
С1138ОЗH/17о
СНзSOзН 202
С НзSOç Н/248 — 250
СНЗЯОЗН/236 — 238
СН SOÇÍ) 300 301
СНзSOçÍ/218
СНЗЯОЗН/275 — 79
СН3803Н/270
492О85
Продолжение
Кислота/т. пл. или т. разл. соли, С и/или т. пл. основания, с С
ОСИ с, ИХ Х
1 112 11 2
256 †2
С11 С11, — Х
/ \
\ l
С2Нв где А означает радикал
В
>i >r C > >
CH С11-, 35
Аналогично получают приведенные ниже соединения.
Сульфонат метана 1-(4-(3 - бензилимидазолидинон-(2) -ил) - фенэтил) - 4 - (2) - метилфенил)-пиперазина, т. пл. 194 †1 С.
Дигидрохлорид 1- (4- (3- (2 — диметиламиноэтил) -имидазолидинон - 2) — ил) - фенэтил) -4(2 - метилфенил) - пиперазина, т. пл. 308 С (разложение) .
Дигидрохлорид 1-(4-(3-(3 - диметиламинопропил) — имидазолидинон - (2) -ил) -фенэтил)—
4-(2 - метилфенил)-пиперазина, т. пл. 309 С (разложение) .
Гидрохлорид 1- (4- (3-этилимидазолидинон(2) -ил) -фенэтил) -4- (2 - метилфенил) - пиперазина, т. пл. 286 С.
Гидрохлорид 1- (4- (3 - аллилимидазолидинон- (2) -ил) - фенэтил) - 4 - (2 - метилфенил)пиперазина, т. пл. 287 С (разложение).
Сульфонат метана 1-(4-(3 - пропаргилимидазолидинон- (2) -ил) -фенэтил) - 4 - фенилпиперазина, т. пл. 232» — 233 С.
Сульфат 1- (1- (4 - имидазолидинон - (2) -илфенил) -1-н-бутилкарбамоилоксиэтил) - 4 - (2метилфенил)-пиперазина, т. пл. 127 С (разложение) .
Формула изобретения
Способ получения фенилимидазолидинонов формулы I где R означает водород, низшую алкильную или алкоксигруппу или атом галогена, R — одну из групп в мета- или пара-положении — CHR, — Q — А, — CHR,— А и — Π— CHRIS — CHR, — q — А, Q — неразветвленную или разветвленную алкиленовую цепь с 1 — 4 атомами углерода, R> — атом водорода, низшую алкоксигруппу или группу — Π— СΠ— Яв, R — атом водорода или метильную группу, Ra и R4 могут быть одинаковыми или различными и означают атом водорода, низшую алкильную или алкоксигруппу, атом галогена или трифторметильную группу или вместе образуют приконденсированное алифатическое или ароматическое пяти- или шестичленное кольцо, Кв — низшую алкильную группу, которая
20 может быть замещена галогеном, или алкокси-, или диалкиламиногруппу, Z — ароматическое кольцо с 1 — 2 гетероатомами, к которому может быть приконденсировано и бензольное кольцо, 25 R" — атом водорода или низший неразветвленный или разветвленный алкильный, алкенильный, алкинильный, диалкиламиноалкильный или аралкильный радикал, отличающийся тем, что производные
30 этилендиамина общей формулы где R, R и R" имеют указанные значения, подвергают циклизации путем взаимодейст40 вия с производными угольной кислоты или с металлическим цианатом в присутствии кислоты, с последующим выделением целевого продукта в виде основания, соли и/или диастереомеров или оптических антиподов изве45 стными приемами,