Способ получения сердечных гликозидов
Иллюстрации
Показать всеРеферат
тена. е,(,д
ОПИСАНИЕ
ИЗОБРЕТЕНИЯ
К йАТЕНТУ
Союз Советских
Социалистических
Республик (i) 504494 (61) (ополнительный к патенту— (22) Заявлено" 4.09.73 (2)) 1962276/23-4 (23) Приоритет — (32) 18.09.72 (31) P 2245726. 7 (33) ФРГ (43) Опубликовано 25.02.76.Бюллетень № 7 (45) Дата опубликования описания 02.04.76 (51) M. Кл.
С 07 J 9/00
Государственный комитет
Совета Министров СССР оо делам изобретений н открытий (53) УДК
547. 689. 6 (088.8) Иностранцы
Вольфганг Эберлейн, Иоахим Хейдер (ФРГ), Вилли Дидерен (Нидерланды) и Вальтер Кобингер (Австрия) (72) Aвторы изобретения
Иностранная фирма
Лр. Карл Томе ГмбХ" (ФРГ) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ СЕРДЕЧНЫХ ГЛИКОЗИДОВ
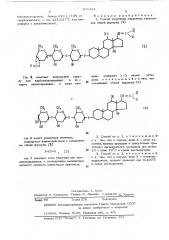
Н0 СН=С Н
СН
CH ан
Предлагается способ получения новых где R означает нитрильную группу или карболкоксирадикал, причем алкоксирадикал может содержать 1-3 атома углерода, Соединения указанной формулы обладают ценными фармакологическими свойствами.
Способ получения новых сердечных гликозидов обшей формулы 1 основан на изсердечных гликозидов обшей формулы (1) вестной реакций карбонилироваиия производ2О ных углеводов, входяших в состав названных соединений, которую однако, не применяли ранее для синтеза таких соединений.
Предлагаемое соединение получают вза25 нмодействием соединения обшей формулы(2) R
НО СН= C
CH.
СН
CH (2) О
ЮН OH где Р имеет укаэанные значения, с соединением обшей формулы(3)
Х-CO-X (3 ) 15 где Х означает атом галогена или имидазолидрадикал, с .последуюшим выделением целевого соединения известными приемами.
Процесс обычно ведут в растворителе, например в простом эфире, диоксане, тетра- 20 гидрофуране, метиленхлориде, дихлорэтане или диметилформамиде, Если Х означает галоген,,то взаимодействие предпочтительно проводить в присутст- вии третичного органического основания, И такого как триэтиламин или пиридин, кото-рое одновременно может служить растворителем, и с избытком соединения обшей формулы 3 при температурах между — 601 и температурой кипения применяемого растворителя, предпочтительно при мввус 20о
v плюс 20 С.
Если Х - имидазолидрадикал, то взаимодействие проводят предпочтительно с одним мольэквивалентом соединения обшей формуо лы 3 при 0-100 С.
Пример 1. 3-(3/5-Тридигитоксозил-12 Р, 14 Р -диокси-5Р -андростан-17 — и! !!!
-ил) акрилнитрил-3, 4 -карбонат.
К раствору 1,5 г (1,9 ммоль) 3-(3P—
-тридигитоксозил-12 .,,4 Р -диокси-.5 P—
-андростан-17Р -ил)-акрилнитрила в 75 мл пиридина, охлаждая льдом, каплями добавляют 18 мл 10%-ного раствора фосгена в толуоле. В течение 1 час смесь размешивают 4á о о при О С и затем вливают ее в 200 мл ледяной воды. Экстрагируют несколько раз хлороформом, промывают соединенные органические вытяжки последовательно разбав ленной солянои кислотой, насышенным раствором бикарбоната натрия и водой, сушат сульфатом натрия и упаривают досуха на роторном испарителе. Хроматографией на
200 г активированного силикагеля в системе хлороформ-ацетон (6: 1 - 2: 1) получают 530 мл (25,6%. от теоретического) целевого продукта, после двукратной перекристаллизации иэ хлороформа с циклогексаном), т. пл. 250-252 С, R(:0,45 (атил,о
-М ацетат). ИК-спектр (твердый в.КВЗ),. см: 3400-.3550 (ОН), 2230 (CH), 1810 (харбонат), 1 6 25 (-С = С-), !
Пример 2. 3-(3P -Тридигитоксоэил-12Р, 14ф -диокси-5 j3 -андростан-17P—
И! !!!
-ил)акрилнитрил-3, 4 -карбонат.
1,5 г (1,9 ммоль) 3-(3P -тридигитоксоэил}-12Р, 14Р -диокси-5Р -андростан-17Р-ил)акрилнитрила и 0,32 г (1,9 ммоль)
N,М -карбонилдиимидаэола в 50 мл абсолютного"тетрагидрофурана кипятят 2 час с обратным холодильником. Разбавляют 100 мл воды и .экстрагируют несколько раэ хлороформом. Соединенные органические экстракты промывают водой, сушат над сульфа том натрия и упаривают досуха в вакууме.
Хроматографией на 350 r активированного силикагеля в системе хлороформ — ацетон (6: 1 — 2: 1) получают кроме 0,7 г неизменного исходного материала 310 мг (15% от теоретического) необходимого целевого о продукта, т. пл. 250-252 С (из хлороформа с цивлогексаном).
Пример 3. 3, 4 " -Карбонат метилового эфира 3-.(3 Р-тридигитоксозил-12/, 14/3 -диокси-5 j3-андростан-17Р -ил) акриловой кислоты.
Соединение синтезируют, как описано в примере 1 1,5 г (1,9 ммоль) метилового эфира 3-(3/3 -тридигитоксозил-12Р, 14) —
-диокси-5ф -андростан-17Р -ил).акриловой кислоты и 18 мл 10%-ного раствора фосгена в толуоле. После перекристаллиэации
} из хлороформа с циклогексаном получают
620 мг (30% от теоретического) чистого о соединения, т. пл. 225-227 С, Pf 0,45 (этилацетат), ИК-спектр (твердый в КВ2 ) см;3550-3200(OH), 1810 (карбонатС=- О), 1715 (сложный эфир -СО), 1630 (-С = С-)
Пример 4. 3,4 " -Карбонат метилового афира 3-(3P,-тридигитоксозил-12, 14Р -диокси-5Р -андростан-17P—
-ил)акриловой кислоты.
Соединение получают, как описано в примере 2; из 1,5 г (1,9 ммоль) метилового эфира 3-(Зф -тридигитоксоэил-12, 14P -
-диокси-5 j3 -андростан-1 7 Р -ил) акриловой
I кислоты и 0,32 г (1,9 ммоль) И, Й-кар504 !8 !
Но СН= с R д
СН сн, О
ОН
О =C-О
Он сн= с Н
СН сн (2) 0Н
Х-Со-Х
) Составитель A. Кост
РедактоР О. КУзнецова .ТехРед М. Ликович КоРРектоР В Микита
Заказ 66
Подписное
Тираж 576
БНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий
113035, Москва, K-35, Раушская наб., д. 4/5
Филиал ППП Патент", г. Ужгород, ул. Гагарина, 101 бонилдиимидаэола. Выход 210 г (10% оТ о теоретического, т. пл. 225-227 С (из хлороформа с циклогексаном) .
Где К означает нитрильную груп.пу или карболкоксирадикал, в ко — . тором алкоксирадикал, в свою очегде 1с имеет указанные значения, подвергают взаимодействию с соединением общей формулы t3) где Х означает атом галогена или имидазолидрадикал, с последующим выделением целевого продукта известными прйемами.
Формула изобретения
1. Способ получения сердечных гликоэи« дов обшей формулы (1) редь, содержит 1 — 3 атома. углерода, о т л и ч а ю ш и и с я тем, что соединение обшей формулы (2) 2. Способпоп. 1, отличающи йс я тем, что в случае, если Х вЂ” атом галогена, процесс проводят в присутствии третичного органического основания при минус о
20 - плюс 20 С в среде растворителя.
3. Способ по и. 1, о т л и ч а ю щ и йс я тем, что в случае, если Х вЂ” имидазолидрадикал, процесс проводят прп 0-100 С в среде растворителя.