Способ получения производных простановой кислоты
Иллюстрации
Показать всеРеферат
О П И С А Н И Е „„ бзовзт
ИЗОБРЕТЕН ИЯ
Союз Советских
Социалистических
Республик 4 ПАТЕНТУ. (61) Дополнительный к патенту(22) Заявлено 03.09.71 (21) 1692114/04 (51) M. Кл.о
С 07 С 61/06
С 07 С 69/74 (23) Приоритет — р2) 04.09. 70;
30. 1 1.70 (З)) 7032255;
Ф анция
7 042924 () Франция (43) Опубликовано30.09.76.Бюллетень № 36
Государстоеииый комитет
Совета Миииотроа СССР оо делам изабретеиий и открытий (53) УДК
547.458.82.07 (088,8) (45} Дата опубликования описания 21.02,77
Иностранцы
Жак Мартель, Жан Бюандья и Эдмон Тороманоф (Франция) (72) Авторы изобретения
Иностранная фирма
Руссель-Уклаф (франция) (71) Заявитель
Я )— (P4) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ
ПРОСТА?! ОВОЙ КИСЛОТЫ
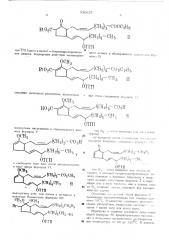
О (сн,},— соотг, сн,),-сн, где К означает атом водорода или метилт единения формулы ll т ная группа, заключаюшийся в том, что со-! 25
Изобретение относится к новому способу получения производных простановой кислоты группы простагландина А, обладаюших вы сокой физиологической активностью.
Ь
Известен способ получения простагландина А путем обезвоживания простагландина Е под -ействием уксусйой кислоты. Однако по и =тному способу целевой продукт получают низким выходом, так как исход- lp
1ный простагландин E получают либо путем
) трудоемкогс пооцесса экстракции сытья жи вотного происхождения, либо путем много.стадийного син-.еза.
Uem ю предлагаемого способа является устранение указанных недостатков и упрошение процесса.
В соответствии с изобретением описывается способ получения производных проста,иовой кислоты формулы I ззосз (CH J) — COOC2Hg
И
Где Тю Px (здесь и далее) тетрагидропираниль ег н щего агента и образующееся совал ":.. В,,с,- as защита, подвергают дейс-.вию метилирую- мульа а! а
Оеа В . ".! Е фо;-СН Н
1Р, »
Qyzq омылйвт щелоччым реагентом, получаемое при этом соединение Жоомул ы 1. подвергают хагреван.аю и образующуюся кис- лоту формулы У
ГДЕ Я =- В«-О vi ВОДОРОД"- а.,7(И . - и" -a-ë гpy! IIIa, р4 (СНpI СО дН
ИЗ КОТОроГО ПОСЛЕ О .ЕК-".=- -П1-
Водорода получьнот соедин=-н := ФО", - - :"-у ; ,),— CHg
ОТГ11
В свободном Виде или, после метилирования, в виде эфира формулы У1 га а дЕ Г» -„- ВТОМ ВОдОреда И IH,:аЕ-. Па-.:.:а: группа, В ко ВОрОй етрагидропирйкк. аьнvþ BaUIHTp снима;от с помощью гидролиза и полу- чают цепсвое cF F! -..HCHH формулы 7 В виде эфира или В ваде .испо-.ы,. HJIH В случае, когда 8, означае;,.;етнл, омыляют эту слаожноэфирную групп-,.
Омыление сс ;и:-:.=.:!Hs 3ol åé фо-мулы !!. . производят предпочтительно пои темпера —,;. о
1 1 ниже 50 С. В качестве щелочног реа:-:.,-::= можно употреблять гидрос;IcI ще-.. Очно : талла - едкий натр IJIH едкое кали.
Обработку В горячем состоянии сое.;"..=;ения обшей форму:IbI 1 У предпочтительно про:.IçI спят в безводном органическом нзствори-еле при температуре QT 5О дО 1 20 С. В кйчестОИЛ подвергают дейс Вию брома в метано ае и получают бромкеталь формулы УИ
CH-„0 (>vH ((н gI (.О,я, Н ),IC Н „y)а
Стадия А. 6-(< -тетрагидропиранилокси)-1-хлор-4-гексин. о
Охлаждают до -35 С 150 сьмэ аммиака, прибавляют 0,77 г лития в присутствии небольшого количества азотнокислого окисного железа в качестве катализатора и оставля-! ют!в контакте в течение одного часа, при .бавляют при перемешивании 14 г пиранило,вого эфира пропаргилового спирта в растворе
50 смэ и продолжают перемешивание в те.чение двух часов. Затем прибавляют раствор
:15,7 г хлорбромпропана в 25 смз эфира и перемешивают в течение 3 час при -35 С о
1 нейтрализуют прибавлением 5,25 г хлорис того аммония, упаривают аммиак, обрабаты вают остаток эфиром, насыщенным водой, а
:,затем водой, экстрагируют эфиром, промы;вают эфирные слои водой, су-щат их и упари вают дОсуха. I10луча1ОТ 1 3 Г 6-(Д. -TeTpB1
; гидропиранилокси)-1-хлор-6-гекспн в виде бесцветного жидкого продукта, растворимого
1 ! в спиртах, эфире бензоле и хлороформе, ки1
1пящего при 100 С (0,6 мм рт.ст,); и хо = 1,485.
Исходный продукт — пираниловий эфир
1пропаргиловог0 спирта получают Описанным
1способом.
Стадия Б. Нитрил-7-(f1. -тетрагидропиранилокси)-5-гептина.
Вводят 34,174 г 6-(ф. -тетраг1н1ропиранилокси)-1-хлор-4-гекснна в 75 смэ диметилформамида, прибавляют водный раствор
13,6 г циа1п1стого калия и перемешивают реакционную смесь B течение восьми часов
О при 80 С, затем охлаждают, прибавляют
100 см воды н экстрагнруют эфиром, зфирный слой промывают водой до нейтральности промывных ВОд, cvtitGT над сернокислым маг нием и упарива1ст досуха, при этом получают
23 г HHTpHllB 7-{ 4 -тетрагидропираннлокси)-5-гептина в виде. бесцветной жидкости, растворимой в спиртах, эфире, бензоле и хлороформе, нерастворимой в воде, кипящей при
115 С (0,1 мм рт.ст.); 11 = j,481
I в
ИК-спектр показывает присутствие тетрагидропиранилокси И-Сй групп.
Стадия В, 7-(Д,-тетрагидропиранплокси)-5-гептиновая кислота групл.
Смесь, состоящую из 22,5 г норина 7-(<А, -тетрагидрспнранилокси)-5-гептила, 9,5 r едкого кали и 120 см 50" -но1О этао .нала нагрева1от при 80 С в Te tet«fe 18 час в атмосфере азота и при перемеш11ва111111, затем удаляют зтанол в вакууме, приба IRKxt
G *, г.
50 см води, Охлаждают, прибавляют 1 10см эфира и доводят рП смеси до -1 пр111:1в;«.нием ледяной 0,5 н. соляной кисло г1:1. 1фи1-! ttbttf слой IIPo f1!Bettor водой, У tt. 1 (ft 1 с Ptto530637
:ве органического растворителя можно исполь зовать ксилол.
- Для превращения,простатриеновой кисло, ты обшей формулы У в сложный эфир;проста ;триеновой кислоты общей формулы Vi используют диазоалкан, соответствующий целе:,вому сложному эфиру, и работают в среде
1 органического растворителя, например в хло, ристом метилене, хлороформе и дихлорэтане.
В качестве.,реагента этерификации можно р
;также употреблять соответствующий галоид1ный алкил или диалкилсульфат.
Избирательное бромметоксилирование слож;ного эфира простатриеновой кислоты общей рмулы () производят в особо мягких ус- @ ловиях, предотвращающих фиксацию брома на других двойных связях (Ь и Ь ) и миграцию этого брома и приводящих к получению бромкеталя формулы Vll причем процесс проводят в интервале температур -70 9 о до -30 С. Для того чтобы нейтрализовать кислую среду, прибавляют щелочную сольслабой кислоты — уксуснокислый натрий или Однокислотный фосфорнокислый натрий.
Для отщепления бромистого водорода от 2Ь бромкеталя обшей формулы Ч! предпочтительно используют диазабициклоалкен, и в особенности диаза -1,5-бицикло- (4,3-01
-нон-5-ен и проводят реакцию в биполярном
Ф
1 апротонном растворителе; диметилсульфокси- 10 де, диметилформамиде, диметилацетамиде, или гексаметилфосфотриамид е.
Для гидролиза тетрагидропиранилового эфира общей формулы Vl{{ употребляют в качестве кислотного реагента предпочтительно щавелевую кислоту и реакцию проводят в Органическом растворителе, например в этаноле. При желании эфир формулы V!il можно омылить с помощью мягкого щелочного ре4О агента: кислого углекислого натрия.
Для приготовления роиэводйых простановой кислоты общей формулы; Х можно также бромметоксилировать производное самой .простатриеновой, кислоты общей форму- 45 лы g . и после отщепления бромистого во- . дорода из образовашегося бромистого производного, подвергнуть полученное производное кислому гидролизу.
Благодаря этому можно упразднить ста- ф ,иию зтерификации производного простатрие- . новой кислоты обшей формулы ff/ и таким образом исключить стадию конечного Омыления, что значительно улучшает выход целевого продукта. М
Описанные ниже примеры иллюстрируют данное изобретение а также получение исходных соединений, О и bt т 1 . 1 (pff t oToBJI
1зфира 7-бром-5-1 О1пе.1овой I;tfc,ttoTI t. 69
530637 кислом магнив,; фильтруют и упаривают.я вакууме. Получают 21,3 r 7-(с1 -тетра1идропиранилокси)-5-гептиновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире, бензоле и хлороформе, нерастворимой 5 в воде; и = 1,485. (Стадия Г, Этиловый эфир 7-(б. -тетрагидропиранилокси)-5-гептиновой кислоты.
Смесь, состоящую из 20 г 7-(д тетрагилропиреиилокси)-5-гептииоиой кислоты, l0
100 см метанола и 5,4 г метилата натрия перемешивают в течение 1 час при комнатной температуре упаривают метанол в вакууме и получают 22 г натриевого эфира 7-(d. -тетрагидропиранилокси)-5-гептиновой l5 кислоты. Смешивают 21 г полученной таким образом соли с 70 см диметилформамида, з прибавляют 27,2 г бромистого этила и нас гревают реакционную смесь при 80 С в, течение 2 час. при перемешивании, выливают М в воду, экстрагируют эфиром, промывают водой эфирный слой, после чего сушат надсернокислым магнием, упаривают растворитель и фракционируют остаток. Получают 13 r этилового эфира 7-(Ck -тетрагидропиранилок-@ си)-5-гептиновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире, бензоле и хлороформе, нерастворимой в воде, о о кипящей при 122 С (0,1 мм рт.ст); Г ц)
1,47.
Стадия Д. Этиловый эфир 7-окси-5-гептиновой кислоты.
Перемешивают один час 10 г этилового эфира 7-(5, -тетрагидропиранилокси)-5-гепз тиновой кислоты, 20 смз эфира, 5 см 25%н,н серной кислоты и 20 смз метанола, прибавляют 30 см воды, экстрагируют эфиром, з промывают водой эфирный слой; сушат над углекислым натрием и упаривают эфир в ва- > кууме. Получают 4,3 г этилового эфира 7-окси-5-гептиновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире,: бензоле и хлороформе, нерастворимой в воде, сипяшей при 91 С (0,5 мм рт.ст.); t р (=,р
9.0
1,465.
Этиловый эфир 7-окси-5-гептиновой кислоты может быть также получен следующим образом.
Нагревают с обратным холодильникол в 60 атмосфере азота в течение 3 час смесь 20 r
7-(с3.-тетрагидропиранилокси)-5-гептиновой кислоты, 12 г этанола, 50 см бензола и з две капли концентрированной серной кислоты.
Затем дают тел1пературе дойти до комнатной 5 и прибавляют 20 см 12,5. -ной серной кислоты, 30 смз эталона и следы лаурисульфата натрия. Перемсшивают в точ HH< одной о ночи при 20 С, а з«т .м но гп «лизуют углекислым патрик м, экстраг1« ул i эфц -,.t. су- 69 шат, упаривают растворитель под уменьшенным давлением и ректифицируют остаток. Таким образом получают 8,5 г этиловогозфира 7-окси-5-гептиновой кислоты, идентичиа с описанным выше.
Стадия Е. Этиловый эфир 7-окси- 5-гептеновой кислоты.
Вводят 300 мг 5%-ного палладия насернокислом барие в 20 смз этилового эфира уксусной кислоты, продувают и пропускают ток водорода. После поглощения 6 смз водорода прибавляют раствор 4 г этиловогоэфира 7-окси-5-гептяновой кислоты в 7 смз этилового эфира уксусной кислоты,.содержа= щего 0,4 см хинолина и споласкивают 14см этилового эфира уксусной кислоты, затем продувают и пропускают ток водорода. После поглощения 570 смз водорода фильтруют, спосласкивают фильтр этиловым эфиром уксусной кислоты, промывают органические сжп
0,5 н. соляной кислотой, а затем водой, сушат над сернокислым магнием, обрабатывают активированным углем, фильтруют и упаривают досуха. Получают 2,6 r этилового эфира 7-окси-5-гептеновой кислоты в виде бесцветной жидкости, растворимой в спиртах, эфире, бензоле и хлороформе, нерастворимой в воде; f A 1 = 1,453.
Стадия Ж: Этиловый эфир 7-бром-5-гептеновой кислоты.
Смешивают при перемешивании 10 r этилового эфира 7-окси-5-гептеновой кислоты и 120 см петролейного эфира, охлаждают о до -10 С и прибавляют раствор 2,9 г трибромида фосфора в 30 смз петролейногоэфира, перемешивают в течение тридцати мио о нут при -10 С и в течение 1 час при 0 С, выливают реакционную смесь в воду, экстрагируют эфиром, промывают водой эфирные слои до нейтральности промывных вод, сушат над сернокислым магнием и упаривают под уменьшенным давлением. Собирают 11,55 r маслянистого продукта, который очищают пропусканием через. двуокись кремния и элюированиел смесью циклогексан-этиловый эфир уксусной кислоты (85-15). Получают 9,73г этилового эфира 7-бром-5-гептеновой кислоты в виде бесцветного жидкого продукта, растворимого в спиртах, эфире, бензоле и хлороформе, нерастворимого в воде;(П 1 о — 1,4825.
Опыт П. Приготовление этилового эфира
3-(3 - cL -тетрагидропиранилокси-транс-октецил-1 g --циклопентанон-2-карбоновой кислоты.
Стадия Л. Этиловый эфир 3-оксо-6-гептиновой кислоты.
1) Енолят кислого магнийэтилового эфира л1алоновой кислоты. B атмосфере азота растворяют 7,3 г кислого этилового эфира малоновой кислоты в 50 см тетрагидрофурана, з прибавляют 0,10 моль бромистого изопропилмагния B тетрагидрофурановом растворе, слегка нагревают, доводят заново до комнатной
,температуры и сохраняют в атмосфере азота.
2) N, N -тионилдиимидазола. . Раст1 з воряют 15 г имидазола в 100 см тетрагидрофурана, прибавляют раствор 6 r хлористого тионила в 30 смз тетрагидрофурана при .перемешивании в течение 15 мин, фильтруют, промывают фильтр;тетрагидрофураном и получают раствор N, P --тионилдиимидазола.
3) Пропаргилацетилимидазол. К полученt ! ному выше раствору Р4 и -тионилдиимидазо- Ь
1 ла прибавляют 5 r пропаргилуксусной кислоз ты, растворенной в 50 см тетрагидрофура на и перемешивают в течение 15 мин при комнатной температуре, при этом получают раствор пропаргилацетилимидазола, который 20 употребляют в данном виде.
4),Конденсация. Этот раствор прибавляют к еноляту магнийорганического соединения, полученного по способу 1 и перемешивают при комнатной температуре в теченйе од- I . ной ночи, подкисляют прибавлением 4%-ной соляной кислоты, экстрагируют эфиром, промывают эфирный слой водным раствором кислого углекислого натрия, сушат, обрабатывают активированным углем, фильтруют и упа- Э0 ривают досуха. Остаток пропускают через глинозем, элюируют хлористым метиленом и получают 6,03 г этилового эфира 3-оксо-6-гептиновой кислоты, которые употребляют в данном виде в следуюшей фазе. Соеди35 некие имеет вид светло-желтых призм, растворимых в спиртах, эфире, бензоле и хлороформе, нерастворимых в воде, плавящихся о при 25 С.
Стадия Б. Этиловый эфир З-этокси-б-.ин-2-гептеновой кислоты.
Растворяют 10 г этилового эфира 3-ок,со-6-гептиновой кислоты в 60 см зтанола, з прибавляют ЗО см этилового эфира ортому-45 з равьиновой кислоты и О, 35 смз серной кислоты и перегоняют 25 смз растворителя при пропускании азота в течение сорока 5 мин.
Затем охлаждают, прибавляют хлористый метилен, промывают 2 н. едким натром, экст- р рагируют хлористым метиленом, сушат органический слой над сернокислым натрием, об рабатывают животным углем, фильтруют и упаривают досуха в вакууме. Остаток хроматографируют на силикагеле, элюируют хлорис-б тым метиленом и получают 7,05 г этилового эфира 3-этокси-6-ин-2-гептеновой кислоты в виде светло-желтой жидкости, растворимой в спиртах, эфире, бензоле и хлороформе, нерастворимой в воде.
530637
Этиловый эфир 3-зтокси-6-ин-2-гептеновой кислоты может быть еше приготовлен следуюшим образом.
И атмосферу азота перемешивают 10,1 г этилового эфира 3-кето-6-гептиновой кислоз з ты, 100 см зтанола, 20 см этилового эфи,ра ортомуравьиной кислоты и 1 г и — толу1, олсульфокислоты и нагревают с обратным холодильником в течение одного часа и 20мин. Затем охлаждают, прибавляют хлорнстый мез ,тилен, выливают реакционную смесьв 100см ледяного 1 н. едкого натра, промывают органический слой ледяным 1 н. едким натром, а затем водным раствором хлористого нат1 рия заново экстрагируют промывные раство:ры хлористым метиленом, сушат объединен ;ные слои над сернокислым натрием, фильтру;ют и упаривают досуха в вакууме, Остаток, хроматографируют на силикагеле, элюируют хлористым метиленом и получают 6,716 г . этилового эфира 3-зтокси-6-ин-2-гептеновой
:кислоты, одинакового с предыдушим.
Стадия В. Этиловый эфир 3-зтокси-8-окIce-9-хлор-6-ин-2-теторадеценовой кислоты.
Охлаждают до -25 С смесь 2 г этилово;го эфира 3-этокси-6-ин-2-гептеновой кислоз
iThI и 15 см тетрагидрофурана и прибавляют
9,25 см 1,085 н. эфирного раствора бутиллития, оставляют в контакте в течение 1 час о о
30 мин. при -25 С, охлаждают до -30 С и прибавляют 3 г ck -хлоргептаналя, оставо ! ляют в контакте в течение 30 мин при-20 С, о ,затем в течение 30 мин при О С и дают дойти ao, комнатной температуры. Реакционную смесь выливают в ледяной водный раст;вор монофосфата натрия, экстрагируют эфиром, промывают органический слой водным .раствором кислого углекислого натрия, а за,тем водой и наконец водным раствором хлористого натрия, сушат над сернокислым нат;рием, обрабатывают активированным углем, фильтруют и упаривают досуха. Остаток хроматографируют на силикагеле, элюируют хло-! ристым метиленом, содержашим 0,5% ацето» . а, остаток очишают повторно хроматографией на силикагеле и элюированием хлористым метиленом, содержашим 0,25% ацетона, а аатем хлористым метиленом, содержашим 0,5О% ацетона. Получают 1,85 r этилового ! эфира 3-этокси-8-окси-9-хлор-6-ин-2-тетраг
1 деценовой кислоты в виде аморфного, светло желтого продукта, растюримого в спиртах, 1 и эфире, нерастворимого в воде.
Вычислено, %: Cl 10,28.
С Н 0 Сl 344,87.
Найдено, %: Cl 10,3.
УФ-спектр (этанол): макс. при 237 нм, Е 357.
1е
530637
Стадия Г. Этиловый эфир 3-оксо-8-окси-
-9-хлор-6-тетрадеционовой кислоты. о
Нагревают при 50 С в течение 1 час
ЗО мин„смесь 6,95 r этилового эфира 3-этокси-8-окси-9-хлор-6-ин-2-тетрадеценовой кислоты, 70 см этаиола и 35 смз 2 н. соляной кислоты, при перемешивании и в атмосфере азота, охлаждают, выливают реакционную смесь вводу,,экстрагируют хлористым метиленом, промывают органический слой вод-g ным раствором кислого углекислого натрия, а затем водой до нейтральности промывных вод, сушат над сернокислым натрием, фильм руют и упаривают досуха в вакууме. Получают 6 г сырого этилового эфира 3-оксо-8-окси-9-хлоро-6-тетрадециновой кислоты, которые очищают хроматографией на силикагеле и эпюированием смесью циклогесан-эти/ повый эфир уксусной кислоты (70-30).
Соединение имеет вид светло-жептыхкрис- 0 галлов, растворимых в спиртах и эфире и не- растворимых в воде.
Вычислено, %: С1 11Д2.
С Н О С1 316,82.
16 25 4
И
Найдено, %: С6, 11,4.
УФ-спектр.
1 К, 1 ) Этаноп. Макс при 2 447lhh 1см 34.
Перегиб у 279 пм И „6.
2) Этанол, 0,1 н. ЯаОН:
Макс, при 275 пм. Е 668, 4сн
Можно также получить этиловый эфир 3«оксо-8-окси-9-хлор-6-тетрадепиновой кислоты исходя из этилового эфира 3- этокси-6-ин-2-гептеновой кислоты (полученного в стадии Б), и работая следующим образом.
1) Конденсация. Охлаждают до -60оС смесь, состоящую из 6,5 r этилового эфира Ç-эток-, .з 40 си-6-ин-2-гептеновой кислоты и 110 см з тетрагидрофурана и прибавляют 29 см 1,6н. раствора бутиплития в гексане, при перемешивании в течение 3 час. Затем прибавляют
I раствор 9,7 ; -хлоргептанапя в 25 см тетрагидрофурана и перемешивают в течение о
1 час при -60 С, затем дают температуре о дойти до О С, выливают реакционную смесь
B ледяной, насыщенный водный раствор первичного фосфата, экстрагируют эфиром, про- g мывают эфирный спой насьпденным, водным раствором кислого углекислого натрия, а затем водой до нейтральности промывных вод, сушат над сернокиспым магнием и упаривают досуха. з
Ь
2).Гидропиз. Остаток растворяют в 100см
i3 этанола и 56,5 см 2 н. соляной кислоты, о нагревая при 50-60 С в течение 1 часЗОмин при перемешивани и в атмосфере азота, ох лаждают и выпивают раствор в смесь воды Щ со льдом, затем экстрагируют эфиром, промывают эфирный слой водой до нейтральности промывных вод, сушат над серноксилым магнием и упаривают досуха. Получают 16 г сырого этилового эфира 3-оксо-8-окси-9-хлор-6-тетрадеционовой кислоты.
3) Очистка. Летучие вещества, находяппь еся в 16 г сырого соединения, удаляются перегонкой под уменьшенным давлением, по окончании перегонки охлаждают, забирают остаток эфиром, обрабатывают животным углем, фильтруют и упаривают досуха.
Остаток растворяют в 5 см3 иэопропилового эфира, прибавляют при перемешивании
4 объема петролейного. эфира, охлаждают о раствор до -60 С, прибавляют петролейный эфир до образования осадка и декантируют.
Остаток смешивают с 22 см этанола и з
113 см насыщенного раствора уксусномед-. ной соли, перемешивают смесь в течение одной ночи, декантируют, промывают образовавшийся медный комплекс водой и фильтруют под уменьшенным давлением. Вводят комплекс в суспензию петролейно» го эфира, перемешивают в течение 1 час в бане пед-вода, фильтруют, промываютфильтр ледяным петропейным эфиром, а затем ледяной смесью петропейного эфира и эфира(21); осадок растворяют в хлористом метипене, подкиспяют прибавлением разбавленной уксусной кислоты, прибавляют хлористый ме- типен, промывают водой хпористометипеновые слои, а затем водным раствором кислого угпексилого натрия и наконец водой до ней-ральности промывных вод, сушат над сернокиспым магнием и упаривсют досуха.
Получают этиловый эфир 3-оксо-8-окси-9 -хлор-6-тетрадециновой кислоты, одинаковый с предыдущим.
Стадия Д. Этиловый эфир 3-оксо-8-окси-9-хлор-цис-6-тетра-деценовой кислоты.
Вводят 240 мг 5%-ного палпадия на серз нокиспом барие в 15 см этилового эфира уксусной кислоты, продувают и пропускают ток водорода в течение 30 мин. После погпощеэ ния 6 с.м водорода прибавпя от раствор3,03г этилового эфира 3-оксо-8-окси-9-хлор-6з
-тетрадециновой кислоты в 5 см этилового з эфира уксусной кислоты, содержащего 0,3cM з хинопина и пропопаскивают 15 см этилового эфира уксусной кислоты, продувает, пропускают ток водорода в течение 2 час. После поз гпошения 223 см водорода фильтруют, пропопаскивают фильтр этиповым эфиром уксусной кислоты, промывают органический спой
0,5 н. соляной кислотой, а затем водой, сушат над сернокиспым натрием, обрабатывают активированным углем, фильтруют и упарива-! ют досуха в вакууме. Получают 3 r этипо5Ç0G37 вого эфира 3-оксо-8-окси-9-хлор-цис-6-тетрвдеценовой кислоты в виде светло-желтого аморфного продукта, растворимого в спиртах и эфире и нерастворимого в воде.
Вычислено, %: C 60,27 . Н 8,54; Cl 11,12., С Н 0 Сl 318 84.
Найдено,%: С 60,0; Н 8,4; Сl 10,8. .УФ-спектр (этанол):
«o/
Перегиб у 226 пм Е 25
10 макс при 243 пм Е «, „32.
Стадия Е. Этиловый эфир 3-оксо-транс-8,9-эпокси-цис-б-тетрвдеценовой кислоты.
Растворяют 5 г этилового эфира 3-оксоt 8-окси-9-хлор-цис-6-тетрадеценовой кисло-)э ты в 50 см третичного бутанола и прибавз ляют в атмосфере азота 32 см 1 н. растворе третичного бутилата калия в третичном бутаноле при перемешивании в течение сорока пяти минут. Прибавляют хлористый мети- 6 лен, выливают в насыщенный водный раствор монофосфата натрия, экстрагируют хлористым метиленом, промывают органический слойводой, сушат нвд сернокислым натрием, обрабатывают активированным углем, фильтруют 6 и упаривают досуха. в вакууме. Остаток хроматографируют на силикагеле, элюируют смесью циклогексвнэтиловый эфир уксусной кислоты (1-1) и получают 3,4 r этилового эфи- о ра З-оксо-транс-8,9-эпокси-цис-б-тетрадеценовой кислоты в виде светло-желтой жидкости, растворимой в большинстве обычных органических растворителей и нерастворимой в воде.
Вычислено, %: С 68,05; Н 9,28. 35
С Н 0 282 38.
Найдено, %: С 68,3; Н 9,4.=
УФ-спектр (этанол):
Макс. при 246 пм. Е 49. 40
«си
Стадия Ж. Этиловый эфир 3- N -пирролидил-транс-8, 9-эпокси-2-цис-6-тетрвдекадиеновой кислоты.
Смешивают 1,5 г этилового эфира 3-ок16 со-транс-8,9-эпокси-цис-б-тетрадеценовой з з кислоты, 15 см бензола 1,5 см пирролидина и 75 мг п)- толуолсульфокислоты, продувают азотом иоставляют реакционную смесь в течение 4 дней при перемешивании и при комнатной температуре. По истечении этого времени упаривают досуха в вакууме, прибавляют;толуол для удаления избытка пирролидина, забирают хлористым метиленом, про» мывают органический слой водой, заново р экстрагируют хлористым метиленом, сушат объединенные органические слои на сернокислом магние, обрабатывают активироввнным углем, фильтруют, и упаривают досуха; в ввI кууме. Получают 1,9 г этилового эфира 3- gy г« -пирролидил-транс-8,8-эпокси-2-цис-6-тетрадеквдиеновой кислоты в виде темножелтого аморфного продукта, растворимого в спиртах и хлороформе, и нерастворимого в воде.
Вычислено, %: Й 4,17.
С Н 0 М 335 47.
20.33 3
Найдено, %: N 4,9.
УФ ïeKTð (этвнол): перегиб 230 пм E 70. макс. при 289-290 пм Е «,,740. полосы
В ИК-спектре присутствуют: полосы при 1,671, 1 565, 1 446, и 1 143см «
Отсутствует полоса — ОН.
Стадия 3. Этиловый эфир З-(3 -оксиI
-транс-1 -октенил)-(циклопентанон)-2 -карбоновой кислоты. о
Вводят 9,3 г этилового эфира 3- N-пирролидил-транс-8,9-эпокси-2-цис-б-тетр".дез квдненовой кислоты в 110 см тетрагидрофурвна и прибавляют в атмосфере азота 4,3г амида натрия. Реакционную смесь оставляют на одну ночь при перемешивании при комнатной температуре, выливают смесь в лед-.чой водный раствор монофосфата натрия, экстрагируют хлористым метиленом, промыввйзт водой органический слоф сушат над сернокислым магнием, обрабатывают животным углем; фильтруют и упаривают досуха под уменьшенным давлением. Остаток су роматогрвфируют на силиквгеле и получают 3,4 г этилового эфира 3-(3 -окси-транс-1 -октенил)-циклопентанон-2- карбоновой кислоты, в видежелтой жидкости, растворимой,у спиртах, эфире, бензоле и хлороформе, нерастворимой в воде.
Вычислено,%: С 57,98; Н 5,88; g 5,88, С2 Н2809 2 476,47(динитробензоат).
Найдено,%: С 57,8; Н 6,0; и 6,1.
Стадия И. Этиловый эфир 3-(3 - д.-тетрагидропиранилокси-транс-1 -октенил)-цикло пентвнон-2-карбоновой кислоты.
Растворяют 3 г этилового эфира 3-(3 -окси-транс-1*-октенил)-циклопентанон-2-карбоновой кислоты в 10 см эфира, охлажз о дают до 0 С и прибавляют 4 кристалла п.-толуолсульфоксилоты, затем 4 см дитждроз пирана, дают дойти реакционной смеси до комнтаной температуры, прибавляют безвод» ный углекислый натрий и перемешивают в течение одного чвсв в атмосфере азота, фильч руют,.упаривают при пониженном давлении рвстворитель и избыток дигидропирана и получают 3,89 г этилового эфира 3-(3 - о(.» тетрагидропиранилокси-1 -октенил) -цикло(пентвнон-2-карбоновой кислоты в виде бес530637
Найдено,%. С 68,9; Н 9,2.
В ИК-спектре: присутствуют полосы карбонилов при 1 727 5 и 1 746 см 1
Стадия Б. Этиловый эфир 15 а(-(oL-тетрагидропиранилокси)-10-карбэтокси-9-оксо-5-цис-1 3-транс-простадиеновой кислоты.
Смешивают 2,8 г этилового эфира 15d-—
-(d. -тетрагидропиранилокси }-9-оксо-10-карб« этокси-5-цис-13-транс-простадиеновой кислоты и 5,6 смз 1,02 н. раствора этилата натрия и нагревают с обратным холодильником B течение 7 час, охлаждают, прибавляют 20смз толуола, перегоняют азеотро нческн спирт до поднятия темпе1)птуры!10 .t. 10 С, сильно охлаждают ренкннонную смесь, aH!HHHî ют ее в водный раствор л)оно с ф тн нат1)ия ири 60
:цветной жидкости, растворимой в спиртах, эфире и хлороформе, нерастворимой в воде.
Вычислено, %: С 68,85; Н 9,29.
С21Н3405 366.
Найдено, %: С 68,9; Н 9,0.
Опыт Ш. Приготовление этилового эфира
15 d- -(cL -тетрагидропиранилокси)-10-карбо- этокси-9-оксо-5-цис-13-транс- - простадиеновой кислоты.
Ствлии А. Этиловый эфир lо О.-(иС-тит- t рагидропи ранилокси ) 9.-оксо-8-карбэтокси-5-
-цис-1 3-транс-щ остадиеновой кислоты.:
К раствору 3,3 r этилового эфира 3-(3 — Q -тетрагидропиранилокси-транс-1 -окте-
1 нил)-циклопентанон-2-карбоновой кислоты в
15 см бензола прибавляют 1,165 г третичз ного бутилата калия в атмосфере азота и перемешивают в течение 1 час при комнатной температуре, затем прибавляют раствор, 2,76 г этилового эзра 7-бром-5-гептено. вой кислоты в 5 см бензола и оставляют реакционнуф смесь в течение 24 час при комнатной температуре. Выливают смесь в, ледяной, водный раствор монофосфата натрия,) экстрагируют хлористым метиленом, промы- вают водой органический слой до нейтральности промывных вод, экстрагируют промывные воды хлористым метиленом, сушат объединенные органические слои над сернокис-, З0 лым магнием и упаривают досуха. Остаток хроматографируют на силикагеле, элюируют смесью циклогексан-этиловый эфир уксусной кислоты (80-20) и получают 3,9 г этилового эфира 15 d -(О -тетрагндропиранилок-,ц си)-9-оксо-8-карбэтокси-5-цис-13-транс-простадиеновой кислоты в виде бесцветной жидкости, растворимой в органических раст ворителях и нерастворимой в.воде.
Вычислено; %: С 69,23; Н 9,23. 40
С ОН 0 520.
30 48 7
:16 перемешивании, экстрагируют эфиром, промы. вают водой органический слой, сушат над сернокислым магнием и упаривают раствори тель под уменьшенным давлением. Остаток хроматографируют.на силикагеле и элюируюг смесью циклогексан - этиловый эфир уксусной кислоты (90-10), содержащей 1% триэтиламина, получают 2,3 г этилового эфира
154- -(ф-тетрагидропиранилокси)-10-карбэтокси-9-оксо-5-цис-13-транс-простадиеновой кислоты в виде бесцветной «жидкости, растворимой в органических растворителях и не растворимой в воде.
Вычислено, %: С 69,23; Н 9,23.
С30Н, 807 520.
Найдено, %: С 69,4; Н 8,9.
Пример 1. Метиловый эфир 15 cL -окси-9-оксо-5-цис-10)13-транс-простатриеновой кислоты.
Стадия А. Этиловый эфир 15А-(d -тетрагидропиранилокси) -1 0-карбэтокси-9-метокси-5-цис-9, 13-транс-простатриеновой кислоты.
Растворяют 420 мг этилового эфира 15 а(- ((L -тетрагидропиранилокси)-1 0-карбэтокси-9-оксо-5-цис-1 3-транс-простадиеноз вой кислоты в 1 0 см эфира, прибавляют при ОС з
40 см хлористометиленового раствора диаз зометана, содержащего 1,5 r на 100 см и перемешивают, дают реакционной смеси дойти до комнатной температуры и продолжают перемешивание в течение 8 час, упаривают избыток диазометана под разреженным давлением, и выдерживают температуру нио же 40 С, экстрагируют эфиром, сушат на сернокислом магние и упаривают досуха. Остаток хроматографируют на силикагеле иэлюируют смесью циклогексан-этиловый эфир уксусной кислоты - триэтиламин (80-20-0,3).
После испарения элюанта получают 295 мг этилового эфира 15 с3 -(с3-.тетрагидропира- нилокси )-1 0-карбэтокси-9-метокси-5-цис-9,13-транс-простатриеновой кислоты в виде светло-желтой жидкости, растворимой в большинстве органических растворителей и нерастворимой в воде.
Вычислено,%: С 68,5; Н 9,4.
С31 Н 5007 534.
Найдено, %: С 68,3; Н 9,0.
В ИК-спектре (в хлороформе) имеется полоса несопряженного сложного эфира при
1 729 см 1, сопряженного сложного эфира при 1 693 см 1, сопряженный С=С при
1 627 сл 1 и С-О-С.
УФ-спектр. л акс. при 254 лм E = 10,600
Насколько известно, это соединение в лиTo/)oTgl)p Hp. Описано.
530637
17
Стадия Б, 15 0 -(А-тетрагидропиранилокси)-1 О-карбокси-9-метокси-5-цис-9, 13-транс-простатриеновая кислота.
Нагревают в течение .6 час "при 70 С о
190 мг этилового эфира 15d — (CL-тетра- б гидропиранилокси)-1 О-карбэтокси-9-метокси-5-9,13-транс-простатриеновой кислоты, 1,065 см 1 н. едкого натра и 1 см смеси диоксан-метанол /1-1/ отгоняют растворитель под умейьшенным давлением при тем-30 о пературе, не превышающей 40 С, прибавляют
3 см воды и экстрагируют эфиром, чтобы удалить нейтральные фракции, охлаждают водный раствор, насыщают хлористым натрием и подкисляют прибавкой 1 н. соляной кисло- И ты, экстрагируют эфиром водный слой, промывают водой до нейтральности промывных а вод, сушат на сернокислом магние и упариЪают досуха под уменьшенным давлением.
Получают 170 мг 15 с . -(di -гетрагидропи- 0 ранилокси)-10-карбокси-9-метокси-5-цис-9,13-транс-простатриеновой кислоты в виде светло-желтой жидкости, растворимой в большинстве органических растворителей и нерастворимой в воде.
Вычислено, : С 65, 38; Н 8,94.
С27Н4207 478.
Найдено, О : С 65,7; Н 8,8.
В ИК-спектре (хлороформе) имеются полосы дО
С-О-С, кислоты, комплексного С=О при
1 726 и 1 713 см и комплексного С=-С при 1 634 и 1 615 см
УФ-спектр. макс. при 250 пм, Е = 8 950. 35
Насколько известно, это соединение в литературе не описано.
Стадия B. Метиловый эфир 9-метокси-15 d- -(с -тетрагидропиранилокси)-5-цис-9, 1 3-транс-простатриеновой кислоты.
40 вают растворитель под уменьшенным давлением и получают 1 г метилового эфира 15-(д -тетрагидропиранилокси)-10
-бром-9, 9-диметокси-5-цис-1 3-транс-простадиеновой кислоты, который употребляют в данном виде в следующей стадии.
Насколько известно, это соединение в литературе не описано.
Стадия Д. Метиловый эфир 15 б.-(d
-тетра гидропиранилокси ) -9-оксо-5-цис-1 О, 13-транс-простатриеновой кислоты. о
Нагревают в течение 15 час при 85 С смесь 1 г метилового эфира 10 с, -бром-15 0 -(0 -тетрагидропирапцлокси)-9,9-диметокси-5-цис-13-транс-просталиецоеой кислоты, 15 смз диметилсульфоксцда и 1,15 r
1, 5-диазабц цикле-(4-3-0 ) -цон-5-ена. Затем перегоняют дцк1етцлсульфоксид и 1,5 ceca:сп,бпццкло-(4-3-0)-цен-5-ен при HO"С и при
Нагревают с обратным холодильником в течение 3 час смесь 478 мг 15 Ь- -(д—
-тетрагидропиранилокси)-10-карбокси-9-метокси-5-цис-9,13-транс-простатриеновой 4б з кислоты и 1 2 см ксилола, а затем упаривают ксилол под уменьшенным давлением о при температуре, не превышающе" 60 С и получают 1 5 А -(С) -тетрагидропиранилокси)-9-метокси-5-цис-9,13-транс-простатриено- р вую кислоту. 15б. -(6, -тетрагпдропиранилокси) -9-меток си-5-цис-9, 1 3-транс-простатриеновая кислота может быть очищена хроматографически на силикагеле (элюент-этиlloRbcA эфир уксусной кислоты), и забрацаэфи-5б о ром, затем прибавляют при 0 С хлористометиленовый раствор диазометана, содержащий з
1,5 r последнего на 100 см, упаривают растворитель при уменьшенном давлении, хроматографируют остаток на силцкагеле и элкъ- б0
18 ируют смесью циклогексан - этиловый эфир уксусной кислоты - триэтиламин (90-10-1) после упаривания элюента получают 125 мг метилового эфира 1 5 d -(д -тетрагидропиранилокси)-9-метокси-5-цис-9,13-транс-простатриеновой кислоты в виде светло-желтой жидкости, растворимой в большинстве органических растворителей и нерастворимой в
:воде. Вычислено, : С 72,38; Н 9,9.
С Н4 0 448. ,Найдено, %: С 72,2; Н 10,1. ,Число омыления: вычисленное 125. найденное 125.
В ИК-спектре (в хлороформе) имеются по лосы:
С=С при 1645 см 1- и С=О сложного эфира.
Насколько известно, это соединение в литературе не описано.
Стадия Г. Метиловый эфир 15б.-(d.-тетрагидропиранилокси)-10-бром 9,9-диметокси
5-цис, 13-транс-простадиеновой кислоты. о
Охлаждают до -60 С смесь 836 мг мети;лового эфира 1 5д -(О. -тетрагидропирани;.локси)-9-метокси-5-цис-9,13-транс-проста триеновой кислоты, 50 смз метилового спирта и 690 мг ацетата натрия, затем прибав ляют 9,5 смз метанолового раствора брома, з содержащего 3,3 r на 100 см дают реакционной смеси дойти до комнатной температуры, прибавляют 500 мг кислого углекислого натрия и оставляют на один час при комнатной температуре, упаривают досуха подуменьшенным давлением, забирают остаток смесью эфир-вода (3-1), промывают водой эфирные слои до нейтральности промывных вод, сушат на сернокислом магние и кислом углекислом
„натрие, и фильтруют, К эфирному раствору прибавляют 2-3 капли триэтиламина, упари530637
19 давлении ртути в 0,5 мм, забирают остаток этиловым эфиром уксусной кислоты, вылива» ют в насыщенный раствор монофосфата натрия и перемешивают в течение 15 мин,затем декантируют, промывают органический !!! слой водой, экстрагируют хлористым метиленом водные слои, сушат соединенные органи- ческие слои на сернокислом магние и упари-! вают досуха. Остаток хроматографируют на силикагеле и элюируют смесью циклогексан-q)@ этиловый эфир уксусной кислоты (70-3G); после упаривания элюента получают380 мг метилового эфира 15 Ck-(4. -тетрагидропк-. радилокси )-9-оксо-5-цис-1 О, 1 3-транс -прос.татриеновой кислоты в виде желтого масла, В растворимого в большинстве органических растворителей и нерастворимого в воде.
Вычислено, %: С 72,22; H 9,25.
С26Н4005 432.
Найдено, %: С 72,5; h 9,3, ЯО
В ИК-спектре (в хлороформе) имеются полосы С=О сложного эфира при 1 730 см
С=О пиклопентенона при 1 705 см 1 и С=С при 1 588 см .
УФ-спектр (этанол); макс. при 217 пм, Е = 10 050.
Насколько известно, это соединение в литературе не описано.
Стадии E. Метиловый эфир 15 (,-окси- Щ
-9-оксо-5-цис-1 О, 1 3-транс-простатриеновой кислоты.
Смесь 360 мг метилового эфира 15 Ck.-(б -тетрагидропиранилокси)-9-оксо-5-цис-1 0, 1 3-транс-простатриеновой кислоты, 1 Осмз метанола, 21 мг щавелевой кислоты с 2Н О
2 и 1 см воды нагревают при 45 С при перез о мешивании и в течение 8 час, затем упаривают растворители под уменьшенным давлением забирают остаток хлороформом, промывают хло- )О роформный слой водой до нейтральности про. мывных вод, сушат на сернокислом магние и упаривают досуха. Остаток хроматографируют на силикагеле и элюируют смесьюциклогексан-этиловый эфир уксусной кислоты (50-50). После упаривания элюента получают 220 мг метилового эфира 15 ф -окси-9-оксо-5-цис-1 О, 13-транс-простатриеновой кислоты в виде бесцветной жидкости, раство-ф римой в большинстве органических растворителей и нераств римой в воде.
Вычислено, %>. С 72,37; Н 9,26.
С, Н 204 348.
Найдено, %: С 72,7; Н 9,4, И
УФ-спектр (этанол): макс, прц 216 пм е, =- 10 100
Пример 2. 15 d -окси-9-оксо-5-цис-10, 1 3-т!!й!!е-и(!еетатр!!енеаая кислота. 69
Стадия А,,15 А -(d -тетрагидропиранилокси)-10 (бром-9,9-диметокси-5-цис-13-транс-простадиеновая кислота.
Охлаждают до -70 С 2,45 r 15d -(4.-тетрагидропиранилокси)-9-метокси-5-цис-9, 1 3-транс-простатриеновой кислоты, полученной по способу, описанному в стадии В примера 1, или по способу, описанному ниже,, 200 сьР метилового спирта и 2,13 г ацетата натрия, а затем прибавляют по к