6 -фторциклогексано (1",2",16 ,17 ) -прегн-4-ен-3,20-дион, обладающий гестагенной активностью и способ его получения
Иллюстрации
Показать всеРеферат
Оп ИСАНИЕ
ИЗОБРЕТЕНИЯ
К АВТОРСКОМУ СВИДИТВЛбСТВУ
Союз Советских
Социалистических
Республик (11) 55513 6 (61) Дополнительное к авт. свид-ву (22) Заявлено14.01.76 (21) 2312326/04 с присоединением заявки №вЂ” (23) Приоритет— (43) Опубликовано25.04.77.Бюллетень № 15 (45) Дата опубликования описания 01.06.77 (51) M. Кл, С07 J 5/00
IIA61 К 31/57
Государственный комитет
Совета Мииистрое СССР па делсм иэооретений и открытий (53) УДК 547.689.6. .07 (088.8) А. А. Ахрем, А. В. Камерницкий, И. С. Левина, Л. Е. Куликова, A. И. Терехина, Л. И. Лисица и И. В. Ганина (72) Авторы изобретении
Научно-:исследовательский институт по биологическим испытаниям химических соединений и Институт органической химии им. Н. Д. Зелинского (71) Заявители (5 ) 6 оС-фТОРЦИКЛОГЕКСАНО р.,г ; 16 о/, 17 а)
ПРЕГИ-4-ЕН-3,20-ДИОН, ОБЛАДА ЮШИЙ ГЕСТА ГЕННОЙ
АКТИВНОСТЬЮ, И СПОСОБ ЕГО ПОЛУЧЕНИЯ
ОФ. Изобретение относится к новому представителю класса пентациклических стероицов-пентаранов, а именно к 6@с -фторциклогексано (1, 2, 16оС, 17оС) прегн-4-ен-3,20-диону, обладающему гестагенной активностью, и к способу его получения. Известен ацетат мегестрола, обладающий гестагенной активностью. Однако последний проявляет выраженную антиандрогенную активность,что нежелательно и получают его сложным девя-щ тистадийным синтезом pl) .
Целью даннрго изобретения является получение нового соединения, обладающего повыщенной гестагенной активностью и не проявляющего антиандрогенной активности. 15
Это новое соединение представляет собой
6 о -фторциклогексано (1,2; 16сс, 17сС) прегн-4-ен-3, 20-дион формулы
Получают это соединение четырехстадийным синтезом, так как известно, что непосредственное введение фтора в стероидную молекулу затруднено (2).
Способ получения целевого соединения заключается в том, что сначала синтезируют
1 (5с -бром-6 р -фторциклогексано (1, 2;
16 ос, 17ос1 прегнан-3 р -ол-20-он путем взаимодействия Я -бромацетамида с циклогексано t1,2; 16 с, 17<) прегн-5-ен-3 Р -ол-20-оном в присутствии фтористоводородной кислоты, взятой преимущественно в избытке, и при температуре от -70 о до -80 С. Эту стадию проводят в полярном органическом растворителе, например хлорис.— том метилене. Для избежания побочных процессов к реакционной смеси добавляют тетрагидрофуран.
Продукт реакции окисляют по Джонсу путем обработки хромовым ангидридом и серной кислотой преимущественно в среде полярного органического растворителя, например ацетона, и получают 5 сс -бром-6ф-фторциклогексано (1,2; 16сС 17<1 прегнан-3,20 дион. Последний под действием тока
555116
Вычислено: V 4,91%.
ИК-спектр: l! 1620, 1680, 1695 см.
Проведенные фармакологические исслецования показали, что предлагаемое соедине5 ние обладает высокой гестагенной активностью, судя по тесту сохранения беременности у крыс и по влиянию на секторные изменения эндометрия у неполовозрелых крольчих.
10 Гестагенное действие проявляется при пороговой эффективной дозе 6 сс -фторциклогексано (1,2; 16 с(, 17с< j прегн-4-ен-3,20-диона 0,08 мг/кг, в то время как прогестерон обнаруживает аналогичный эф15 фект при дозе, в 5 раз превышающей, т.е.
0,4 мг/кг. Хотя пороговая эффективная доза мегестрола-ацетата ниже, чем у 6 о(, -фторциклогексано (1 2; 16оС 17@(1 прегн-4-ен-3,20-диона, но способ синтеза последнего выгодно отличается от способа синтеза мегестрол-ацетата. сухого хлористого водорода в ледяной уксусной кислоте переводят в 6о -фторциклогексано (1,2; 16 сС, 17с6 прегн-4-ен-3,20-дион, который выделяют в чистом виде.
Структура полученного соединения подтверждена данными элементного анализа и
УФ-спектроскопии. о
Пример 1. К охлажденному до-70 г i раствору 2 г циклогексано (1 ; 16 оС, 17 о(,) прегн-5-ен-3 р -ол-20-она в 40 мл хлористого метилена и 1 5 мл тетрагидрофурана при перемешивании прибавляют 3 мл плавиковой кислоты, охлажденной до такой же температуры. Затем в реакционную массу вносят 0,73 г g -бромацетамида (94,5%) и перемешивание продолжают в тео чение часа при -70, затем еще 4 часа при о
0 . Реакционную массу небольшими порциями выливают в охлажденный разбавленный раствор аммиака, отделяют органический слой и промывают водой до нейтральной реакции.
После удаления растворителя к остатку добавляют метанол и отфильтровывают 1,42 г (58%) выпавшего порошкообразного 5 с
-бром-6 р -фторциклогексано (1,2; 16сС
17с61 прегнан-3 р -ол-20-она, Я = 0,53 (бензол (ацетон-9:1; 9 0 ) ..
Раствор 1,42 r 5оС вЂ” бром-бр -фторциклогексано- (1,2; 1 6 1 7@ j прегнан-3 Р-ол-20 — она в 130 мл ацетона охлаждают до о
0 и в него прибавляют 1,5 мл раствора по1 лученного из 26,72 г С 0 з, 23 мл концентрированной (4 gQ и воды до 100 мл.
Я 4 о
Реакционную массу перемешивают при 5 в течение 10 мин, затем выливают в лед.Выпавший осадок отфильтровывают, промывают на фильтре водой и сушат на воздухе. Получено 1,29 г (90%) 5<-бром-6 Р -фторциклогексано (1,2; 16 (17с4) прегнан-3,20-диона, Я 0,71 (бензол/ацетон — 9: 1;9l0>)
Б раствор йолученного 3-кетона в 100 мл ледяной уксусной кислоты в течение 10 час пропускают ток сухого хлористого водорода при 10 о
Смесь оставляют затем на 20 час при темо пературе 4-8, затем выливают в лед, органический слой экстрагируют хлороформом, экстракт промывают разбавленным раствором NaHCO»sopor и сушат над gggQ„Остаток после удаления растворителя хроматографируют в колонке с 80 r силикагеля (200 мин). Элюирование смесью гексан/ эфир (6,5:3,5) дает 0,83 г (37% на три стадии) 6 оС -фторциклогексано (1,2
16 с, 17ос п егн-4-ен-3,20-диона с т.пл. 230-233 (эфир/гексан), R< = 0,38 (б ензол/ацетон-9: 1 ) .
Найдено: Р 4,79/o .
Гестагенное действие соединения по способности охранять беременность превосхо25 дит по эффективности как прогестерон, так и мегестрол-ацетат. Так, в условиях действия 6 с(, -фторциклогексано (1,2 ; 16о, 17 ) прегн-4-ен-3,20-диона процент выживших плодов у овариоэктомированных к рыс составляет 93/о, т.е. сколько обычно о практически выживает у нормальных, не овариоэктомированных животных. При действии мегестрола-ацетата в той же дозе выжива85 ет 80%, а при действии прогестерона-60%.
Установлено, что соединение не обладает андрогенной анаболической, минералокортикоидной и антиандрогенной активностью. От40 сутствие последнего эффекта выгодно отличает вновь синтезированное соединение от мегестрола-ацетата, который проявляет выраженную антиандрогенную активность (см. табл. 3 ). Уретрофное действие у исследуе45 мого соединения выражено в такой же степени, как у прогестерона и мегестрола-ацетата.
Изучением острой токсичности показано, 50 что 6оС-фторциклогексано (1 2 16с
1 1 1
17<) прегн-4-ен-3,20-дион мало токсичен.
П ри однократном подкожном введении мышам в дозе 300 мг/кг никаких проявлений токсического действия не обнаружено.
55 Таким образом, фармакологические исследования заявляемого соединения показали, что оно обладает гестагенной активностью, превосходящей прогестерон по обоим изученным показателям гестагенного действия и мегестрол-ацетат по тесту сохранения бе555116
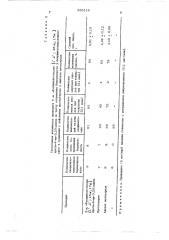
Табл ица 1
Гестагенная активность соединения 6 о(, -фторциклогексано (1,2
16 оа 17 ) прегн-4-ен-3,20-диона в сравнении с действием прогестерона и ацетата мегестрола.
0,7
0 ременности у овариоэктомированных животных, а также по избирательности этого действия.
6 аС -Фторциклогексано
f1,2; 16 с 17сс)прегн-4-ен-З, 20-диона
Прогестерон
Ацетат мегестрола
Способ получения этого соединения значительно проше, чем способ получения мегестрола-ацетата.
4 4
2 0,6
4 4
555116 сц C() о с) о
+! +! о
Я т-! с!
l0 о
+1 (Ц
1:(:Ц
Ф
О Щ о
Е о
<о
И
Щ
М
М
Щ
Щ о
Е( о
Ц
М ж
t ч-1 о
0, Щ
А ф Ж и
Щ Т!! ай
И
Щ о м
1»
1 о
Ц
М
3, Л
И о
1 о
Ц
М
Щ ж
М о
Ц о
М Ж
М Ф
f»
А
М
g ж
М
Щ о
Щ
t! о
М
Ф ж
& 11
Ж Щ
6.
1 о
6 о
М о о ь: о !
» и и о .с
1. Й о !
» Ж м в
Щ
0 а
Щ и
Щ и Й и
0
2
Л
< их
»» т1 1Щ о л 0 а и и
0 ф
CU C о
9 и ом
Щ 1- Ф
cv2 и о
Ж C
Ф Ж
Ф C
8 e а>
Ж Ф C
Е о ж
E „""C о
Ф о
1Ф и «>
0, И
Ф Ж ао щ
И 0 !»
A C
&» Ж Ф иоц о м ж
Щ 1
„„o у м с !» М
C (D
C Щ ф
ЩФа к!O
1 щ
C Ж
4 и
3 а
И и о щ и ц Ф
„Щ Я д ищ ее. л аи
Щ
)(Ж
0,0 „0 ф1 1 и 8
М о
1 и (О а о !
»
& я
8СО g й:( о
Я
Щ (Ж о
Э О. м И
Я 1
Ц о
0 о
Ж
Lf и о
Ц о
Ц
v и о ж !
» и о
v и о
10 т-( о о» о
CQ
03
l
CO
CU! о о о
СЧ
t » л.
CS
X.
° »
° и т о >!
О о о» о о т т-!
+ !
g & а е
q v ж Я
СЧ
+1
Г с! (Q
l о
CQ о л
Dl о о о
v (О т-!
+!
Г т-! Р
tA
0 ж ф
4 а о и
И д а д (9
+ ! » д ж
Э
jJ м о
И ф !
Ф !
« о
Ф
6 ж
cf о
k о м!
« ф ф ад 3
Ф а
И ф «тт
Ф о х;(й тт о î
o - ф
Q ф
М
CL
И а (2
Ж о о и 00 й
И й, ф
Ж о ф
М !«Q) фо v щ д о ж!
4 !«д
«т «Ж о ф!
» ф «, : o э (0 ф й o т»«
< а
Ф й( м о
g ъ о
Q) ттт дно! Щ «« о ф
О аа о и а жо ц а !
Я м т !т ф gl 2 ф
6) М
555116 (р с
+ ! о !
pC! CQ
+! +!
CD с !
CD т- о
+!
+!
03 т-! о 0! Ъ
8 0 т-т л ) О CU +
Ф О р о
3 о!
+ o cu о
O !
Ц о
+ Ф и аДФ
555116
10
Составитель В. Пастухова
Редактор Н. Лжарагетти Техред А. Богдан Корректор Н. Бугакова
Заказ 412/12 Тираж 572 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений и открытий
113035, Москва, Ж-Э5, Раушская иао., д. 4/5
Филиал ППП "Патеит", г, Ужгород, ул. Проектная, 4
Формула изобретения г 1
1. 6 сС -Фторциклогексано (1,2; 16с, 17 ) прегн-4-ен-3,20-дион формулы
О 5 обладающий гестагенной активностью.
2 . Способ получения 6 с -фторциклогексано (1,2; 16с6, 17с() прегн-4-ен-3,20-диона по п. 1, отличающийся г тем, что циклогексано 1,2; 16сС 17 ) прегн-5-ен-3 Р, -ол-20-он подверга1от взаимодействию с Я -бромацетамидом в присутствии фтористоводородной кислоты в полярном органическом растворителе, образующийся 5сС -бром-6 Р фторциклогексано (:,2; 16 с(g 17с() прегнан-3 Р -ол-20-он обрабатывают хромовым ангидридом в присутствии серной кислоты, полученный
5 сС -бром-6 Я -фторциклогексано (1, 2
16сС, 17сС) прегнан-3,20-дион обрабатывают хлористым водородом в ледяной уксусной кислоте с последующим выделением целевого продукта.
Источники информации, принятые во внимание при экспертизе: с. Ре1ючч V."Thecontvaceptive pvogestagens СИеи . Rev., 1970, 70, р. 713.
2. Organic reactions in 8tevo d сЬеииИtnt" едко by D.F ÷d аль D,Edward.V.ÕË .N-З, 1972, V. 1, р, 423.