Способ получения производных канамицина
Иллюстрации
Показать всеРеферат
ОП ИС
АНИЕ
ИЗОБРЕТЕН ИЯ
Союэ Советских
Социалистических
Республик (11) 576047
К ПАТЕНТУ (61) Дополнительный к патенту (22) Заявлено 12,07.72 (21) 1812196/23 — 04 (23) Приоритет — (32) 27.01.72 (S1) М. Кл " С07 Н 15/22
Государственный комитет
Совета Инннстроо СССР по делам нэаоретеннй и открытий (31) 221378 (33) CILIA (43) Опубликовано 05.10.77. Бюллетень № 37 (53) УДК 547.813.07 (088.8) (45) Дата опубликования описания29.08.77 (72) Авторы изобретения
Иностранцы
Хироси Кавагути, Такаюки Найто, Сусуму Накагава (Японо я) Иностранная фирма
"Бристол Майерс Компани" (США) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ КАНАМИЦИНА
-ЯН
НО
НЕОН () Н0
Изобретение относится к способу полученчя новых производных канамицина, которые могут найти примечевие в фармацевтической промышленностии.
Известны различные производные канамицина, например N - полиалкильные производные, получаемые восстановительным алкилированием канамицина, Однако способ получения 1 - аминопроизводных канамицина А или канамицина Б, содержащих т - амино - а - оксибутирильную группу, которые по антибактериальной активности превосходят известные аналоги, не известен.
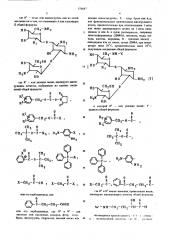
Основанный на известной реакции ацилирования аминосоединений, чредлагаемый способ получения производных канамицина общей формулы
Il
1чН С СН ьН2 СН2 МН
ОН
576047 низшая алкоксигруппа; Х -- хлор, бром или и д, или функциональным производным ацилирующего агента, предпочтительно при использовании 1 моль или менее ацилирующего агента на 1 моль канамицина А или Б, в среде растворителя, .например диметилформамида (ДМФА), метанола, воды, этанола, ацетона, пиридина, N - (низший алкил)
-пиперидина или их смеси, лучше ДМФА, при температуре ниже 50 С, предпочтительно ниже 25 С, 1О полученное соединение общей формулы
ЯQ +2 Н2
НΠ— ИН-Y
НО
НО
„ но
Нгм
ЙО где R — как указано выше, ацилируют ацили > руюшнм агентом, выбранным из группы соеди иений общей формулы
СН20Н 0 н, 25
Н.OI
З5
ОяХ
45 или его карбодиимида, или.0
И
С 6И -t!H2 ОООН
55 где R — окси- или аминогруппа, или их солей заключается в том, что канамицин А или канамицин
Б общей формулы
О ОФ К 11 3
СН вЂ” 0 — С -О-N
0
О
R2 11
СН;О-С-Х, R3
Сн, а
11
Ое,-) 0-С-З,, Jn, О
Х 0 СН ,Е11 I
/ -C-0-6-СН„
Сн
II 1I
Х-ВНг- С -ОН, Х- Сн,— С -Х или его карбодни мида, где RÐ и R — одн паковые или различные, водород, фтор, хлор, бром, нитрогруппа, гидроксил, низший алкил или
s которой R — как указано выше; Y радикал общей формулы
О 2 II Сн,-о- —, R
Сн, II
СН -С -О-6—
)
О О
11 г
Х-СЫ вЂ” — С вЂ” СНг СНг Сгде R и R3 имеют значения, приведенные выше, ацилируют ацилирующим агентом обшей формулы
ОН 0
1Aj хн- eH — Сн - сн -С -и
2 2 являющимся производным L - (-) - т ал1ииоц - оксимасляной кислоты, тле JV рк;икал, 576047
02 .К
НО
НО
НО
5
Выбранный иэ группы, содержащей радикалы об.) щей формулы о о
0 х СН2 с 7 - с-Сн — 4-6где R, Y u W имеют указанные выше значения, 1 удаляют блокирующие группы W u Y известным опособом. Когда ЧЧ и Y — радикалы общей формулы образовавшееся соединение гидрируют водородом в присутствии металлическо;о катализатора
I такого, как палладий, платина, никель Ренея, родий, рутений и никель, предпочтительно палладий на угле, в системе вода-растворитель, смешивающийся с волой, например в сь; си волы с пзн>ксаном, ТГФ, . в
Ђ”радикал, выбрайный иэ группы, содер
Жащей радикалы общей формулы
-0 N, -0 И02Ф
/ где R и R — как указано выше, или функ- циональным производным ациЛнрующего агента при использовании не менее 0,5 моль ацилирующего
«1 агента на 1 моль соединения формулы 1, в среде растворителя, такого, как смеси воды и диметилового эфира этиленгликоля, диоксан, диметялацетамид, ДМФА, тетрагидрофуран (ТГФ), диметнловый эфир прапнленгликоля, предпочтительно в смеси ВОды и димечилОВОГО эфира этиленгликоля (1:1), и из образовавшегося соединения общей формулы циметиловыь эфиром этиленгликоля или пропиленгликоля, предпочтительно в смеси воды с диоксаном (1:1), в присутствии каталитического количества ледяной уксусной кислоты.
Дпя получения нетокснчных фармацевтически приемлемых аддитивных солей (моно-, д..-, три- и тетрасоли) к 1 моль целевого соединения добавляют 1 моль нетоксичной фармацевтически приемлемой кислоты, например уксусной, соляной, серной, миндальной, маленковой, фосфорной, азотной, бромистоводородной, аскорбиновой, яблочной и лимонной кислоты.
Для ацнлирования аминогрупп получаемых промежуточных соединений можно использовать
60 ацилирующие агенты, образующие нестойкие груп576047
Значительное повышение температуры, например до 50 С, также сопровождается снижением выхода из-эа протекания побочных реакций.
Во всех примерах ИК-спектр снимают в таблетке с KBr, а ЯМР-спектр в системе ацетон-д, триметилсилан.
Пример 1. Получение 1 - (-) - у бензилоксикарбоннламино - а - оксимасляной кислоты. 55
7,4г (0,062 моль) 1 - (-) - у - амино - а-оксимасляной кислоты добавляют к раствору 5,2 г (0,13 моль) едкого натра в SO мл воды, при леремешивании и 0 — 5 С в течение 30 мин прибавляют по каплям 1,7 г (0,0068 моль) хлора нгидрида 60
7 пы, блокирующие аминогруппы (нестойкие блокирующие группы обычно используют при синтезе пептидов), которые должны легко удаляться изве стным способом.
Функциональные производные ацилирующих агентов для ацилирования первичных аминогрупп могут представлять собой соответствующие хлор- и бромангидриды, ангидриды карбоновых кислот, включая смешанные ангидриды, полученные из более сильных кислот, например низший алифатический моноэфир угольной кислоты, алкил- или арилсульфоновой кислоты и более пространственно затрудненных кислот, например дифенилуксусной кислоты.
Кроме того, можно применять азиды, активные эфиры или тиоэфиры карбоновых кислот (наприжр, с и - нитрофенолом, 2,4 - динитрофенолом, тиофе иолом, тиоуксусной кислотой) или сами свободные кислоты можно сочетать с канамицнном
А или канамицином Б после предварительного взаимодействия указанной свободной кислоты с хлористым N, N - диметилхлорформинием или с применением ферментов, или N,N - карбонилдиимидазола, или N,N - карбонилдитриазола, или алкиниламинового реагента, или кетениминового реагента, или соли изоксазолия.
Другим эквивалентом хлорангидрида является соответствующий азолид, т.е. амид соответствующей кислоты, у которого атом азота амидогруппы является членом квазиароматического пятичленного кольца, содержащего по крайней мере два атома азота, например имидазола, пиразола, триазолов, бензимидазола, бензотриазола и их замешенных производных.
Для получения канамицина, содержащего блокированную аминогруппу в положении 6, рекомен35 дуется регулировать молярное соотношение между реагентами таким образом, чтобы на 1 моль блокированного б - аминоканамицина приходилось не более 1 моль ацилирующего агента.
Увеличение количества ацилирующего агента приводит к снижению выхода целевого промежуточного продукта вследствие протекания большего числа побочных рвакций, сопровождающихся образованием при-месей из одного или нескольких полиацильных соединений, бензилоксикарбоновой кислоты, перемешивают
1 час при этой же температур, промывают смесь
50 мл эфира, подкисляют разбавленной соляной кислотой до рН 2и экстрагируют 4х 80мл эфира, Эфирные экстракты соединяют, промывают небольшим количеством насыщенного раствора хлорида натрия, сушат безв одным сульфатом натрия и фильтруют. Фильтрат упаривают под вакуумом, перекристаллизовывают остаток из бензола и получают 11,6 г (74%) бесцветных пластин, т. пл.
78,5 — 79,5 С; (а) p = 4,5 (с=2, метанол).
ИК-спектр, см : 1740, 1690 (у ).
ЯМР-спектр (б), м.д.: 2,0 (2Н, m), 3,29 (2Н, d».
-d, J= 6,7 и 12 гц), 4,16 (1Н, d g d, J= 4,5 и 8 гц), 4,99 (2Н, $), 6,2 (2Н, широкий), 7,21 (SH, S).
Вычислено,%: С 55,91; Н 5,97; N 5,53.
С z H s ИО .
Найдено,%: С 56,66; Н 5,97; N 5,47.
Пример 2. Получение эфира N - оксисукцинимида 1 - (-) - у - бенэилоксикарбониламино - а° оксимасляной кислоты, Раствор 10,6 г (0,042 моль) 1 - (-); у-бензилоксикарбониламино - a - оксимасляной кислоты и 4,8 г (0,042 моль) N - оксисукцинимида в 200 мл этилацетата охлаждают до 0 С, добавляют
8,6 г (0,042 моль) дициклогексилкарбодиимида, выдерживают в течение ночи в холодильнике, отфильтровывают дициклогексилмочевину, концентрируют фильтрат до 50 мл под вакуумом, образовавшиеся бесцветные кристаллы (6,4 г, т.пл.
1 21 — 122,5 С), отфильтровывают, упаривают фильтрат досуха под вакуумом, промывают кристаллический остаток 20 мл смеси бензола с н-гексаном и получают дополнительное количество целевого продукта. Общий выход 13,4г (92%); (а) p= 1,5 (с= 2, хлороформ).
ИК-спектр, см : 1810, 1755, 1740, 1680 (ус =o
ЯМР-спектр (О), м.д,: 2,0 (2Н, m), 2,83 (4Н, S), 3,37 (2Н, d - d, J= 6,5 и 12,5 гц), 4,56 (1Н, m), 4,99 (2Н,S), 6,3 (2Н, широкий), 7,23 (5Н, S).
Вычислено,%: С 54,85; Н 5,18; N 8,00.
Ci 4Н аО,.
Найде H0,%: С 54,79; 54,70; Н 5,21; 5,20; и 8,14; 8,12.
П р и м.е р 3. Получение 1 - (1 - (-) - у-бензилоксикарбониламино - а - оксибутирил) - б -карбобензоксиканамицина А.
Раствор 1,6 г (4,6ммоль) продукта, полученного в примере 2, в 40мл диметилового эфира этиленгликоля добавляют по каплям к перемешиваемому раствору 2,6 r (4,2 ммоль) 6 - монобензилоксикарбонилканамицина А в 40 мл 50%-ного водного диметилового эфира этиленгликоля, перемешивают в течение ночи, упаривают под вакуумом и получают вещество бурого цвета, которое применяют без дополнительной очистки, Пример 4. Получение 1 - (1 - (-) - у - амино— а - оксибутнрил)»канамицина А.
Неочищенный продукт, получлгный в примере 3, растворяют в 40 мл 50%-по о водного, н<ч..сз: а, отфиль ровывают нера створгппппе «и $ м. < и, 576047
9 добавляют к фильтрату 0,8 мл ледяной уксусной кислоты и 1 г 10%-ного палладия на угле. гидрируют при комнатной температуре в течение 24 час в аппарате Парра дпя гидрировання, удаляют катализатор и упаривают фильтрат досуха под вакуумом. Остаток растворяют в 30мл воды и. хроматографируют на колонне, заполненной ионообменной смолой марки CG-50 (аммониевого типа, размер 50 " 1,8 см1 . Колонну промывают 200 мл воды, элюируют 800 мл 0,1 н. раствора аммиака, 500 мл 0,2 н, раствора аммиака и наконец 500 мл
0,5 н. раствора аммиака. Собирают фракции по
10 мп и фракции 146 — 154, содержащие 552 мг (22%, считая на карбобензоксиканамицин А) продукта В — К8, т. пл. 187 С (разл.), объединяют.
Раствор 250 мг продукта В — К8 в 10 мл воды хроматографируют на колонне, заполненной смолой марки CG-50 (аммониевого пша, размер
30" 0,9 см). Колонну промывают 50 мл воды, элюируют 0,2 н. раствором аммиака, собирая фракции по 10 мл, фракции 50 — 63 соединяют, упаривают досуха под вакуумом и выделяют 98 мг чистого целевого продукта (продукт К8), т.пл. 194 С (разл);; (а)Я =+85 (с= 2,вода), Вычислено,%: С 40,62; Н 6,68; N 9,87.
C» H. з 4 О! з 2Е4 с03.
Найдено,%: С 40,21; 39,79; Н 6,96; 6,87;
N 9,37; 9,49.
Пример 5. Получение N - (бензилоксикарбонилокси) - сукцинимида.
23 r ((00,2 моль) 1ч - оксисукцинимида растворяют в растворе 9 г (0,22 моль) едкого патра в
200 мл воды, при перемешивании и охлаждении водой добавляют по каплям 34г (0,2 моль) хлорангидрида бензилоксикарбоновой кислоты, перемешивают при комнатной температуре в течение ночи, отфильтровывают осадок и сушат на воздухе. Выход 41,1г (82%). После перекристаллизации из сме и бензола с н-гексаном (10:1) получают бесцветные призмы, т. пл. 78 — 79 С.
Пример 6. Получение 6 - карбобензоксиканамицина А.
Раствор 42,5 г (90 ммоль) свободного основания канамицина А в 450 мл воды и 500 мп ДМФА охлаждают до температуры ниже 0 С и тщательна перемешивают, добавляют по каплям в течение
-2час раствор 22,4г (90ммоль) N - (бенэилоксикарбонилокси)-сукцинимнда в 500 мл ДМФА, перемешивают в течение ночи при (-10) - 0 С и s течение одного дня при комнатной температуре, упаривают под вакуумом при температуре ниже
50 С, растворяют маслянистый остаток в смеси
500 мп воды и 500 мл бутанола, фильтруют и разделяют на два слоя. Бутанольньп» и водный слои обрабатывают 2 500 мл воды, насыщенной бутанолом, 21 500 мл бутанола, насьпценного водой, с применением метода противоточного распределения. Три водных слоя соединяют упаривают досуха под вакуумом, к маслянистому остатку, часть ко1орого к рис!алли зуе1ся при комнатной темпера!ура, лоб1влянп --1С(! мл мет: ноля, кото10
10 куумом и выделяют 24,6 г (45%) бесцветного 6 20
- карбобензоксиканамицпиа А, которь|й начинает о плавиться и окрашиваться прн 204 С и разлагаться при 212 С с выделением газа; (n)g — — +106" (с=2, вода). !
В системах и - пропанол - ииридпн - уксусная
60 рый растворяет масло, 11 полученную жидкость отделяют от кристаллов. После доб!Явления -300 мл этанола выдерживают смесь при комнатной температуре в течение ночи и отфильтровывают 44 г кристаллов, содержащих небольшое количество канамицина А (по данным тонкослойной хроматографии в системе н -пропанолпиридин - уксусная кислота - вода (15:10:3:12} при проявлении нннгидрнном)
Неочищенный продукт растворяют в 300 мп воды и хроматографируют на колонне (диаметр
30мм), заполненной смолой марки CG-50 {Яммониевого типа, 500 мп), элюируя О,l н. раствором аммиака и собирая фракции по 10 мл. Пеленой продукт содержится в фракциях 10 — 100, канамнцин А извлекают из менее подвижных фракций. Я один илн несколько изомеров целевого продукта, по-видимому, содержится в более подвижных фракциях. Фракции 10 — l 10 уиаривают иол вакислота - вода; ацетон - уксусная кислот-. - norra (20:6:74); хлороформ - метанол - раствор аммиака
- вода (1:4:2:1) и метилацетат - lr - пронанолраствор аммиака (45:105:60) ири тонкослойной хроматографии (снликягель F, <, проявление нингидрином) величина В1 Лпя 6 - карбобензоксиканамицнна А или канам1щиня А составляет 0.42 (больший), 0,33 н 0,15 (меиыиий); 0,24; 0,76 и
0,22 (с помощью антронсерной кислоты нлн 0,04:
0,14; 0.50 и 0,04 (с помощью Я1пронсерной! кислоты) соответственно.
Конечный продук г, соде ржЯ1цнй два сопутствующих компонента (ио данным тонкослойной хроматографии), применяют без послелуняней очистки для получения продук-.,à БВ- КЙ.
Пример 7. 1!Олученис L - (-) З - амино - Ооксимяслянои кислоты.
5,0 г амбуп1розиня н 160 мл 0,5 и. едко!о lla lpa кипятят 1 час с обратньгм хололн!н н11кол1, нейтрализуют тидролизат 6 н. соляной кисл нО1! л хр1матографируют на колонне, заполненной смолой марки CG-50 (Яммонисвого ниа) . проявляют колонну водой и уля1ья1о| волу лнофплыгой сушкой. Получают крнстяплп песк Ос веще ство, т. пл. 212,5 — 214,5 С.
Пример 8. Получе1п1е 6 - карбобензоксикянамициня Б.
К охлажденному раствору 8,1 г {0,0168 л1О!1ь| канамицнна Б в 120 мл волы н 80 мл 1," . диметоксизтана добавля1ог но ка11лял! лри перемешиваш1и раствор 4,2 г (0,0168 моль) N - (бензил. оксикарбонилоксн) - сукцлнимида в 40 мп 1,2диметокснзтяня, леременл1вяют в течение ночи и упарнва1о иод вякуул1Оч. рясгворяют остаток в
100 мл в1ьчы и взба п11ван1 дважды с 50 мл н-бутанОля, иясь!11гегпlОГО воi! )й1 Водный слОЙ Отдеilflrol, 576047
11 адсорбируют иа колонне, заполненной смолой
CG-50 (аммониевого типа), промывают колонну
2 10 мл воды, злюируют 0,05 н. раствором аммиака и собирают фракции по 10 мл. Фракции 121-180 собирают, упаривают, подвергают лиофильной сушке и получают 1,58 г (15%) целевом продукта.
Фракции 1 — 120 упаривают, хроматографируют иа колонне, заполненной смолой С6-50 (аммониевого типа) и получают 1,21 r (12%) продукта, т. пл. 151:152 С (разл); (а) 4 = +104 (с=2,5, вода).
ИК-спектр, см : 1710 (у С, О ).
Вычислено,%: С 50,56; Н 7,02; 1ч 11,34.
С2бН4 з Ь4 012.
Найдено,%: С 50,71; Н 7,38; N 11,48.
А I
Rg в системе н - пропанол - пиридин - уксусная кислота - вода (15:10:3:12) и ацетон - уксусная кислота - вода (20:6:74) составляет 0,03 и 0,16 соответственно.
Пример 9. Получение 1 - (1 - (-) - у.беизилоксикарбониламино - а - оксйбутирил);- 6 - карбобензоксиканамицина Б.
К перемешиваемому раствору 1,85 r (3,0ммоль) 6 - карбобензоксиканамицина Б в
40 мл воды и 50 мл 1,2 - диметоксиэтана при 5 С добавляют сразу 1,1 г (3,1 ммоль) N - (L - у-карбобензоксиамино - а-оксибутирилокси) - сукцинимида, перемешивают в течение ночи при комнатной температуре и подвергают гидрогенолизу без выделения карбобензоксипроизводного. Вг в тех же системах, что и в примере 8, 0,06 (исходный материал), 0,41, 0,57 и 0,11 (исходный материал), 0,21, 0,34, 0,46 соответственно.
В примерах 8 и 9 для тонкослойной хроматографии используют силикагель F2 z 4.
Пример 10. Получение 1 -, L - (-) - y - anew- a - оксибутирил) - канамицина Б.
К раствору, полученному по методике примера
9, добавляют 0,2г 10%-ного палладня на угле, гидрируют при атмосферном давлении в течение
5 час, добавляют 0,1 г 10%-ного палладия на угле и
10 мл воды, гидрируют в течение ночи, фильтруют, упаривают фильтрат под вакуумом, растворяют остаток в 50 мл воды и хроматографируют на колонне, заполненной смолой CG-50 (аммоние ого типа, 1,2 50 см). Колонну промывают 200 мл воды, элюируют 500 мл 0,1 н, раствора аммиака, 500 мл 0,2 н. раствора аммиака, 900 мл 0,5 н. раствора аммиака и 500 мл 1 н. раствора аммиака, собирая фракции по 10 мл. Канамицин Б извлекают из фракций 60 — 76. Выход 459 мг (72%). Фракции
128 — 138 упаривают под вакуумом, подвергают лиофильной сушке и получают 318 мг (17% в пересчете на карбобензоксиканамицин Б) целевого
-продукта (продукт ВВ K26), т. пл. 186 — 187 С (раэл.), (a)> = +78 (с=1,15, вода).
ИК-спектр, см : 1640 (ус О ).
Вычйслено,%: С 42,72„Н 7,17; и 13,00, С22Н44Nб А)2, Н2CC 3Найдено,%: С 42,23; Н7,19; и 12,37.
При тонкослойной хроматографии (силн.сагель
F2,4, нингидрии) в системе ацетон - уксусная
5 !
О кислота - вода (20, б:74) и хлороформ - метанол . концентрированный раствор аммиака;вода (1:4:2:1) Ry составляет 0,11 и 0,19 соответственно.
Фракции 201 — 222 упаривают под -вакуумом, подвергают лиофильной сушке и получают 209 мг (12%) продукта ВВ-К27, т. пл. 183 — 184 С (разл.), ИК-спектр,см : 1750 (у ).
Вычислено,%: С4272; H7,17; N 13,00, С2 2 Н44 Йб О g Н2 С02 °
Найдено,%: С 42,25; Н6,93; N 12,18;
При тонкослойной хроматографии на силикагеле F»4 в тех же системах, что указано выше, Rg равно 0,15 и 0,07 соответственно.
Пример 11. Получение L - (-) - у - амино - а15 Оксимаслянои кислоты.
К раствору 25г (0,1 моль) 2 - окси - уфталимидомасляной кислоты в 200 мл этанола добавляют раствор 29 г (0,1 моль) дигидроабиетиламина в 130 мл зтанола, тщательно взбалтывают
1 мин, выдерживают 5 час при комнатной температуре, отфильтровывают тонкие игольчатые кристаллы, промывают их 50 мл этанола, сушат на воздухе и получают 30,1 г (56%) 1 - a- океи -у-фталимидобутирата дегидроабиетиламмония, т.пл. 9394 C; (ajт2т = +15 (с= 2,5,метанол).
После перекристаллизации из 300мл этанола получают 23,2 г (43%) чистого продукта, т. пл. 94—
95 C; (a) 24 = +10,8 (c=2,5, метанол), Дальнейшая перекристаллизация не влияет на величину констант.
Вычислено,%: С 69,54; Н 8,02; N 5,07.
С22Н42М20б Н20.
Найдено,%: С 69,58; Н 8,08; N 5,07.
К раствору 1,5 r ((00,014 моль) карбоната натрия в 40 мл воды добавляют 5 3 г (0,01 моль) L - аокси - у - фталимидобутирата дегидроабиетиламмовня и 60 мл эфира и тщательно взбалтывают до почти полного растворения всех твердых компонентов. Эфирньй слой отделяют, водньй слой
4О промывают 2 20 мл эфира и упаривают до обьема
15 мл под вакуумом. К остатку добавляют 10 мл концентрированной соляной кислоты, кипятят
10 час с обратным холодильником, охлаждают, отфильтровывают фталевую кислоту, упаривают
45 фильтрат под вакуумом, растворяют остаток в
10 мл воды и упаривают досуха. Эту операцию повторяют дважды (удаление избытка хлористого водорода). Сиропообразный остаток растворяют в
10 мл воды, фильтруют, адсорбируют фильтрат в колонне, заполненной смолой l R-120 (водородного типа, размер 1 х 3,5 см), промывают колонну
300 мп воды и элюируют 1 н. раствором аммиака, собирая фракции по 15 мл. Фракции 10 — 16 с положительной ниигидринной пробой объединяют, упаривают под вакуумом, наблюдая образование постепенно кристаллизующегося сиропа, растирают кри",галлы с этанолом, фильтруют и сушат в вакуум - эксикаторе. Получают 0,78 г (66%) L - (-)- у - амино - a - оксимаслянэй кислоты, т. пл. 206— бо 207 С, (а) a+4 = -29 (с=2,5, вода) 57п04
13!
СНг — ЯН
НО, СНгОН О
55 сн ! )!
СН вЂ” С вЂ” 0 — С вЂ” И
Ъ
9
613
ИК-спектр поглощения идентичен с ИК-спектром образца, получепшям из гмбутирозина.
Пример 12. Получение моносульфата 1- (1-(-) - 7- амино - а - оксибутирил) - канамицина А или канамицина Б.
1 моль 1 - (1. - (-) - 7 - амино - а - оксибутирил) - канамицина А или канамицина Б растворяют в 1 — 3 л воды, фильтруют, охлаждают, при перемешивании добавляют раствор 1 моль серной кислоты в 500 мл воды, перемешивают 30 мин, добавляют холодный этанол, отфильтровывают осадок и получают целевой моносульфат.
Пример 13. Получение дисульфата 1 - (1 - (-)
- 7 - амино - а - оксибутирил) - канамицина А (ВВКВ 2HgSO4) !
35 г 1 - (1 - (-) - 7 - амино - а - оксибутирил)канамицина А (тригидрат монобикарбоната растворяют в 125 мл деионизированной воды (pH -9,0), подкисляют 50%-ной серной кислотой до рН 7 — 7,5, 20 добавляют 8,6 r активированного угля "Дарго
G-60" и перемешивают 30 мин при комнатной температуре, Уголь отфильтровывают, промывают
40 мл воды, добавляют промывные воды к фильтрату, подкисляют 50 -ной серной кислотой до рН
2 — 2,6, наблюдая выделение большого количества двуокиси утлерода, и перемешивают 20 мин под вакуумом для удаления избытка двуокиси углерода.
К дегазированному раствору добавляют 8,5г
30 активированного угля "Дарго G-60", перемешивают 30 мин при комнатной температуре, отв которой R - окси- или аминогруппа, или их солей, отличающийся тем, что канамицин А или канамицин Б ацилируют ацилирующим агентом, выбранным из группы соединений обшей формулы
0 О, г JJ сн,— о- с-о — и
Къ
L 0 / ьо фильтровываюг уголь, промывают 35 мл деионпзи рованной воды и добавляют волу к фпльтргту.
Объединенные фильтргт и промывные воды подкисляют 50%-ной серной кислотой до рН 1 — 1,3, при перемешивгпии в течение 10 мин выливают в
600 — 800 мл метанола (3 — 4 объема метанола), перемешивают 5 мин при рН 1-1,3, пропускают через сито (100 меш), перемешивают 2 мин и отстаивают в течение 5 мин. Большую часть верхнего слоя декантируют, фильтруют шлгм, промывают
200 мл метанола и сушат под вакуумом при 50 С в течение 24 час. Выход аморфного продукта 33--34 г, т. разл. 220 — 230 С; (а) — — +74.75 (водг).
Найдено,%: С 32,7; 33,5; 32,3; N 8,78; 8,7;
8,2; 8,8; S 8,75, 8,9; 7,8; 8,85.
Вычислено,%: С 33,5; N 8,97; S 8,2.
Данные элементарного анализа приведены цля сухого вещества.
Продукт не содержит золы. Содержание воды (по Карлу Фишеру) 2,33, 1,79, 2,87% (теоретически моногидрат содержит 2,25% воды). Соль гигроскопична, но не разжижается. После хранения части пробы на воздухе при комнатной температуре в течение 18 час содержание воды повышается до
9,55, 9,89% (теоретически пентагидрат содержит
10,33% воды).
Формула изобретения
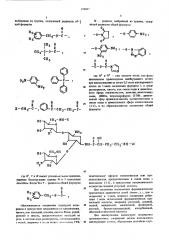
1. Способ получения производных кангмицина общей формулы
О
ll
МН- С- ea — Сн,— Сн,-мн, ОН
Rã J) сн2- О-e — x, В3
576047
02М
025
02, 1
1 -6 ; -рн или его карбодиимида, или
II
6 C1i.2 СН2 МООЫ
НО
Н0
0
II
Х- СН вЂ” 6—
1. н, (И
-0
Æ02% 0 Х
М4
%02
СН O е Д
4!Н -C-0-С—
Ъ 1 (Н0
-с-о-с-я 1 =м
0 Сп ®1
М- C — - 0-6-C K
О2
CB.g
Х
II х-Ск -4 -х или его карбодиимида, где Я и Яз - одинаковые или различные, водород, фтор, хлор, бром, нитрогруппа, гидроксил, низший ыкил или низшая алкоксигрутша; Х - хлор, бром или йод, или функциональным производным этих соединений, полученное соединение общей формулы в которой R имеет значения, приведенные выше; Y - радикал общей формулы
0 2 II
Cm -O-C—1
О О
10 II Il -0П2-С-, - С-СН -В - 2 где R и R3 имеют указанные выше значения, ацилируют ацилирующим агентом общей формулы
ОН 0
I II
W-Xn-Cn -СН -CH-0-
2 2
20 являющимся производным 1 - (-) - у - амино; а - оксимасляной кислоты, в которой W - радикал, выбранный из группы, содержащей радикалы общей формулы
О2М
В сн20 С
О 0 у I !1 Il
С- Щ -CH — С- >. 2 2
М вЂ” радикал, выбранный из группы, содержащей радикалы общей формулы
0%
-0-М е
P / Ì02
2 7
60 где R u R — как указано выше, или его, 2 3
576047 бн2 Мн Y
НО
Н2М 0
ОН
Составитель Е. Соколова
Техред К Асголош
Корректор )L Мел ыи<ченко
Редакто р Т. Карганова
Тираж 553 Подписное
ЦНИИПИ Государственного комитета Совета Министров СССР по делам изобретений н-открытый
1! 3035, Москва, Ж-35, Раушскан наб., д, 4/5
Закаэ 2756/4<) Филиал ППП "Патент", г. Ужгород, уп. Проектная, 4
17 функциональным зквивалеитом, таким, как ацилирующий агент для первичного амина, s соотнопюнии не менее 0,5 моль ацилирующего агента на в которой R, Y u N имеют значения, приведенные sauue, блокирующих групп Yи :Ф и выделением
1 моль соединения фо1,мулы 1, в среде раствори- теля, с последующим удалением в синт<эзироваииом соединении общей формулы целевого продукта или превращением его в соль известными приемами.