Способ получения производных просцилларидина
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕН ИЯ (61) Дополнительный к патенту (22) Заявлено;25.07.7й(2)) 2162229/04
Союз Советских
Сов1иалистических
Республик ((() 578(.)07 (51) М. Кл.в
С 07 J 19/00 (23) Приоритет - (32) 05.08.74 (53) 1ДК 547.689.6..07 (088.8) Государственный номвтвт
Совете Мвннстрае СССР ее делам нэобрвтвннй е етхрмтнй (3t) Р 2437693.0 (33) фр1 (43) Опубликовано 25.10.77. Бюллетень М 39 (45) Дата. опубликования описаннФ27.10.77
Иностранцы (72) Авторы Вальтер leaem» Вернер 1 раунэккер и Вольфганг Х е изобретения (фРГ) Иностранная фирма К. Х. Берингер Зон (фРГ)
;71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ПРОСЦИЛЛАРИДИНА т4 в.
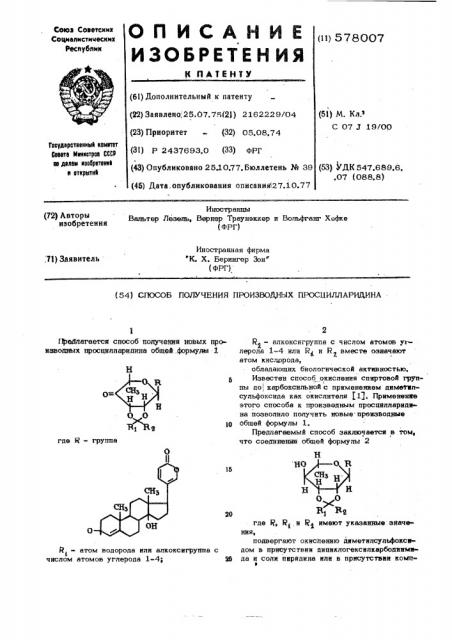
10 где Й - группа
1б
1
Предлагается способ получения новых производных просцилларидина общей. формулы 1
Й - атом водорода или алкоксигруппа с
1 числом атомов углерода 1-4; М
1т - алкоксигруппа с числом атомов уг2 лерода 1-4 или R< и R вместе означают и атом кислорода, обладающих биологической активностью.
Известен способ окисления спиртовой груя1 пы до(карбоксильной с применением диметилсульфоксида как окислителя j1$. Применение этого способа к производным просциллариднна позволило получить новые- преизводиые общей формулы 1.
Предлагаемый способ заключаетси в том, что соединения общей формулы 2
О O
В Бд
me Re R и К имеют указанные значения подвергают окислению диметилсульфоксндом в присутствии дипиклогексилкарбодиимада и соли пиридина или в присутствии компФ
578007 лекса не основе пиридина/трехокиси серы v, триэтиламина, Реакцию проводят при комнатной температуре при необходимости в при-! сутствии безводного инертного опганического растворителя. Пригодными растворителями являются, в частности, ароматические углеводороды, например бензол или этилацетат, поскольку образующаяся дициклогексилмо вина нерастворима в этих средах, а выпадает в осадок.
Исходные соединения общей формуль! 2 можно получать из проспилларидина A путем реакции обменного разложения в присутствии кислого катализатора с тетраалхильными эфирами ортоугольцой кислоты или триелкильными эфирами ортомуравьиной кислоты или путем реакции обменного разложения с активным производным угольной кислоты, таким ! квк 1,1 -карбонилдиимидазор, бензиловый эфир имидазол- Й -карбоновой кислоты, эфи- g(} ры хлоругопЬной кислоты, фосген или эфиры пироугольной кислоты, при необходимости с добавлением связывающего кислоту средства. !
Пример 1. Зр -(2, 3 -Метоксиме- 25 ! 4 тилиден-4 -оксо-n L -рамнозил)-14/3-оксибуфа-4,20,22-триенолид, К 1,720 r (3 ммоль) 2,3 -метоксиме-. тилиденпросцилларидина,растворенного в 30 мл абсолютного циметилсульфоксиде, добавляю! ЗО
650 мг (6 ммоль) гидрохлорида пиридиния и 3,7 r (18 ммоль) дициклогексилкарбодиимида и в течение 1-2 час .перемешивают при комнатной температуре, -Окончание реакции устанавливают с помощью тонкослойной 35 хроматографии. В реакционную смесь добавля ; ют 100 мл этилацетата, .отсасывают, в филь рат вводят 500 мл воды, органическую фазу отделяют. Промывные растворы еще раз-встряхивают с 50 мл этилацетета, органические и фазы соединяют, сушат сульфатом натрия и упаривают досуха. Остаток очищают, пропуская его через колонку с силикагелем (0,20,5 мм), элюентхлороформ/уксусный эфир в соотношении 2:1, и кристаллизуют из смеси 45 хлороформ/петролейный эфир, выход 1,47 г (86% от теоретического)»т. пл. 213-, 215оС.
Пример 2. Зф-(2,3 -Метоксиметилиден-4 -оксо- о(- L -рамнозил) -1 4Р -оксибуфа-4.,20,22-триенолид; 50
К 2,00 r (3,5 ммоль) 2, 3 -метоксиметилиденцрб»=циллеридина,1растворенного в смеси из 10 мл абсолютного диметилсульфокси да и 5 мл триэтилемина, добавляют раствор
1,8 г (ll ммоль) комплекса на основе пири- у дина/трехокиси серы в 10 мл абсолютного диметилсульфоксида. По истечении 1 чвс в раст вор вводят этилацетат и встряхивают по очереди с 2 н. соляной кислотой, 5%-ным раствором бикарбоната натрия и додой. После cyt»»-!60 ки безг одным сульфатол» натри»!. раствор упери»»еют досуха. (3статок бычище»от, пропускают его через колонку,с силикагелем (0,20,5 л»м), элюент хлороформ/ухсусный эфир в соотношении 2; 1, выход 1,22 г (6 1% от теоретического), т. пл, 2 1 1-2 16оС. !
Пример 3. 3/3-(2,3 -этоксиэтилн- ден-4 -оксо-p(— L -рвмнозил) «1 1/3-оксибуфе-4,20,22-триенолид.
2, 35 г (4 ммопь ) 2, 3 -этоксиэтили ден,! просциллеридина подвергают взаимодействию с диметилсульфоксидом в присутствии гидрохлориде пиридиния и дициклогехсилкарбодиимида аналогично примеру 1. После очистки нв колонке с силикагелем (0,2-0,5 мм), элюенr-хлороформ/уксусный эфир в соотношении 2:1, получают 2,12 г продукте (87% от теоретического), т. пл. 113-1.15 С. ,»
Пример 4, Зф-(2,3 -).»иметоксиме ти ли де к-4-окс о-ос- » -р ам ноз ил ) -1 4/3-окс ибуфе 4,20,22-триенолид.
1,81 r (3 ммоль) 2, 3 -диметоксиметили-! денпросцилларидина растворяют в смеси из
10 мл диметилсульфоксида и 5 мл триэтил емина и добавляют 1,75 r (11 ммоль) комплексе на основе пиридина/трехокиси серы в
100 мл диметилсульфоксида. По истечении приблизительно 30-50 мин реакционную смесь разбавляют этилацететом, добавляют приблизительно 10-кратное количество воды и после довательно промывают 2 н. соляной кислотой, 5%-ным раствором бикарбоната нетрия и водой. После сушки над сульфатом натрия уперивают досуха и остаток на колонке с силикагелем (0,2-0,5 мм), элюент хлороформ/ уксусный эфир в соотношении (3:1), хроматогрвфируют. Кристеллизуют из смеси уксусный эфир/петролейный эфир, выход 1,23 r (68% от теоретического), т. пл. 190-191 С, Пример 5. Зф-(2,3 -Циэтоксиметилиден-4 -оксо- »х — ),-рвмнозил) -14P -оксибуфа-4,20,22-триенолид.
1,89 г (3 ммоль) 2,3 -диэтоксиметили( иенпросцилларидина в 30 мл диметилсульфоксиде подвергают взаимодействию с 650 мг (6 ммоль) гидрохлорида пиридиния и 3,7 r (18 ммоль) дициклогексилкарбодиимида и смесь обребатывают аналогично примеру 1, После хроматографии на колонке с силикагелем (0,2-0,5 мм), элюент-хлороформ/ уксусный эфир в соотношении 2:1, получаю!
1,52 r продукта (81% от теоретического), т. пл. 106-107оС. !
Пример 6. 3/5-(2,3 -Циклокарбонил-4-оксо-оа - L -рамнозил)-14р -оксибуфв-4,20, 2-триенолид, 1,67 г. (3 ммоль) просцилларидин-2, 3-циклокврбонате подвергают взаимодействию с 650 мг (6 ммоль) хлоридв пиридиния и
3,7 r:(18 ммоль), дициклогексилкербодиими578007
О 0
H Rs где 9 - группа
Составитель A. Анисимов
Редактор О. Кузнецова Техред И. Гоксич Корректор С. L! :..кмар
Заказ 3251/55 Тираж 553 Подписное
ЦНИИПИ Государственного комитета Совета Министоов СССР по делам изобретений и открытий
113035, Москва, Ж-35, Ра чшская наб„д. 4/5
Филиал !!Г!П Патент", г. Ужгород, ул. !!роектная, 4 да в 30 мл абсолютного диметнлсульфоксида и смесь обрабатывают аналогично примеру 1, После хроматографического разделения реакционной массы на колонке с силикагелем (0,2-0,5 мм), элюент-хлороформ/уксусный эфир в соотношении 2:1, получают 153 мг продукта.
Формула изобретения
1. Способ получения производных просцилларидина общей формулы
Н!
Г - атом водорода или алкоксигруппа с числом атомов углерода 1-4; ! т — алкоксигруппа с числом атомов уг»
2 лерода 1-4 или Р и h вместе означают
2 атом кислорода, отличающийся тем, что соединение общей формулы где R, R и !т имеют указанные значе2 нияр подвергают окислению диметилсульфокси д м в присутствии дициклогекснпкарбодинми да и соли пиридина или в присутствии комплекса на основе пиридина трехокнси серы и триэтиламина с последующим выделением целевого продукта.
4 .. Способ по п. 1, о т л и ч а ю щ и йс я тем, что реакцию проводят при комнат ной температуре, Источники информации, принятые во внимание при экспертизе
a. x.aine!!es.v.g., нет! еп.то1Леа vv.L., у.6 .С! атп. Бас.. 4.йМ g5 Г96.