Способ получения -(метоксиметил) фурилметил-6,7- бензоморфанов или морфинанов или их солей
Иллюстрации
Показать всеРеферат
ОПИСАНИЕ
ИЗОБРЕТЕН ИЯ
Союз Советских
Социалмстимеских
Республик (11) 578870
{61) Дополнительный к патенту(22) Заявлено25.10,74 (21} 2069685/04 (51) M. Кл
С 07 D 221/26
//А 61 К 31/485 (23) Приоритет - (32) 27.10.73 (31) Р 2354002,5 (33) ФР1 (43) Опубликовано 30,10.77 Бюллетень № 40 (53) УДК547 ° 834..2 (088,8) (45) Дата опубликования описания10.12.77
Иностранцы
Герберт Мерц, Адольф Лангбейн, Герхард Вальтер и Клаус Штотскхаус (ФРГ) (72) Авторы изобретения
HHOCTpBHH&H фирма лК. Х. Берингер ЗотР(ФРГ) (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ 5 -(МЕТОКСИМЕТИЛФУРИЛМЕТИЛ)-6,7 БЕНЗОМОРФАНОВ ИЛИ -МОРФИНАНОВ
ИЛИ ИХ СОЛЕЙ
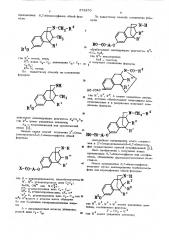
Изобретение относится к способу получения новых производных ряда бензоморфанов или -морфинанов, обладаюших пенными фармакологическими свойствами, обшей формулы
l0 или г где К и R — одинаковые или различные и 20 означают атом водорода или алкил С - С;
h — атом водорода или метильная груп1 па (бензол|орфаны) или R u R вместе образуют 1,4-бутиленовую цепь;
К вЂ” атом водорода (-морфинаны);
В литературе широко описаны различные способы получения производных бензоморфаg5 нов, в частности, известен способ получения
Гооудвротвенный ноинтет
CoBBTI Мнннстров СССР
Во делам нзобретеннй н открытий
-СН -В ф
2 з
И
R - метоксиметилфурильный радикал фо
4 мулы
5 и R - атом водорода, метильная или ацетиль« ная группа, или их солей.
578870
СН -Я
НО-СО A-О
1О d обрабатывают ацилирующим реагентом R-CO- «»а8
6 где «т - циклопропил;
На(— галоген; и получают соединение формулы
В О
-СО-R
ЦО-СОА0
25 где Й . Й, Р, А имеют указанные значения, которые обрабатывают подходящим abcстановителем и в результате получают соединение формулы
-СН -В
2 действуют алкилирующим реагентом «2(4СН А, 4 4 3 «(э где 4 - имеет указанные значения;
А(2 — неорганический или органический анион (1).
Описан также способ получения 2 (гипМ роксиалкокси)-6,7-бензоморфанов обшей формулы
-Н
Я 3
И где 6 - циклопропилметил, циклобутилметил;50
R, Ц вЂ” углеводородные цепи С-С ; (Х-GHý ОК 2faH и т э (((- 4
Р - углеводородная цепь С С,>.
Hl
В - Н, углеводородная цепь С - С4 Ф г с R = ««, углеводородная цепь С1- С* или 55
8 и R вместе с атомом азота обпазуют
5- или 6-члеиное гетероциклическое коль цо;
А - двухвалентный остаток углевод родной цепи С, С . бО производных 6,7-бензоморфанов обшей формулы
1 где R - метил, этил;
R — алкил С -.С, циклоалкил С - С
4 я 5
Сб «»» э
К» - Н, метил.
По известному способу на соединение формулы
По известному способу соединение фор- мулы йальнейшее превращение этого соединения в 2 -(гидроксиалкокси)-6,7-бензоморJ фан осуществляют прямой этерификацией (2j.
Бель изобретения - получение новых . производных 6,7-бензоморфанов или -морфинанов, обладающих фармакологическими своиствами.
Новые производные 6,7-бензоморфанов получают путем алкилирования норбензоморфана или норморфинана обшей формулы
К 3 где 8, 8-, К и R имеют указанные значения, соединением формулы
У-СН - К
r ge Ц имеет указанное значение;
578870
У вЂ” нуклеофильно уйаляемая группа, такая, как хлор, бром или йод, h -толуолсульфонил, . триметиламмоний и бензолсульфонильная группа.
Применяют эквимолярное количество или избыток алкилирующего средства и процесс проводят преимущественно в присутствии связывающего кислоту средства, например карбоната натрия или калия, гидрокарбоната натрия, триметиламина. 10
Работают в инертных растворителях или в смеси растворителей (тетрагидрофуран и диметилформамид). Температуру реакции поддерживают в пределах точки кипения растворителя или смеси растворителей. 15
Предлагаемые соединения являются основаниями и могут быть переведены обычным способом в соли минеральных или органических кислот (соляная, метансульфоновая, щавелевая) .
Способ позволяет получать как рацематы, так и оптические активные антиподы, предпочтительно L (-)-формы предлагаемых соединений.
Пример 1. 5,0-с(-диметил-2-(2-ме- 25
l токсиметилфурил-(3)-метил-2 -окси-6,7-бензоморфанметансульфонат.
1,63 г (7,5 ммоль) 5,9- с(-диметил-2 -окси-6,7-бензоморфана с 1 г гид окарl боната натрия и 1,31 r (8,25 ммоль 3- 30
-хлорметил-2-метоксиметилфурана в 10 мл абсолютного диметилформамида и 15 мл абсолютного тетрагидрофурана в течение 4 ч, размешивая, кипятят с обратным холодильником. Затем в ротационном выпарителе под 35 вакуумом упаривают и остаток зкстрагнруют
35 мл хлороформа и 35 мл воды путем встряхивания. После отделения хлороформовой фазы водный раствор экстрагируют еше
2 раза, каждый раз 15 мл хлороформа пу- 40 тем встряхивания. Соединенные хлороформьвые растворы промывают 30 мл воды, суIlIQT сульфатом натрия и упаривают в вакууме. Остаток от упаривания состоит из сырого продукта превращения, который с помощью метансульфоновой кислоты переводят в соответствующий метансульфонат. йля этого растворяют остаток основания примерно в 10 мл метанола, раствор подкисляют
0,72 г (7,5 ммоль) метансульфоновой кис50 лоты. После добавления к раствору абсолют- ного простого эфира до начинающегося помутнения кристаллизуется указанное соедине ние. Нля окончания кристаллизации раствор оставляют стоять в холодильном шкафу в течение ночи. Затем отсасывают и промывают примерно 5 мл смеси метанол-эфир (1:2), затем 10 мл простого эфира. Кристаллизат сушат сначала на воздухе, затем о при температуре 80 С, Выход 2,9 r (88,5% от теории); т. пл. о
220-225 С. После перекристаллизации из о смеси метанола эфира т. пл. 224-225 С.
Пример 2. Гндрохлорид 5,9- с(-диметил-2-(2-метокс ил етил-фурил- (3 ) -ме тил )f
-2 -мет окс и-6, 7-бензоморфа на.
2,68 r (0,01 моль) гидрохлорипа 5,94
- d.-диметил-2 -метокси-6,7-бензоморфана подвергают взаимодействию с 1,75 г (0,01 1 моль) 3-хлорметил-2-метоксиметилфурана и 2,1 r гидрокарбоната натрия в
15 мл диметилформамида и 25 мл тетрагипрофурана при размешивании и кипячении в течение 4 ч с обратным холодильником.
Реакционную смесь аналогично примеру 1 разделяют и продукт реакции кристаллизуют в виде гнпрохлорипа. Йля этого остаток от упаривания экстрактов хлороформа растворяют в небольшом количестве абсолютного этанола (примерно 10-15 мл), раствор подкисляют 4 мл 2,5н. зтанольной соляной кислоты и к нему добавляют абсолютный простой эфир до начинающегося помутнения. Раствор с выпадающими кристаллами оставляют отстаиваться в течение ночи в холодильном шкафу. Затем отсасывают, промывают сначала смесью этанола с простым эфиром (1:2, и затем простым эфиром. Пос1 ле высушивания на воздухе и затем в суо шильном шкафу при 80 С получают указанное соединение с выходом 2,5 г (66".< о от теории); т. пл. 140-142 С.
После перекристаллизации из смеси этанола и простого эфира т. пл. повышается до
142-144 С.
Пример 3. 5,9-ck-диэтил- -оксн/
-2-(2-мет оксиметил-фурнл-(3)-метил)-6,7-бензоморфанметансульфонат.
Из 1,83 r (7,5 ммоль) 5,9- К-диэтил4
-2 -окси-6,7-бензоморфана аналогично примеру 1, путем взаимодействия с 1,32 r
2-метоксиметил-3-хлорметилфурана получают указанное соединение с выходом 2,8 r (80% от теории); т, пл. 172-174 С ° После перекристаллизации пз 90%-ного из смеси о этанола и простого эфира т, пл. 173-175 С.
Пример 4. 2 -Оксн-2-(2-метоксит ме тилфурил- (3 ) -ме тил )-5-метил-6,7-бензоморфанметансульфона.
Из 1,52 г 2 -окси-5-метил-6,7-бензоf морфана аналогично примеру 1 путем взаимодействия с 1,32 r 2-метоксиметил-3-хлорметилфурана получают указанное соединение с выходом 1,8 r (57Ъ от теории); о т. пл. 160-163 С (она не изменяется после перекристаллизацпи пз смеси этанола и простого эфира. т
Пример 5. 2 -Оксп-2-(2-метоксиметил-фурил«(3)-метил)-5- Н -пропил-6,7-бензоморфанметансульфонат.
578870
Из 1,73 г (7;5 ммоль) 2 -окси-5I
- H-пропил-6,7-бензоморфана аналогично примеру 1 путем взаимодействия с 1,32 г
2-метоксиметил-3-хлорметилфурана получают указанное соединение. Выход составляет
2,8 г (82,5% от теории); т. пл. 187-190 С.
После перекристаллизации из смеси этанопа о и простого эфира т. пп. 189-191 С.
Пример 6. 5,9-с -диметил-2-(21
-метоксиметипфурил-(3)-метил)-2 -окси
-6,7-бензоморфанметансульфонат.
1,63 r(7,,.5 ммоль) 5,9-d,-диметил-2-окси-6,7-бензоморфана, 1,5 r карбоната калия и 1,5 г 3-бромметил-2-метоксиметипфурана в 10 мл диметилформамида и
15 мл тетрагидрофурана нагревают с обратным холодильником при размешивании в течение 3 ч. После переработки аналогично примеру 1 получают 2,35 г метансульфоната с т. пл. 223-224 С.
Пример 7. 5,9 с(-диметил-2 -окси-2-(2-мет оксиме тилфурип-(3)-ме тил)-6, 7-бензоморфанметансупьфонат.
В смеси из 10 мл диметилформамида и 15 мл тетрагидрофурана кипятят в течение 1 ч с обратным холодильником 1,3 r
3-хпорметил-2-метоксиметилфурана и 1 г триметипамина. В раствор добавляют 1,83 г (7,5 моль} 5,9-4-диметип-2 -окси-6,7/
-бензоморфана и смесь нагревают с обратным холодильником в течение 2 ч.
B результате переработки аналогично примеру 1 получают 2,79 г метансульфоната с т. пп. 174-175 С. о
"1 у - -- — 35
Пример 8. 2 -окси-2 (2-метоксi : метил-фурип-(3)-метил) 5-метил-6,7 бензоморфанметансул ьфонат, В смеси из 10 мл диметилацетамида и
10 мп тетрагидрофурана с обратным
40 холодильником кипятят в течение 1 ч
1,7 5 г 3-окси метил-2-метоксиметилфурана ч эквимопярное количество хпорида П - топуопсульфокислоты. После охлаждения добавляf ют 1,8 r 2 -окси-5-метил-6 7-бензомор45 фана и раствор кипятят: с обратным холодильником в течение 3 ч. В результате переработки аналогично прил еру 1 соединение получают с выходом 74% от теории;
r, пп. 160 161 С.
Пример 9. Метансульфонат; 5 9-Й.! е диметип-2 -окси-2-(2-метоксиметил- фурил- (3 ) -ме тп и )-6,7-бензолюрфана.
Е смеси из 10 л л диметипформамида и
15 мп тетрагидрофурана добавляют 1,0 г
3-йод петли-2-метокспметипфурана, 1 г гп цюкарбоната натрия и 1,83 г (7,5 ммоль)
5,.>- А-диметип- d -окси-6,7-бензолюрфана
А 1
ti смесь нагревают в течение 2 ч с обрат и м холодильником, Переработку проводят
«напогично примеру 1.
Получают 85 г метансульфоната с т. пп.
174-175 С.
Пример 10. Метансульфонат 2-окси-2-(2-метоксиметилфурил-(3)-метил)-5«метил-6,7-бензоморфана, 1,75 r 3-оксиметил-2-метоксиметилфурана и эквимолярное количество хлорангидрида бензолсульфоновой кислоты нагревают в течение 2 ч с обратным холодиль ником в смеси из 10 мл диметилацетамида и 10 мп тетрагидрофурана. После охлажде
I ния добавляют 1,8 r 2-окси-З-метил-6,7-бензочорфана и раствор кипятят в течение
3 ч с обратным холодильником. Переработку проводят аналогично примеру 1.
Получают указанное соединение с выходом 87% от теории; т. пл. 160-161 С.
Формула изобретения
1. Способ получения И -(метоксиметилфурилметил)-6,7-6ензоморфанов или -морфинанов обшей формулы
СК -В з р2 цбо с где 1 и Pi — одинаковые или различные и означают атом водорода или алкил С - С;
К атом водорода ипи метипьная группа (бензоморфаны) > ипи R u R вместе 1,4-буZ
3 типеновая цель, Р атом водорода (-морфинаны), 4
К вЂ” метоксиметилфурильный радикал формулы
К - атом водорода, метипьная ипи апетипьиая группа, или их солей, о т и и ч а ю578870
ВО
2 Ь где R, P, R u R имеют указанные значения, алкилируют соединением формулы
У-СН «Р, где К имеет указанное значение и У - нуклеофильно удаляемая группа, такая как клор, бром или йод, И -толуолсульфонил, триметиламмоний и бензолсульфонильная группа, в прйСоставитель И. Федосеева
Техред О. Луговая Корректор И. Гоксич
Редактор Т. Никольская
Заказ 3827/707 Тираж 553 Подписное
UHHHHH Государственного комитета Совета Министров СССР по делам изобретений и открытий
113035, Москва, Ж»35, Раушская наб., a. 4/5
Филиал ППП Патент, г. Ужгород, ул. Проектная, 4 ш и и с я тем, что норбензоморфан или . норморфинан обшей формулы сутствии растворителя при текп ературе кипения реакционной массы с последующим выделением целевого продукта в свободном виде, в виде соли, в виде рацемата или оптически активного антипода.
2. Способ по и. 1, о т л и ч а ю ш и йс я тем, что процесс проводят в присутствии смеси тетрагидрофурана и диметилформам ила
3. Способ по пп. 1 и/или 2, о т л и ч аю ш и и с я тем, что Й-алкилирование проводят в присутствии связывающего кисло: ту средства.
Источники информации, принятые во вни. мание при экспертизе:
1. Патент США ¹ 3634433, кл. С 07tt 39/00. опублик. 1972.
2. Патент США № 3865834, кл. С 07ц 39/00, опублик. 1975, приоритет от 05.01.73.