Способ получения производных хиназолина или их солей
Иллюстрации
Показать всеРеферат
ОП ИСАНИ Е
ИЗОБРЕТЕН ИЯ
Союз Советских
Социалистимеских
Республик
К ПАТЕНТУ (61) Дополнительный к патенту(22) Заявлено 25,07,75 (21) 2162232/23-04 (51) М. Кл.
С 07 Э 239/94
С 079 401/04
ПА 61 К 31/505 (23) Приоритет - (32) 25. 07.74
Гасударственный комитет
Совета Министров СССР но делам изобретений и открытий (33) Великобритания
{31) 32 805/74
1 (43) Опублнковано 30. 10.77.Бюллетень № 40 (53) УДК 547.856. . 1 (088.8) (45) Дата опубликования описания 10.12.77
Иностранцы
Джон Кристофер Данилевич, Антони и Колин Томсон (Великобри гания) Иностранная фирма
"Пфайзер Корпорейшн" (Панама) (72) Авторы изобретения
Гарт Эванс
Ала,нЛесли Хэм (71) Заявитель (54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ХИНАЗОЛИНА
ИЛИ ИХ СОЛЕЙ
1
Изобретение относится к способу получения новых производных хиназолина формулы где К1 - атом водорода или алкильная груп- 1б пас С -С, К - алкоксигруппа с С вЂ” C4, У вЂ” группа Z ÑÎ-ИР Кт
@n«Z-COP>, me Z представляет собой - СН вЂ” или-И, где R> - алкийьная группа с
RQ
С вЂ” C4 или алкоксигруппа с С- С4, Рл4 1 атом водорода или алкильная группа с С - С
R — алкильная группа с С1- С, R -атом т водорода или алкильная группа с С «С, или их солей, которые обладают биологичес кой активностью и могут найти применение в медицине.
В литературе известен способ получения
4-аминозамешенных хиназолинов взаимодействием 4-хлорхиназолинов с аминами (1).
Предлагаемый способ получения соединений формулы 1, основанный на известной в органической химии реакции, заключается в том, что хиназолин формулы где R и К имеют указанные значения, и
Q представляет собой флор, бром, йод, алкоксигруппу с С1- С4 или алкилтиогруппу с С1 Сбъ
578874
3 подвергают взаимодействию с смцном формулы где Y имеет укаэанные значения, в среде органического растворителя при температуо ре от 75 до 150 С с последуюшим выделе нием целевого продукта в свободном виде или в виде их солей.
Фармецевтически применимые сопи соединений формулы 1 могут быть следующие: гидрохлорид, гидробромид, гидройодид, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, i малеат, фумарат, оксалат, лактат, тартрат, цитрат, глюкоиат, caxapar и и -то."2О луилсульфонат.
Пример 1, 4-Хлор-6,7-диметоксихиназолин (45 гJ, 4-(3-н-бутилуреидо)-пиперидиномоногидрохлорид (80 r ) и триэтилемин
{140 мл) нагревают с обратным холодиль- >5 ником в среде этанола {450 мл) в течение
1 ч 15 мин, Затем смесь концентрируют в вакууме и полученное в результате твердое вешество перемешивают в воде, рН которого затем устанавливают равным 11 с помошью ЗО
5 и. раствора. NaOH. Суспензию встряхивают с хлороформом и органический1слой отделяют, сушкой (М а СО5) и выпаривают в вакууме досуха с образованием желтого маслянистого твердого вещества.
Обработка эфиром с последуюшей перекристаллизецией из этанола приводит к получению 4- 4-(3-н-бутилуреидо)-пиперидино)-6,7-диметоксихиназолина (37 r). Не- 40 большие следы примесей удаляют в результате заливания раствора этого соединения в хлороформе в стеклянную колонку, заполненную ИогчыР и элюируют 10/ным раствором изопропанола в хлороформе. После вы-35 парйвания,соответствуюшие фракции собирают и перекристаллизовывают из этанола с образованием чистого продукте (21 г); т,пл. 204-205 С, Вычислено,%: С 62,0; Н 7,5 . М 18,1. 50 2оН"Рь, Найдено,%: С 62,1; Н 7,6; N 18,3.
Мономалеат получают путем обработки спир тового раствора свободного основания спиртовым раствором малеиновой кислоты. Осаж-i55 денную сопь перекристеллизовывеют из этанола; т.пл. 195-197 С. о
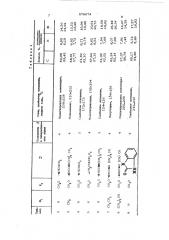
По примеру 1 из соответствуюшего производного 4-хлорхиназолина и амина получают соединения, представленные в табл. 1. о
Пример 10, Получение 4-(4-аминопиперидино)-6, 7-диметоксихиназолина.
4-Хлор-6,7-диметоксихиназолин (0,9 г)
4-(трифторацетнламинопиперидингидрохлорид (76% чистоты, 1,25 г), триэтиламин
{ 2,2 мл) и этанол (25 мл) нагревают с обратным холодильником в течение приблизительно 45 мин. Смесь выпаривают в вакууме досуха с последующим подшелачиванием
5н . раствором гидроокиси натрия и экстракцией хлороформом. Хлороформный экстракт сушат и выпаривают в вакууме с образова» нием после перекристаллизации из этанола
4- (4-трифторацетамидопицеридино)-6,7-диметоксихиназолина (1,5 r), т.пл. 217-220 С.
Вычислено,%: С 50,7; Н 5,3; g 13,9.
С„НДИ„О
Найдено, 6: С 50,8; Н 4,75; М 13,9.
4-(4-Трифторацетамидопиперидино) «6,7-диметоксихиназолин (59,5 г), 5й, раствор гидроокиси натрия (250 мл) и тетрагидрофурен (ТГФ) (500 мл) нагревают с обратным холодильником при перемешивании, в течение 2 ч 30 мин, ТГФ-слой декантируют и концентрируют до небольшого объема с последуюшей обработкой водой и экстракцией
СНС
Выпаривание хлороформа приводит к образованию желтого масла, которое после обра ботки эфиром дает желтые кристаллы 4-(4-аминопиперидино)-6,7-диметоксихинаэолина (42 г); r.nn. 133-135 С.
Пример 11. Получение 4-(4-оксопи перидино) -6, 7-диметоксихинезолина, 4-Хлор-6,7-диметоксихиназолин {30 r)
4-пиперидинэтиленкетальгидрохлорид (25 r), триэтиламин (35 r) и этанол (250 мл) нагревают с обратным холодильником в тече ние3 ч. добавляют водный раствор кербоната натрия с последующей экстракцией хлороформом и хлороформный экстракт сушат и выпаривают в вакууме с образованием масла. Масло повторно растворяют в водном растворе хлористоводородной кислоты (1,5п „200 мл) и нагревают с обратным холодильником в течение 2 ч с последуюшим охлаждением, подшелачиванием 10%-ным раствором Ма CO
2 и экстракцией хлороформом, Выпаривание высушенного хлороформного ркстракта приво1 дит к образованию 4-(4-оксопиперидино .—
-6,7-диметоксихиназолина (37,6 r), т.пл.
176-178 С, Пример 12. Получение 4- j4-(3-н-бутил-1-(2-пиридилметил)- уреидо) -пиперидин)-6,7-диметоксихиназолин (1,2 r) в виде бледно-желтых кристаллов; т.пл.
162-164 С.
578874
Вычислено,%: С 65,25; Н 7,2; f4 17,6.
С„Щ Р,:
Найдено,%: С 65,2; Н 7,2; N 17,4.
Пример 13, Получение 4)4-(3-П -пннннп1пнинп)пипи иннин j, 6,7-@Hue s о токсихинаэолина (1,5 г; т.пл. 192-194 С.
Вычислено,% . С 62,8, Н 7,8 N 17,4.
ChVP
Найдено,%: С 62,4, Н 8,0;8 17,8.
Пример 14. Получение 4- (4-(1-ме-to тил-3-н -пропилуреидо,-пиперидино1-6,71
-диметоясихинаэолин (0,4 г); т.an. 203211 С.
Вычислено,%: С 61,3; Н 7,6; N 17,9, С «УР и4 Н О
Найдено,%; С 61,3; Н 7,6; N 17,4, Соединения, полученные по примерам
15-40, представлены в табл. 2. (Во всех соединейиях Y находится в 4-положении).
Пример 41. Получают 4-(4-ацето, нил-l,2,5,6-тетрагидропирид-1-ил)-6,7-циметоксирнаэолин мономалеата; т.пл.
17 8-181 С.
Вычислено,%: С 59,6; Н 5,7; И 9,5, Найдено,%: С 53,7; Н 5,7; М 9,3.
678874
t CV р 0) (Ф н н
O) rr с е (о ч н,.(р (О с3 оо оо
«(н сС(Ж
<р (О
1(co cv (Я кв
g) YJ ч (о, с .,(((( Да e<. О(а (.® -(g с- = о . ((" "
pj СЯ сО р l с(:(t (0
o t-„
t ({) lQ Ф ((tQ (Q C) д Cg о р) Щ g) Щ с Щ
Я % (((tQ оо
o t-. ж (а3 ((с Щ g) g) а оо ,-(СЯ
<р (0
1 " (I
СЯ
Ф в ч
4 о о о (((о х о
rn
° х
O O х о м х о
Я хЖ
8 o /) — и х (0 O х " х х
O О х о х к о х O х х и х х х и
o o o
II% Щ м Ю х х х и о
° Щ ц О (о
И O
578874 с9, о
t l у1
CD g) Ф чф
CD a " гЧ
% GO о
t t» -,-< (0 О сц С0
С0 С0 -
CD с0
t lA (О t0
° Ч Ф
Сп
t t - с0 t CD с с
O C0 CD CO
CDt сЧcO QO
tn e с0 сО
l t с» с
О с о -. с0 с0 сО CD
l t
t t
° 1 9-1
Ф IA с0 с0 сО с0
CD t0 и
С0 с0
lQ CO
° -1 ц )
O CD с0 g) сц гч
CO t0 сч « с0 с0
Л 0
CO W сЧ cQ (0 с0 оа е-(ся .1 TE с0 с0 с0 с0 с0 О) с
Щ СО ж се <„
<ч Щ
<0 с0
Ь) LQ с0 с0
cv сЧ с0 с0
l о (Ч
Я о с4
3 о о
Ф
3 о
g 4
3 о
3 о,„
Ф
8., 3 о
34
Д CD о " о
X о 4 х о х и х и о и о х о о х о.
Ю х оо х о о х" и о и х о
cQ сО Ж с4
4l tсЧ
<О с CO CD
° Ч м-1 Ф-4 54
Ю
I Ф
3 ф оС0 о -1 сч
Т.7 м Фъ
5 Я ф х C у — 7
o o о м
ИЪ
О ея
В6
3 о„>
3 и файф
Ф
Ж ф - СР
Itl
О
4 — 6 (с{ (»- Щ
СО СО н
«6 «О
W CO
СО «О н
СЧ 3
CO СЧ
О «О 4 Ф1
° ф CO с Р3 (t
91 у о3
CO »
1-
Ю (Ч
t CO
CO «О
° «( ( t
CO tQ
r О)
t» t
W Р)
О 1
l Г»
О) CD . Г4 «11
t» t а
t CD
СО 0)
CO р»
СО «О
ДО
«О ф 5 1
CO CO и О О
° ф
О" О
СО СО
«Ч Ф
CO O
СМ Л (O CO
EQ CO
Н СО
О CD"
CO «О а.1 CO н с
Р1 т1
СО СО
«О CO
N t
«О «О
«О «Q о
8 х а о м х и о о. о х
0 о х
0 о х о
O O х
0 0 о о с
CU а
g О) g С о о х
0 и х о
IVI и и х
0 о
Ф « о, 1-1 о Д васо
1-1 о
0 а
I о
С
2 и
CON
rt и
Юа ЛСО н. -
6
3Я м, в о Д
Н о СИ Ю " Ф о о
g СЯ и х
0 уг Ю х г» х г
О о ж
СЧ CO W IQ ñ ïå
t t C t а а о Е о „ж о «О
g. С й«
2 " о х
Х.
8 х м
578874
О
«(С
- О
«(03 CO
Ф CD
«
«1 ° (" t
«t СО
«О Ю
«1 «1
«4 СО
° ф CO ф 03
«
«1
o " э
СО С 3
Т «(С0 С0
О) tQ
«1 «1
С М
CD CO
«Q С )
«1
t С) «Ч О
«О «0
«1
С
О Г«О Ф
1- о и
Ф и
9 ф
С0 СО
Ю «О
С0 С0
cQ ()
Щ «0
t t
CV О)
ОО
t t гЧ т 4
«О «О
t t
CD Cg
°
С0 «р
С СЯ О)
СО Я
О СО
Ф С0
СО СО
ОО
ОО
1 t
t «О
«Ч «g
t t
С) g)
9(«О («О
И ц) («О р «4
«О «О
t C0
С О
С0 Л
К tO (О t
Ф СО
«Q «О
«0 t6
«О СО
0) Щ
ОО
С0 «0
«Ч Ж
«О Л
Р ) Р7
«О K
CD O Ф
«О «О 1 (О с
«Ч «Ч
«О «О
° «
С0 «О
„u о .
v о
3 и о
1о о ф х о
М
Ям 6 х «ц — с
Ф о
X о о
X о о м х о о м х о х" х" х о v о и
X о
О и
X о
O.
Q.
Е" й
03 Я
CD
«"3
Ф
«II CO
1 о Я
8À
3t ( и
И о о
) 0l ф
М о
5
Ц
Цw о
3. о «0
ge
g «
2 о
Ф о а о «<
3 о
Ф
3 фо O
8 «-
g t о
Ю
3„ о
3 «О
Д «1
А (3
Л : х о о
Д " о х
578874
Формула изобретения
Составитель Т. Якунина
Техрец О. Луговая Корректор И. Гоксич
Редактор Т, Никольская
Заказ 3828/707 Тираж 553 Подписное
llHHHlIH Государственного комитета Совета Министров СССР по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., n. 4/5
Филиал ППП «Патент, r. Ужгород, ул, Проектная, 4
Способ получения производных хиназолинв формулы Т где R - атом водорода или алкильная группас С-С ;
R- - алкоксигруппа с С - (, it !
У - группа Z «СО -HR
rpynrra c C„- Ск> R атом водорода или алкильная группа с С - С или их солей,.о т л и ч а ю ш и и с я тем, что хиназолин формулы Н
Q где R u R имеют указанные значения, и
Q представляет собой хлор, бром,, йод, алкоксигруппу с С - C4 или алкилтиогруппу с 0 С4 Ckl подвергают взаимодействию с амином формулы lH
K где Y имеет укаэанные значения, в среде органического растворителя при температур ре от 75 до 150 С с последуюшим выделением целевого продукта в свободном виде или в виде его солей.
Источники информации, принятые во внимание при экспертизе:
1. Эльдерфильд P. Гетероциклические соединения, М., изд. "И.Л.," 1960, т.6, зо с. 296.